Введение
Синдром двигательных нарушений (СДН) является одним из синдромов восстановительного периода гипоксически-ишемической энцефалопатии (ГИЭ), который, в зависимости от патогенеза, локализации и объема повреждения мозговой ткани, проявляется умеренными и тяжелыми отклонениями мышечного тонуса, формирования позы, движений и моторных навыков [1]. Восстановительный период болезней центральной нервной системы перинатального периода обозначен в пределах от 1 мес. до 12 мес., для недоношенных детей сроки продлеваются до 24 мес. Концепция восстановительного периода подразумевает определенную временную условность, теоретически он не может закончиться, если дефект остается после указанного срока [2].
С позиций семиотики наиболее частыми проявлениями СДН являются синдромы пирамидной и экстрапирамидной недостаточности, нарушения статики, локомоции, часто в сочетании с нарушениями высших корковых функций. Двигательные нарушения по вариантам клинического течения могут быть как стойкими (органическими) и проявляться формами церебрального паралича, так и преходящими (транзиторными) в виде темповой задержки формирования функции контроля позы, вертикализации и самостоятельной ходьбы. О наличии и выраженности СДН церебрального происхождения целесообразно судить после 56–60 нед. постменструального возраста [3].
Традиционно в нашей стране задержка психомоторного развития рассматривается в рамках единого синдрома, однако в зарубежных неврологических школах задержка моторного развития (motor delay) рассматривается независимо от задержки интеллектуального развития (mental retardation). Для задержки моторного развития (ЗМР) нет строгого определения, и обычно под этим термином понимают временное отставание формирования двигательных навыков более чем на 30% по моторному коэффициенту (motor quotient). Постановка диагноза ЗМР основывается на трех основных параметрах: развитии моторных навыков, данных классического неврологического осмотра и признаках неврологической и моторной зрелости [4].
В остром периоде ГИЭ с целью точной оценки степени повреждения головного мозга проводится инструментальная диагностика топики и патоморфологии поражения с применением КТ, МРТ, ЭЭГ и вызванных потенциалов. В восстановительном/резидуальном периоде, когда этиология и патогенез поражения известны и уже не являются основными целями лечения, акцент медицинской помощи смещается в сторону проведения абилитации, а инструментальные исследования отходят на второй план. Традиционно оценка эффективности лечения и абилитации проводится клиническими методами с применением разнообразных шкал психомоторного развития (шкала Л.Т. Журба, календарный метод профессора В.П. Зыкова, шкалы Bayley, Griffiths, Denvertest, шкала неврологического осмотра младенцев Хаммерсмита и т. п.) [2].
В повседневной практике возникает потребность в дополнительных критериях эффективности абилитации для решения вопроса о целесообразности модификации лечебных мероприятий. Для такой цели доступен метод транскраниальной допплерографии (ТКДГ) основной артерии (ОА). Принято считать, что данный метод особенно информативен при окклюзионных поражениях церебральных сосудов. В неонатологии для оценки мозгового кровотока в остром периоде ГИЭ диагностическая ценность допплерографии невелика. Это обусловлено тем, что показатели зависят от фазовых изменений кровотока после родов и фактора гипоксии. Другими словами, интерпретация осложняется тем, что нелегко отличить физиологические фазовые изменения кровотока в послеродовом адаптационном периоде от заведомо патологических признаков потери ауторегуляции [5].
В настоящее время ТКДГ занимает определенное место в ряду методов инструментальной диагностики перинатальной патологии. Так, в остром периоде ГИЭ с помощью ТКДГ выявляют изменения мозгового кровотока, характеризующие дезадаптацию глубоко недоношенных детей, оценивают степень флуктуации мозгового кровотока при снижении индекса резистентности и скорости венозного кровотока [6]. Определены различия мозгового кровотока у доношенных и недоношенных детей, сформулированы прогностические признаки [7]. Выявлено, что на протяжении нескольких месяцев жизни у недоношенных детей церебральный кровоток характеризуется высокой резистентностью сосудов и интенсивным увеличением скорости в передней мозговой артерии и ОА. Наиболее информативными показателями являются индекс резистентности Пурселло (RI) и пульсаторный индекс. Отмечено, что при легкой форме ГИЭ показатели мозгового кровотока быстро восстанавливаются, а при тяжелых формах имеют разнонаправленные отклонения в остром и раннем восстановительном периодах [8, 9].
В раннем восстановительном периоде ГИЭ можно судить о динамике восстановления тонуса сосудистого русла. Индекс резистентности возвращается в пределы 0,65–0,69, что имеет существенное прогностическое значение. По этой фазе можно предположить стойкое резидуальное изменение регуляции тонуса артериального сосудистого русла, если RI остается сниженным (менее 0,65) [10].
В отдаленном периоде при формировании синдрома детского церебрального паралича (ДЦП) выделяются допплерографические паттерны стенозирования магистральных артерий, шунтирования, остаточного кровотока, затрудненной перфузии, эмболии, ангиодистонии по гипо- или гипертоническому типу, дистальной вазоконстрикции или атонии, венозной дисциркуляции. Показатели кровотока в вертебро-базилярной системе характеризуются значительным повышением тонуса, вторичным недостатком кровотока по позвоночным артериям и по ОА [11].
У детей раннего возраста с церебральной ишемией перинатального периода также проводился анализ линейных скоростей кровотока — выявлялись выраженные признаки ангиодистонии [12]. Однако в доступной нам литературе не обнаружено работ, посвященных ТКДГ как методу инструментального определения степени ЗМР и динамической оценки параметров церебрального кровотока у таких детей на последующих этапах позднего восстановительного периода ГИЭ.
В отношении тяжелых последствий ГИЭ 2–3-й степени — стойких (органических) клинических форм (различные формы гидроцефалии, тяжелые органические формы нарушения психического развития, тяжелые формы нарушений моторного развития в виде ДЦП, симптоматические формы эпилепсии) диагностический и лечебный алгоритм, а также реабилитационный прогноз представляются вполне очевидными. Однако что касается последствий менее тяжелых вариантов ГИЭ, формирующих транзиторные клинические формы, то здесь дать реабилитационный прогноз, определить степень компенсации и сроки приобретения детьми моторных навыков становится для врача трудной задачей. Понятно, что в данном случае патологическую постуральную активность можно расценивать как переходную фазу перед полным восстановлением функции, но именно в этом периоде труднее всего установить грань нормы и патологии [13].
Удобство применения допплерографии ОА в раннем и младшем детском возрасте обусловлено относительно короткой продолжительностью исследования (локация в одной позиции, одной артерии) и, соответственно, снижением вероятности двигательных артефактов, что позитивно сказывается на качестве результатов. Возрастные нормативы допплерографических показателей у детей раннего возраста определены нечетко, в связи с чем в нашей работе мы использовали референсные значения нормальных параметров мозгового кровотока, полученные при анализе 6000 клинически здоровых детей в возрасте от 1 года до 14 лет [14].
Практическая необходимость использовать в клинической работе инструментальные показатели церебральной гемодинамики обусловлена недостаточной полнотой клинической оценки динамики восстановления ребенка раннего возраста после перенесенной ГИЭ.
Цель исследования: изучить состояние мозгового кровообращения в бассейне ОА у детей с синдромом двигательных нарушений и ЗМР в позднем восстановительном периоде ГИЭ и определить его значение для объективизации клинических данных и динамической оценки реабилитации.
Материал и методы
В исследование вошли 28 детей с СДН с темповой ЗМР в результате перенесенного гипоксически-ишемического поражения ЦНС перинатального периода (код по МКБ-10 G 93.4, G 96.8), не имеющие нижнего парапареза, а также без признаков аномалий Виллизиева круга по данным ТКДГ. Возраст детей составил 1–2 года (средний возраст 1 год 7 мес.), соотношение мальчиков и девочек 1,5:1. Степень задержки оценивали по календарному методу, предложенному профессором В.П. Зыковым [2]. Клиническое неврологическое обследование проводили по стандартным методикам.
Допплерографические исследования проводили на протяжении 3–8 мес. с интервалом 3–4 мес. Исследования выполняли на ультразвуковом аппарате «Toshiba Aplio 500» с помощью секторного датчика pst-25bt 2,5 МГц. Для исследования линейной скорости мозгового кровотока (ЛСК) использовали ультразвуковое субокципитальное окно. Проведена оценка ЛСК в ОА, анализировали следующие показатели: RI, среднюю скорость кровотока (Vm). Сравнивали средние величины в каждой группе, повышение или снижение относительно референсных значений в конкретной возрастной группе. Всего проведено 49 допплерографических исследований.
Ретроспективно дети были разделены на 3 группы по степени ЗМР и срокам овладения навыками самостоятельной ходьбы: 1-я группа (n=12) — легкая степень ЗМР (начало самостоятельной ходьбы отмечалось к возрасту 1 год 3 мес.); 2-я группа (n=6) — средняя степень ЗМР (начало ходьбы отмечалось до 1 года 6 мес.); 3-я группа (n=10) — тяжелая ЗМР (начало ходьбы отмечалось позже 1 года 6 мес.). Группу контроля составили 10 детей без двигательных нарушений.
Статистическую обработку проводили в программе Statistica 6.0. Для сравнения показателей использовали непараметрический U-критерий Манна — Уитни. Статистически значимыми считали различия при р<0,05.
Результаты исследования
Все дети основных групп имели аномальные показатели церебрального кровотока в бассейне ОА по данным ТКДГ.
Ультразвуковые синдромы представлены следующими вариантами:
изолированное повышение RI, гипертонический тип, — 5 человек, средний RI 0,65;
изолированное снижение RI, гипотонический тип, — 4 человека, средний RI 0,44;
сочетанное повышение Vm и RI, комбинированный тип, — 10 человек, средний RI 0,65, средняя Vm 66,1 см/с;
изолированное повышение Vm, гиперкинетический тип, — 9 человек, средняя Vm 58,37 см/с.
Группу контроля (n=10) составили дети с нормальным типом кровотока: средний RI 0,58, средняя Vm 49,7 см/с.
В группе легкой степени ЗМР количественно преобладали пациенты с высокими показателями Vm и RI (гипертонический тип и комбинированный тип), всего 58%, изолированно высокие параметры Vm отмечались в 42% случаев. Группа средней степени ЗМР характеризовалась высокими значениями показателя периферического сопротивления RI — преимущественно гипертоническим и комбинированным типом кровотока (50% и 32% соответственно). Дети с низкими значениями RI (гипотонический тип) наблюдались исключительно в группе тяжелой степени ЗМР и составили 40% от числа детей в этой группе (рис. 1).
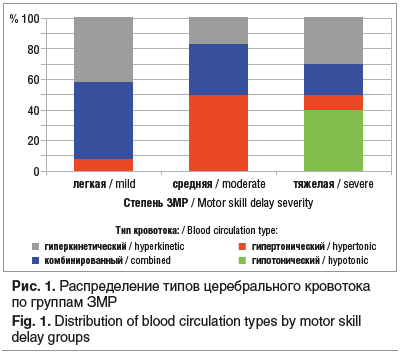
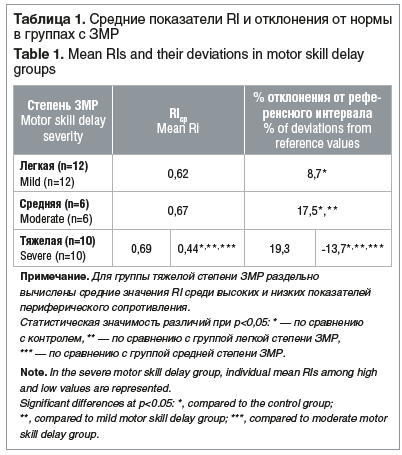
При сравнении параметров кровотока по каждой группе ЗМР выявлены следующие особенности. Степень отклонения индекса RI от референсных значений соответствовала тяжести ЗМР. По уровню повышения RI группы легкой и средней степени ЗМР различались между собой и отличались от контрольной группы. Группа тяжелой степени ЗМР характеризовалась как повышенными, так и сниженными значениями RI. Причем статистически значимые различия с детьми с легкой и средней степенью ЗМР и с контрольной группой были выявлены только при низких значениях RI.
А высокие значения RI в группе тяжелой степени ЗМР отличались от значений в группах легкой и средней степени ЗМР только на уровне тенденции (табл. 1).
По уровню повышения Vm выявлена достоверная разница с контрольной группой. Различия показателей Vm между группами ЗМР находились на уровне тенденции к более высоким значениям ЛСК в группе детей с легкой степенью ЗМР (табл. 2).
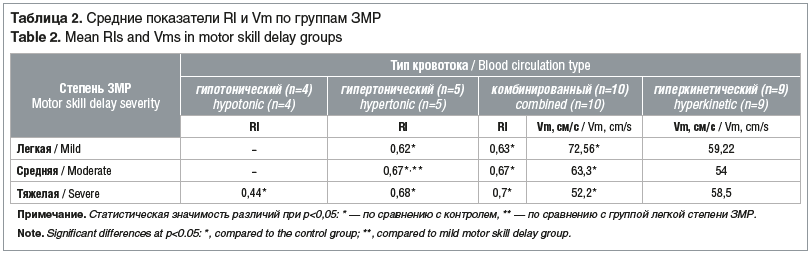
Выявлена достоверная прямая зависимость между повышением RI и тяжестью ЗМР во всех трех группах ЗМР при комбинированном типе кровотока. Аналогичная прямая зависимость при гипертоническом типе кровотока наблюдалась при сравнении групп легкой и средней тяжести ЗМР, тогда как при сравнении групп с тяжелой и среднетяжелой ЗМР при гипертоническом типе кровотока ее не обнаружено. Группа тяжелой ЗМР характеризовалась достоверно низкими показателями RI (гипотонический тип кровотока). Отмечена тенденция к более высоким показателям Vm (при комбинированном типе кровотока) в группе легкой степени ЗМР. Скоростные показатели кровотока при гиперкинетическом типе достоверно не отличались по группам ЗМР.
По мере приобретения с возрастом двигательных функций отмечалась нормализация допплерографических показателей кровотока в ОА. На начальном этапе клинического восстановления нормализовались значения RI (рис. 2), а у детей с исходными высокими скоростными показателями (комбинированный тип) после нормализации RI постепенно снижалась Vm.
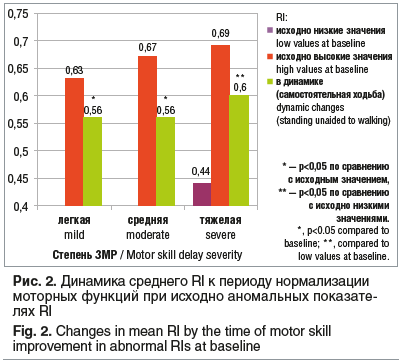
Достоверно различались исходные показатели RI и показатели RI в динамике клинического улучшения в группах легкой и средней степени ЗМР. В группе тяжелой ЗМР достоверна нормализация низких значений RI (р<0,05)
(см. рис. 2).
Гиперкинетический тип кровотока являлся переходным в период клинического улучшения у 70% детей с комбинированным типом кровотока и у 22% детей с исходно аномальным RI (гипертонический и гипотонический типы). Важно отметить, что указанная динамика показателей RI и Vm предшествовала клиническому улучшению (в сроки 1–3 мес.) и сохранялась в периоде освоения нового двигательного навыка. Достоверно снижались показатели Vm в группах с легкой и средней степенью ЗМР (р<0,05). В группе тяжелой степени ЗМР динамика скорости кровотока диагностически незначима (рис. 3).
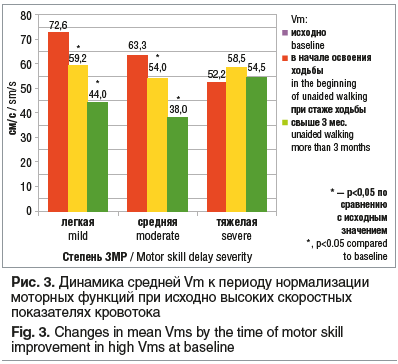
Обсуждение
По результатам проведенного исследования выявлена зависимость степени ЗМР и сроков прогнозируемого приобретения функции самостоятельной ходьбы от величин RI и Vm. Диагностически значимым для ранжирования детей по тяжести состояния явился показатель RI, величина отклонения которого от референсного интервала соответствовала степени ЗМР:
легкая степень ЗМР соответствовала повышению RI в пределах 10% (в диапазоне 0,61–0,63) относительно интервала референсных значений;
средняя степень ЗМР соответствовала повышению RI на 11–20% (в диапазоне 0,64–0,68) относительно интервала референсных значений;
тяжелая степень ЗМР соответствовала повышению RI более чем на 20% (0,69 и выше) относительно верхней границы либо снижению более чем на 10% (ниже 0,47) относительно нижней границы референсного интервала.
Сочетание тяжелой степени ЗМР с низкими показателями RI, выявленное в нашем исследовании, совпадает с данными литературы [10]. Сочетание высоких ЛСК и RI не имело самостоятельного значения, а динамика овладения моторными навыками зависела от уровня RI и соотносилась с той или иной степенью ЗМР. Наличие повышенных значений Vm, по нашему мнению, отражает компенсаторные механизмы на этапе процессов нормализации ауторегуляции церебрального кровотока.
Изолированное повышение ЛСК (Vm) при нормальных показателях RI (гиперкинетический тип) регистрировалось у детей с ЗМР за 1–3 мес. до овладения навыками самостоятельной ходьбы и сохранялось после начала реализации моторной функции на протяжении 3–6 мес. с тенденцией к постепенной нормализации данного показателя. Таким образом, гиперкинетический тип церебрального кровотока является переходным в период клинического улучшения у части детей.
Основываясь на полученных данных, предполагаем, что показатели церебрального кровотока ОА можно использовать в качестве маркера степени ЗМР и объективизировать прогноз приобретения навыков ходьбы у детей с СДН и ЗМР в восстановительном периоде ГИЭ.
При динамической оценке результатов повторных ТКДГ наблюдалась следующая особенность: характеристики кровотока и прогнозируемые сроки овладения самостоятельной ходьбой не зависели от возраста ребенка в момент проведения исследования, другими словами, легкие изменения гемодинамики предполагали скорое наступление клинического улучшения даже при выраженной степени отставания ребенка. Однако этот вопрос требует дальнейшего изучения.
Выводы
Полнота представления о глубине дефекта при СДН и ЗМР и динамике этого состояния позволяет, с одной стороны, оптимизировать лечебный процесс, а с другой — повлиять на вовлеченность родителей в процесс реабилитации, что безусловно отражается на их комплаентности. Немаловажное значение имеет и медико-экономический аспект лечения таких детей. Наличие в арсенале практикующего врача дополнительных методов объективизации оптимизирует лечебный и реабилитационный процесс.
Транскраниальную допплерографию бассейна ОА через субокципитальный доступ можно рассматривать как доступный объективный (скрининговый) метод динамической оценки тяжести двигательных нарушений и этапности формирования моторных навыков у детей младшего возраста с СДН, перенесших ГИЭ. Это обусловлено простотой локации одной артерии при обследовании детей указанной возрастной группы с учетом их эмоциональной и поведенческой активности.
Определение допплерографических показателей кровотока в ОА удобно использовать в практической работе для объективизации клинико-инструментальной динамики на промежуточных этапах лечения с целью оценки необходимости коррекции реабилитационных мероприятий.
Получен комплекс инструментальных данных, позволяющий охарактеризовать каждую степень ЗМР в зависимости от величины отклонения RI от нормы в бассейне ОА: легкая и тяжелая степень ЗМР —
RI превышает референсный интервал в пределах 10% и на 10–20% соответственно; тяжелая степень ЗМР — превышение RI более чем на 20% или снижение более чем на 10% относительно верхней и нижней границ референсного интервала соответственно.
Выявлена последовательность изменений церебрального кровотока, соответствующая положительной клинической динамике: нормализация RI с последующим постепенным восстановлением скоростных показателей кровотока. Данные показатели могут быть использованы как маркеры состояния функций головного мозга, в основе которых лежит сохранность ауторегуляции церебрального кровотока.
Сведения об авторах:
Пуголовкин Кирилл Анатольевич — врач-невролог 11-го отделения ГБУЗ «НПЦ ДП ДЗМ»; 119602, Россия, г. Москва, Мичуринский пр-т, д. 74; ORCID iD 0000-0001-8781-7803.
Ефимова Екатерина Андреевна — врач функциональной диагностики 11-го отделения ГБУЗ «НПЦ ДП ДЗМ»; 119602, Россия, г. Москва, Мичуринский пр-т, д. 74.
Домбровская Екатерина Андреевна — врач-невролог 11-го
отделения ГБУЗ «НПЦ ДП ДЗМ»; 119602, Россия, г. Москва, Мичуринский пр-т, д. 74.
Платонова Ирина Юрьевна — врач-невролог 11-го отделения ГБУЗ «НПЦ ДП ДЗМ»; 119602, Россия, г. Москва, Мичуринский пр-т, д. 74.
Соловьев Андрей Александрович — врач-невролог, заведующий 11-м отделением ГБУЗ «НПЦ ДП ДЗМ»; 119602, Россия, г. Москва, Мичуринский пр-т, д. 74.
Контактная информация: Пуголовкин Кирилл Анатольевич, e-mail: pkirill-msk@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 12.04.2021.
Поступила после рецензирования 06.05.2021.
Принята в печать 01.06.2021.
About the authors:
Kirill A. Pugolovkin — neurologist of 11th Department, Research Practical Center for Children’s Psychoneurology; 74, Michurinskiy av., Moscow, 119602, Russian Federation; ORCID iD 0000-0001-8781-7803.
Ekaterina A. Efimova — diagnostician of 11th Department, Research Practical Center for Children’s Psychoneurology; 74, Michurinskiy av., Moscow, 119602, Russian Federation.
Ekaterina A. Dombrovskaya — neurologist of 11th Department, Research Practical Center for Children’s Psychoneurology; 74, Michurinskiy av., Moscow, 119602, Russian Federation.
Irina Yu. Platonova — neurologist of 11th Department, Research Practical Center for Children’s Psychoneurology; 74, Michurinskiy av., Moscow, 119602, Russian Federation.
Andrey A. Solov’ev — Head of 11th Department, Research Practical Center for Children’s Psychoneurology; 74, Michurinskiy av., Moscow, 119602, Russian Federation.
Contact information: Kirill A. Pugolovkin, e-mail: pkirill-msk@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 12.04.2021.
Revised 06.05.2021.
Accepted 01.06.2021.
.
Информация с rmj.ru





