Содержание статьи
Введение
Несмотря на то, что сам метод компьютерной томографии (КТ) появился гораздо раньше магнитно-резонансных исследований, его активное использование в клинической практике еще долго сдерживалось многими нерешенными техническими задачами. Первые компьютерные томографы, появившиеся в 1973 г., имели рентгеновскую трубку, пучок лучей, которой был направлен только на один принимающий детектор. При этом один оборот трубки вокруг объекта позволял получить изображение только одного слоя. В результате такое пошаговое сканирование проводилось с довольно низкой скоростью, что, наряду с прочими факторами, ограничивало его применение в клинической практике. Во втором поколении томографов за основу был взят веерный тип конструкции, при котором напротив трубки устанавливалось уже несколько детекторов, при этом время обработки изображений в разы сокращалось, давая возможность исследовать более протяженную область за один оборот трубки. С появлением аппаратов третьего, а затем и четвертого поколений, работающих по принципу спирального сканирования, обусловленного одномоментным движением стола и рентгеновской трубки относительно друг друга, стало возможным еще больше сократить время сканирования, снизив при этом лучевую нагрузку на пациента.
Первые попытки проведения непосредственно ангиографических исследований центрального и периферического сосудистого русла с использованием КT были предприняты в конце 1990-х годов. Возможности КТ-ангиографии были продемонстрированы на примерах визуализации внутримозгового кровообращения, артерий брюшной полости и легочной артерии [1–4]. С учетом имеющихся технических ограничений, связанных с невозможностью при сканировании охватить большие по протяженности участки тела, визуализация проходила на каком-то одном выбранном уровне: грудной или брюшной полости, подвздошно-бедренного или подколенного сегментов нижней конечности [5–7]. Кроме того, отсутствие возможности обработки изображения в 3D-режиме не позволяло добиться во всех случаях качественной визуализации сосудистых магистралей или более мелких артериальных коллатералей.
Появление 8-детекторных сканеров позволило проводить сканирование по всем трем осям (X, Y и Z), что было необходимым условием для построения изображения в 3D-формате. При этом значительно сократилось и время проведения обследования [8–10]. Кроме того, данные технические решения позволили проводить одномоментное сканирование сегментов тела протяженностью до 1,5 м, что давало возможность получить визуализацию артериального кровотока всей нижней конечности и таза за один захват сканирования и построение изображения в 3D-режиме [11–13].
Проведение быстрого сканирования при использовании 8 детекторных сканеров в условиях использования тонких срезов позволило получить изображения артерий более высокого качества, со значительным уменьшением количества артефактов, без необходимости использования дополнительного количества контрастного вещества [14, 15].
Одними из первых о явных преимуществах многодетекторной компьютерной томографии (Multi-Detector CT, MDCT) в визуализации брюшного отдела аорты и артериальной системы нижних конечностей сообщили M.L. Martin et al. [16]. В данных исследованиях авторы продемонстрировали высокую информативность MDCT-ангиографии в сравнении с цифровой субтракционной ангиографией (Digital Subtraction Angiography, DSA). Так, чувствительность и специфичность метода в диагностике артериальных окклюзий составили 88,6% и 97,7% соответственно, а в диагностике выраженных стенозов – 92,2% и 96,8% соответственно. Кроме того, по мнению авторов, MDCT-ангиография позволила в сравнении с DSA значительно улучшить визуализацию дистального артериального русла на уровне голени, где DSA демонстрировала результаты гораздо хуже из-за больших различий в скорости наполнения артерий [17]. Это делало метод MDCT-ангиографии особо ценным в диагностике окклюзионных поражений артерий ниже коленного сустава при необходимости принятия решения о характере и объеме операционных вмешательств [16]. При этом расчетным путем было установлено, что доза облучения при MDCT-ангиографии была в 3,9 раза ниже, чем при DSA [15].
Первые 16-детекторные сканеры появились в 2004–2005 гг. В них, помимо еще большего количества детекторов, был использован спиральный принцип сканирования, который изначально имел название винтового [8]. Построение более качественного и цветного 3D-изображения стало возможным c внедрением функционально новых вариантов обработки изображения: многоплоскостного преобразования (Multi-Planer Reformation, MPR) и объемного представления (Volume-Rendering, VR) [18].
Благодаря внедрению MDCT процесс визуализации стал намного быстрее, а полученное изображение имело более высокое разрешение. Использованием спирального принципа сканирования решалась одна из основных задач — уменьшение толщины пучка рентгеновского излучения (коллимации). В однодетекторных системах размер коллимации равнялся толщине томографического среза и составлял 5–8 или 10 мм. Четыре детекторные системы позволили уменьшить размер коллимации, в результате чего 4 детектора при коллимации 1 мм позволяли получить 4 изображения с толщиной среза в 1 мм, 2 изображения по 2 мм или 1 изображение с толщиной среза (размером коллимации) в 4 мм с продольной интерполяцией изображения при одном обороте детекторов на 360° или 180°. В данном случае продольная интерполяция изображения представляла собой способ увеличения количества пикселей в растровом изображении [19]. Понятно, что при спиральном способе обработки сигнала в условиях 16 детекторов количество пикселей на определенной площади увеличивалось. В данном случае все зависело от шага спирали. Второй величиной, влияющей на быстроту получения изображений, являлась скорость смещения стола, при увеличении которой, например, в 2 раза за одинаковое количество оборотов рентгеновской трубки протяженность зоны сканирования вырастала вдвое при равном времени сканирования [20]. Другим следствием увеличения скорости движения стола являлась возможность уменьшения величины коллимации при сохранении общего времени сканирования и протяженности зоны исследования [18].
Таким образом, конечный результат сканирования определялся не только толщиной пучка рентгеновского излучения (размером коллимации), но и формой спирали, ее «растяжением» вдоль продольной оси. Более точной и полной характеристикой спирального сканирования является понятие «шаг спирали» — питч (pitch), который представляет собой отношение смещения стола за один оборот рентгеновской трубки (table feed per rotation) к толщине пучка рентгеновского излучения (slice collimation). В спиральной КТ шаг спирали может изменяться от 0,1 до 2. Чем больше величина шага спирали, тем быстрее осуществляется сканирование при равной толщине томографического слоя и протяженности зоны сканирования [21]. Другими словами, в многодетекторных спиральных аппаратах толщина томографического слоя превышала величину коллимации рентгеновского излучения, из-за чего при получении более качественного изображения снижалась доза облучения [20]. При использовании многодетекторной спиральной КТ толщина слоя уменьшилась до 1 мм, что позволило увеличить скорость сканирования и пространственное разрешение вдоль продольной оси сканирования в 8–10 раз по сравнению с обычными «толстыми» томографическими слоями [21]. После такого краткого, но столь необходимого погружения в суть физических явлений, лежащих в основе спиральной КТ, становится понятным, какие возможности в получении объемной визуализации сосудистой системы могли ожидать специалисты с появлением 32-, 64- и 128-срезовых томографов, которые были представлены в 2004–2005 гг. [21].
Очередным шагом к повышению качества получаемого изображения мелких артериальных ветвей стало использование синхронизации сканирования с работой сердца. В первую очередь это касалось возможности получения высококачественного изображения кардиоторакальной системы, где наличие влияния постоянно присутствующих артефактов движения на получение конечного изображения имело особо важное значение. Для проведения сканирования в наиболее подходящий момент работы сердца (диастола) его ритм был синхронизирован с компьютерным томографом c помощью ЭКГ. С этой целью были разработаны специальные математические модели electrocardiography (ECG)-triggered sequential scanning и ECG-gated [22–24].
Сканирование с использованием ECG-trigger осуществлялось последовательно, с заранее заданной задержкой, которая отсчитывалась от предыдущего сердечного сокращения. После получения первого изображения стол, в соответствии с сердечным ритмом, в основную фазу исследования перемещался с заданной скоростью для осуществления всего цикла сканирования. Последующая реконструкция изображений осуществлялась путем ретроспективного выбора данных в определенную фазу сокращения сердца из имеющегося полного набора данных на основе записанной ЭКГ. Возможность реконструкции изображений в различных фазах сердечного сокращения (обычно используется диастола), устойчивость к неправильному ритму, возможность редакции данных ЭКГ и способность к реконструкции изображений с перекрытием по толщине делают на сегодняшний день спиральную КТ с ЭКГ-синхронизацией предпочтительным методом неинвазивной коронарографии [21, 25, 26]. В дальнейшем этот же принцип был использован и при проведении магнитно-резонансных (МР) исследований коронарных артерий [27, 28]. В 2007–2010 гг. были сконструированы 256-срезовые, а позже и экспериментальные образцы 320-срезовых КТ-томографов, которые стали новым этапом развития метода. Такое оборудование сегодня позволяет получать не только высокоинформативные изображения, но и буквально в реальном времени наблюдать за процессами, происходящими в сердце и сосудах [29].
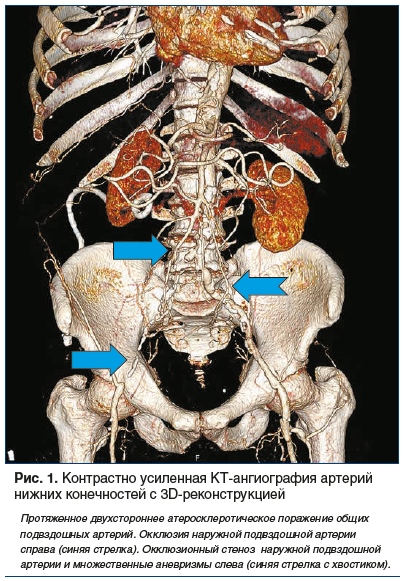
Таким образом, благодаря возможности решения большого количества технических задач метод КТ-визуализации артериальной сосудистой системы на сегодняшний день имеет широкое применение (рис. 1) [21, 30, 31].
Возможности КТ-венографии в диагностике тромбоза глубоких вен и венозного тромбоэмболизма
Бесспорно, ангиологи и сосудистые хирурги почти сразу обратили внимание на то, что метод КТ-ангиографии наряду с артериальной системой позволяет визуализировать и венозное русло нижних конечностей (рис. 2, 3).
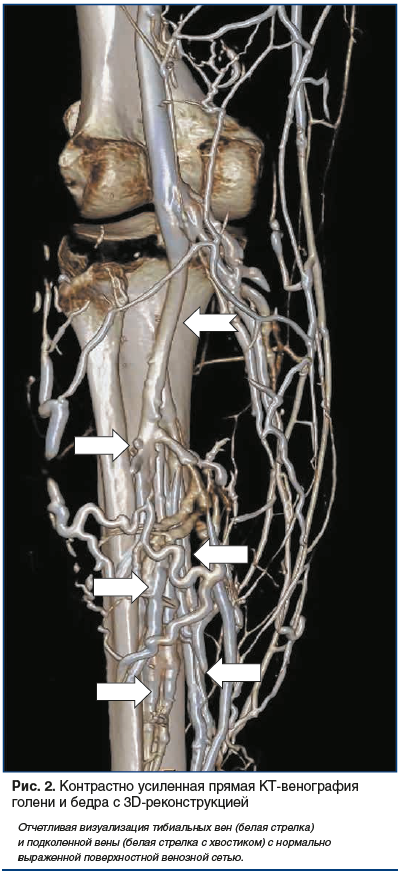
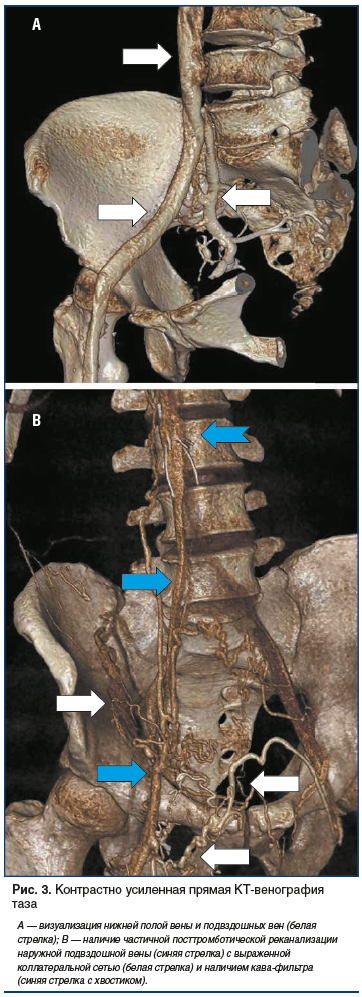
С учетом того, что тромбоз глубоких вен нижних конечностей (ТГВ) и тромбоэмболия легочной артерии (ТЭЛА) являются, по существу, проявлением одного заболевания, а именно венозной тромбоэмболии (ВТЭ), логичной представлялась попытка объединения диагностики этих двух состояний в один метод. Поэтому стремление сосудистых хирургов совместно с врачами-рентгенологами диагностировать ВТЭ и одновременно получить достоверную и подробную информацию о локализации ее источника имело все основания. Перспективность этих попыток была продиктована следующими преимуществами: однократностью исследования и отсутствием необходимости использования дополнительного введения контрастного препарата [32], скоростью выполнения сканирования, например, в сравнении с магнитно-резонансной томографией (МРТ) [33], получением дополнительной информации о состоянии периферической венозной системы при наличии у пациентов ТЭЛА [34, 35]. Следует отметить, что чувствительность и специфичность КТ-ангиографии при визуализации венозной системы нижних конечностей уже по результатам первых исследований оказались сопоставимыми с данными ультразвукового дуплексного сканирования (duplex Ultra-Sound, US) [34]. В некоторых исследованиях были показаны неоспоримые преимущества КТ-ангиографии перед US в распознавании тромбоза вен брюшной полости и таза [36].
Изначально при выполнении КТ-ангиографии с целью визуализации венозной системы специалисты пробовали вводить контрастное вещество через кубитальную вену. Так как основной целью было достижение визуализации вен, данный метод получил название непрямой компьютерно-томографической венографии (Indirect CT-Venography, ICTV). В основе проведения непрямой (верхней) ICTV лежала отсрочка сканирования нижних конечностей от 2,5 до 4 мин после болюсного введения в кубитальную вену 80–100 мл контрастного препарата со скоростью от 2,5 до 4,5 мл/с [37]. Несмотря на полученные некоторыми авторами в своих исследованиях флебограммы нижних конечностей и таза хорошего качества, практически все специалисты столкнулись с проблемами. Основной сложностью в исследовании венозной системы нижних конечностей при таком методе введения контраста была невозможность четкого временного дифференцирования венозной фазы кровотока в зависимости от подвергаемого исследованию сегмента тела человека [38]. Так, J.F. Uhl et al. [39] при активном внедрении метода на практике столкнулись с проблемой невозможности четкого дозирования количества контрастного препарата и определения времени начала сканирования, что не позволило отчетливо и воспроизводимо визуализировать венозную магистраль на протяжении всей нижней конечности и таза, а следовательно, подтвердить или исключить наличие ТГВ в более чем половине случаев. По этой причине каждый исследователь вынужден был разрабатывать свой собственный способ или совершенствовать существующие методики проведения КТ-венографии в зависимости от поставленных задач, чего в принципе не требовалось для артерий нижних конечностей, где методика проведения КТ-ангиографии довольно быстро была отработана и по сегодняшний день остается «золотым стандартом» при планировании реконструктивных операций на магистральном и периферическом артериальном русле.
S.P. Kalva et al. [32] и A.M. Kelly et al. [33] пришли к выводу не только о большой вероятности получения сомнительных результатов при проведении ICTV, но и о полной бесполезности ее в 15,2% случаев — по причине банального отсутствия контрастирования вен нижних конечностей из-за невозможности уловить венозную фазу, которая по многим причинам была индивидуальна, часто время ее наступления устанавливалось просто интуитивно. По этой же причине специалисты часто сталкивались с невозможностью построения 3D-модели, которая должна была стать основным преимуществом СTV в сравнении с DSV [40].
Последнее крупное многоцентровое ретроспективное исследование, включающее сравнительный анализ одновременного комбинированного использования контрастной КТ-ангиопульмонографии и непрямой КТ-венографии было проведено в 2012 г. с привлечением всех ведущих рентгенологов Великобритании [41]. В исследовании участвовало более 800 пациентов. В результате углубленного анализа специалисты полностью согласились с выводами, сделанными J.F. Uhl et al. [39] ранее, и были вынуждены сделать заключение о малой перспективности дальнейшего использования непрямого метода КТ-венографии с целью диагностики ТГВ при его комбинированном использовании у симптоматических пациентов с ТЭЛА или в изолированном виде с целью подтверждения ТГВ. Особенно частыми оставались сомнения в визуализации небольшого и локально расположенного тромба [41].
Также было отмечено, что методика проведения ICTV требовала дополнительного и гораздо большего объема кубитального введения контрастного препарата (до 150 мл), чем этого требовала изолированная КТ-ангиопульмонография. Необходимо было учитывать и дополнительную лучевую нагрузку на пациента. Таким образом, обоснованность применения комбинированного СTA и ICTV сканирования на сегодня является спорной, оно не включено в настоящий момент в обязательные протоколы обследования пациентов с подозрением на ТЭЛА в большинстве европейских стран [38].
В результате крайне негативного отношения к использованию ICTV с целью визуализации вен J.F. Uhl и C. Gillot в 2012 г. в очередной раз призвали мировое флебологическое сообщество отказаться от попыток проведения у пациентов данного метода контрастирования вен и вернуться к проверенной десятилетиями дистальной флебографии, но теперь испытать этот метод в условиях компьютерно-томографического исследования (КТ-венография), т. е., по сути, к методу прямой компьютерно-томографической венографии (Direct CT-Venography, DCTV) .
Первые попытки проведения DCTV при дистальном введении контрастного препарата путем пункции одной из вен на тыле стопы были предприняты в 1994 г. Основными этапами метода, предложенного M.K. Stehling et al. [42], являлись: катетеризация вены стопы, наложение двух турникетов на среднюю треть бедра и нижнюю треть голени, приподнимание конечности над уровнем стола за счет двух держателей, введение контрастного вещества и последующее сканирование конечности в один этап в течение 60 с. Основным недостатком данной методики проведения DCTV-исследования было частое отсутствие четкого контрастирования всех вен на протяжении всего сканируемого сегмента. Причиной этого могла быть ошибка в правильности выбора времени задержки сканирования или недостаточный объем вводимого рентгеноконтрастного раствора, в результате чего не удавалось получить все изображение целиком, так как в одних (дистальных) сегментах конечности контраст задерживался, а в других (проксимальные отделы и таз) к моменту начала сканирования покидал сосудистое русло еще до этого момента.
Указанные недостатки могли быть связаны и с отсутствием в то время многодетекторных систем, сканирующих в спиральном режиме. К тому же используемые сегодня методики постобработки изображения вен в 3D-режиме на тот период времени еще не были разработаны. Это не позволило авторам более активно ввести в клиническую практику данный метод визуализации венозной системы нижних конечностей. Однако и с появлением многодетекторных систем, несмотря на кажущуюся простоту проведения исследования, визуализация венозной системы нижних конечностей оставляла желать лучшего [40].
Проблемы были связаны с выбором оптимального времени задержки старта сканирования от момента введения рентгеноконтрастного вещества, определением объемов дополнительного введения болюсом физиологического раствора, поиском оптимального количества сканирований и его направленности, определением характера и необходимости проведения функциональных проб.
С целью повышения качества визуализации вен нижних конечностей Р.Г. Аскерхановым и соавт. в 2013 г. [43] был разработан способ мультиспиральной компьютерной томографии-флебографии вен нижних конечностей, с помощью которого авторы попытались стандартизировать вышеуказанные критерии. В результате использования данных последовательностей удалось значительно лучше визуализировать магистральные вены обследуемой нижней конечности в целом, однако не получилось достичь идеальной картины изображения глубоких вен голени. Необходимость проведения функциональной пробы с задержкой дыхания (пробы Вальсальвы) превратилась в недостаток, так как больше половины пациентов выполняли ее недостаточно эффективно, что существенным образом влияло на скорость продвижения рентгеноконтрастного вещества и полноту контрастирования магистральных вен. Таким образом, выполнение одной только функциональной пробы с задержкой дыхания не позволило эффективно осуществить задержку эвакуации контраста и добиться максимально полного контрастирования всех венозных коллекторов нижней конечности.
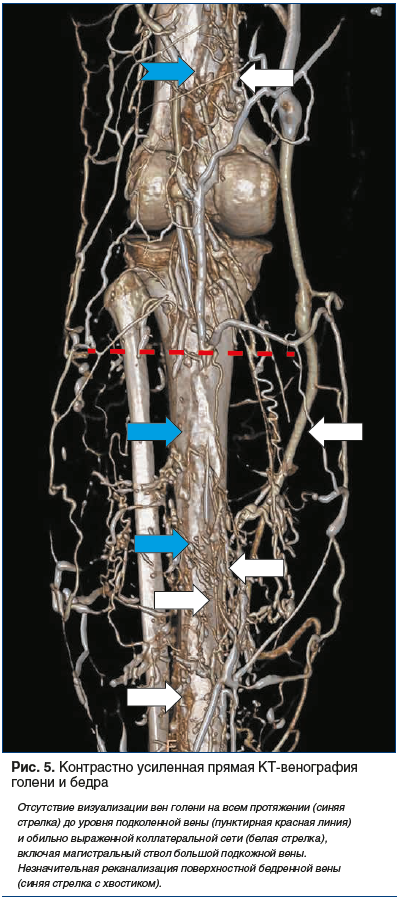
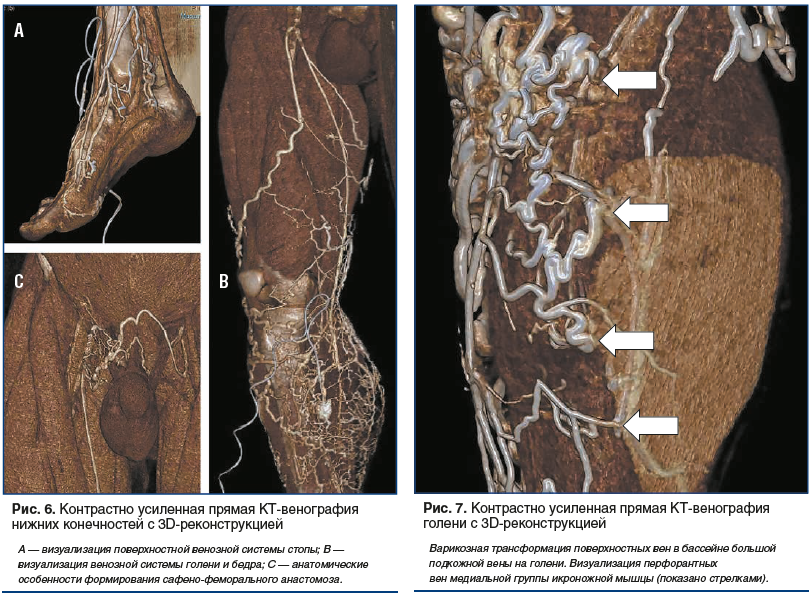
К дальнейшему поиску решений имеющихся задач по стандартизации проведения DCTV в 2016 г. присоединился наш исследовательский коллектив (патент на изобретение RU № 2638920 от 03.08.2016). В основе предложенного нами метода было поэтапное двухколбовое болюсное введение в одну из вен на тыле стопы рентгеноконтрастной смеси, состоящей из 50 мл неионного контрастного вещества и изотонического раствора хлорида натрия (из расчета 1 мл 0,9% физиологического раствора на 1 см роста исследуемого), со скоростью 4 мл/с. После предварительного сканирования задавалась область сканирования (вся нижняя конечность и область таза) с направленностью от таза к стопе. В программу сканирования вводились изменения и временные параметры в соответствии с разработанной нами схемой проведения DCTV нижних конечностей и таза. Над лодыжками накладывалась пневматическая манжета, давление в которой поднималось до 60 мм рт. ст., после чего начиналось введение рентгеноконтрастной смеси, которое в зависимости от расчетного объема длилось около 40 с. После окончания введения всего объема контраста и изотонического раствора хлорида натрия давление во второй манжете, наложенной на середине бедра, поднимали до 60 мм рт. ст., пациент делал глубокий вдох, задерживал дыхание и натуживал мышцы передней брюшной стенки. С этого момента начинали 1-е основное сканирование, общая продолжительность которого составляла 12–15 с. После его окончания пациент делал выдох и выполнял несколько тыльных сгибательных движений стопой, затем принимал исходное положение. В среднем по истечении 40 с начинали 2-е основное сканирование, которое также выполняли в направлении от таза к стопам. После его завершения исследование заканчивали и производили реконструкцию трехмерного изображения вен конечности и таза с помощью автоматических протоколов обработки данных Intelli Space Portal, заложенных в компьютере. Использование данного метода проведения КТ-венографии позволило добиться отчетливой визуализации не только проксимальных отделов вен нижней конечности (см. рис. 3А), но и вен голени, что для диагностики ТГВ имело принципиальное значение (рис. 4, 5).

Одно из последних исследований по улучшению визуализации тромботического поражения венозного русла нижних конечностей за рубежом было проведено W.-Y. Shi et al. [44]. C целью диагностики ТГВ была предложена методика DCTV, суть которой заключалась в одновременном комбинировании непрямой и прямой КТ-венографии. Исследование состояло из трех последовательных этапов. Изначально в кубитальную вену вводили 80 мл контрастного вещества со скоростью 4 мл/с. Затем через 1,5 мин в катетеризированную вену стопы вводили со скоростью 1,5 мл/с 60 мл рентгеноконтрастной смеси, состоящей из 12 мл контраста и 48 мл физиологического раствора, с наложенным выше лодыжки жгутом. Сканирование начиналось через 60 с после завершения дистального введения рентгеноконтрастной смеси. Исследования были проведены с участием 96 пациентов, а результаты подвергнуты контролю методом DSV и US. Точность методики в установлении локализации и протяженности ТГВ составила от 96,9% до 97,9%, чувствительность — от 95,2% до 96,8%, специфичность — 100%, положительная прогностическая ценность — 100%, а отрицательная прогностическая ценность имела диапазон от 91,7% до 94,3%. Исходя из этих данных, авторы сделали вывод о перспективной диагностической точности предложенной ими методики и явных преимуществах комбинированной КТ-венографии перед прямой и непрямой, выполняемой в отдельности [44]. И хотя авторы были полностью удовлетворены полученными результатами, в дальнейшей перспективе нам не удалось найти ссылки на использование данной методики другими специалистами.
С учетом того, что среди пациентов с ТГВ до 40% имеют ассоциированную и бессимптомную ТЭЛА, а в случаях подтвержденного диагноза ТЭЛА почти в 90% наблюдений ее источником являются вены нижних конечностей, своевременная и точная диагностика ВТЭ всегда имела первоочередное значение [45, 46]. С внедрением в клиническую практику диагностики ТЭЛА КТ-ангиографии она практически сразу заняла лидирующую позицию, так как показала свою более высокую чувствительность и специфичность (94–96% и 94–100% соответственно) по сравнению с традиционно использовавшимися ранее для диагностики ТЭЛА вентиляционно-перфузионным радионуклидным сканированием (V/Q) и рентгенографией грудной клетки, не уступая при этом по своей информативности классической ангиопульмонографии, которая на протяжении многих лет в диагностике ТЭЛА считалась «золотым стандартом» [47, 48].
На сегодня все технические детали проведения КТ-ангиопульмонографии полностью стандартизированы. Проводится данное исследование по единому во всем мире протоколу. Сканирование проводится в каудо-краниальном направлении от верхней апертуры грудной клетки до купола диафрагмы. Интенсивность дыхательных артефактов значительно ниже в верхних отделах легких по сравнению с нижними, поэтому артефакты в конце исследования имеют в этом случае меньшее значение. Коллимация и скорость движения стола альтернативно могут увеличиваться. Отсрочка времени сканирования зависит от клинического статуса пациента. У большинства пациентов отсрочка 15 с достаточна для получения оптимального контрастирования сосудов. У пациентов с легочной гипертензией и правожелудочковой недостаточностью время отсрочки может варьировать между 15 и 30 с и должно определяться индивидуально. При использовании центрального венозного катетера отсрочка может составлять 5 с. Введение неионного контрастного вещества требует использования автоматического инжектора. С успехом могут использоваться контрастные вещества как низкой, так и высокой концентрации. При низкой концентрации вводится 120–150 мл контрастного вещества (с содержанием 120– 200 мг йода) со скоростью от 4 до 5 мл/с. При использовании контраста высокой концентрации вводится 100–120 мл контрастного вещества с уровнем содержания 270–320 мг йода и скоростью введения 2–3 мл/с [11]. КТ-ангиография, проводимая в режиме ангиопульмонографии, обеспечивает прямую визуализацию тромбоэмболов внутри легочных артерий в виде дефектов наполнения низкой плотности внутри сосудов, частично или полностью окруженных контрастированной кровью, или как полный дефект наполнения, который делает дистальные сосуды полностью неконтрастируемыми. Использование мультидетекторной КТ в условиях контрастирования позволяет на современных аппаратах визуализировать сосуды легкого до ветвей шестого порядка с возможностью реформации изображения в различных плоскостях, эмболы в которых распознаются как дефекты внутрипросветного наполнения, которые частично или полностью закупоривают сосуд. При этом детальное изображение паренхимы легких дает дополнительную информацию. Трудности в интерпретации спиральных КТ-ангиограмм могут быть обусловлены дыхательными артефактами, которые способны давать псевдогиподенсные области, мимикрирующие сгусток или неконтрастирующуюся область в сосуде [38].
Обсуждение
Касаясь непосредственно диагностики нарушений гемодинамики у пациентов с сердечно-сосудистыми заболеваниями, еще раз необходимо ответить, что US остается «золотым стандартом» флебологической диагностики [49, 50]. В отношении использования томографических методов диагностики речь идет только о случаях, с которыми мы можем столкнуться на практике при ультразвуковой визуализации отдельных венозных сегментов [51]. В первую очередь это касается оценки проходимости подвздошных вен и нижней полой вены [52]. Очень часто в таких сложных диагностических ситуациях заключение строится не на непосредственной визуализации, а на результатах проб с дистальной компрессией или проксимальной декомпрессией. Ошибки также довольно часто могут наблюдаться в месте соединения подколенной и поверхностной бедренной вены в начале аддукторного канала. В данной анатомической области поверхностная бедренная вена в 20% случаев может проходить двумя стволами, что и приводит к диагностической ошибке, когда оператор видит хорошую проходимость одного венозного ствола и не обращает внимания на тромбоз дублирующей венозной магистрали [38].
В некоторых случаях хотелось бы получить большую чувствительность и специфичность ультразвукового дуплексного исследования при обследовании дистальных отделов венозной системы, а именно внутримышечных вен голени, высокий процент нераспознанного тромбоза которых при бессимптомном течении настораживает, например, у женщин на фоне длительного приема гормональных препаратов [53, 54]. Проблемы с отчетливой визуализацией суральных вен могут возникнуть у пациентов с выраженным ожирением или отеком [53]. В рандомизированном исследовании была показана ограниченная диагностическая ценность US из-за относительно высокой вероятности получения недостоверной информации при обследовании пациентов, перенесших эндопротезирование тазобедренных суставов [55]. Также высока вероятность получения ложноположительных результатов при проведении US у пациентов при наличии трофических расстройств с развитием липодерматосклероза и сопутствующим отеком, при невозможности проведения теста на сжимаемость [51].
По мнению большого количества зарубежных специалистов, исключение диагноза ТГВ во всех описанных клинических ситуациях требовало уточняющего обследования, так как риск развития даже бессимптомной ТЭЛА оставался высоким, а отсутствие сведений о вероятном источнике не позволило своевременно назначать соответствующую антикоагулянтную терапию или проводить ее коррекцию, основываясь исключительно на результатах повторных скрининговых US [55].
Одним из таких уточняющих методов в обследовании вен таза и нижней полой вены может стать МРТ, которая благодаря внедрению современных протоколов позволила визуализировать венозную систему в очень высоком пространственном разрешении, основным преимуществом МРТ перед КТ, бесспорно, является отсутствие лучевой нагрузки на пациента.
Анализ проведенных в мире исследований показал высокую перспективность МР-венографии при обследовании пациентов во всех сложных для диагностики клинических случаях при использовании бесконтрастных методик проведения МР-венографии. Подтверждением этого являются проведенные в 2017 г. исследования по дальнейшей разработке и использованию в МРТ-диагностике бесконтрастной прямой визуализации венозного тромба [56], а также значительно усовершенствованных методов бесконтрастной прямой визуализации венозного тромба [57]. Используя эти новые комбинированные импульсные последовательности обработки изображения, можно получать высококачественную визуализацию магистральных вен и при использовании наиболее распространенных в практике на сегодня сканирующих систем с магнитным полем 1,5 Тесла [58]. Не потеряли своей актуальности и методы контрастно усиленной МР-венографии. Можно предположить, что в ближайшем будущем, с дальнейшей разработкой новых контрастных препаратов «пула крови», МР-венография сможет показать высокую диагностическую ценность и при обследовании дистальных сегментов нижней конечности. Особой информативности при наличии дополнительного контрастного усиления с использованием данной группы препаратов можно ожидать при проведении одновременного комбинированного МРТ-сканирования легких и периферической венозной системы [38]. На данный момент такие исследования проводятся, однако окончательного решения этой задачи можно будет ожидать лишь в будущем. Еще одним принципиальным показанием для назначения МР-венографии, по мнению зарубежных авторов, является необходимость исключения ТГВ во время беременности. В этих условиях результаты US часто двусмысленны, особенно на последних сроках беременности. Грозным венозным осложнением у данной группы пациенток может стать тромбоз яичниковых вен или послеродовой тромбофлебит этих вен, который, по данным американских авторов, в 25% случаев приводит к развитию сепсиса и ВТЭ [59].
Что касается КТ, то следует отметить, что данный метод исследования в условиях дополнительного непрямого контрастирования на сегодняшний день остается «золотым стандартом» диагностики ТЭЛА [32, 33, 49, 50]. Многократные попытки добиться отчетливого контрастирования периферических отделов венозной системы путем ICTV изолированно или одновременно с проведением КТ-ангиопульмонографии не привели к устойчивому позитивному результату [34, 35, 60], так как в большом количестве исследований из-за размытости контраста в периферических венах построение 3D-модели венозного кровотока оказалось невыполнимым [40].
Иные возможности визуализации вен нижних конечностей открылись после внедрения в диагностическую практику DCTV с помощью болюсного введения контраста путем пункции одной из вен тыла стопы [39, 40, 61]. Однако и при использовании данного метода вероятность диагностических ошибок остается. Основная причина неудовлетворительных результатов данного исследования заключается в отсутствии стандартизации и четкой методологии проведения исследования. Именно по этой причине чувствительность и специфичность DCTV имеют диапазон от 89% до 100% и от 94% до 100% соответственно [62]. При этом наибольшую специфичность и чувствительность КТ-венография имеет при диагностике бедренного тромбоза, а наименьшую — при обследовании вен голени [63].
На основании результатов применения КТ-исследований в практике большого количества флебологов США, в соответствии с рекомендациями Американского венозного форума, показанием к проведению данного исследования помимо диагностики ТЭЛА является изучение обструкций крупных вен грудной клетки, живота, нижней полой и подвздошных вен [64]. Аналогичным образом определены сегодня показания к проведению КТ-исследований у пациентов с хроническими заболеваниями вен и в российских клинических рекомендациях [49, 50].
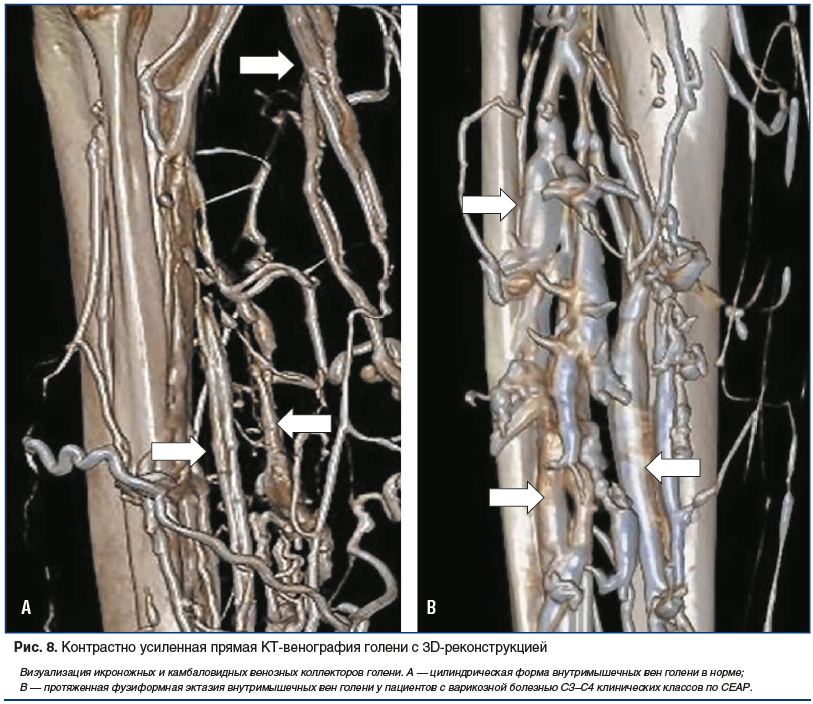
Еще одним и незаменимым инструментом контрастно усиленная КТ-венография может стать в изучении особенностей топографо-анатомического строения венозного русла (рис. 6–8). Полученные данные прижизненной визуализации венозных коллекторов нижних конечностей позволили не только иначе взглянуть на прикладное значение анатомических данных в развитии варикозного синдрома [65, 66], но и уточнить некоторые гемодинамические механизмы формирования хронической венозной недостаточности [67]. Проведены исследования по изучению с помощью контрастно усиленной КТ-венографии функциональной анатомии голеностопной мышечно-венозной помпы с точки зрения участия в венозном оттоке из нижних конечностей не только основных венозных коллекторов, но и перфорантных вен [68–70].
Заключение
Таким образом, на основании представленного обзора и анализа опубликованных данных можно сделать вывод, что интерес к проведению МРТ- и КТ-венографии у пациентов с хроническими заболеваниями вен будет только возрастать. Во-первых, это продиктовано тесной взаимо-связью сердечно-сосудистых заболеваний с ТГВ и ТЭЛА, являющихся, по сути, проявлениями одного заболевания, а именно ВТЭ, что требует свое-временной диагностики обоих состояний. Во-вторых, необходимость более точной топической диагностики с 3D-визуализацией венозной системы нижних конечностей и таза обусловлена нарастающим в последние годы интересом сосудистых и интервенционных хирургов к более активному внедрению во флебологическую практику эндовазальных методов коррекции венозного кровотока. Очевидно и то, что использование методов МР- и КТ-визуализации в исследовательской работе позволит уточнить данные клинической анатомии, а следовательно, иначе взглянуть на некоторые основные патогемодинамические звенья развития сердечно-сосудистых заболеваний у пациентов с заболеваниями венозной системы.
.
Информация с rmj.ru






