Возможности использования биологических маркеров для прогнозирования госпитальной летальности при инфаркте миокарда
Содержание статьи
Введение
Результаты многочисленных исследований подтверждают, что атеротромбоз и последующий некроз (инфаркт) миокарда сопровождаются активацией многих патологических реакций (гиперагрегация и гиперкоагуляция, активация клеточно-гуморального гомеостаза, миокардиальный дистресс-синдром), которые обусловливают системные эффекты повреждения миокарда и являются непосредственными механизмами формирования неблагоприятного прогноза заболевания [1–7].
Имеются данные, что максимально ранний мониторинг
биологических маркеров активации системных патологических процессов, сопровождающих инфаркт миокарда (ИМ), может повысить эффективность стратификации риска пациентов в отношении неблагоприятного исхода острой коронарной катастрофы [8]. В частности, «золотым стандартом» как ранней диагностики ИМ, так и рискометрии при всех типах острого коронарного синдрома (ОКС) является серийное определение высокочувствительных тропонинов [9]. Биомаркеры включены в некоторые действующие модели оценки риска у пациентов с ОКС (GRACE, CRUSADE), тем не менее даже «золотой стандарт» диагностики ИМ — высокочувствительный тропонин имеет ограничения, обусловленные недостаточной специфичностью этого признанного биомаркера некроза миокарда, а также невозможностью повсеместного внедрения этого метода лабораторной диагностики в практику отделений, принимающих пациентов с подозрением на ОКС для дифференциальной диагностики.
В силу этого сохраняется интерес к использованию мультимаркерных моделей диагностики и риск-стратификации ОКС, когда серийное определение нескольких биологических маркеров, отражающих активность основных патологических реакций, может быть эффективным для оценки риска неблагоприятного исхода в разные периоды заболевания.
Цель исследования: оценка возможности использования мультимаркерной модели для прогнозирования риска летального исхода у пациентов с острым ИМ.
Материал и методы
В исследование был включен 81 пациент, госпитализированный в Окружной кардиологический диспансер «Центр диагностики и сердечно-сосудистой хирургии» (региональный сосудистый центр г. Сургута) в течение 1 мес. 2017 г. с подтвержденным диагнозом ИМ, установленным согласно действующим критериям Российского кардиологического общества.
При включении все пациенты подписали информированное добровольное согласие на участие в исследовании, одобренное локальным этическим комитетом СурГУ. В исследование не включали пациентов, не подписавших информированное согласие, имевших при поступлении в клинику острой сердечной недостаточности Killip IV и тяжелую соматическую патологию (терминальная хроническая почечная недостаточность, онкологическое заболевание с метастазированием), ограничивающую вероятность выживания пациента более 12 мес.
На первом этапе исследования был составлен общий клинико-анамнестический портрет исследуемой группы пациентов с ИМ. Далее в течение стационарного лечения регистрировались «жесткие» конечные точки (госпитальная летальность, рецидивы ИМ, желудочковые нарушения ритма сердца, инсульты, большие кровотечения, повторные экстренные реваскуляризации).
На 1, 2–3, а также 7-е сут от момента возникновения ИМ у всех доживших пациентов — участников исследования забирали образцы крови для лабораторной оценки нескольких биологических маркеров [тропонин I, высокочувствительный тропонин Т (hsТnT), миоглобин (MG), N-терминальный фрагмент предшественника мозгового натрийуретического пептида (NTproBNP), тканеспецифичный С-реактивный белок (hsCRB), растворимый сывороточный лиганд CD40 (sCD40L), миелопероксидаза (MPO), эндотелин-1 (ЭТ-1), плацентарный фактор роста (PLGF)]. Плазменные концентрации тропонина I, миоглобина, NTproBNP, PLGF (лабораторный набор Roche Cobas, Швейцария), sCD40L (лабораторный набор Bender MedSystems, Австрия) эндотелина-1 (лабораторный набор Biomedica Gruppe, Австрия), МРО (лабораторный набор HyCult biotechnology, США), а также тканеспецифичного тропонина Т (лабораторный набор Roche Elecsys, Швейцария) определяли методом иммуноферментного анализа (ИФА) на анализаторе для лабораторной экспресс-диагностики COBAS E411 (Roshe, Швейцария); величины hsCRB определяли на иммунохемилюминесцентном анализаторе IMMULITE 1000 (Siemens, Германия). При этом референсными считали уровни: ТnI — до 0,3 нг/мл; hsТnT — до 0,1 нг/мл; MG — до 70 мкг/л, NTPBNP — до 125 пк/мл; hsCRB — до 10 мг/л; MPO — до 350 пк/мл; sCD40L — до 1,5 нг/мл; ЭТ-1 — до 1 фмоль/л; PLGF — до 22 пг/мл.
В завершающей части исследования в группах живых и умерших после ИМ пациентов путем статистического анализа лабораторных показателей, отличных от референсных значений, выявляли предикторы госпитальной летальности.
Количественные показатели в исследовании представлены в виде средних значений с учетом стандартного отклонения, качественные — в частоте в процентах. При распределении признаков, отличном от нормального, применены методы непараметрической статистики в виде расчета медианы, а также нижних и верхних квартилей. Различия количественных признаков оценены с помощью критерия Манна — Уитни, качественные — дифференцировали по Хи-квадрату Пирсона. Для выявления предикторов госпитальной летальности рассчитывался относительный риск (ОР) и 95% доверительные интервалы (ДИ), чувствительность и специфичность. Критический уровень значимости в исследовании принят как р<0,05. Статистические расчеты выполнены с использованием программы Statistica 10.0 (Stat Soft Inc., USA).
Результаты исследования
При оценке клинико-анатомических особенностей пациентов, поступивших в региональный сосудистый центр (табл. 1), было выявлено, что в целом портрет пациента с ИМ в Югре соответствовал таковому, полученному в общероссийском регистре РЕКОРД-3, описанному в ранее опубликованных работах [10], и характеризуется высоким сердечно-сосудистым риском.
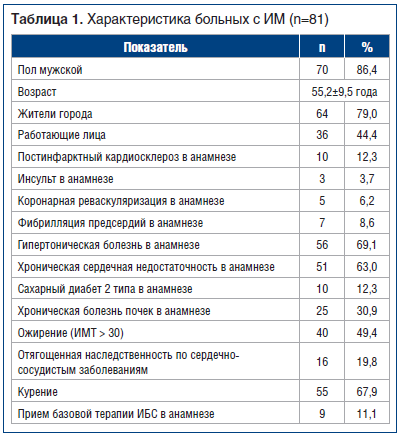
Большинство пациентов с ИМ имели при поступлении ОКС с подъемом сегмента ST [n=79 (97,5%)]. Острая сердечная недостаточность Killip II–III при поступлении регистрировалась у 10 (12,3%) пациентов.
Коронарография при поступлении выполнена всем пациентам. По ее результатам 60,5% больных (n=49) проведено стентирование инфарктзависимой артерии стентами с лекарственным покрытием. У остальных больных технической возможности выполнения эндоваскулярного вмешательства не было. Догоспитальная тромболитическая терапия и экстренное коронарное шунтирование были выполнены 1 (1,2%) пациенту.
Несмотря на то, что большинство пациентов в обследованной группе имели ИМ на фоне ОКС с подъемом сегмента ST, согласно оценке по шкале GRACE больные характеризовались низким и умеренным риском госпитальной летальности (средний показатель 100,6+25,0 баллов). Геморрагический риск по шкале CRUSADE соответствовал уровню в 16,1+11,6 балла (очень низкий риск крупного кровотечения во время госпитализации в стационаре). Формально согласно стандартным шкалам пациенты с ИМ имели незначительный риск развития конечных точек исследования.
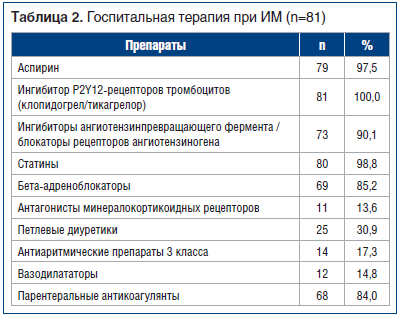
В стационаре пациенты получали стандартную коронароактивную терапию (табл. 2). Почти всем пациентам назначена двойная антитромбоцитарная терапия.
В течение госпитального периода лечения ИМ у пациентов, несмотря на суммарно низкий риск, достаточно часто развивались конечные точки. Значимые конечные точки за период наблюдения выглядели следующим образом (табл. 3).
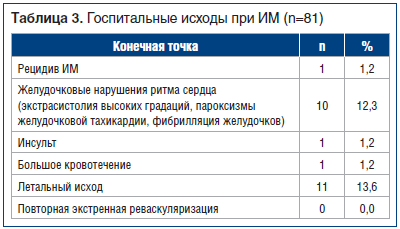
Все летальные исходы (n=11, 13,6%) являлись результатом текущего ИМ (сердечно-сосудистая смерть), осложнившегося кардиогенным шоком, жизнеугрожающими нарушениями ритма с неэффективной реанимацией. Обращает на себя внимание достаточно высокий уровень госпитальной летальности у пациентов с ИМ, несмотря на исходно невысокий расчетный риск ее развития. Такой уровень соответствует данным регистра
РЕКОРД-3 [10], где ранние госпитальные летальные исходы лишь в 39% (839 случаях) ассоциировались с GRACE более 140 баллов. Аналогичные данные были получены и в Кемеровском регистре ОКС за 2015 г., который также продемонстрировал развитие госпитальной летальности только в 24,9% (у 62 человек) из группы высокого риска осложнений [11].
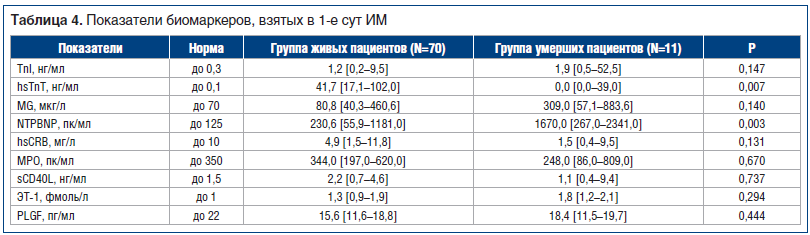
Медианы и интерквартильный интервал всех и изучаемых на 1-е сут биомаркеров представлены ниже (табл. 4), они для ряда показателей были выше норм, указанных производителями наборов. В большинстве случаев результаты были сопоставимы среди умерших и выживших в течение госпитального периода пациентов. Однако в группе умерших при поступлении с ИМ регистрировались достоверно меньшие средние значения hsТnT и значимо более высокие значения NTPBNP.
Дополнительно проведена стратификация пациентов в обеих группах с уровнями биомаркеров выше референсных значений в оцениваемых точках в разные сроки от начала ИМ. Согласно полученным данным (табл. 5), на 1, 2–3 и 7-е сут после ИМ регистрировалось сопоставимое количество диагностически значимых повышений следующих биомаркеров: MG, NTPBNP, hsCRB, MPO, ЭТ-1, sCD40L в группе умерших пациентов и hsТnT, MPO, ЭТ-1, PLGF — в группе выживших больных.
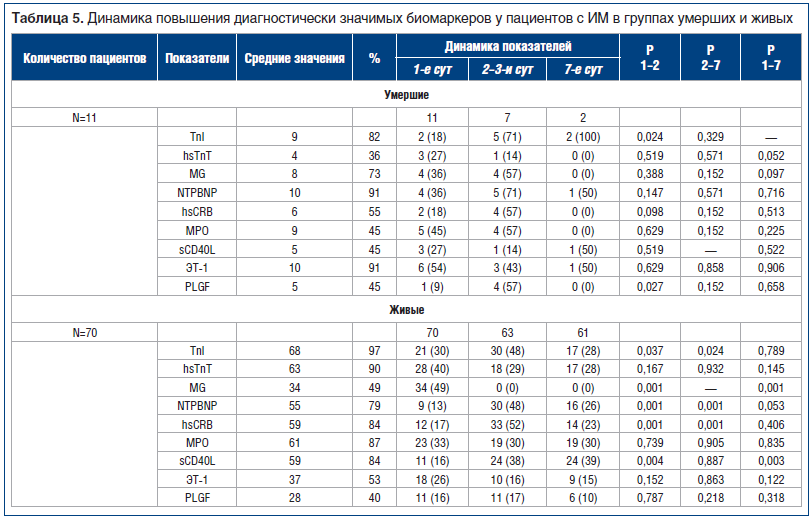
В группе умерших больных значимо чаще отмечались диагностически значимые повышения ТnI и PLGF на 2–3-и сут от начала ИМ по сравнению с 1-ми сут заболевания. Чаще выявлялись диагностически значимые повышения hsТnT на 1-е сут ИМ по сравнению с недельными результатами забора крови.
У выживших пациентов на 1-е сут ИМ по сравнению с другими сроками определения биомаркеров чаще регистрировались диагностически значимые повышения MG. На 2–3-и сут ИМ по сравнению со значениями 1-х и 7-х сут чаще выявлялись диагностически значимые повышения для ТnI, NTPBNP, hsCRB. Для sCD40L диагностически значимые повышения чаще регистрировались на 2–3-и и 7-е сут ИМ, чем на 1-е сут.
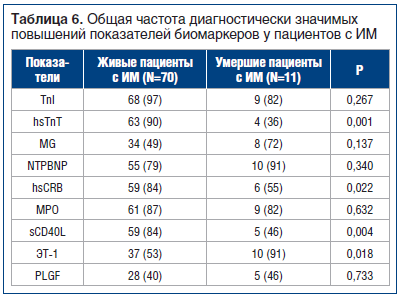
Согласно общей частоте выявления диагностически значимых повышений кардиомаркеров между сравниваемыми группами живых и умерших пациентов после развития ИМ было зарегистрировано сопоставимое число повышений для ТnI, MG, NTPBNP, MPO, PLGF, однако среди умерших больных были достоверно чаще выявлены повышения для ЭТ-1, реже — для sCD40L, hsCRB, hsТnT (табл. 6).
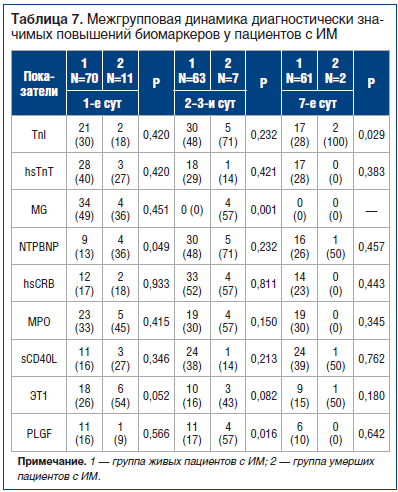
Сравнение межгрупповой частоты выявления диагностически значимых повышений маркеров у живых и умерших пациентов с ИМ в разные сроки заболевания показало, что в группе умерших пациентов на 1-е сут ИМ чаще регистрировались диагностически значимые повышения NTPBNP, на 2–3-и сут — MG и PLGF, на 7-е сут — ТnI (табл. 7).
При углубленном изучении было установлено, что из всех взятых у пациентов биомаркеров более мощным предиктором госпитальной летальности при ИМ в течение всего госпитального этапа лечения был hsТnT (табл. 8).
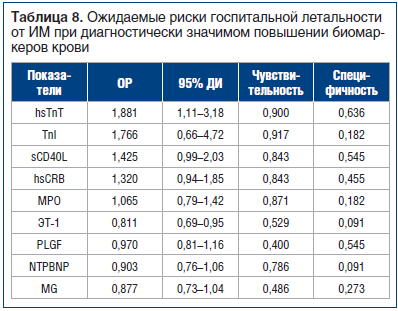
Обнаружение прироста ЭТ-1, отличного от референсного, напротив, ассоциировалось в исследуемой группе со снижением частоты возникновения летальных исходов. Тем не менее формально все изучаемые биомаркеры с показателем ОР > 1 могут рассматриваться для прогнозирования высокого риска госпитальной летальности.
Обсуждение результатов
Согласно данным литературы, на сегодняшний день продолжаются исследования с целью определения оптимальных по чувствительности и специфичности биомаркеров для прогнозирования неблагоприятного течения острых форм ИБС, помимо основного их свойства — детекции некротического повреждения миокарда [12–15]. Так, по данным Р.Р. Хафизова и соавт. [16], неоспоримой для этих целей остается значимость определения классических маркеров некроза миокарда (TnI, креатинфосфокиназы (ее общей и МВ фракции)), что подчеркивается и другими авторами [17–20]. Однако эти же авторы [16] в исследовании 126 пациентов с ИМ показывают высокую прогностическую значимость раннего определения маркеров нестабильности атеросклеротической бляшки (МРО) и острофазового ответа (hsCRB), особенно при переднем ИМ.
Помимо маркеров некроза миокарда высокую прогностическую значимость показали также биологические факторы оксидативного стресса [21], миокардиального растяжения и ремоделирования [22, 23], провоспалительные цитокины и факторы нестабильности атеросклеротической бляшки [24–28].
В настоящем исследовании биологические маркеры, формально не ассоциированные с некрозом миокарда, также показали свою высокую прогностическую значимость при повышении выше референсных значений.
Тем не менее не все авторы поддерживают «мультимаркерный» подход при рискометрии пациентов с ОКС. Например, согласно исследованию J.M. Poldervaart et al., большинство указанных биомаркеров не подтвердили значимой дополнительной прогностической ценности при сравнении с традиционными маркерами некроза миокарда, а также клинической, электрокардиографической и ультразвуковой диагностикой [29].
Несомненно, в настоящее время стандартным показателем для подтверждения/исключения наличия ИМ является высокочувствительный тропонин [19, 30], имеющий в 99% абсолютные изменения концентраций в течение 1-го ч острой ишемии миокарда. Однако и этот показатель не имеет абсолютной специфичности, что делает актуальной и перспективной дальнейшую апробацию мультимаркерного подхода помимо использования стандартных подходов к оценке риска у пациентов с ОКС.
Обращает на себя внимание то, что стандартные клинические шкалы оценки риска у пациентов с ОКС могут «занижать» риск потенциальных неблагоприятных, в т. ч. летальных, исходов. На популяции региона Севера России этот тезис получил свое очередное подтверждение, что уже было показано в ранее проведенных исследованиях [31].
Заключение: результаты исследования показали актуальность и обоснованность использования мультимаркерной модели оценки риска летальных исходов в течение госпитального этапа лечения у пациентов с ИМ.
Cписок литературы Вы можете найти на сайте http://www.rmj.ru
Информация с rmj.ru





