Содержание статьи
- 1 Введение
- 2 Хронические неинфекционные заболевания и воспаление
- 3 Факторы риска и причины воспаления, обусловленного старением
- 4 Цитокиновая гипотеза
- 5 Свободнорадикальная гипотеза (теория оксидативного стресса)
- 6 Генетическая предрасположенность
- 7 Клеточное старение (сенесценция)
- 8 Аутофагия
- 9 Микробиота и проницаемость кишечника
- 10 Старение и остеоартрит
- 11 Заключение
Введение
Наука о жизни и здоровье человека объединяет самые разные отрасли биологии, биотехнологии и медицины. В последние годы данная область стала одним из приоритетов мировой науки, поскольку является основой для обеспечения первоочередных потребностей человека, в т. ч. высокой продолжительности жизни. Многие десятилетия ученые пытаются анализировать огромный массив данных, которые могут объяснить механизмы, лежащие в основе старения организма. Это привело к появлению достаточно многочисленных теорий старения и оригинальных гипотез, порой совершенно не связанных друг с другом. Общее число таких гипотез уже сегодня составляет более 100. Их систематизация представляет собой крайне сложную задачу. В настоящее время благодаря достижениям молекулярной биологии, фундаментальной иммунологии, биоинформатики и генетики изучение процесса старения вышло на качественно новый уровень. С возрастанием продолжительности жизни и увеличением доли людей старшего возраста в общей популяции понимание того, почему старение способствует постепенному развитию хронической патологии, становится приоритетным направлением общественного здравоохранения, а не только сугубо гериатрической проблемой.
Хронические неинфекционные заболевания и воспаление
Клаудио Франчески в 2000 г. впервые использовал термин «воспалительное старение» (inflammaging), предложив гипотезу, основанную на целой серии наблюдений, показавших, что старение многих организмов, включая человека, сопровождается повышением уровня воспалительных маркеров в крови, клетках и тканях [1]. Это хроническое, стерильное, не связанное с наличием инфекционного агента, а в первую очередь обусловленное эндогенными сигналами, субклиническое (бессимптомное), слабовыраженное воспаление, которое ассоциируется со старением. Уже сегодня все больше и больше работ свидетельствуют о том, что «воспалительное» старение или воспаление, ассоциированное с возрастом, является фактором риска многих хронических неинфекционных заболеваний (ХНЗ), таких как сердечно-сосудистые (ИБС, артериальная гипертензия), метаболические (сахарный диабет 2 типа), костно-мышечные (остеоартрит (ОА), остеопороз, саркопения), неврологические (депрессия, деменция, болезнь Альцгеймера), онкогематологические (злокачественные новообразования, анемия) заболевания, что приводит к неблагоприятным последствиям для здоровья людей [2–4]. Многие исследователи сходятся во мнении о том, что количество нозологий не ограничивается указанным списком. Стратегия лечения заболеваний, в патогенезе которых преобладает воспаление, может включать, помимо ограничения калорийности питания и увеличения физической активности, применение лекарственных средств, действие которых направлено на его ограничение путем вмешательства в процессы внутри- и внеклеточной сигнализации на разных стадиях, а не только предполагает воздействие на основные клинические проявления или целевые показатели (артериальное давление, холестерин и сахар крови и т. д.).
Эпидемиологические исследования не дали достаточного количества доказательств в отношении того, первично ли воспаление в инициации ХНЗ и их прогрессирования, или воспаление развивается в ответ на основное патологическое состояние / болезнь. С этой точки зрения интересны результаты рандомизированных контролируемых исследований (РКИ), в которых изучали клинический ответ на действие лекарственных средств с мощным противовоспалительным действием при ХНЗ (табл. 1), таких как нестероидные противовоспалительные препараты, колхицин, генно-инженерные биологические препараты или низкомолекулярные препараты, ингибирующие Янус-киназы.
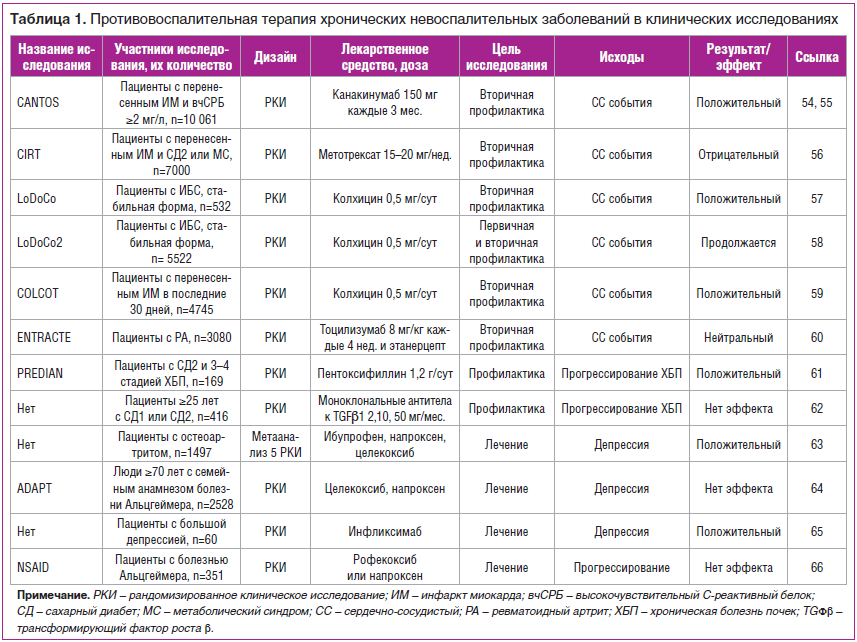
Пока мы можем принять положение о том, что хроническое воспаление является и фактором риска, и патогенетическим механизмом развития многих ХНЗ. Кроме того, субклиническое воспаление в пожилом возрасте часто развивается в контексте мультиморбидности, а в старшем возрасте — и гериатрических синдромов, включая старческую астению, что более очевидно. В любом случае воспаление, ассоциированное с возрастом, приводит к накоплению повреждений в органах и тканях, что в дальнейшем определяет неблагоприятный прогноз для жизни. Механизмы этих повреждений до конца не изучены, но всесторонний анализ литературы показывает, что воспаление неразрывно связано с катаболическими процессами.
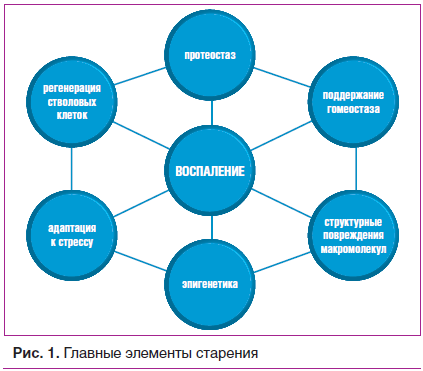
В последующих работах Клаудио Франчески развил свою гипотезу, выделив семь общих «столпов», на которых строятся его предположения об основных механизмах, вызывающих старение и, соответственно, развитие и прогрессирование возраст-ассоциированных заболеваний: адаптация к стрессу, эпигенетика, воспаление, структурные повреждения макромолекул, обмен веществ (поддержание гомеостаза), протеостаз и регенерация стволовых клеток (рис. 1). Важно понимать, что перечисленные механизмы старения не работают по отдельности, а взаимосвязаны, влияют друг на друга, образуя тем самым сложно интегрированную сеть. Все компоненты этой сети в большей или меньшей степени связаны с воспалением, оказывая влияние на его динамику и выраженность. Основной характеристикой воспаления, ассоциированного с возрастом, является хроническая активация врожденного иммунитета, где макрофагам принадлежит центральная роль. И.И. Мечников первым сформулировал теорию фагоцитоза, описал роль физиологического воспаления, которое является основным механизмом борьбы с патогеном и его нейтрализации. В обычных условиях воспалительные реакции разрешаются, когда устраняются экзо- (инфекции) или эндогенные факторы, вызвавшие воспаление. Однако при наличии некоторых, пока еще не определенных, причин, способствовавших сохранению длительной, но незначительной стимуляции иммунной системы, воспаление не переходит в устойчивое состояние разрешения.
Этот новый подход должен изменить традиционные взгляды, которые часто разделяют старение и возраст-ассоциированные заболевания. В действительности следует учитывать как вклад самого заболевания в ускорение старения, так и влияние процессов, связанных со старением, на развитие болезней в старшем возрасте. Исходя из вышеизложенного, актуальным является поиск новых путей, способствующих увеличению периода активного долголетия за счет использования новейших достижений науки и внедрения этих технологий в клиническую практику. Изучение базовых механизмов, лежащих в основе процесса старения, с целью его возможной предиктивной коррекции предупредит развитие необратимых повреждений.
Факторы риска и причины воспаления, обусловленного старением
Цитокиновая гипотеза
Старение ассоциировано с иммунной дисрегуляцией, что наиболее ярко проявляется наличием в крови провоспалительных медиаторов при отсутствии очевидных триггеров воспаления и одновременно снижением способности к разрешению воспалительной реакции на обычные иммуногенные стимулы. Уже давно известно, что у людей старшего возраста с хроническими неинфекционными заболеваниями отмечено повышение таких маркеров воспаления, как интерлейкин-1 (IL-1), антагонист рецептора интерлейкина-1 (IL-1RN), интерлейкин-6 (IL-6), интерлейкин-8, интерлейкин-13, интерлейкин-18 (IL-18), C-реактивный белок (CRP), интерфероны α и β (IFNα, IFNβ), трансформирующий фактор роста-β (TGFβ), фактор некроза опухоли альфа (TNFα) и его растворимые рецепторы (TNF 1A и 1B), сывороточный амилоид А [5, 6]. В настоящее время не представляется возможным составить полный перечень провоспалительных маркеров, связанных со старением. Однако следует отметить, что высокие уровни этих белковых соединений и пептидов выявляются у большинства пожилых людей, даже при отсутствии факторов риска и клинически активных ХНЗ.
Свободнорадикальная гипотеза (теория оксидативного стресса)
Существует тесная взаимосвязь между окислительным стрессом и воспалением, связанным со старением [7]. Эта теория была в 1956 г. представлена Денхамом Харманом, который предположил, что старение является результатом случайного повреждения тканей свободными радикалами. Согласно этой теории причиной нарушения функционирования клеток являются необходимые для многих биохимических процессов свободные радикалы — активные формы кислорода (АФК), которые в норме образуются в клетках в качестве побочных продуктов метаболизма [8]. Однако в определенных условиях АФК вызывают повреждения мембран, коллагена, ДНК, структурных белков, участвуют в эпигенетической регуляции экспрессии ядерных и митохондриальных генов, приводя к метилированию ДНК, влияют на внутриклеточный уровень кальция и т. д. Особенно опасно перекисное окисление полиненасыщенных жирных кислот в составе клеточных мембран, поскольку продукты реакции (пероксиды и гидропероксиды) сами обладают высоким окислительным потенциалом, что может привести к разрушению клеток в результате т. н. оксидативного стресса. Согласно этой теории достаточное потребление антиоксидантов с пищей может улучшить функцию иммунной системы за счет снижения уровней маркеров окислительного стресса [9].
Генетическая предрасположенность
В больших популяционных исследованиях было идентифицировано множество генетических вариантов, которые влияют на уровень воспалительных медиаторов в крови [10]. Изучение общих вариантов гена IL-1RN показало, что минорная аллель rs4251961 ассоциировалась с пониженным уровнем IL-1RN в сыворотке крови, а однонуклеотидный полиморфизм rs579543 также независимо связан с уровнем IL-1RN, в то время как гаплотип IL-1RN 1018 коррелировал с более высокими концентрациями IL-1 и ИФНγ. Эти выводы были подтверждены в нескольких независимых когортах, а дальнейшие исследования показали, что эти факторы влияют на патофизиологические механизмы и риск развития инсулинорезистентности и ОА коленных суставов [11–13].
Наличие однонуклеотидного полиморфизма в промоторной области гена IL-6 в позиции 174G/C связано с повышением продукции IL-6 в ответ на воспалительный стимул, однако эта последовательность не ассоциируется с уровнем базальной секреции IL-6. Носители мутации 174G/C имели повышенный риск развития различных заболеваний, включая болезнь Альцгеймера [14], сердечно-сосудистые заболевания [15], инсулин-независимый сахарный диабет [16], остеопороз [17] и системный хронический ювенильный артрит [18]. Полногеномный поиск ассоциаций среди долгожителей и лиц среднего возраста из Китая показал, что полиморфизм rs2069837 в гене IL-6 ассоциировался с высокой продолжительностью жизни, подтверждая связь этого цитокина с уровнем заболеваемости и смертности, особенно среди людей старших возрастных групп [19].
В других исследованиях было установлено, что некоторые варианты гена рецептора IL-6 связаны с повышенным риском ИБС, ревматоидного артрита, фибрилляции предсердий, аневризмы брюшной части аорты, а также предрасположенностью к бронхиальной астме, сахарному диабету 1 типа и депрессии [20, 21]. Мультилокусное секвенирование гена С-реактивного белка показало, что некоторые варианты полиморфизма ассоциируются с его высоким уровнем и нарастанием риска инфаркта миокарда и сердечно-сосудистой смерти [22]. Кумулятивный эффект этих генетических полиморфизмов может быть фактором риска мультиморбидности и старческой астении, хотя эта гипотеза нуждается в дальнейшей проверке. Исследование экспрессии генов у большой когорты населения Европы и США показало, что повышенный иммунный ответ и воспаление были тесно связаны со старением [23].
Клеточное старение (сенесценция)
Клеточная сенесценция — это необратимая потеря способности к делению. Предполагается, что этот феномен направлен на защиту от канцерогенеза и характеризуется блокадой клеточного цикла в стадии G1, потерей пролиферации, отсутствием реакции на ростовые факторы и устойчивостью к апоптозу. Стареющие клетки приобретают так называемый секреторный фенотип (SASP), связанный с сенесценцией, который проявляется секрецией широкого спектра растворимых молекул. Перечень этих молекул был уже обозначен, но следует отметить, что он может различаться в зависимости от типа клеток и триггерных факторов, но обычно включает интерлейкины (IL-1и IL-6), хемокины (IL-8), ростовые факторы (фактор роста фибробластов 2 и фактор роста гепатоцитов), металлопротеиназы (коллагеназа 3, стромелизин 1), другие нерастворимые белки и внеклеточные матричные компоненты. Эти секреторные молекулы в основном обеспечивают паракринный характер регуляции и могут вызывать развитие клеточного старения в соседних клетках, но некоторые из них высвобождаются в циркуляцию, поддерживая системное воспаление. Сенесцентные клетки можно распознать по специфическим маркерам, включая ингибитор циклинзависимой киназы 2A (известный как p16INK4A) и повышенную активность лизосомальной β-галактозидазы [24].
Исследования на лабораторных животных показали, что стареющие клетки накапливаются в различных органах и тканях экспоненциально с возрастом. У людей обнаружение маркеров старения наблюдалось в коже, Т-лимфоцитах, атеросклеротических бляшках, инсулинпродуцирующих клетках, почках, эндотелии сосудов, висцеральном жире, суставном хряще, сердечной мышце, печени и многих других тканях [25–27]. Некоторые ткани, вероятно, имеют большую склонность к развитию клеточной сенесценции, чем другие, но результаты исследований в этой области достаточно ограничены.
Аутофагия
Стабильность клеточных структур в течение жизни поддерживается сложным молекулярным механизмом, направленным на ликвидацию биологического «мусора» в виде клеточных органелл, агрегированных белков и других фрагментов. В клетках поврежденные макромолекулы и органеллы подвергаются физиологической переработке посредством аутофагии [28, 29]. Внеклеточный «мусор» распознается иммунной системой через различные рецепторы, в т. ч. паттерн-распознающие рецепторы, а затем деградирует путем поглощения везикулами. Целое семейство белков, обозначенное как DAMP (молекулярный фрагмент, ассоциированный с повреждением, — damage-associated molecular pattern), способно инициировать неинфекционный воспалительный ответ при их высвобождении из клетки в результате повреждения (некроза). В качестве DAMP могут выступать АТФ, окисленные кардиолипины, фрагменты ядерных и митохондриальных ДНК, секретируемые белки теплового шока, а также мочевая кислота, кристаллы холестерина и др. Накопление этих молекул может способствовать поддержанию воспаления, ассоциированного с возрастом [30, 31]. Например, DAMP определяются с помощью так называемых сенсорных молекул инфламмасом, в т. ч. NLRP3 (NOD-подобных рецепторов), в результате чего реализуется каспаза 1-зависимый механизм секреции провоспалительных цитокинов (IL-1, IL-18, интерлейкин 33). Известно, что у людей с возрастом отмечается повышение уровня IL-18 в крови. В исследовании на мышах было убедительно показано, что блокада NLRP3 инфламмасомы способствует продлению их жизни, а также снижению резистентности к инсулину и уменьшению потери костной ткани [32].
Висцеральное ожирение
Ожирение, особенно центрального типа, тесно ассоциируется с системным воспалением [33, 34]. Адипоциты, где бы они ни располагались, могут синтезировать провоспалительные и хемотаксические молекулы, такие как IL-6, IL-1, TNFα и C-C хемокин 2 (CCL2), а также гормоны, которые модулируют воспаление (адипонектин, лептин) [35]. Висцеральная жировая ткань людей с ожирением инфильтрирована Т-лимфоцитами, макрофагами и моноцитами. Т-лимфоциты секретируют IFNγ, что стимулирует выработку нескольких хемокинов из адипоцитов, в т. ч. CCL2, CCL5, C-X-C хемокин 9 (CXCL9) и CXCL10, которые еще больше усиливают миграцию Т-клеток в ткани. Количество B-лимфоцитов и макрофагов в висцеральной жировой ткани также увеличено и коррелирует с индексом массы тела [36].
Исследования на моделях животных показали, что в перитонеальной полости удается обнаружить повышенное количество TNF, IFNγ и гранзима B [37]. Цитокины, продуцируемые В-клетками, способствуют переключению адипоцитов к синтезу адипокинов и других провоспалительных агентов. Снижение массы тела за счет диетических ограничений или бариатрических вмешательств приводит к снижению продукции провоспалительных цитокинов в результате нормализации экспрессии специфических генов в белой жировой ткани, а также подавления активации инфламмасом. Кроме того, ограничение калорийности пищи сопровождается снижением уровня провоспалительных маркеров в крови [38]. Снижение массы тела в сочетании с физическими упражнениями улучшает функциональный статус людей с ожирением, что отражается на снижении риска сердечно-сосудистых заболеваний [39].
Микробиота и проницаемость кишечника
Одна из гипотез происхождения воспаления связана с изменениями в микробиоте кишечника. Несмотря на большую изменчивость микробиоты, которая обнаруживается в различных популяциях, географических регионах и условиях, научные данные свидетельствуют о том, что старение связано с уменьшением полезных комменсальных микроорганизмов, таких как Coprococcus, Faecalibacterium и Lactobacillus, а также снижением коэффициента Firmicutes/Bacteroides [40, 41]. Исчезновение этих микроорганизмов имеет важное значение, поскольку они не дают развиваться патогенной флоре, сохраняя при этом целостность кишечного барьера путем поддержания пристеночного брожения, производства слизи и липидных метаболитов, таких как короткоцепочечные жирные кислоты. Формирующийся дисбиоз может приводить к повышенной проницаемости слизистой оболочки кишечника, что будет способствовать попаданию в кровоток таких макромолекул, как DAMP, PAMP (патоген-ассоциированный молекулярный паттерн), MAMP (микроб-ассоциированный молекулярный паттерн). Все эти макромолекулы вызывают и поддерживают хроническое воспаление [42]. Дисбиоз становится более выраженным при наличии коморбидных заболеваний, таких как ожирение и сахарный диабет 2 типа у людей старшего возраста [43]. Также была показана тесная связь между изменениями в составе микрофлоры кишечника и выраженностью старческой астении. В кишечной флоре долгожителей отмечался повышенный состав Akkermansia, Bifidobacterium и Christensenellaceae, что обеспечивает нормальное функционирование иммунной системы, противовоспалительную активность, поддержание нормального метаболизма [44, 45].
В соответствии с существующими данными можно констатировать, что изменения в составе микрофлоры кишечника влияют на некоторые показатели здоровья пожилых людей, а ограничение калорий (доказанная стратегия увеличения продолжительности жизни на моделях животных) вызывает изменения микробиоты, что уменьшает воспаление и улучшает проницаемость кишечного барьера [46]. Здоровая флора кишечного тракта теоретически может поддерживаться за счет использования пробиотиков, пребиотиков или их сочетания [47–49]. Некоторые исследования показали, что эта стратегия позволяет снизить проявления системного воспаления, а не только воздействовать на центральное ожирение.
Старение и остеоартрит
Старение является одним из наиболее значимых факторов риска развития ОА. Многочисленные исследования указывают на то, что с возрастом заболевание прогрессирует, при этом могут поражаться крупные (коленные, тазобедренные) и мелкие суставы кистей и стоп, позвоночника [50]. Известно, что ОА является причиной развития болевого синдрома и снижения функциональной активности больных, что в дальнейшем приводит к общему ограничению индивидуальной жизнеспособности. Функциональные и структурные изменения в суставах, обусловленные ОА, не развиваются линейно, но имеют определенную связь с количеством прожитых лет, однако прогнозировать течение заболевания достаточно сложно. Еще одной особенностью людей пожилого возраста является мультиморбидность, когда у одного человека увеличивается количество хронических заболеваний, которые взаимно отягощают течение друг друга. Кроме того, старение сопряжено с появлением патологических состояний, которые хотя и имеют свое представительство в Международной классификации болезней, но никогда не занимают место основного заболевания. Эти состояния называют гериатрическими синдромами, которые имеют сложный и комплексный патогенез (старческая астения, саркопения, падения, инконтиненция, деменция, когнитивный дефицит, головокружение и т. д.). Лечение ОА в условиях мультиморбидности в сочетании с гериатрическими синдромами требует от врача соблюдения правил рациональной фармакотерапии и индивидуального подхода на основе знаний в области смежных специальностей.
Все представленные механизмы развития основных хронических неинфекционных заболеваний с акцентом на системное воспаление, ассоциированное с возрастом, в полной мере реализуются при ОА. Основная стратегия лечения ОА должна заключаться в применении нефармакологических методов и лекарственной терапии, направленной на подавление локального и системного воспаления, с учетом международных и отечественных клинических рекомендациий.
В этой связи вполне оправданным может служить подход к лечению ОА, учитывающий принципы биорегуляционной системной медицины. В основе этой модели лежит представление об организме человека как многоступенчатой и многоуровневой регуляторной сети, неотъемлемым свойством которой является саморегуляция. С учетом обсуждаемой концепции, а также положения о незавершенности воспаления при ОА были разработаны и широко используются в клинической практике биорегуляционные лекарственные препараты Траумель С и Цель Т, которые доступны в настоящее время в различных лекарственных формах (сублингвальные таблетки, раствор для внутримышечного и околосуставного введения, мази). Эти лекарственные средства имеют более чем 20-летнюю историю применения при ОА и травмах околосуставных мягких тканей (тендинитах, эпикондилитах, других повреждениях связочного аппарата) [51–53]. В основе многочисленных научных работ клинической направленности (наблюдательные сравнительные исследования) лежат указания на факты, свидетельствующие об активации процессов репарации, снижении признаков локального субклинического воспаления и уменьшении болей в суставах при ОА.
Заключение
Модулирующее действие биорегуляционных препаратов, вероятно, будет наиболее эффективным при их применении на ранней стадии ОА. При этом важно подчеркнуть, что имеющийся опыт применения препаратов Траумель С и Цель Т в качестве адъювантной терапии ОА показал, что количество нежелательных реакций не нарастало в условиях мультиморбидности. Таким образом, биорегуляционные препараты природного происхождения могут рассматриваться в качестве эффективной и безопасной адъювантной терапии ОА, в т. ч. для мультиморбидных пациентов, лечение которых представляет собой сложную задачу в связи с высоким риском развития нежелательных реакций.
Благодарность
Авторы и редакция благодарят компанию «Биологише Хайльмиттель Хеель» ГмбХ за предоставление полных текстов иностранных статей, требовавшихся для подготовки обзорной части данной публикации.
Информация с rmj.ru






