Влияние содержания таурина в плазме крови и генетической предрасположенности к диабету на изменение чувствительности к инсулину на фоне гипокалорийной диеты (реферат)
Введение
Таурин (2-аминоэтансульфоновая кислота) — доминирующая свободная аминокислота, которая составляет примерно 0,1% общей массы тела. Таурин поступает с пищей (мясо, морепродукты), а также может синтезироваться в организме из метионина и цистеина [1]. Метаболизм таурина непосредственно взаимосвязан с развитием ожирения, инсулинорезистентности и диабета. Результаты экспериментальных исследований на животных свидетельствуют о потенциальном положительном влиянии таурина на уровень глюкозы в крови и инсулинорезистентность [3, 4]. При сахарном диабете (СД) имеет место пониженное содержание таурина в крови [5–7]. По данным крупного эпидемиологического исследования, уровень выделения таурина с мочой (как мера оценки поступления таурина с пищей) обратно пропорционально взаимосвязан с сердечно-сосудистыми факторами риска [2].
Все больше данных указывает на то, что положительное влияние может быть опосредовано модификацией экспрессии генов ожирения [8–10], метаболизма липидов [11, 12] и диабета [13, 14]. Кроме того, выдвинуто предположение о том, что на риск возникновения заболевания влияют генетическая восприимчивость в сочетании с метаболическим статусом [15]. Авторам не удалось обнаружить исследований, в ходе которых изучалось влияние генетической восприимчивости и уровня циркулирующего таурина на риск развития СД у человека.
Цель исследования: оценить взаимосвязь между содержанием таурина в плазме крови и снижением инсулинорезистентности с позиций изменения характера питания (макронутриентов) у участников крупномасштабного рандомизированного исследования POUNDS Lost (Preventing Overweight Using Novel Dietary Strategies — предотвращение избыточного веса с помощью новых диетических стратегий) продолжительностью 2 года. Анализировалось модифицирующее влияние таурина на генетическую предрасположенность к сахарному диабету 2 типа (СД 2).
Содержание статьи
Материал и методы
Дизайн исследования
Исследование POUNDS Lost — это рандомизированное интервенционное исследование, в ходе которого сравнивали влияние вариантов гипокалорийной диеты с различным содержанием жиров, белков и углеводов на массу тела. Исследование проводилось в период с 2004 г. по 2007 г. Дизайн исследования, методы и результаты описаны ранее [16]. 811 человек с лишним весом или ожирением (средний возраст 51±9 лет; 64% женщин; ИМТ 33±4 кг/м2) были рандомизированы по 4 группам, в которых была назначена диета с различным содержанием жиров, белков и углеводов: группа 1 — 20%, 15% и 65%; группа 2 — 20%, 25% и 55%; группа 3 — 40%, 15% и 45%; группа 4 — 40%, 25% и 35% соответственно. Все участники исследования POUNDS Lost давали добровольное информированное согласие в письменном виде
В ходе исследования POUNDS Lost масса тела и обхват талии измеряли утром перед завтраком исходно, через 6 мес. и через 2 года. Уровень глюкозы натощак определяли в аналогичные сроки. Инсулинорезистентность оценивали с помощью индекса HOMA-IR (математическая гомеостатическая модель инсулинорезистентности), который рассчитывали следующим образом:
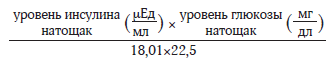
Секрецию инсулина оценивали с помощью индекса HOMA-B (математическая гомеостатическая модель β-клеток), который рассчитывали следующим образом:

[19].
Содержание таурина натощак определяли в апреле 2014 г. в образцах плазмы крови, хранившихся при температуре -80 °С [18, 19].
Генотипирование
ДНК экстрагировали из лейкоцитарной пленки центрифугированной крови с помощью набора QIAmp Blood Kit (Qiagen). Отобран 31 единичный нуклеотидный полиморфизм (SNP), на полногеномном уровне достоверно ассоциированный с развитием СД у лиц европеоидной расы [20]. Для каждого индивидуума авторы суммировали количество аллелей риска SNP, чтобы получить невзвешенный индекс генетического риска [21]. SNP, включенные в индекс генетического риска, были успешно генотипированы у 734 из 811 участников исследования. В доступных образцах ДНК частота успешного генотипирования составила 99%. Реплицированные образцы контроля качества (10%) были включены в каждую плашку генотипирования с конкордантностью более 99% [22]. В настоящее исследование были включены 711 человек, у которых исходно имелись как генетические данные, так и результаты измерения уровня таурина в плазме крови.
Статистический анализ
В качестве первичных исходов оценивали изменения уровней глюкозы натощак, инсулина натощак, инсулинорезистентности и секреции инсулина за период наблюдения. Исходные данные представлены в виде «среднее ± стандартное отклонение». Исходные характеристики сравнивали с использованием теста χ2 в случае категориальных переменных и обобщенных линейных моделей в случае непрерывных переменных. Влияние генетических факторов и изменения характера питания на исходы через 6 мес. и 2 года анализировали с помощью метода генерализованных оценивающих уравнений (GEE). Поправка на ковариаты для ретроспективных исходов в модели 1 осуществлялась на возраст, половую и расовую принадлежность, характер диеты, продолжительность ее соблюдения и исходную величину HOMA-IR. В модели 2 поправка осуществлялась на потерю веса. Потенциальную взаимосвязь между уровнем таурина и индексом генетического риска, а также между уровнем таурина и изменением характера питания оценивали путем включения соответствующих мультипликативных факторов в модели GEE.
В ходе вторичного анализа с помощью смешанных линейных моделей проверяли, меняется ли существенным образом характер влияния генетических факторов на снижение инсулинорезистентности в группах. В ходе анализа чувствительности эти ассоциации оценивали только у представителей европеоидной расы (~80% от всех испытуемых); выяснилось, что результаты одинаковы во всей популяции (данные не представлены).
Все представленные величины р были двусторонними. Различия считались статистически достоверными при p<0,05. Статистический анализ проводился с использованием пакета программного обеспечения SAS (версия 9.4).
Результаты исследования
Исходные характеристики испытуемых
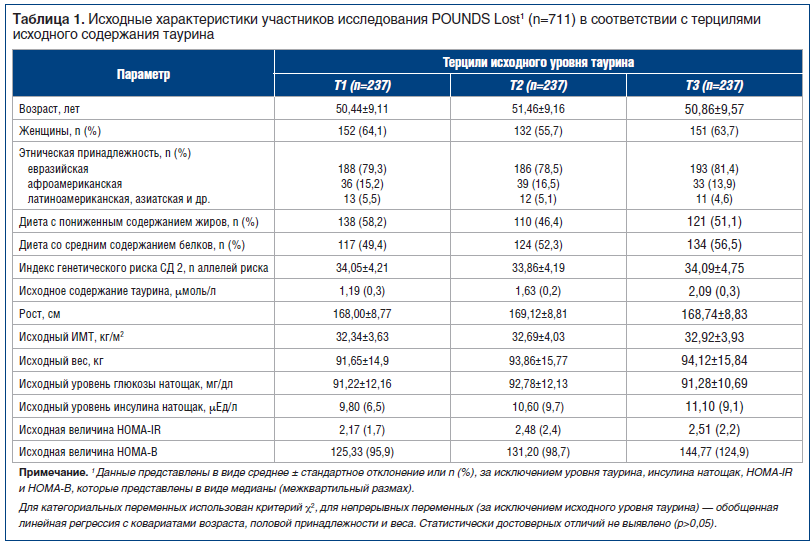
Исходные характеристики испытуемых в соответствии с терцилями исходного содержания таурина представлены в таблице 1. Медианы уровня таурина в соответствии с терцилями составили 1,19 μмоль/л, 1,63 μмоль/л и 2,09 μмоль/л. Распределение генетической предрасположенности к СД и характер распределения участников исследования по группам в зависимости от диеты по терцилям уровня таурина статистически достоверно не отличались (р>0,05).
Влияние содержания таурина в плазме крови и генетической предрасположенности
на уменьшение инсулинорезистентности
После внесения поправки на возраст, половую и расовую принадлежность, характер питания, продолжительность соблюдения диеты и исходную величину HOMA-IR оказалось, что взаимосвязь между исходным содержанием таурина и изменением инсулинорезистентности не достигла статистически достоверного уровня (β=-0,0125; р=0,47).
Количество аллелей риска в наименьшем, среднем и наибольшем терцилях индекса генетического риска (по 31 SNP) оказалось в пределах 15–31, 32–35 и 36–62 соответственно. Установлено, что больший индекс генетического риска ассоциирован с менее выраженным снижением инсулинорезистентности (р=0,03) и уровня глюкозы (р=0,008) при изменении характера питания по сравнению с меньшей генетической предрасположенностью к СД.
Влияние взаимосвязи между исходным содержанием таурина в плазме крови
и генетической предрасположенностью к СД
на изменение инсулинорезистентности
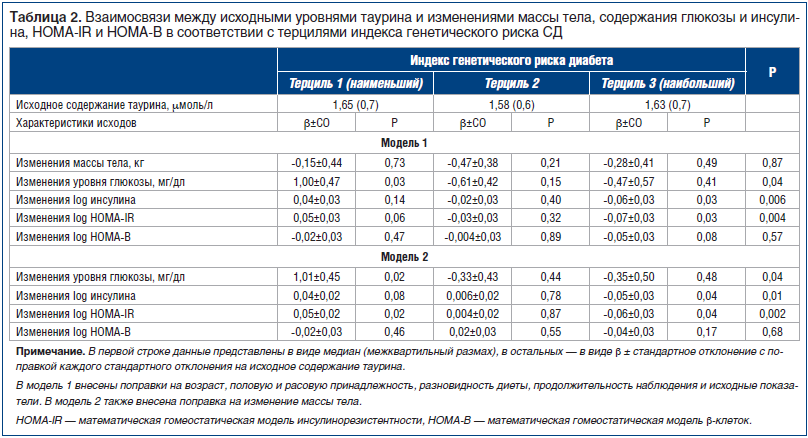
В таблице 2 представлена взаимосвязь между исходным уровнем таурина и изменениями веса, уровня глюкозы натощак, инсулинорезистентности (HOMA-IR) и секреции инсулина (HOMA-B) по терцилям индекса генетического риска СД 2 через 6 мес. и 2 года. Медианы исходного уровня таурина в соответствии с терцилями индекса генетического риска составили 1,65 μмоль/л, 1,58 μмоль/л и 1,63 μмоль/л соответственно (для линейного тренда р=0,47). В модель 1 внесены поправки на возраст, расовую и половую принадлежность, продолжительность соблюдения диеты и исходную величину для оценки ретроспективного исхода. В модель 2 дополнительно внесена поправка на снижение веса. В обеих моделях ассоциации были одинаковыми, причем даже после внесения поправки на снижение веса сохранялось выраженное влияние ассоциации таурин — индекс генетического риска на изменения уровня глюкозы, инсулина и HOMA-IR. Рисунок 1 иллюстрирует ассоциации между исходным содержанием таурина и прогнозируемыми изменениями гликемических параметров в соответствии с терцилями индекса генетического риска в модели 2. В модели 2 у испытуемых с наименьшим терцилем индекса генетического риска СД 2 исходное содержание таурина ассоциировалось с менее выраженным снижением уровня глюкозы натощак и HOMA-IR (для обоих показателей р=0,02), а у испытуемых с наибольшим терцилем индекса генетического риска СД 2 исходное содержание таурина — с более выраженным снижением уровня инсулина и HOMA-IR (для обоих показателей р=0,04). При этом значения р для ассоциации таурин — индекс генетического риска составили 0,04, 0,01 и 0,002 для изменений уровня глюкозы, инсулина и HOMA-IR соответственно (табл. 2). Статистически достоверного влияния ассоциации таурин — индекс генетического риска на HOMA-B не выявлено.
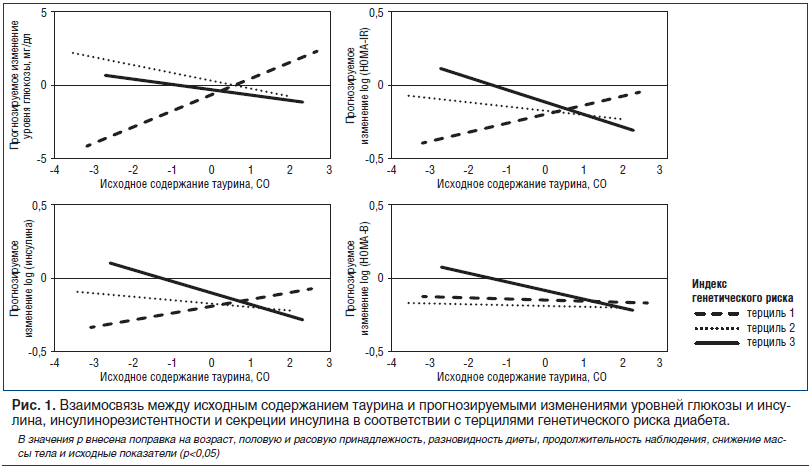
Изменение инсулинорезистентности
Для оценки динамики изменения инсулинорезистентности за время соблюдения диеты в группах с различным содержанием таурина и различными величинами индекса генетического риска были использованы смешанные линейные модели. Как уже сообщалось ранее [16], наиболее выраженное снижение инсулинорезистентности наблюдается через 6 мес., а через 2 года происходит регресс до исходного уровня. Такая регрессия отчасти может быть связана с несоблюдением диеты и возвратом к прежнему весу. Среди испытуемых с наименьшим и средним терцилем исходного содержания таурина взаимосвязь между генетической предрасположенностью к СД и уменьшением инсулинорезистентности статистически достоверно изменялась на протяжении 2 лет (р=0,05 для взаимосвязи индекс генетического риска — время) (рис. 2). Среди испытуемых с наибольшим терцилем исходного содержания таурина эта ассоциация статистически достоверно не изменялась на протяжении 2 лет (р=0,26 для взаимосвязи индекс генетического риска — время) (рис. 2).
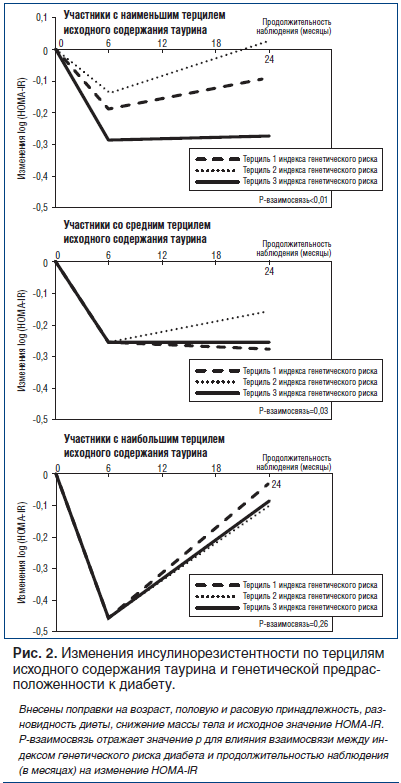
Обсуждение
В ходе рандомизированного интервенционного исследования по снижению веса путем изменения характера питания продолжительностью 2 года было установлено, что исходное содержание таурина в плазме крови статистически достоверно коррелирует с генетической предрасположенностью к СД 2 с позиций уменьшения инсулинорезистентности. Полученные данные свидетельствуют о том, что среди лиц с повышенной генетической предрасположенностью к СД исходно более высокое содержание циркулирующего таурина оказывает более благотворное влияние на снижение инсулинорезистентности на фоне гипокалорийной диеты, по сравнению с исходно более низким содержанием таурина. При этом взаимосвязь между таурином и генетической предрасположенностью к СД 2 не влияла на секрецию инсулина.
Полученные нами данные о модифицирующем влиянии исходного содержания таурина в крови на генетические факторы, определяющие инсулинорезистентность у человека, являются новыми, однако они не противоречат уже длительно существующей концепции взаимодействия ген — метаболит [15, 23]. Потенциальные механизмы положительного влияния таурина на патогенез СД — модуляция фосфорилирования белка IRS-1 (который ассоциирован с индексом генетического риска) [24] и содержания PPARα (транскрипционного фактора ядерного рецептора, затрагивающего метаболизм жирных кислот) [25], взаимодействие с рецептором инсулина с повышением чувствительности к инсулину [24, 26], влияние на антиоксидантную систему/воспаление [27] и регуляция экспрессии генов, ассоциированных с развитием СД [7, 13, 14, 28]. Среди этих регулирующих генов отдельного упоминания заслуживает ген рецептора γ, активируемого пероксисомными пролифераторами (PPARG) [29], который включен в индекс генетического риска СД 2. Описаны различные механизмы, посредством которых метаболиты осуществляют «тонкую настройку» экспрессии генов, в частности, рибосвитчи, прямое взаимодействие с транскрипционными факторами, регуляция кофакторов, ремоделирование хроматина, модификация хроматина и гормональная сигнализация [30]. Пока не установлено, на каком уровне взаимодействуют клеточные пути, регулируемые генетическими факторами риска развития СД 2 и индуцируемые под действием циркулирующего таурина. Но принимая во внимание представленные выше данные, можно предположить, что снижение инсулинорезистентности под влиянием взаимодействия таурин — индекс генетического риска по крайней мере отчасти отражает регулирующее действие таурина плазмы крови на экспрессию генов, ассоциированных с СД.
Еще одно возможное объяснение заключается в том, что способность таурина препятствовать ожирению [27] может опосредовать взаимодействие ген — таурин с позиций снижения инсулинорезистентности. Впрочем, этой гипотезе противоречит то, что мы наблюдали в ходе нашего исследования, а именно тот факт, что изменение массы тела лишь в незначительной степени затрагивало эффекты взаимодействия ген — таурин. Для уточнения характера подобных функциональных механизмов необходимы новые экспериментальные и клинические исследования.
Для оценки общей вероятности развития СД мы подсчитали генетическую предрасположенность к СД на основании 31 доказанного варианта, предрасполагающего к СД 2, которые были идентифицированы в ходе полногеномных исследований. Как мы и предполагали, выяснилось, что повышенная генетическая предрасположенность к СД ассоциирована с менее контролируемым уровнем глюкозы в крови и менее выраженным снижением инсулинорезистентности на фоне гипокалорийной диеты. Среди испытуемых с меньшим содержанием таурина более выраженное уменьшение инсулинорезистентности отмечено у лиц с меньшей генетической предрасположенностью, чем у лиц с повышенной генетической предрасположенностью (рис. 2). Подобные наблюдения могут быть использованы в целях персонализированной медицины. Впрочем, в повседневной клинической практике приходится обращать внимание на стоимость генетических и/или метаболомических исследований с позиций эффективности подобного индивидуализированного лечения, особенно в группах высокого риска.
Уровень циркулирующего таурина отчасти контролируется за счет изменения скорости его биосинтеза в печени, где он также утилизируется посредством конъюгации с желчными кислотами. Не исключено, что поступающие с пищей жиры способны влиять на содержание циркулирующего таурина путем модуляции экскреции желчных кислот. Так, в ходе опытов на животных установлено, что аминокислоты, поступающие с пищей, могут влиять на метаболизм таурина [31]. Впрочем, мы не отметили какого-либо выраженного влияния диеты (как изменения характера питания в целом, так и конкретного варианта) на уровень циркулирующего таурина (данные не представлены) или влияния взаимосвязи между таурином и составом макронутриентов на инсулинорезистентность. Также не выявлено влияния взаимосвязи между таурином и генетической восприимчивостью к диабету на секрецию инсулина, хотя результаты предшествующих исследований позволяют предположить, что таурин улучшает функционирование островков поджелудочной железы [32, 33].
Насколько нам известно, в ходе этого продолжительного рандомизированного исследования было впервые проанализировано влияние взаимосвязи между содержанием циркулирующего таурина и общей генетической предрасположенностью к диабету на инсулинорезистентность. Мощность данного исследования повышается благодаря анализу исходов во множестве временных точек. Кроме того, модель GEE устойчива к выбору коррелирующих структур и гибка с позиций отсутствия каких-то данных по сравнению с другими моделями [34].
Тем не менее очевидно, что данное исследование обладает недостаточной мощностью в плане выявления незначительных ассоциаций между таурином и инсулинорезистентностью или взаимосвязей между таурином и питанием. Кроме того, полученные результаты не могут быть экстраполированы на популяцию в целом в полной мере, поскольку 80% испытуемых составляли лица европеоидной расы.
Заключение
Таким образом, выявлено влияние взаимосвязи между исходным содержанием таурина в крови и генетической предрасположенностью к диабету на инсулинорезистентность в ответ на изменение гипокалорийной диеты в течение 2-х лет. В зависимости от существующего генетического фона и исходного содержания циркулирующего таурина гипокалорийная диета может оказывать благоприятное воздействие на инсулинорезистентность различной выраженности.
Реферат подготовлен редакцией «РМЖ» по материалам статьи: Zheng Y., Ceglarek U., Huang T. et al. Plasma Taurine, Diabetes Genetic Predisposition, and Changes of Insulin Sensitivity in Responseto Weight-Loss Diets. J Clin Endocrinol Metab. 2016;101(10):3820–3826. DOI:10.1210/jc.2016–1760.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Информация с rmj.ru