Содержание статьи
Актуальность
Анкилозирующий спондилит (АС) представляет собой хроническое воспалительное заболевание из группы спондилоартритов, характеризующееся обязательным поражением крестцово-подвздошных суставов (КПС) и/или позвоночника и частым вовлечением в патологический процесс энтезисов и периферических суставов. Прогрессирование заболевания связано с пролиферацией костной ткани, проявляющейся ростом синдесмофитов и процессом анкилозирования КПС, что определяет необратимые функциональные ограничения и высокий риск инвалидизации молодых пациентов [1, 2]. В настоящее время возможности терапии АС в плане торможения структурного прогрессирования существенно расширились за счет генно-инженерных биологических препаратов: ингибиторов фактора некроза опухоли альфа (ФНО-α) и ингибиторов интерлейкина (ИЛ) 17, с некоторым преимуществом последних [3].
В то же время при данном заболевании не редкость и внескелетные проявления с поражением внутренних органов, в частности сердечно-сосудистой системы (ССС) [2, 4]. В реальной клинической практике в большинстве своем патологию выявляют на поздних стадиях, например в виде поражения аортального клапана, а субклинические ранние изменения (нарушения ритма сердца, дисфункция эндотелия, диастолическая дисфункция), способные приводить в дальнейшем к жизнеугрожающим состояниям, остаются недиагностированными [4, 5]. Тем более остается малоизученным влияние терапии основного заболевания на указанные изменения.
Существует мнение о влиянии хронического системного воспаления при ревматологических заболеваниях на автономную регуляцию деятельности сердца, основанное на наличии обратной корреляционной взаимосвязи между величиной основных показателей вариабельности сердечного ритма и уровнями острофазовых маркеров (СОЭ, С-реактивного белка, фибриногена) [5]. С другой стороны, повышение уровней провоспалительных цитокинов (ИЛ-6, ФНО-α и др.) происходит и при самих кардиоваскулярных заболеваниях, в частности при хронической сердечной недостаточности с сохраненной фракцией выброса, особенно у пациентов с коморбидной патологией [6]. В исследованиях при АС отмечена корреляционная связь между активностью заболевания и толщиной интимы, скоростью пульсовой волны сонных артерий [7], а также изменение жесткости сосудистой стенки, что может служить маркером поражения ССС у пациентов с АС [8].
При этом повышенный сывороточный уровень эндотелиального фактора роста сосудов (Vascular endothelial growth factor — VEGF) отмечен как предиктор рентгенологического прогрессирования спондилита у пациентов со спондилоартритами [9], а рентгенологическое прогрессирование обусловлено активацией зависимых от ИЛ-23 гамма-дельта клеток, продуцирующих ИЛ-17 [10]. Соответственно, можно предположить, что имеется взаимосвязь между указанными показателями и сосудистой дисфункцией. Так, описано, что зависимые от ИЛ-23 гамма-дельта клетки, продуцирующие ИЛ-17, аккумулируются в аортальном клапане у пациентов с АС [11]. Кроме того, повышенный уровень ИЛ-17 ассоциируется с высокой активностью системных васкулитов, болезни Бехчета [12, 13]. Интерес представляет работа, где ИЛ-17 рассматривается как проатерогенный биомаркер, поскольку у кардиологических пациентов его уровни были выше по сравнению со здоровым контролем (p<0,001), и он коррелировал с уровнем общего холестерина сыворотки крови и триглицеридов [14]. Проатерогенные эффекты ИЛ-17 могут быть вызваны индукцией провоспалительных цитокинов или хемокинов эндотелиальными клетками или макрофагами. Продемонстрировано, что ИЛ-17 и ИЛ-23 обнаруживаются в атеросклеротических бляшках и ассоциируются с их повышенной уязвимостью, экспрессия ИЛ-17 в сонных артериях человека связана с фиброзным фенотипом с более низким содержанием макрофагов и высоким содержанием гладкомышечных клеток [15].
При другом заболевании из группы спондилоартритов, псориатическом артрите, продемонстрирована роль ИЛ-17 в ухудшении функции эндотелия и потенциальном повышении риска сердечно-сосудистых событий [16]. При этом ингибирование ИЛ-17 в эксперименте показывает положительное влияние на вазодилятацию, уменьшение жесткости эндотелия, подавление прогрессирования атеросклероза и тенденцию к снижению VEGF, а также металлопротеиназ [17].
Соответственно, снижение уровня ИЛ-17 представляется перспективным в отношении кардиоваскулярного благополучия у пациентов со спондилоартритами [17]. Так, на фоне 52 нед. терапии секукинумабом (ингибитором ИЛ-17А) у пациентов с псориазом улучшение кожных проявлений коррелировало с уменьшением воспалительной реакции сосудистой стенки аорты [18].
Цель исследования: установить взаимосвязь между приемом секукинумаба и изменениями в систолической и диастолической функциях миокарда у пациентов с АС.
Материал и методы
Было обследовано 69 пациентов с достоверным АС (согласно модифицированным Нью-Йоркским критериям, 1984 г.). В 1-ю группу вошли 33 пациента, получавших секукинумаб в стандартной дозе не менее 3 мес. на момент обследования. 2-ю группу составили 36 пациентов, сопоставимых по возрасту, полу, основным параметрам заболевания с 1-й группой и не получавших генно-инженерную биологическую терапию (ГИБТ) (табл. 1).
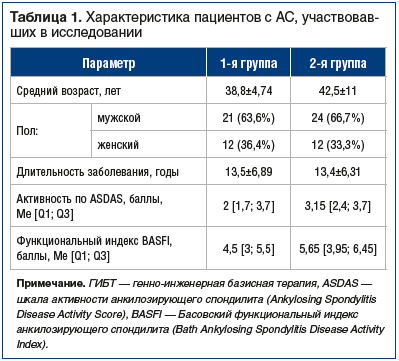
Контрольная группа включала в себя 40 практически здоровых лиц: 26 мужчин и 14 женщин (средний возраст — 40,5±13,3 года), соответствующих по возрасту и полу первым двум группам.
В исследование не включались пациенты с такими верифицированными хроническими сопутствующими заболеваниями, как сахарный диабет, ишемическая болезнь сердца, артериальная гипертензия 2–3 стадии, кардиомиопатии, клапанные пороки сердца. До включения в исследование пациенты подписывали информированное согласие установленной формы.
Обследование пациентов с АС проводили согласно рекомендациям Международного общества по оценке спондилоартритов (Аssessment of SpondyloArthritis International Society — ASAS), Европейской лиги по борьбе с ревматизмом (European League Against Rheumatism — EULAR) и Федеральным клиническим рекомендациям по диагностике и лечению АС (болезнь Бехтерева) 2018 г.
Всем пациентам проводились стандартные лабораторные и инструментальные диагностические исследования, включавшие в себя общие анализы крови и мочи, биохимический анализ крови, рентгенографию и/или магнитно-резонансную томографию позвоночника и крестцово-подвздошных сочленений (в 1-й и 2-й группах). Кроме того, нами выполнялась тканевая допплерография сердца на ультразвуковом аппарате GE Vivid E9 (GE Healthcare, Израиль), трансторакальная эхокардиография, а также определение уровня матриксной металлопротеиназы (MMП) -9 в сыворотке крови.
Тканевая допплерография, деформации и скорости деформации миокарда могут выявить субклиническую дисфункцию миокарда, когда традиционные эхокардиографические параметры оказываются в пределах нормы. Известно, что трансторакальная эхокардиография недостаточно информативна при диагностике диастолической дисфункции по сравнению с тканевой допплерографией сердца в связи с тем, что при стандартной эхокардиографии влияет наличие преднагрузки, а при тканевой этого влияния нет [19, 20]. Поэтому в условиях отсутствия верифицированного поражения миокарда в исследуемых группах нами был использован этот диагностический метод для выявления возможных ранних патологических изменений в мышце сердца.
В ходе тканевой допплерографии нами проводились стандартные вычисления: e’L — пиковая скорость движения кольца митрального клапана в раннюю диастолу, e’S — пиковая скорость движения перегородки в раннюю диастолу, e’R — пиковая скорость движения кольца трикуспидального клапана в раннюю диастолу, S’L — пиковая систолическая скорость движения кольца митрального клапана, S’S — пиковая систолическая скорость движения межжелудочковой перегородки, S’R — пиковая систолическая скорость движения кольца трикуспидального клапана, E/e’ левого желудочка — отношение скорости ранней фазы трансмитрального кровотока к скорости раннего диастолического движения фиброзного кольца митрального клапана, E/e’ правого желудочка — отношение скорости ранней фазы транстрикуспидального кровотока к скорости раннего диастолического движения фиброзного кольца трикуспидального клапана.
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2013. Статистический анализ проводился с использованием программы Statistica 10.0 (StatSoft.Inc, Россия). Совокупности количественных показателей, распределение которых отличалось от нормального, описывались при помощи значений медианы (Me) и нижнего и верхнего квартилей [Q1; Q3]. Номинальные данные описывались с указанием абсолютных значений и процентных долей. Количественные показатели оценивались на предмет соответствия нормальному распределению, для этого использовался критерий Шапиро — Уилка. Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовался U-критерий Манна — Уитни. При сравнении нескольких выборок количественных данных, имеющих распределение, отличное от нормального, использовался критерий Краскела — Уоллиса. Сравнение номинальных данных проводилось с помощью точного критерия Фишера. С целью изучения связи между явлениями, представленными количественными данными, распределение которых отличалось от нормального, использовался непараметрический метод — расчет коэффициента ранговой корреляции Спирмена. Критическим уровнем статистической значимости принималась величина 0,05.
Результаты исследования
При проведении трансторакальной эхокардиографии были получены следующие результаты (табл. 2). В случае выявления различий при сравнении всех групп с помощью критерия Краскела — Уоллиса для более точного описания наблюдаемых тенденций был использован критерий Манна — Уитни, позволяющий оценить различия показателей при сравнении групп попарно. При этом было обнаружено, что у лиц, страдающих АС, достоверно выше индекс массы миокарда левого желудочка по сравнению с контрольной группой (1-я группа, р=0,008, 2-я группа, р=0,002). Аналогичная картина наблюдалась и в отношении фракции выброса. Несмотря на то, что во всех исследуемых группах она не выходила за рамки нормы, в 1-й и 2-й группах она была достоверно выше (р=0,02, р=0,002 соответственно).

В ходе исследования было проведено сравнение показателей тканевой допплерографии между группами (табл. 3). Установлены статистически значимые различия: е’L в 1-й группе и контрольной были выше по сравнению с показателем 2-й группы (p=0,01 и p=0,002 соответственно); е’S у пациентов, принимавших секукинумаб, выше по сравнению со 2-й и контрольной группами (р=0,009 и р=0,049 соответственно), а во 2-й группе ниже, чем в контрольной (р=0,03); параметры S’S, S’R в 1-й группе оказались выше, чем в контрольной (р=0,008, р=0,001 соответственно).
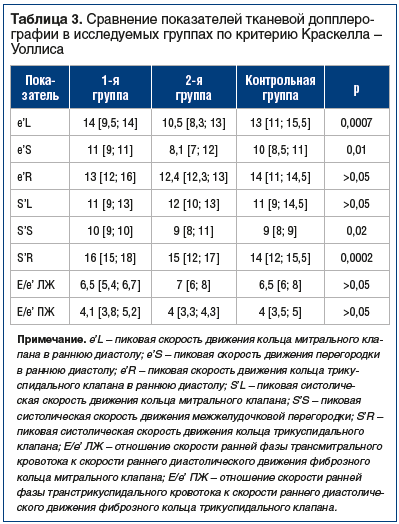
Достоверные различия количественных параметров были подкреплены сравнением частоты выявления диастолической дисфункции в исследуемых группах. Оказалось, что диастолическая дисфункция диагностировалась только во 2-й группе: из 36 человек — у 14 (38,9%), что статистически значимо отличается от двух других групп (р<0,0001).
Анализ уровня MMП-9 в сыворотке крови исследуемых лиц выявил значимые его различия в группах. Как в 1-й, так и во 2-й группе он был выше, чем в группе контроля:
176,26 [165,7; 186,03], 170,66 [131,01; 190,44], 103,85 [74,32; 120,56] нг/мл соответственно (р<0,001).
Корреляционный анализ показал, что в группе пациентов, принимавших секукинумаб, отмечается обратная связь средней силы между S’R и уровнем ММП-9
(r= -0,53, р=0,02), между E/e’ ЛЖ и уровнем ММП-9 (r= -0,49, р=0,04), а также прямая связь средней силы между конечным диастолическим размером левого желудочка и ММП-9 (r=0,58, р=0,01). Во 2-й группе корреляционной связи не обнаружено.
Обсуждение результатов
Известно, что воспалительная реакция в организме способствует увеличению массы миокарда [6, 14]. Повышение провоспалительных цитокинов ассоциируется с прогрессированием атеросклероза, эндотелиальной дисфункции и хронической сердечной недостаточности [6, 7, 15]. Так, высокие концентрации ИЛ-17 опосредуют изменения в кровеносных сосудах, печени, сердечной и скелетных мышцах. Воздействие ИЛ-17 на сосудистые и сердечные клетки может способствовать повышению риска сердечно-сосудистых событий, которые происходят у всех пациентов с воспалительными заболеваниями [15]. Проведенное исследование, действительно, показало, что у пациентов с АС индекс массы миокарда левого желудочка достоверно выше, чем в контрольной группе, причем среди пациентов, не принимающих ГИБТ, он оказался наиболее высоким, что соотносится с воспалительным фактором, описанным выше. Увеличение массы миокарда у пациентов с АС в нашем исследовании ожидаемо сопровождается увеличением фракции выброса по сравнению с таковым в группе контроля. Однако следует отметить, что у всех исследуемых лиц этот параметр не выходил за пределы нормы, поэтому говорить о значимом влиянии АС на фракцию выброса можно лишь в сравнительном контексте.
Такой показатель тканевой допплерографии, как пиковая скорость движения различных областей в раннюю диастолу (e’L, e’S, e’R), характеризует диастолическую функцию миокарда, и его снижение является ранним маркером нарушения этой функции. Нами выявлено, что у пациентов с АС, не использовавших секукинумаб, оказались наиболее низкими пиковые скорости движения кольца митрального клапана и перегородки в раннюю диастолу по сравнению с таковыми в двух других группах. Иными словами, у этих лиц обнаруживаются ранние доклинические признаки диастолической дисфункции миокарда (напомним, у всех пациентов отсутствовали клинические признаки сердечной недостаточности). Это подтверждается сравнением не только количественных параметров, но и частоты распространения диастолической дисфункции, определяемой рядом показателей и соотношений (например, E/e’), которая была достоверно выше во 2-й группе.
В 1-й группе исследуемых лиц было выявлено повышение систолической скорости движения перегородки и кольца трикуспидального клапана S’S и S’R по сравнению с группой контроля. Подобные изменения трактовались как усиление систолической функции на фоне применения секукинумаба. Учитывая то, что у этих пациентов не было других возможных факторов, способствующих повышению систолической функции (различные гемодинамические нарушения, пороки и т. п.), был сделан вывод о том, что применение секукинумаба сопровождается достоверным усилением сократительной функции миокарда, причем в большей степени правого желудочка и межжелудочковой перегородки. Как известно, ревматические заболевания склонны приводить к различным кардиологическим нарушениям. В частности, для спондилоартритов характерна высокая частота субклинического поражения миокарда, в т. ч. с развитием диастолической дисфункции [4, 5, 8, 15, 17]. На фоне этого особенно привлекательным выглядит возможность секукинумаба усиливать сократимость миокарда у пациентов с АС.
Уровень ММП был выше у лиц с АС. Это объясняется воспалительным характером заболевания, вовлечением в патологический процесс соединительной ткани. Действительно, ИЛ-17 также участвует в процессе ангиогенеза, синтезе металлопротеиназ и С-реактивного белка [15]. Соответственно, активность АС может сопровождаться повышением уровня ММП-9. У пациентов 1-й группы увеличение уровня ММП-9 сопровождается снижением систолической скорости движения кольца трикуспидального клапана, отношения скорости ранней фазы трансмитрального кровотока к скорости раннего диастолического движения фиброзного кольца митрального клапана, а также расширением конечного диастолического размера левого желудочка. Судя по всему, в этой группе пациентов подъем уровня ММП, будучи маркером разрушения соединительной ткани, ассоциируется с ухудшением систолической функции правого желудочка и диастолической функции левого желудочка.
Выводы
Для АС характерна высокая частота субклинического поражения ССС в виде диастолической дисфункции миокарда, что определяет целесообразность проведения углубленного обследования (тканевой допплерографии) таким пациентам, особенно с высокой активностью основного заболевания и кардиоваскулярными рисками. Уровень ММП-9 может служить маркером дисфункции миокарда у пациентов с АС.
Ингибирование ИЛ-17 как ключевого цитокина в патогенезе АС способно уменьшать диастолическую дисфункцию, а значит, и прогрессирование сердечной недостаточности. Это подтверждается улучшением сократительной способности миокарда на фоне терапии секукинумабом.
.
Информация с rmj.ru



