Влияние различных видов сахароснижающей терапии на концентрацию бета-гидроксибутирата у пациентов с сахарным диабетом 2 типа
Содержание статьи
Введение
Лечение ингибиторами натрий-глюкозного котранспортера 2 типа (ИНГТ-2) пациентов с атеросклеротической болезнью сердца и сосудов и высоким риском сердечно-сосудистых событий связано с уменьшением сердечно-сосудистой смертности и госпитализаций по поводу сердечной недостаточности [1, 2]. Хотя положительное влияние ИНГТ-2 на сердце и сосуды обусловлено множеством факторов, гиперкетонемия представляется одним из важных потенциальных механизмов [3]. Суть этого механизма состоит в обеспечении находящегося в условиях гипоксии миокарда энергией, получаемой из бета-гидроксибутирата — «бережливого» энергетического субстрата, требующего меньшего расхода кислорода для образования АТФ по сравнению с глюкозой и лактатом [3]. С другой стороны, лечение ИНГТ-2 потенциально ассоциировано с развитием эугликемического диабетического кетоацидоза (ДКА), состояния, при котором на фоне околонормальных значений гликемии развивается клиническая картина кетоацидоза [4]. ДКА является ургентным состоянием, которое может вызвать обезвоживание, гипотензию, потерю сознания, отек мозга, а в некоторых случаях приводить к летальному исходу. В 2015 г. Управление по контролю за продуктами и лекарствами США (FDA) опубликовало предупреждение о повышенном риске ДКА, связанного с применением ИНГТ-2 [5]. Ввиду малой доступности выраженность кетонемии не исследуется в повседневной клинической практике. Уточнение важности мониторинга кетонемии и кетонурии при терапии ИНГТ-2, определение клинических ситуаций, в которых он будет показан, имеет большое клиническое значение.
Цель исследования: оценить динамику уровня бета-гидроксибутирата в крови на фоне лечения ИНГТ-2 в сравнении с другим широко используемым классом сахароснижающих препаратов — ингибиторами дипептидилпептидазы-4 (иДПП-4).
Материал и методы
В исследование включали пациентов с сахарным диабетом 2 типа с неудовлетворительным контролем гликемии на фоне монотерапии метформином, которые никогда не получали терапию ИНГТ-2 или иДПП-4. Критериями включения были: возраст 20–75 лет, содержание гликированного гемоглобина (HbA1c) от 7,5 до 10% и скорость клубочковой фильтрации (СКФ) по CKD-EPI >60 мл/мин на 1,73 м2. Критериями исключения из исследования были: инсулинотерапия или получение других сахароснижающих препаратов, прием препаратов, снижающих массу тела, и/или бариатрическая хирургия в анамнезе за последний год. Пациенты были распределены в 2 группы, сопоставимые по полу, возрасту, длительности диабета, показателям HbA1c и индексу массы тела (ИМТ). В исследование были включены 46 пациентов: 21 пациент — в исследуемую группу, 25 — в контрольную группу. В течение 3 мес. в исследуемой группе пациенты получали дапаглифлозин 10 мг/сут, в контрольной группе — вилдаглиптин 100 мг/сут. Образцы крови забирали натощак (время голодания составляло от 8 до 12 ч, накануне исключали прием алкоголя). Концентрацию НbA1c оценивали методом аффинной хроматографии (Bio-Rad, США) (норма <6%); биохимические показатели (креатинин, мочевину в сыворотке и моче, липидный спектр) определяли с использованием реактивов и анализатора Cobas Integra 400 plus (Roche, Франция); концентрацию бета-гидроксибутирата в сыворотке измеряли с помощью фотометрического метода (реактивы фирмы DiaSys, Германия) (референсный диапазон 0,02–0,27 ммоль/л). Выбор бета-гидроксибутирата как оцениваемого показателя связан с тем, что он составляет около 80% циркулирующих кетонов и является более стабильным в крови, чем ацетоацетат и ацетон. Повышение уровня бета-гидроксибутирата выше верхней границы референсного диапазона расценивали как наличие гиперкетонемии.
Статистический анализ проводили с использованием пакета статистического программного обеспечения STATISTICA 10 (StatSoft Inc, США). Данные представлены как среднее ± стандартное отклонение (M±SD) или в виде медианы и квартилей (Me, 25% квартиль — 75% квартиль) в случае ненормальности распределения. Различия между группами анализировали с использованием U-критерия Манна — Уитни. Корреляционный анализ проводили с использованием рангового коэффициента корреляции Спирмена. Нулевая гипотеза отвергалась при р<0,05.
Результаты исследования и обсуждение
Пациенты в обеих группах не отличались друг от друга по оцениваемым показателям (табл. 1). В обеих группах уровень HbA1c и уровень глюкозы натощак превышали целевые значения. Средний ИМТ был повышен и соответствовал I степени ожирения. Средние уровни АД находились в целевом диапазоне. Уровень бета-гидроксибутирата был в пределах нормальных значений до начала терапии.
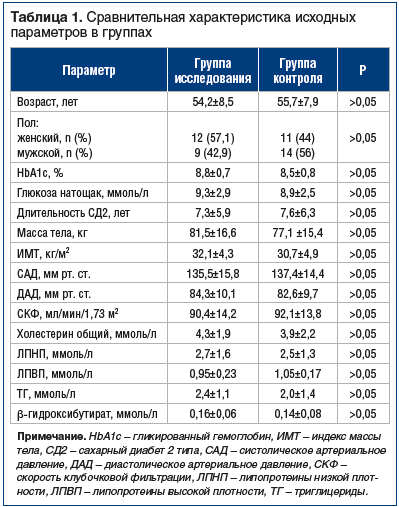
На фоне терапии дапаглифлозином отмечалось значимое снижение концентрации HbA1c с 8,8±0,7% до 7,4±0,5% (р=0,005), глюкозы плазмы натощак с 9,3±2,9 ммоль/л до 7,3±1,2 ммоль/л (р=0,007). Через 3 мес. в группе дапаглифлозина отмечалось снижение массы тела на 2,4±1,9 кг. В группе вилдаглиптина также отмечалось снижение концентрации HbA1c и глюкозы плазмы натощак, хотя и менее выраженное (с 8,5±0,8% до 7,9±0,5% (р=0,01) и с 8,9±2,5 ммоль/л до 7,8±1,4 ммоль/л (р=0,009) соответственно). При этом в группе вилдаглиптина не отмечалось изменения массы тела и ИМТ через 3 мес. терапии по сравнению с исходными значениями. Увеличивалась концентрация бета-гидроксибутирата по сравнению с исходным уровнем до лечения (0,24±0,13 против 0,16±0,06, p=0,003). В группе дапаглифлозина концентрация бета-гидроксибутирата через 3 мес. лечения была значимо выше, чем в группе вилдаглиптина (0,24±0,13 против 0,17±0,05, р=0,006). Гиперкетонемия была выявлена у 5 пациентов (23,8%) в группе дапаглифлозина и у 1 (4%) пациента в группе вилдаглиптина (р=0,035). Тем не менее ни у одного из пациентов не было зафиксировано клинических симптомов, таких как тошнота, рвота, одышка, усталость или спутанность сознания.
Не было получено статистически значимых корреляций между повышением концентрации бета-гидроксибутирата и возрастом пациента, длительностью диабета, уровнем СКФ, изменением HbA1c. Отмечалась слабая отрицательная корреляция изменения концентрации бета-гидроксибутирата и динамики массы тела (r= -0,48, p=0,02), но не ИМТ (r= -0,32, p=0,09).
В настоящем исследовании показано, что уровень бета-гидроксибутирата увеличивается в ходе терапии дапаглифлозином по сравнению с терапией вилдаглиптином. Полученные результаты согласуются с данными других исследований, в которых у пациентов с диабетом, получавших ИНГТ-2, происходило увеличение концентрации кетоновых тел в крови по сравнению с контрольными группами [6–8]. Развитие гиперкетонемии не сопровождалось появлением каких-либо клинических симптомов и не потребовало отмены терапии ни у одного из пациентов.
Хотя точный физиологический механизм, ответственный за развитие кетогенеза, вызванного ИНГТ-2, изучен не полностью, считается, что основным фактором является изменение соотношения инсулина и глюкагона вследствие уменьшения секреции инсулина в ответ на снижение уровня глюкозы в плазме за счет глюкозурии и увеличения секреции глюкагона за счет меньшей стимуляции альфа-клеток глюкозой и снижения паракринного влияния инсулина [9]. В среднем расчетное молярное отношение внутрипеченочного инсулина к глюкагону снижается с 9 до 7 натощак и с 29 до 24 во время еды [10]. Эти изменения способствуют липолизу жировой ткани, активации кетогенеза в печени и увеличению концентрации кетоновых тел в крови. Считается, что уменьшение потребления углеводов, значимое снижение доз инсулинов, сопутствующие острые заболевания и обострения хронических, употребление алкоголя могут предрасполагать к развитию ДКА. Риск ДКА может быть выше также у пациентов с длительным анамнезом СД2, с недостаточностью β-клеток или при латентном аутоиммунном диабете у взрослых (LADA) [4].
Однако данные по влиянию ИНГТ-2 на риск развития ДКА остаются противоречивыми. Так, в одном из исследований, в котором анализировали базы данных отчетов о нежелательных реакциях, риск ДКА у пациентов, получавших ИНГТ-2, был значимо выше, чем у пациентов, получавших иДПП-4 [11]. В другом исследовании на основе базы данных за 2 года также сравнивали влияние терапии ИНГТ-2 и иДПП-4 на риск ДКА. Отношение рисков (ОР) ДКА для ИНГТ-2 составило 2,2 (95% ДИ 1,4–3,6) [12]. Однако в этом исследовании не учитывали недавнюю историю инфекций, включая инфекции верхних дыхательных путей, мочевыводящих путей и желудочно-кишечного тракта, или использование лекарств, которые влияют на функции почек, таких как диуретики, ингибиторыангиотензинпревращающего фермента или антагонисты рецепторов ангиотензина II. C другой стороны, метаанализ 81 исследования показал, что прием ИНГТ-2 не ассоциирован с риском развития ДКА [13]. Wang et al. также показали, что применение ИНГТ-2 не повышало риск ДКА по сравнению с применением других пероральных антигипергликемических препаратов [14]. Тем не менее анализируемые группы не были полностью идентичными, что могло отразиться на результатах исследования. В 2018 г. были опубликованы результаты общенационального популяционного когортного исследования, в котором сравнивали данные 56 325 пациентов в группе ИНГТ-2 с данными 974 179 пациентов в группе иДПП-4 [15]. За время наблюдения было зарегистрировано 63 случая ДКА. Не было получено увеличения риска госпитализации по поводу ДКА в группе ИНГТ-2 по сравнению группой иДПП-4 (ОР 0,956; 95% ДИ 0,581–1,572; р=0,996). Частота госпитализаций по поводу ДКА в течение первых 30 дней после начала терапии ИНГТ-2 составила 2,501 случая на 1000 человеко-лет, что было значимо больше, чем в течение последующих 3 лет наблюдения (0,614 случая на 1000 человеко-лет). При этом не было получено различий в риске ДКА между двумя группами в зависимости от времени, прошедшего после начала приема препарата. Применение ИНГТ-2 ассоциировалось с незначительным повышением риска ДКА у пациентов с диабетическими микрососудистыми осложнениями (ОР 2,044; 95% ДИ 0,900–4,640; p=0,088) и у пациентов, принимающих диуретики (ОР 3,648; 95% ДИ 0,720–18,480; p=0,118). Среди факторов, которые могут влиять на результаты исследования, надо отметить его ретроспективный характер и отсутствие рандомизации, а также отсутствие данных по дозаминсулинов,продолжительности СД, уровню ИМТ и некоторых результатов лабораторных исследований (например, уровня С-пептида). В целом развитие ДКА на фоне применения ИНГТ-2 при СД2 встречается с частотой менее 0,2% [16, 17]. В большинстве случаев это наблюдается в первые 2 мес. использования препаратов [11, 18, 19]. При развитии таких симптомов, как тошнота, рвота, особенно после приема алкоголя или недавнего снижения дозы инсулина, может быть полезным увеличение потребления жидкости и углеводов. Пациентам следует временно прекратить прием ИНГТ-2, обратиться к своему врачу и ввести дополнительную дозу ультракороткого инсулина вместе с приемом углеводов и достаточным количеством жидкости [20]. Как показали результаты нашего исследования, у пациентов с длительностью СД2 менее 10 лет, не получавших инсулин и не имеющих признаков абсолютной инсулинопении, без тяжелых сопутствующих заболеваний терапия дапаглифлозином не приводила к развитию ДКА.
Заключение
Необходимы дальнейшие проспективные исследования с надлежащими лабораторными тестами для выявления пациентов, которые склонны к развитию у них ДКА в начале лечения ИНГТ-2. Врачи должны учитывать риски ДКА при старте ИНГТ-2, однако с учетом низкой вероятности развития ДКА рутинный мониторинг кетоновых тел, в т. ч. бета-гидроксибутирата, нецелесообразен.
Информация с rmj.ru

