Влияние противопаразитарной терапии на течение бронхиальной астмы у детей
Содержание статьи
Введение
Бронхиальная астма (БА) — хроническое полиэтиологическое воспалительное заболевание дыхательных путей, занимающее первое место среди хронической бронхолегочной патологии в детском возрасте. Распространенность БА в мире достигает 24%, в России ее удельный вес среди взрослого населения превышает 5%, у детей — более 10% [1–3].
Наряду с наследственной предрасположенностью в развитии атопической БА важное значение имеют факторы окружающей среды, в частности паразитозы. Прямо или косвенно паразиты влияют на слизистую оболочку бронхов, т. к. имеется филогенетически обусловленное морфологическое сходство между бронхиальным и кишечным эпителием, происходящим из «первичной кишки» [4]. При этом наблюдаются рост количества тучных клеток в эпителии слизистых оболочек, значительные изменения и увеличение в 2–4 раза числа эпителиальных бокаловидных клеток, повышение количества секретируемой ими слизи, отек слизистой оболочки бронхов, бронхоспазм [5].
В ряде исследований показано, что паразитарная инвазия сопровождается более высокими показателями кожной реактивности к аллергенам, повышением уровня общего IgE и эозинофилов крови, снижением показателей внешнего дыхания и ассоциирована с гиперреактивностью бронхов, а также с высоким риском развития БА [6–8]. Зарубежными учеными была установлена взаимосвязь перенесенной в раннем возрасте паразитарной инвазии и уменьшения реактивности кожного аллергологического тестирования в последующем [9, 10]. Отечественные исследователи доказали значительное влияние паразитарной инфекции на потенцирование неспецифической сенсибилизации к распространенным аллергенам. Авторы отмечают положительное влияние антипаразитарного лечения на течение БА, бронхообструктивного синдрома и проявления аллергии в целом, а также увеличение кожной реактивности, однако исследования в этом направлении малочисленны и, как правило, описываются в общих чертах с точки зрения паразитологов [11].
Таким образом, несмотря на значительные успехи в изучении БА, на сегодняшний день роль факторов окружающей среды, а также механизмы превентивного или провоцирующего эффекта некоторых факторов, таких как паразитозы, по-прежнему, до конца не изучены.
Цель исследования: изучить клинические и иммунологические особенности БА у детей с паразитарной инвазией до и после противопаразитарной терапии.
Материал и методы
Нами было проведено проспективное сравнительное исследование 75 детей с атопической БА (средний возраст 6,3±0,68 года). Диагноз БА устанавливался согласно «Федеральным клиническим рекомендациям по диагностике и лечению бронхиальной астмы» (Москва, 2016) [12]. Выборка детей проводилась сплошным методом по обращаемости за медицинской помощью в период обострения болезни. Аллергологическое обследование пациентов проводилось в специализированных аллергологических кабинетах поликлиники ГБУЗ РБ ГДКБ № 17, многопрофильного медицинского центра «Клиника аллергологии и педиатрии» (г. Уфа). Для углубленного обследования дети были госпитализированы в педиатрическое отделение ГБУЗ РБ ГДКБ № 17 (г. Уфа).
Всем пациентам с установленной БА было проведено углубленное аллергологическое и иммунологическое обследование: изучение аллергологического анамнеза, анализ имеющихся результатов аллергологического обследования по данным медицинской документации; кожное аллергологическое тестирование с бытовыми, пыльцевыми, пищевыми, эпидермальными и грибковыми аллергенами; оценка уровня общего IgE; специфического IgE к бытовым, пыльцевым, пищевым, эпидермальным и грибковым аллергенам; определение уровня эозинофилов сыворотки крови; спирография и пикфлоуметрия; цитологическое исследование назального и бронхиального секрета.
С целью верификации паразитарной инвазии использовали метод иммуноферментного анализа и стандартные микроскопические методы исследования. Всем детям с выявленной паразитарной инвазией была проведена эрадикационная антипаразитарная терапия препаратом албендазол, который эффективен в отношении большинства кишечных нематод, а также ларвальных (личиночных стадий) цестод и лямблий. Препарат назначали в дозе 200 мг или 400 мг внутрь однократно или в течение 3 дней по показаниям и в зависимости от возраста ребенка, как рекомендовано инструкцией к препарату. При этом все родители/опекуны подписали добровольное информированное согласие на обследование и лечение. При проведении противопаразитарной терапии не было отмечено каких-либо побочных эффектов или осложнений. Наблюдение за пациентами с БА составило 3 года после проведенной противопаразитарной терапии. С целью выявления реинвазий и повторных инвазий всем пациентам проводилось многократное копроскопическое исследование на протяжении всего периода наблюдения. При обнаружении яиц гельминтов или цист лямблий повторяли противопаразитарную терапию. При изучении катамнеза особое внимание уделялось динамике основных клинических симптомов БА (степень тяжести, частота обострений, уровень контроля), изменению показателей внешнего дыхания и данных аллергологического обследования.
Статистическая обработка полученных результатов проводилась с использованием статистической программы Statistica 6.0. Для определения достоверности различий в альтернативных выборках в связи с распределением показателей, отличным от нормального, использовали U-критерий Манна — Уитни. Распределение качественных переменных сравнивали при помощи критерия c2 Пирсона с поправкой Йетса. Количественные признаки характеризовали с помощью расчета медианы и квартилей (Me [Q25; Q75]). Качественные показатели были представлены в виде абсолютного числа наблюдений и доли (%) от общего числа больных по выборке в целом или в соответствующей группе. Пороговое значение статистической значимости принималось равным 0,05.
Результаты и обсуждение
Комплексная диагностика паразитозов показала: паразитарная инвазия была выявлена у 30 из 75 детей с БА, что составило 40%. Таким образом, обследуемые дети были разделены на 2 репрезентативные группы для дальнейшего обследования и наблюдения: 1-я группа — дети с БА без паразитарной инвазии (45 пациентов), 2-я группа — дети с БА и паразитозами (30 пациентов).
При изучении клинического течения БА установлено, что атопическая форма заболевания регистрировалась у всех исследуемых детей, независимо от наличия паразитоза. По степени тяжести среди пациентов 1-й группы достоверно чаще отмечалась легкая интермиттирующая БА (46,7%, p=0,041, χ2=4,188), среди инвазированных больных — легкая и среднетяжелая персистирующая БА, хотя различия не были статистически значимы (рис. 1).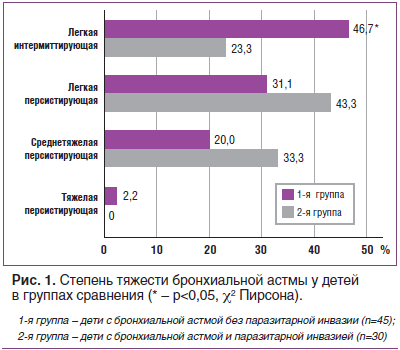
Обострения БА развивались у всех детей, независимо от наличия паразитоза. При этом редкие обострения (1–2 раза в год) значимо чаще отмечались у неинвазированных больных (40,0%, p=0,013). У детей с паразитарной инвазией, напротив, наблюдались частые обострения: 3–5 раз — 73,4% (p=0,119), более 5 раз в год — 13,3% (p=0,164) (табл. 1).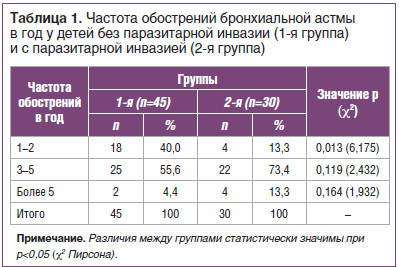
Объем базисной противовоспалительной терапии у детей с БА определялся в соответствии с положениями «Федеральных клинических рекомендаций по диагностике и лечению бронхиальной астмы» [12]. В качестве средств базисной терапии использовались антагонисты лейкотриеновых рецепторов у 23,3 и 14,8% пациентов в 1-й и 2-й группах соответственно (p=0,333, χ2=0,937). В топических глюкокортикостероидах нуждались 39,5% детей без инвазии и 40,7% больных паразитозами (p=0,809, χ2=0,058). Комбинированные препараты, содержащие глюкокортикостероид и бронхолитик длительного действия, использовали 37,2% пациентов 1-й группы и 44,4% — 2-й (p=0,630, χ2=0,231). Необходимость в использовании бронхолитиков в качестве средств неотложной помощи отмечалась у 42,2% неинвазированных детей с БА и у 70,0% пациентов с БА и паразитозами (p=0,016, χ2=4,52). В стационарном лечении с целью купирования приступов БА нуждались 26,7% детей 1-й группы и 40,7% детей 2-й группы (p=0,225, χ2=1,471). Аллергенспецифическую иммунотерапию (АСИТ) получали 24,0% неинвазированных детей и 38,5% больных БА в сочетании с паразитозами (p=0,152, χ2=2,048).
При этом, несмотря на адекватный объем базисной противовоспалительной терапии, неконтролируемое течение заболевания отмечали у 28,6 и 66,7% (p=0,0012, χ2=10,426), частично контролируемое — у 57,1 и 33,3% (p=0,038, χ2=4,309) пациентов в 1-й и 2-й группах соответственно. Контролируемая БА была установлена у 14,3% детей 1-й группы и не установлена ни у одного ребенка во 2-й группе (p=0,039, χ2=4,276).
Аллергический ринит (АР) сопутствовал БА одинаково часто у детей 1-й и 2-й групп (78,6 и 77,8%, p=0,91, χ2=0,013). Сочетание АР с симптомами конъюнктивита наблюдалось с одинаковой частотой у неинвазированных и инвазированных больных БА — 9 (20,0%) и 6 (20,0%) соответственно (p=0,768, χ2=0,087). Атопический дерматит регистрировался у 10 (33,3%) детей с паразитозами и лишь у 8 (17,8%) неинвазированных больных (p=0,122, χ2=2,388).
Повышение уровня общего IgE наблюдалось у 40 (88,9%) детей с БА и у 22 (73,3%) больных с сочетанной патологией (p=0,076, χ2=2,051). Гиперэозинофилия периферической крови регистрировалась в 68,8% случаев у пациентов с БА и паразитарной инвазией и лишь у 41,1% неинвазированных больных (p=0,024, χ2=4,419).
Результаты кожного аллергического тестирования показали, что у всех детей с БА, независимо от наличия паразитарной инвазии, ведущую роль играли бытовые аллергены (рис. 2).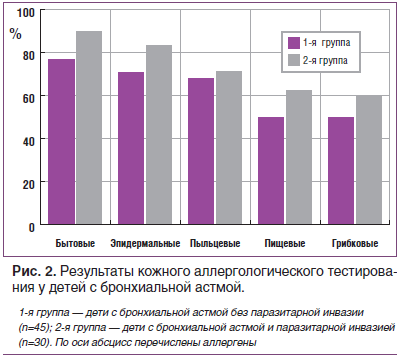
В группе неинвазированных больных с БА, равно как и у детей с паразитозами, наиболее часто отмечалась бытовая аллергия — 76,7 и 90,9% (p=0,180), несколько реже — эпидермальная (70,8 и 83,3%, p=0,347), пыльцевая (68,2 и 71,4%, p=0,837), пищевая (50,0 и 62,5%, p=0,436); грибковая (50,0 и 60,0% соответственно, p=0,639).
Среди ведущих бытовых аллергенов были зарегистрированы в 1-й группе клещи Dermatophagoides pteronyssinus (82,8%), домашняя пыль (76,7%) и клещи Dermatophagoides farina (75,9%); во 2-й группе исследуемых — домашняя пыль и клещи Dermatophagoides pteronyssinus (по 95,5%), Tyrophagus putrescentiae (90,6%). При этом у детей с сочетанным течением БА и паразитозов достоверно чаще определялась аллергия: к домашней пыли (p=0,007); аллергенам шерсти собаки (p=0,008) и морской свинки (p=0,001); кукурузной муке (p=0,027), рыбе (хек), (p=0,034), грецкому ореху (p=0,034), ананасу (p=0,018), грейпфруту (p=0,01) и землянике (p=0,018); грибкам Aspergillus fumigatus (p=0,036) и Candida albicans (p=0,024). У пациентов 1-й группы, напротив, значимо чаще отмечались положительные результаты кожного тестирования к следующим пыльцевым аллергенам: одуванчику (p=0,012), полыни (p=0,042), тимофеевке (p=0,022).
По результатам определения аллергенспецифических IgE у неинвазированных детей с БА наиболее часто определялась бытовая сенсибилизация (72,2%), реже — пищевая (69,2%), пыльцевая и эпидермальная (по 55,6%); в группе больных с БА и паразитозами — сенсибилизация к бытовым, пищевым, эпидермальным и грибковым аллергенам, хотя различия не достигли статистической значимости. Средний уровень аллергенспецифического IgE значимо отличался у исследуемых детей только на аллерген трески и был достоверно выше у пациентов 1-й группы (5,5 [4,0; 9,0], p=0,024).
Функция внешнего дыхания была исследована у 21 пациента с БА методом спирографии. Анализ результатов спирометрического исследования показал нарушение бронхиальной проходимости у 27,3% детей в 1-й группе и у 60,0% — во 2-й (p=0,004, χ2=8,333). Нарушение функции внешнего дыхания сопровождалось снижением основных показателей — форсированной жизненной емкости легких и объема форсированного вдоха за 1 с более чем на 20% от должного значения.
Также нами был проведен цитологический анализ бронхиального секрета у обследованных детей с БА, неинвазированных и инвазированных паразитами. Полученные данные показали, что более высокий средний уровень лимфоцитов (9 [6; 18], p=0,721), макрофагов (5 [3; 6], p=0,580) и эозинофилов (2 [0; 8], p=0,181) бронхиального секрета был отмечен у детей в 1-й группе по сравнению с пациентами 2-й группы. Средний уровень нейтрофилов, напротив, был выше у пациентов 2-й группы (47 [26; 54], p=0,202), хотя различия не были статистически значимы.
Всем детям с выявленной паразитарной инвазией проводилась эрадикационная антипаразитарная терапия. Динамика клинических симптомов БА и результатов повторного аллергологического обследования у исследуемых детей оценивалась в конце периода наблюдения.
Определение степени тяжести БА после противопаразитарной терапии показало (табл. 2), что в группе ранее инвазированных пациентов наблюдалось увеличение количества детей с легкой степенью тяжести (p=0,0001), число пациентов со средней персистирующей степенью тяжести, напротив, уменьшилось с 33,3 до 6,7% (p=0,0098).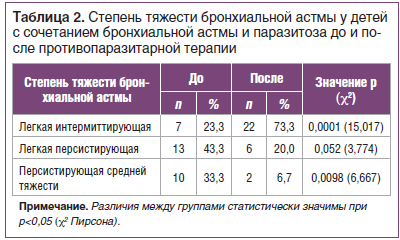
После противопаразитарной терапии число обострений БА в год значительно уменьшилось у всех детей. Так, у большинства детей (72,8%) наблюдались редкие обострения (1–2 в год). От 3 до 5 обострений в год отмечалось лишь у 9,0% пациентов с БА, что значимо отличалось от аналогичных данных, полученных на начальном этапе исследования. Стойкая длительная ремиссия (более 1 года) регистрировалась у 18,2% детей (рис. 3).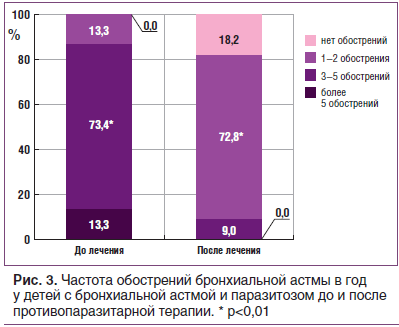
На начальном этапе наблюдения среди детей с БА в качестве средств базисной противоаллергической терапии использовались антагонисты лейкотриеновых рецепторов лишь у 14,8% пациентов, после противопаразитарной терапии — у 24,0% (p=0,317, χ2=1,002). В ингаляционных глюкокортикостероидах нуждались 40,7% больных БА и паразитозами, после противопаразитарного лечения — 44,0% (p=0,793, χ2=0,068). При этом уменьшилось число детей, использующих комбинированные препараты, содержащие глюкокортикостероид и бронхолитик длительного действия, с 44,4 до 24,0% (p=0,100, χ2=2,7). Необходимость применения короткодействующих бронхолитиков в качестве средств неотложной помощи наблюдалось у 11 детей (36,7%), до лечения — у 21 пациента (70,0%), p=0,0072, χ2=10,248. Лечение в условиях стационара с целью купирования приступов БА не проводилось ни у одного пациента среди ранее инвазированных больных, что свидетельствовало об отсутствии тяжелых обострений.
Количество детей с высоким уровнем эозинофилов бронхиального секрета во 2-й группе было меньше, чем в 1-й группе, и не отличалось от таковых на конечном этапе наблюдения (22,2 и 20,0% соответственно; p=0,372, χ2=0,108). Однако наблюдалось уменьшение среднего уровня эозинофилов крови и общего IgE у детей с БА после антипаразитарной терапии (табл. 3).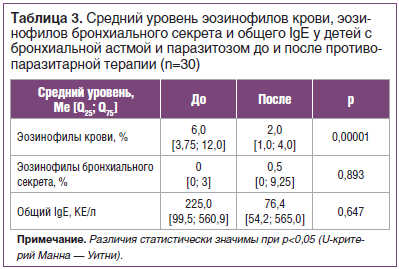
Кожное аллергологическое тестирование, проведенное в конце наблюдения у пациентов 2-й группы, показало увеличение значимости бытовых (p>0,05) и пыльцевых (p>0,05) аллергенов. При этом частота положительных результатов кожных аллергопроб уменьшилась на эпидермальные (p>0,05) и грибковые аллергены (p>0,05), с достоверностью различий — на пищевые аллергены (p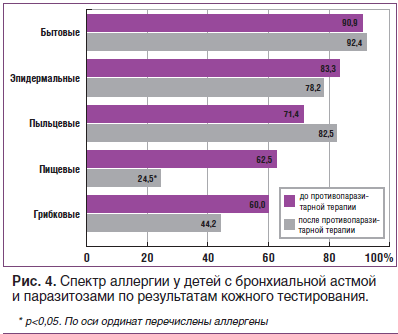
Заключение
Таким образом, инвазия паразитами у детей с БА является частым коморбидным состоянием и способствует более тяжелому персистирующему течению БА, снижению показателей внешнего дыхания, повышению уровня эозинофилов крови и общего IgE, кожной реактивности к распространенным аллергенам по результатам кожного аллергологического тестирования. Противопаразитарная терапия приводит к достоверному уменьшению частоты обострений и степени тяжести БА, улучшению контроля над заболеванием, снижению уровня эозинофилов крови, повышает объективность аллергологической диагностики. Полученные данные целесообразно учитывать специалистам в своей практической работе, особенно в случае недостаточной эффективности проводимой базисной терапии у детей с БА.
Информация с rmj.ru






