Влияние полиморфизмов Arg389Gly и Ser49Gly гена ADRB1 на эффективность лечения бисопрололом у больных стабильной стенокардией, перенесших инфаркт миокарда
Введение
Увеличение продолжительности и качества жизни больных, перенесших инфаркт миокарда (ИМ), является главной задачей профилактики у них повторных сердечно-сосудистых событий [1, 2]. Одним из условий успешной профилактики повторных ИМ является снижение частоты сердечных сокращений (ЧСС) до целевого уровня — 55–60 в 1 мин. Основными препаратами, уменьшающими ЧСС, у таких пациентов являются β-адреноблокаторы (БАБ) [2]. Эффективность лечения БАБ определяется выраженностью блокады β1-адренорецепторов (β1-АР). Чувствительность β1-АР к различным БАБ в популяции неодинакова [3, 4] и зависит от их различной функциональной активности, которая, в свою очередь, может быть обусловлена полиморфизмами генов, кодирующих их синтез [5]. Бисопролол является одним из наиболее эффективных и часто назначаемых высокоселективных БАБ, рекомендован к применению у пациентов, перенесших ИМ, при отсутствии противопоказаний [6, 7]. Известно, что на эффективность бисопролола могут влиять изменения в гене ADRB1, отвечающем за синтез β1-АР. Имеются 2 наиболее значимых однонуклеотидных полиморфизма этого гена — Gly49Ser и Arg389Gly. Полиморфизм Arg389Gly гена ADRB1, находясь в центре связывания с белком, может изменять функциональную активность β1-АР, в связи с чем возможна его ассоциация с различной чувствительностью к бисопрололу [5]. Полиморфизм Ser49Gly гена ADRB1 локализован во внеклеточной части β1-АР, в N-концевом его фрагменте, который под действием различных лигандов может менять конформацию β1-АР, чем может обусловливаться различная степень связывания бисопролола с ним [8]. Однако единого мнения о степени влияния этих полиморфизмов на активность бисопролола у больных после ИМ пока нет, что требует дальнейшего изучения и разработки на основе полученного материала решений, индивидуализирующих его прием.
Цель исследования: изучить влияние полиморфизмов Arg389Gly и Ser49Gly гена ADRB1 на эффективность лечения бисопрололом у больных стабильной стенокардией, перенесших инфаркт миокарда.
Материал и методы
Открытое одноцентровое сравнительное исследование поперечного среза было выполнено на базе БУЗОО «ГКБ № 1 им. Кабанова А.Н.» г. Омска в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации клинических центров, одобрено локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России, протокол № 63 от 9 октября 2014 г. До включения в исследование у всех участников было получено письменное информированное согласие. Все пациенты относились к европеоидной расе, были представителями российской популяции, проживали на территории г. Омска и Омской области и не состояли в кровном родстве.
Критерии включения: перенесенный ИМ со стабильным течением ишемической болезни сердца (ИБС) на протяжении 6 мес., предшествующих точке включения в исследование, возраст — от 35 до 65 лет; устойчивый синусовый ритм; умеренная и высокая приверженность лечению, регулярный прием подобранной оптимальной максимально переносимой дозы бисопролола.
Критерии исключения: абсолютные противопоказания к назначению БАБ; чрескожное коронарное вмешательство или аортокоронарное шунтирование ранее 6 мес., предшествующих точке включения; сахарный диабет; тяжелая сопутствующая патология, имеющая самостоятельное негативное влияние на прогноз (декомпенсированная хроническая сердечная недостаточность (ХСН), дыхательная, печеночная, почечная недостаточность (хроническая болезнь почек 3 и более стадии)); острые заболевания на момент включения в исследование; психические заболевания; злоупотребление алкоголем и наркотическими средствами; прием других пульсурежающих препаратов.
Постановка диагноза ИБС: стабильная стенокардия, постинфарктный кардиосклероз проводилась в соответствии с действующими клиническими рекомендациями [9]. Согласно стандартам обследования, всем пациентам после сбора жалоб и анамнеза, физикального обследования определяли функциональный класс стенокардии, наличие ХСН, осложнившей течение ИБС, опираясь при этом на рекомендации по диагностике и лечению стабильной ИБС и ХСН [9, 10]. В соответствии с критериями включения и исключения в исследовании участвовали 107 больных с диагнозом ИБС: стабильная стенокардия, постинфарктный кардиосклероз. Средний возраст пациентов составил 54,7±6,2 года, среди них было 14 (13,1%) женщин и 93 (86,9%) мужчины.
В качестве БАБ все пациенты получали бисопролол. Наблюдение и лечение респондентов проводились амбулаторно в соответствии с актуальными клиническими рекомендациями. При динамическом наблюдении выполняли общеклиническое обследование: подсчет ЧСС покоя на верхушке сердца
за 1 мин, измерение артериального давления (АД) (оно у всех было в пределах допустимых значений), клинический анализ крови, общий анализ мочи, биохимический анализ крови, электрокардиограмма (ЭКГ), холтеровское мониторирование ЭКГ (ХМ-ЭКГ)); специальное исследование вариабельности сердечного ритма (ВСР): 5-минутная ВСР в фоновой и активной ортостатической (АОП) пробах, а также забор крови для исследования полиморфизмов гена ADRB1.
Генотипирование проводили на базе лаборатории фармакогеномики ИХБФМ СО РАН (г. Новосибирск), где определяли аллельные варианты Arg389Gly гена ADRB1 (rs1801253) методом полимеразной цепной реакции (ПЦР) в реальном времени со специфическими праймерами. Для генотипирования Ser49Gly гена ADRB1 (rs1801252) выделяли ДНК набором реагентов Diatom™ DNA Prep 200 (Россия). Полученные рестрицированные фрагментативные продукты генотипировали путем присутствия тех или иных фрагментов.
Оценку ЧСС респондентов выполняли как в покое, так и при анализе ХМ-ЭКГ и ВСР. При проведении ХМ-ЭКГ и регистрации ЭКГ в течение 22–24 ч в условиях свободной активности пациента, в модифицированных грудных отведениях V1 и V5, анализировались следующие показатели: ЧСС минимальное, максимальное, среднее. Исследование ВСР 5-минутных записей ЭКГ в покое (фоновая проба) и в ортостазе (АОП) проводили с использованием аппаратно-программного комплекса «ВНС-микро» (Россия). Анализ ритмограмм осуществлялся с учетом рекомендаций Европейского общества кардиологов и Североамериканского общества по стимуляции и электрофизиологии [11], оценивали ЧСС в фоновой пробе и прирост ЧСС в АОП.
Лечение бисопрололом принято расценивать как достаточно эффективное при достижении целевой ЧСС покоя (55–60 в 1 мин) [9]. Все исследуемые были разделены на 2 группы в зависимости от достижения целевой ЧСС в покое: пациенты, достигшие целевой ЧСС, — 46 человек (43%) и пациенты, не достигшие целевой ЧСС, — 61 человек (57%). Группы были сопоставимы по полу и возрасту: в группе достигших целевой ЧСС было 4 (8,7%) мужчины, а в группе не достигших целевой ЧСС — 10 (16,4%), р=0,24; женщин соответственно — 42 (91,3%) и 51 (83,6%), р=0,24; средний возраст соответственно — 54,48±5,95 и 54,48±5,95 года, р=0,61. Также изучаемые группы пациентов были сопоставимы по принимаемой средней суточной дозе бисопролола: 5,76±3,96 мг в группе достигших целевой ЧСС и 4,55±3,15 мг в группе не достигших целевой ЧСС, р=0,16. Индекс массы тела составил 29,24±3,33 кг/м2 и 29,37±4,32 кг/м2 в 1-й и 2-й группах соответственно, р=0,99.
Статистический анализ был выполнен с помощью пакета прикладных программ Statistica 10.0 и редактора электронных таблиц Excel. Количественные данные на предварительном этапе статистического анализа оценивали на нормальность распределения по критерию Shapiro — Wilk. Непрерывные переменные представлены в виде медианы и интерквартильных интервалов (Ме (25; 75)). Номинальные данные представлены в виде относительных частот объектов исследования n (%). Для оценки различий количественных данных использовали критерий Mann — Whitney U-test, для номинальных данных — Fisher test. Критический уровень значимости нулевой статистической гипотезы (р) принимали равным 0,05.
Результаты исследования
Так как у большинства исследуемых целевые значения ЧСС не были достигнуты, и это не было связано с получаемой дозой бисопролола, было проведено исследование генетических полиморфизмов Arg389Gly и Ser49Gly гена ADRB1. Исследование распределения частот генотипов изучаемых полиморфизмов показало их соответствие общероссийским и европейским данным [12–14]. Так, распределение частот генотипов полиморфизма Arg389Gly гена ADRB1 в исследуемых группах выявило преобладание гомозиготного генотипа Arg389Arg, его частота составила 58,9%; вторым по частоте встречаемости был гетерозиготный генотип Arg389Gly — 36%; наиболее редким был гомозиготный генотип Gly389Gly — 4,7%. По частоте встречаемости аллелей преобладал аллель Arg, его частота составила 77,1%, аллель Gly встречался реже — в 22,9%. Распределение частот генотипов полиморфизма Ser49Gly гена ADRB1 у респондентов было следующим: 84,1% — носители гомозиготного генотипа Ser49Ser, 14% — носители гетерозиготного генотипа Ser49Gly, 1,9% — носители гомозиготного генотипа Gly49Gly. По частоте встречаемости аллелей этого полиморфизма преобладал аллель Ser — его частота составила 91,1%, аллель Gly встречался реже — 8,9%.
Были проанализированы генотипы и аллели изучаемых полиморфизмов в группах пациентов, перенесших ИМ, с достигнутой и недостигнутой целевой ЧСС покоя (табл. 1).
При сравнении в таблице 1 частот аллелей в группах, достигших и не достигших целевых значений ЧСС, было выявлено достоверно большее количество полиморфного аллеля Gly полиморфизма Arg389Gly гена ADRB1 у пациентов, достигших целевой ЧСС на фоне приема бисопролола (р=0,0001), и достоверно меньшее количество полиморфного аллеля Gly полиморфизма Ser49Gly в этой же группе.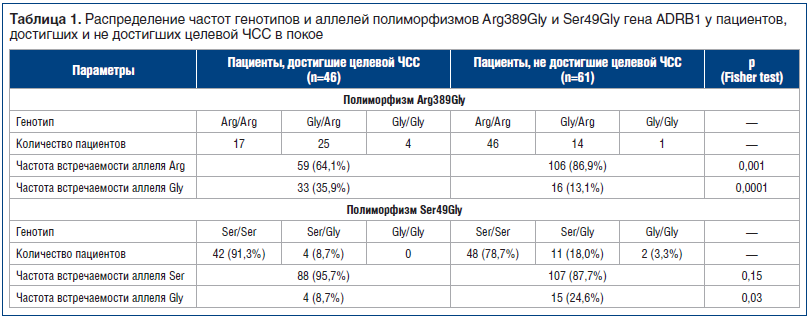
Таким образом, складывается впечатление, что эффективность пульсурежающего действия бисопролола зависит от изучаемых полиморфизмов, причем наличие полиморфного аллеля Gly полиморфизма Arg389Gly, возможно, является предиктором эффективности бисопролола, тогда как наличие полиморфного аллеля Gly полиморфизма Ser49Gly может свидетельствовать о его неэффективности.
Чтобы проверить данную гипотезу и определить различия в ответе на лечение бисопрололом у пациентов в зависимости от генной структуры, всех больных разделили на 4 группы в зависимости от носительства аллеля Gly полиморфизма Arg389Gly (группа G389 и группа A389) и полиморфизма Ser49Gly (группа S49 и группа G49). В группу G389 вошли пациенты, у которых в генотипе присутствовал аллель Gly в гомо- или гетерозиготной форме (44 человека — 39 гетерозигот Arg389Gly и 5 гомозигот Gly389Gly). Группу A389 составили носители гомозиготного генотипа Arg389Arg (63 человека). В группу S49 вошли носители гомозиготного генотипа Ser49Ser (90 человек). Группу G49 представляли пациенты, у которых в генотипе присутствовал аллель Gly в гомо- или гетерозиготной форме (17 человек — 15 гетерозигот Ser49Gly и 2 гомозиготы Gly49Gly). Группы были сопоставимы по полу, возрасту и дозам принимаемого бисопролола (табл. 2).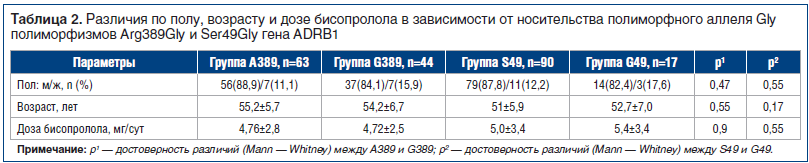
Для оценки влияния изучаемых полиморфизмов на эффективность лечения бисопрололом были исследованы показатели ЧСС покоя, ХМ-ЭКГ, ВСР в группах А389, G389, S49, G49 (табл. 3). В группе G389 ЧСС покоя оказалась статистически значимо ниже, чем в группе A389. У пациентов из группы G389 (носителей полиморфного аллеля)
достоверно чаще достигаются целевые показатели ЧСС также и по показателям фоновой 5-минутной пробы ВСР. Имеется тенденция (р=0,06) к более низкой среднесуточной ЧСС по ХМ-ЭКГ именно в группе G389 (см. табл. 3). Следовательно, носительство полиморфного аллеля Gly полиморфизма Arg389Gly может служить благоприятным прогностическим признаком в достижении целевой ЧСС при приеме бисопролола.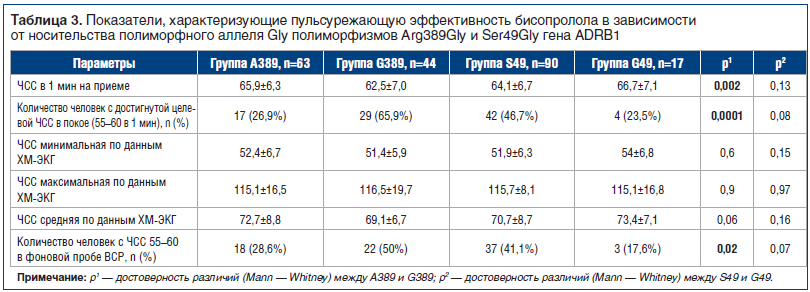
Несмотря на статистически значимое различие в носительстве полиморфного аллеля Gly полиморфизма Ser49Gly у респондентов, достигших и не достигших целевой ЧСС покоя (см. табл. 1), достоверных различий в показателях эффективности бисопролола в зависимости от носительства данного полиморфизма выявлено не было (см. табл. 3). Следовательно, эффективность пульсурежающего действия бисопролола у исследуемых пациентов не зависит от полиморфизма Ser49Gly.
Полиморфизмы Ser49Gly и Arg389Gly гена ADRB1 встречались в исследовании в следующих комбинациях:
Наличие носительства полиморфного аллеля Gly сразу в двух полиморфизмах в гомо- или гетерозиготной форме — у 3,7% (4 человека).
Отсутствие полиморфного аллеля Gly в обоих полиморфизмах — у 47,7% (51 человек).
Наличие полиморфного аллеля Gly Arg389Gly полиморфизма в гомо- или гетерозиготной форме и его отсутствие у Ser49Gly полиморфизма — у 36,4% (39 человек).
Наличие полиморфного аллеля Gly Ser49Gly полиморфизма в гомо- или гетерозиготной форме и отсутствие его у Arg389Gly полиморфизма — у 12,2% (13 человек).
С учетом литературных данных по возможному влиянию комбинаций этих полиморфизмов на эффективность лечения [15, 16] было изучено распределение этих комбинаций в зависимости от достижения целевой ЧСС в покое (рис. 1).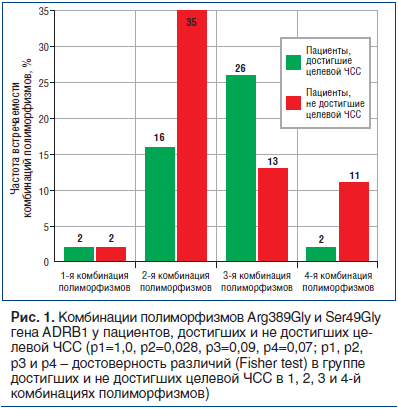
На рисунке 1 показано, что у пациентов, не достигших целевой ЧСС, достоверно чаще встречается комбинация с отсутствием полиморфного аллеля Gly в обоих полиморфизмах, что не противоречит вышеприведенным данным по исследованию полиморфизма Arg389Gly. А наличие полиморфных аллелей Gly полиморфизмов Ser49Gly и Arg389Gly гена ADRB1 в различных комбинациях не различалось в группах пациентов, достигших и не достигших целевой ЧСС.
Обсуждение
Ранее опубликованы противоречивые данные об ассоциации полиморфизмов гена ADRB1 с особенностями ответа на бисопролол при различных заболеваниях сердечно-сосудистой системы [17–19].
Результаты настоящего исследования свидетельствуют, что носительство полиморфного аллеля Gly полиморфизма Arg389Gly гена ADRB1 сопряжено с лучшим ответом на бисопролол в достижении целевой ЧСС у больных стабильной стенокардией, перенесших ИМ. Эти данные совпадают с данными исследования H.Y. Lee et al. (2016), где аналогичный эффект бисопролола описан у больных с застойной ХСН при наличии в генотипе аллеля Gly полиморфизма Arg389Gly [17]. Полученные нами результаты схожи с результатами исследования С.М. Комиссаровой (2015), где у больных гипертрофической кардиомиопатией показано, что лечение бисопрололом эффективнее при носительстве генотипов Arg389Arg и Arg389Gly [19], однако мы в своей работе эффективность лечения бисопрололом оценивали в зависимости от носительства полиморфного аллеля, а не генотипа, что связано с малым количеством полиморфных гомозигот.
Информация о влиянии полиморфизма Ser49Gly гена ADRB1 на эффективность бисопролола противоречива: существуют данные об ассоциации генотипа Gly49Gly с лучшим эффектом бисопролола [20], в другом источнике, напротив, показан лучший эффект бисопролола у лиц с генотипом Ser49Ser [12]. Однако в нашем исследовании не получено данных о влиянии носительства полиморфного аллеля Gly полиморфизма Ser49Gly гена ADRB1 на эффективность лечения бисопрололом. Результаты настоящего исследования совпадают с результатами похожего исследования, где не было выявлено влияния полиморфизма Ser49Gly гена ADRB1 на эффективность бисопролола [21]. В выполненной работе также не было выявлено взаимосвязи эффективности бисопролола с наличием различных комбинаций изучаемых полиморфизмов.
Таким образом, наличие полиморфного аллеля Gly полиморфизма Arg389Gly гена ADRB1 у больных стабильной стенокардией, перенесших ИМ, может служить прогностически благоприятным маркером в достижении целевой ЧСС при терапии бисопрололом. При его наличии и недостижении пациентом целевой ЧСС целесообразна дальнейшая титрация бисопролола, остальным пациентам необходимо рассмотреть альтернативные схемы лечения с применением ивабрадина или заменой на другие пульсурежающие препараты. Знание генотипа таких пациентов обеспечивает терапевту и кардиологу дополнительные возможности в разработке оптимальных схем лечения.
Выводы
Эффективность пульсурежающего действия бисопролола в достижении целевой ЧСС у пациентов со стабильной стенокардией, перенесших ИМ, выше при наличии полиморфного аллеля Gly полиморфизма Arg389Gly гена ADRB1.
Эффективность пульсурежающего действия бисопролола у пациентов со стабильной стенокардией, перенесших ИМ, не зависит от полиморфизма Ser49Gly гена ADRB1 и от различных комбинаций полиморфизмов Ser49Gly и Arg389Gly гена ADRB1.
Информация с rmj.ru





