Введение
Проблема многоплодия в настоящее время является крайне актуальной в связи с увеличением его распространенности из-за широкого внедрения вспомогательных репродуктивных технологий (ВРТ) [1]. Частота наступления беременности монохориальной моноамниотической (МХМА) двойней составляет около 1% от всех многоплодных беременностей и 0,01% — от всех спонтанных беременностей [2–4]. Частота родов МХМА-двоен варьирует от 1 на 5000 до 1 на 25 000 родов [5, 6]. МХМА-двойни появляются вследствие деления бластоцисты на 9–12-й день после оплодотворения [2, 7].
При МХМА-двойне в одной амниотической полости развиваются два плода с единой плацентой [4]. Высокая частота антенатальной гибели МХМА-двоен, достигающая 8–42%, обусловлена как общими для всех монохориальных двоен специфическими осложнениями (фето-фетальный трансфузионный синдром (ФФТС), синдром обратной артериальной перфузии (СОАП), синдром анемии-полицитемии (САП), синдром селективной задержки роста плода (ЗРП )), так и высокой вероятностью переплетения петель пуповин и врожденных аномалий плодов [2, 3, 8–14]. Ввиду малого числа наблюдений в современных исследованиях отсутствует общепринятый алгоритм ведения беременности МХМА-двойней.
Цель исследования: оценить течение и исходы многоплодной беременности при МХМА-двойне.
Материал и методы
За период с 2012 по 2022 г. на базе ГБУЗ ЦПСиР ДЗМ (Москва) и Клинического госпиталя MD GROUP (АО «МД ПРОЕКТ 2000») нами было проведено проспективное исследование, в ходе которого изучены течение беременности и перинатальные исходы у 34 пациенток с МХМА-двойней в возрасте от 21 до 41 года (средний возраст 31,8±4,3 года). У 31 (91,2%) пациентки беременность наступила спонтанно; у 3 (8,8%) — после экстракорпорального оплодотворения (ЭКО). Все беременные подписывали информированное согласие на проведение обследования.
Критерии включения: беременность МХМА-двойней, наступившая как спонтанно, так и после ВРТ. Критерий невключения: «сиамские» (неразделившиеся) близнецы.
Диагностика МХМА-двойни в I триместре основывалась на визуализации двух плодных яиц и одного хориона, а также на отсутствии межамниотической перегородки по данным УЗИ. У всех 34 беременных при скрининговых исследованиях маркеры хромосомной патологии не выявлены.
Беременные с переплетением петель пуповин находились под тщательным динамическим наблюдением начиная с 16-й недели гестации, включающим УЗИ каждые 2 нед., после 26–28 нед. — УЗИ 2–3 раза в неделю в сочетании с кардиотокографическим (КТГ) исследованием плодов. УЗИ выполнялось с помощью приборов Acuson 128/10 ХР и Logic 500 (США). Для проведения КТГ использовался аппарат Sonicaid Team.
Для статистической обработки данных применяли пакет программ IBM SPSS Statistics 23.
Результаты исследования
Угроза прерывания беременности отмечалась у 21 (61,8%) беременной с МХМА-двойней: в I триместре — у 5 (14,7%), во II — у 16 (47,1%), что потребовало стационарного лечения 11 (68,8%) из 16 женщин. Железодефицитная анемия в I и II триместрах диагностирована у 12 (35,3%) и у 9 (26,4%) пациенток соответственно.
Обращала на себя внимание высокая частота истмико-цервикальной недостаточности (ИЦН), которую отмечали у 10 (29,4%) беременных с МХМА-двойней в сроки от 18 до 28 нед. гестации. У 8 (23,5%) беременных была выполнена коррекция (серкляж, акушерский пессарий, микронизированный вагинальный прогестерон), что позволило пролонгировать беременность в среднем на 9±4 нед. гестации.
Преэклампсия умеренной степени тяжести диагностирована у 1 (2,9%) беременной с МХМА-двойней, холестаз — у 2 (5,9%) беременных, гестационный сахарный диабет, не требующий инсулинотерапии, — у 3 (8,8%), многоводие — у 2 (5,9%), маловодие — у 4 (11,8%).
Задержка роста одного плода (снижение предполагаемой массы плода (ПМП)) менее 10-го перцентиля нормативов физического развития для многоплодной беременности) отмечена у 2 (5,9%) пациенток. Клинически значимый дискордантный рост плодов (разница в ПМП 20% и более) по данным фетометрии к моменту родоразрешения диагностирован у 3 (8,8%) беременных с МХМА-двойней, селективная ЗРП (разница в массе плодов более 25% при задержке роста одного плода с ПМП менее 10-го перцентиля, интермитентный кровоток в артерии пуповины плода с задержкой роста) — у 1 (2,9%) беременной.
В ходе исследования ФФТС был выявлен у 2 (5,9%) пациенток. При этом одна из двух беременных с ФФТС обратилась за специализированной помощью в наше учреждение в срок 28 нед. гестации с антенатально погибшим плодом. У другой пациентки с бесплодием в анамнезе и первой беременностью после ЭКО, сопровождавшейся угрозой прерывания и ИЦН (наложены швы на шейку матки), по данным УЗИ выявлена легкая степень ФФТС (I стадия по Quintero), что не потребовало фетоскопической коагуляции анастомозов. Несмотря на динамическое УЗ-наблюдение, у нее также произошла антенатальная гибель одного плода, причиной которой был не ФФТС, а острая гипоксия плода вследствие селективной ЗРП; околоплодные воды у пациентки были мекониальные; при морфологическом исследовании последа выявлен вариант промежуточных дифференцированных ворсин.
Синдром анемии-полицитемии был выявлен у 1 (2,9%) беременной с МХМА-двойней, лазерная коррекция синдрома не проводилась. Пациентка родоразрешена оперативно в срок 32 нед. гестации, оба ребенка выжили, масса тела новорожденных составила 1660 и 1960 г, уровень гемоглобина — 129 и 142 г/л соответственно.
У 1 беременной в срок 20 нед. гестации у одного плода из МХМА-двойни по данным УЗИ диагностированы множественные пороки развития. После консилиума врачей с привлечением детского хирурга и получения согласия родителей было принято решение о проведении фетоскопии с коагуляцией сосудов пуповины плода, после которой беременность вторым плодом была пролонгирована до 37 нед. гестации. Родился новорожденный массой 3400 г, погибший плод был аморфным.
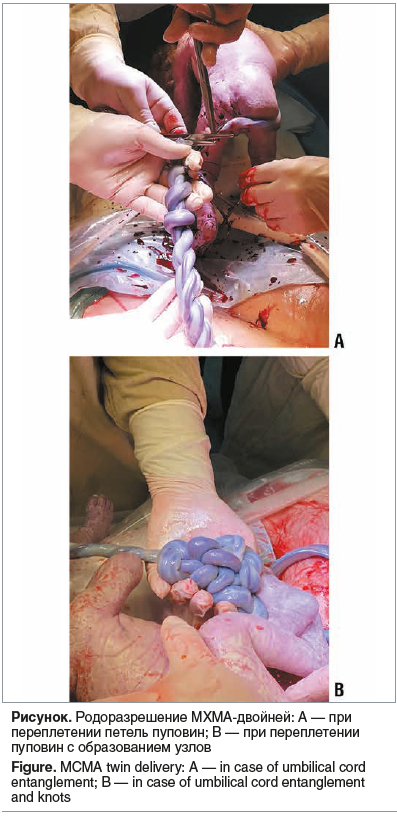
Переплетение пуповин диагностировано в 16 (47,1%) наблюдениях. У 14 (87,5%) из 16 беременных с переплетением петель пуповин, родоразрешенных в сроки 32–35 нед. гестации путем кесарева сечения (КС), родились живые дети (см. рисунок). Несмотря на интенсивное наблюдение, антенатально погибли 3 плода у 2 пациенток (29 и 30 лет). В указанных случаях отмечали многократное переплетение между собой петель пуповины с образованием множества узлов. Беременности наступили после ЭКО, сопровождались угрозой прерывания на протяжении всего срока беременности и ИЦН (вводился акушерский пессарий). У 1 пациентки в срок 29 нед. гестации погибли оба плода, у другой в срок 36 нед. — один плод, так как в начале исследования (2012–2016 гг.) при переплетении петель пуповин мы пытались пролонгировать беременность до 36 нед. для достижения зрелости плодов.
Итого антенатальные потери в нашем исследовании, включая эвтаназию нежизнеспособного плода с множественными пороками развития, составили 8,8% (6 из 68).
Родоразрешены преждевременно были 29 (85,2%) беременных с МХМА-двойней. В сроки 32–34 нед. гестации были родоразрешены 11 (32,3%) женщин, в 34–36 нед. — 16 (47,1%). В срок 28 нед. оперативно родоразрешена поздно обратившаяся в стационар беременная с ФФТС, антенатально погибшим одним плодом и отслойкой нормально расположенной плаценты. В срок 29 нед. гестации была родоразрешена пациентка, у которой антенатально погибли оба плода.
Отдельно стоит выделить 5 (14,7%) пациенток с неосложненной беременностью МХМА-двойней (по данным УЗИ были исключены ФФТС и переплетение петель пуповин), которым на ранних этапах нашей работы (2012–2016 гг.) удалось пролонгировать беременность до 36 нед. Все 10 детей родились в удовлетворительном состоянии и не требовали реанимационных мероприятий, асфиксии и дыхательных расстройств не выявлено.
Практически все (33 (97,1%)) беременные были родоразрешены путем КС, кроме одной пациентки, у которой антенатально погибли оба плода. Пациентка была родоразрешена через естественные родовые пути (индуцирована родовая деятельность) в срок 29 нед. гестации.
Объем кровопотери в родах при МХМА-двойне варьировал от 500 до 1400 мл, в среднем составляя 661,4±173,7 мл. Гипотоническое кровотечение в объеме 1400 мл развилось после планового КС лишь у 1 (3%) первородящей пациентки с САП и наследственной тромбофилией, ей проведена реинфузия аутоэритроцитов (500 мл) с помощью аппарата Cell Saver.
По данным морфологического исследования последов у беременных с МХМА-двойней прикрепление пуповин было центральным или парацентральным, расстояние между пуповинами варьировало от 1 до 5 см.
Всего родились живыми 62 (91,2%) ребенка. В состоянии умеренной асфиксии родились 8 (12,9%) из 62 детей, практически все (7 из 8) — в сроки 28–35 нед. беременности. Дыхательные расстройства различной степени выраженности были выявлены у 29 (46,8%) детей из МХМА-двоен, 26 (89,7%) из 29 рождены в сроки 28–35 нед. гестации. В связи с дыхательной недостаточностью в искусственной вентиляции легких нуждались 10 (16,1%) новорожденных, во вспомогательной вентиляции с постоянным положительным давлением — 19 (30,6%); при этом 20 (68,9%) из 29 рождены в сроки 32–34 нед. Маловесными к сроку гестации родились 5 (8,1%) детей.
Гипоксически-ишемические поражения центральной нервной системы (ЦНС) обнаружены у 20 (32,3%) детей из МХМА-двоен, преимущественно у рожденных в 30–33 нед. гестации; внутрижелудочковые кровоизлияния (ВЖК) 2-й степени — у 1 (1,6%) ребенка, рожденного в срок 28 нед. гестации путем экстренного КС. Неонатальная желтуха выявлена у 10 (16,1%) из 62 новорож-денных, преходящая ишемия миокарда — у 7 (11,3%), анемия — у 4 (6,5%), а также некротизирующий энтероколит — у 4 (6,5%) детей с хронической внутриутробной гипоксией, рожденных в сроки 28–32 нед. гестации, что подтверждает целесообразность уточнения оптимальных сроков родоразрешения пациенток с МХМА-двойней.
У 7 (11,3%) из 62 детей были диагностированы врожденные пороки развития (дефект межжелудочковой перегородки, атрезия легочной артерии 2-го типа, мальпозиция магистральных сосудов, атрезия левого наружного слухового прохода).
Постнатально погиб 1 (1,6%) ребенок, рожденный на 35-й неделе гестации. Причиной смерти явились недоношенность, ЗРП, дыхательная недостаточность и внутриутробная инфекция. Перинатальные потери при МХМА-двойне составили 7 (10,3%) из 68.
Обсуждение
Известно, что многоплодная беременность МХМА-двойней характеризуется высокой частотой гестационных осложнений [3, 11–14]. При этом благодаря протективному действию артерио-артериальных анастомозов при МХМА-двойне частота такого специфического осложнения, как ФФТС, ниже, чем при монохориальной диамниотической двойне (2–6 и 9–15% соответственно) [2, 6, 8, 10, 15]. Низкая частота ФФТС при МХМА-двойне подтверждена и в нашей работе — 5,9% (2 из 34). Дискутабельной на сегодня остается проблема выбора тактики ведения беременных с МХМА-двойней и ФФТС, вопрос о необходимости коррекции ФФТС при МХМА-двойне все еще открыт.
В нашем исследовании коррекция ФФТС не проводилась ни в одном из двух наблюдений, так как одна беременная с ФФТС обратилась за специализированной помощью в срок 28 нед. гестации с антенатально погибшим плодом, у другой — по данным УЗИ выявлена легкая степень ФФТС (I стадия по Quintero), не требующая коррекции, а плод погиб от острой гипоксии вследствие селективной ЗРП.
Наши данные о неблагоприятных исходах беременности МХМА-двойней, осложненной ФФТС, не противоречат результатам, полученным D. Murgano et al. [16], согласно которым коррекция ФФТС не улучшает исход по сравнению с ее отсутствием (27 и 25% соответственно, р>0,05).
В то же время при развитии САП, по данным литературы, подтверждена возможность использования выжидательной тактики у беременных с МХМА-двойней [17]. Однако есть мнение, что исходы беременности, осложненной САП, как для доноров, так и для реципиентов, зависят исключительно от успешности лазерной коррекции синдрома [18]. В нашем исследовании у беременной с САП, которой лазерная коррекция синдрома не проводилась, исход оказался благоприятным — пациентка оперативно родоразрешена в срок 32 нед. гестации, оба ребенка выжили. Однако стоит отметить, что ограничением нашего исследования является оценка единичного случая.
Известно, что при осложненном течении беременности МХМА-двойней с наличием множественных врожденных пороков развития плода проводится лазерная коагуляция сосудов пуповины с целью эвтаназии нежизнеспособного плода [9, 16, 19–21]. В нашем исследовании у беременной в срок 20 нед. гестации у одного плода из МХМА-двойни по данным УЗИ диагностированы множественные пороки развития. Проведение фетоскопии с коагуляцией сосудов пуповины плода позволило пролонгировать беременность вторым плодом до 37-й недели гестации.
Одним из частых осложнений беременности МХМА-двойней является переплетение петель пуповин, что может привести к значительной компрессии сосудов и, как следствие, к внутриутробной гибели обоих плодов [6, 22]. По данным разных авторов, формирование узлов или переплетения пуповин плодов в первой половине беременности связано прежде всего с большой подвижностью плодов в общей амниотической полости [23–25]. Возможности УЗ-диагностики во второй половине беременности позволяют диагностировать две близко расположенные пуповины, не смещающиеся при движениях плодов и смене положения тела беременной, однако в первой половине беременности это осложнение выявить сложнее [23].
Переплетение петель пуповин в нашем исследовании диагностировано у 47,1% пациенток, частота антенатальной гибели плодов при этом осложнении — 9,4%, что согласуется с данными литературы — 42–95 и 8–42% соответственно [22, 24–25].
Итак, антенатальные потери при МХМА-двойне в нашей работе составили 8,8%, что не противоречит результатам других авторов — 3–12% [4, 26].
Еще одной обсуждаемой в литературе проблемой являются сроки родоразрешения при МХМА-двойне, но единого мнения по данному вопросу в настоящее время нет [26, 27]. Учитывая высокие риски антенатальных потерь, обусловленных переплетением петель пуповин, большинство специалистов у беременных с МХМА-двойней рекомендуют плановое оперативное родоразрешение в 32–34 нед. беременности после проведения курса антенатальной профилактики респираторного синдрома плодов [4, 28–30].
В нашей работе в 2012–2016 гг. с целью достижения зрелости плодов осуществлялась попытка пролонгировать беременность до 36 нед. гестации. Неблагоприятный исход отмечен у одной пациентки с переплетением петель пуповин, у которой в срок 36 нед. гестации антенатально погиб один плод. У других беременных с переплетением петель пуповин, родоразрешенных в сроки 32–35 нед. гестации путем КС (n=14), родились живые дети. Также благоприятный исход отмечен у всех 5 пациенток с неосложненной беременностью МХМА-двойней (не выявлено переплетения петель пуповин, ФФТС, САП, селективной ЗРП), родоразрешенных в 36 нед., — асфиксии и дыхательных расстройств у новорожденных не было.
Важной проблемой ведения беременности МХМА-двойней, помимо сроков, является метод родоразрешения. Из-за риска гибели плодов при переплетении петель пуповин во время родов и опасности развития острого интранатального ФФТС при выборе метода родоразрешения у большинства (97,1%) беременных с МХМА-двойней мы отдавали предпочтение операции КС. В этом вопросе наше мнение совпадает с мнением большинства авторов [7, 26, 27].
Следовательно, беременных с МХМА-двойней при отсутствии ФФТС и переплетения петель пуповин можно родоразрешать путем КС позже рекомендуемых сроков (32–34 нед.) и пролонгировать беременность до 36-й недели с целью улучшения состояния новорожденных. При переплетении петель пуповин родоразрешение целесообразно проводить оперативно досрочно, ближе к 35-й неделе гестации, что позволяет повысить выживаемость плодов и тем самым улучшить перинатальные исходы.
Известно, что новорожденные из МХМА-двоен по причине ранних сроков гестации при рождении характеризуются высокой частотой ВЖК, некротизирующего энтероколита, преходящей ишемии миокарда и гипоксически-ишемических поражений ЦНС — 14,5–24,9% [16, 27], что согласуется с нашими данными (1,6, 6,5, 11,3 и 32,3% соответственно) и подтверждает целесообразность уточнения оптимальных сроков родоразрешения пациенток с МХМА-двойней.
Врожденные пороки развития диагностированы нами у 11,3% детей, это реже, чем по данным литературы — 15,7–23,3% [13, 14, 26], и доказывает важность своевременного обследования беременных с МХМА-двойней с целью диагностики пороков развития плода.
Частота перинатальных потерь при МХМА-двойне в нашем исследовании (10,3%) соответствовала данным литературы (6,6–12,4%) [4, 26].
Заключение
Антенатальные и перинатальные потери (8,8 и 10,3% соответственно) при МХМА-двойне обусловлены в основ-ном специфическими осложнениями (ФФТС, переплетение петель пуповины и гипоксия вследствие селективной ЗРП), что подтверждает необходимость тщательного динамического наблюдения пациенток с осложненной МХМА-беременностью в условиях перинатальных центров 3-го уровня. Вопрос о применении лазерной коагуляции анастомозов при необходимости коррекции ФФТС и САП при МХМА-двойне требует дальнейшего изучения.
У всех беременных с МХМА-двойней рекомендуется проведение планового КС. Досрочное оперативное родоразрешение ближе к 35-й неделе гестации при наличии осложнений (переплетение петель пуповины, ФФТС, САП, селективная ЗРП) позволяет повысить выживаемость плодов и тем самым улучшить перинатальные исходы.
При отсутствии ФФТС, переплетения петель пуповин и других осложнений возможно пролонгирование беременности МХМА-двойней до 36-й недели с целью улучшения состояния новорожденных при родоразрешении.
Частота пороков развития у новорожденных из МХМА-двоен составляет 11,3%. При выявлении множественных пороков развития у одного из плодов целесообразно рассмотрение вопроса о проведении селективного фетоцида методом фетоскопии с коагуляцией сосудов пуповины, позволяющего пролонгировать беременность вторым плодом, однако эффективность и безопасность метода требуют дальнейшего изучения.
Сведения об авторах:
Калашников Сергей Аркадьевич — к.м.н., доцент кафедры акушерства и гинекологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2658-5417.
Коноплянников Александр Георгиевич — д.м.н., профессор кафедры акушерства и гинекологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-9923-8833.
Воскобоева Ксения Юрьевна — клинический ординатор кафедры акушерства и гинекологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4484-2229.
Семенова Лейла Рамазановна — клинический ординатор кафедры акушерства и гинекологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4201-5588.
Кулакова Ираида Сахаветовна — клинический ординатор кафедры акушерства и гинекологии ФГБОУ ВО БГМУ Минздрава России; 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0002-2717-8218.
Контактная информация: Калашников Сергей Аркадьевич, e-mail: homeksa@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 16.12.2022.
Поступила после рецензирования 16.01.2023.
Принята в печать 30.01.2023.
About the authors:
Sergey A. Kalashnikov — C. Sc. (Med.), associate professor of the Department of Obstetrics and Gynecology of the Pediatric Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2658-5417.
Aleksandr G. Konoplyannikov — Dr. Sc. (Med.), Professor of the Department of Obstetrics and Gynecology of the Pediatric Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-9923-8833.
Kseniya Yu. Voskoboeva — resident of the Department of Obstetrics and Gynecology of the Pediatric Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-4484-2229.
Leila R. Semenova — resident of the Department of Obstetrics and Gynecology of the Pediatric Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-4201-5588.
Iraida S. Kulakova — resident of the Department of Obstetrics and Gynecology, Bashkir State Medical University; 3, Lenin str., Ufa, 450008, Russian Federation; ORCID iD 0000-0002-2717-8218.
Contact information: Sergey A. Kalashnikov, e-mail: homeksa@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 16.12.2022.
Revised 16.01.2023.
Accepted 30.01.2023.
Информация с rmj.ru




