Педиатрия
Ключевые слова: микробиота, пробиотик, пребиотик, синбиотик, бактериологические препараты, воспалительные заболевания кишечника, бифидобактерии, лактобактерии, энтерококки, олигофруктоза, инулин.
Для цитирования: Раскина К.В., Мартынова Е.Ю., Фатхутдинов И.Р., Потешкин Ю.Е. Современные бактериологические препараты: влияние на микробиоту кишечника и роль в лечении заболеваний // РМЖ. 2018. №5(II). С. 86-91
Raskina K.V.1, Martynova E.Yu.2, Fatkhutdinov I.R.3, Poteshkin Yu.E.3,4
1 Online peer-reviewed journal “Relevant endocrinology”, Moscow
2 Sechenov University, Moscow
3 LLC “Atlas Medical Center”, Moscow
4 Pirogov Russian National Research Medical University, Moscow
Human gastrointestinal tract is colonized by a complex ecosystem of microorganisms. Intestinal bacteria are not just commensals — the gut microbiota constantly undergoes the process of synbiotic co-evolution with its host. These bacteria perform numerous important functions: they produce various nutrients for the host, prevent infections caused by intestinal pathogens, and modulate the immunological response. The relationship between the composition of the intestinal microbiota and a variety of diseases (Crohn’s disease, ulcerative colitis, obesity, type 2 diabetes, etc.) has been proved. Modifying the gut microbiota creates a possibility to effectively influence human health. This is the purpose for which probiotics, prebiotics and synbiotics are used. The following review presents modern data on their optimal composition, discusses the mechanisms of influence of bacteriological agents on gut microbiota and human health, and also describes the results of studies confirming their effectiveness.
Key words: gut microbiota, probiotics, prebiotics, synbiotics, bacteriological agents, inflammatory bowel disease, Bifidobacterium, Lactobacillus, Enterococcus, oligofructose, inulin.
For citation: Raskina K.V., Martynova E.Yu., Fatkhutdinov I.R., Poteshkin Yu.E. Modern bacteriological agents: the effect on gut microbiota and the role in the treatment of diseases // RMJ. 2018. № 5(II). P. 86–91.
В статье приводятся современные данные об оптимальном составе пробиотиков, пребиотиков и синбиотикиов. Обсуждаются механизмы влияния на микробиоту и организм человека в целом этих препаратов, а также описываются результаты исследований, подтверждающих их эффективность.
Содержание статьи
Пробиотики
Согласно современному определению, сформулированному в 2002 г. экспертами ВОП (Всемирной организации по продовольствию ООН) и ВОЗ (Всемирной организации здравоохранения), пробиотики являются «живыми штаммами строго отобранных микроорганизмов, которые при назначении в достаточных количествах оказывают благоприятное действие на здоровье хозяина». Это определение в 2013 г. было поддержано Международной научной ассоциацией пробиотиков и пребиотиков (ISAPP) [1].
Согласно предложениям ВОЗ, ВОП и ЕАБП (Европейского агентства по безопасности продовольствия (EFSA)), пробиотические штаммы должны отвечать таким критериям, как безопасность, устойчивость и практичность (табл. 1) [2, 3].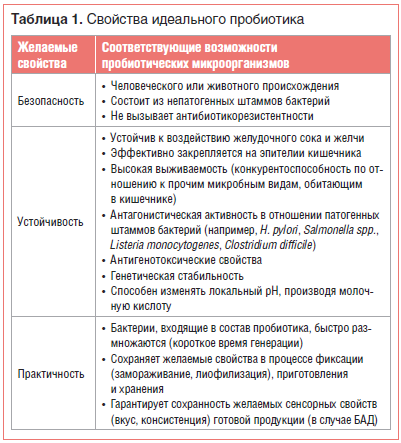
Безопасность для здоровья — первичная и обязательная характеристика пробиотика. В США микроорганизмы, используемые в пищу, обязательно должны иметь статус GRAS (Generally Regarded As Safe — обычно считающийся безопасным), выдаваемый Управлением по контролю за продуктами и лекарствами (FDA). В Европе EFSA ввело термин QPS (Qualified Presumption of Safety — квалифицированная презумпция безопасности). Концепция QPS включает некоторые дополнительные критерии оценки безопасности бактериальных добавок, в т. ч. историю безопасного использования и отсутствие риска приобретенной резистентности к антибиотикам [4].
В частности, по мнению экспертов EFSA, в соответствии с QPS безопасными являются 5 видов бифидобактерий (Bifidobacterium spp.), 33 вида лактобактерий (Lactobacillus spp.), а также Lactoccocus lactis, Leuconostoc spp., Pediococcus spp., Propionibacterium freudenreichii и Streptococcus thermophilus [4].
Пробиотики могут содержать либо один штамм, либо смесь двух или более штаммов бактерий. Эффекты этих препаратов очень специфичны и зависят от сопутствующей терапии, состава микробиоты хозяина и заболевания, по поводу которого принимают пробиотик. В небольшом ряде исследований была показана бóльшая эффективность приема пробиотиков, в состав которых входит не один, а несколько штаммов бактерий [3, 5].
В таблице 2 представлены пробиотические микроорганизмы, наиболее часто содержащиеся в современных фармацевтических препаратах и пищевых добавках [6].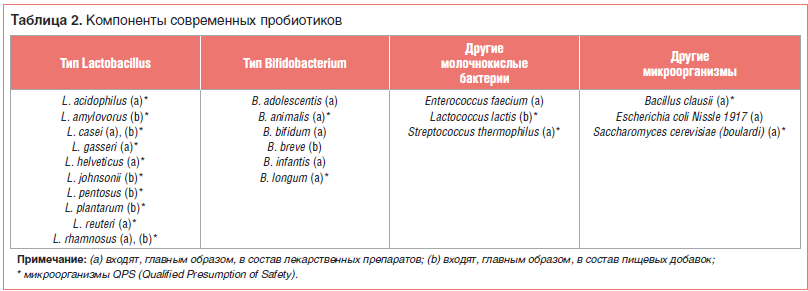
Пробиотики могут обладать множеством полезных эффектов в отношении организма человека. Молекулярные и генетические исследования показали, что в основе этих эффектов лежат 4 главных механизма:
– производство антимикробных веществ [7];
– конкуренция с патогенами за адгезию к эпителию и за питательные вещества [8];
– иммуномодулирующее воздействие на организм хозяина [9];
– ингибирование выработки бактериальных токсинов [10].
Иммуномодулирующее действие пробиотических бактерий основано на 3-х, казалось бы, противоречивых эффектах [9, 11]:
– активации и поддержании состояния иммунологической толерантности к пищевым и ингаляционным антигенам;
– активации и контроле иммунологических реакций против патогенов бактериального и вирусного происхождения;
– ингибировании аутоагрессивных и аллергических реакций.
Вызываемая пробиотиками стимуляция иммунитета проявляется в увеличении производства иммуноглобулинов, усилении активности макрофагов и лимфоцитов и стимуляции продукции γ-интерферона. Пробиотики могут влиять на иммунную систему человека посредством производимых цитокинов, компонентов клеточной стенки и ДНК, распознаваемых специализированными клетками хозяина [12].
К настоящему времени накоплена значительная научная база, подтверждающая, что модификация микробиоты с помощью препаратов и продуктов, содержащих пробиотики (Lactobacillus salivarius, Lactobacillus acidophilus, Lactobacillus rhamnosus, Saccharomyces boulardii, ряд видов Bifidobacterium и др.), может смягчать течение и способствовать лечению целого ряда состояний: ожирения, дислипидемии, инсулинорезистентности, сахарного диабета 2 типа (СД 2), неалкогольной жировой болезни печени (НАЖБП), синдрома раздраженной кишки, диареи различного генеза, воспалительных заболеваний кишечника, атопического дерматита, лактозной непереносимости, колоректального рака [13–23].
Доказано благотворное влияние пробиотиков как на взрослых, так и на детей. Так, в исследовании, проведенном M. Kotowska et al. (Польша), было установлено, что S. boulardii эффективно снижает риск антибиотик-ассоциированной диареи у детей. В этом двойном слепом рандомизированном плацебо-контролируемом исследовании приняли участие в общей сложности 269 детей в возрасте от 6 мес. до 14 лет, с отитом и/или инфекциями дыхательных путей. Дети получали стандартное лечение антибиотиками, в добавление к которому экспериментальная группа (n=132) 2 р./сут получала по 250 мг S. boulardii per os, а контрольная группа (n=137) — плацебо. Выяснилось, что пациенты, получавшие S. boulardii, имели более низкую распространенность диареи (9 человек из 119 (8%) против 29 из 127 (23%), ОР 0,3; 95% ДИ 0,2–0,7) и более низкий риск ассоциированной с антибиотиками диареи (вызванной Clostridium difficile) или иной иначе необъяснимой диареи по сравнению с группой плацебо (4 из 119 (3,4%) против 22 из 127 (17,3%), ОР 0,2; 95% ДИ 0,07–0,5). Никаких побочных эффектов не наблюдалось [16].
Исследование, проведенное на базе 18 детских садов в Хельсинки (Финляндия), показало, что регулярное использование Lactobacillus rhamnosus GG в форме пробиотика приводило к уменьшению числа инфекций дыхательных путей. Чтобы выяснить, может ли долгосрочное потребление молока, обогащенного пробиотиками, уменьшить частоту желудочно-кишечных и респираторных инфекций у детей в детских садах, финские ученые провели 7-месячное рандомизированное двойное слепое плацебо-контролируемое исследование, в которое включили 571 здорового ребенка в возрасте от 1 до 6 лет. Дети получали молоко с или без Lactobacillus GG в среднем по 260 мл в день. В итоге у детей в группе Lactobacillus было меньше пропусков из-за болезни (4,9 против 5,8 дня, разница 16%, p=0,03). Кроме того, в группе Lactobacillus оказалось на 17% меньше детей, переболевших за время наблюдения респираторными инфекциями, и на 19% меньше детей нуждались в антибиотикотерапии при респираторной инфекции [24].
В июне 2017 г. в журнале Nutrients группой итальянских ученых, возглавляемых G. Corsello, были опубликованы результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования, охватившего 126 здоровых детей в возрасте 12–48 мес., которые ежедневно получали по 7 г обезжиренного молока коровы с добавлением L. paracasei CBA L74 (группа A) или плацебо (мальтодекстрины, группа B). При анализе результатов выяснилось, что доля детей, перенесших более 1 эпизода простудных заболеваний, в группе А составляла 18%, тогда как в группе B этот показатель достиг 40%. Доля детей, более 1 раза перенесших инфекцию дыхательных путей, также оказалась значительно ниже в группе A (51% против 74% в группе В, pL. paracasei CBA L74, могут эффективно предотвращать инфекционные заболевания различного рода у детей [25].
Пребиотики
Пребиотики в основном представляют собой неперевариваемые в кишечнике пищевые волокна, которые благотворно влияют на здоровье хозяина, избирательно стимулируя рост и активность некоторых видов микроорганизмов в толстой кишке — как правило, лактобактерий и бифидобактерий [26].
Существует короткий список основных критериев, которым должен соответствовать пребиотик (табл. 3) [27, 28].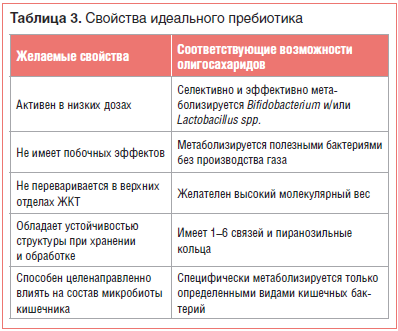
Пребиотики способны стимулировать рост нативных кишечных бактерий, обладают огромным потенциалом для модификации микробиоты кишечника, однако все изменения происходят на уровне отдельных штаммов и видов кишечных бактерий и являются труднопредсказуемыми. Кроме того, кишечная среда, особенно pH, играет ключевую роль в определении результатов межвидовой конкуренции. Таким образом, результаты приема этих препаратов могут быть крайне индивидуальны [29].
Некоторые фрукты, овощи, зерновые культуры и другие съедобные растения могут служить естественными источниками пребиотиков. Среди них: томаты, артишоки, бананы, спаржа, ягоды, чеснок, лук, цикорий, зеленые овощи, бобовые, а также необработанный овес, нерафинированная пшеница, неочищенный ячмень, якон [30].
Пребиотики могут использоваться в качестве альтернативы или дополнения к пробиотикам. Стабильность структуры в течение длительного времени, устойчивые физические и химические свойства, которые оказывают
положительное влияние на вкус и консистенцию продуктов, в которых они содержатся, позволяют пребиотикам составить достойную конкуренцию пробиотикам. Пребиотики могут потребляться длительно и в профилактических целях. Они не являются аллергогенными и не способствуют развитию устойчивости к антибиотикам. Однако следует учитывать, что передозировка пребиотиков может привести к метеоризму и диарее — эти эффекты отсутствуют в случае чрезмерного потребления пробиотиков [31].
Пищевые волокна являются потенциальными пребиотиками. Они вызывают чувство насыщения, но не перевариваются в ЖКТ. Существенное различие между этими двумя терминами (пребиотики и пищевые волокна) заключается в том, что пребиотики ферментируются строго определенными группами микроорганизмов, а диетические волокна используются большинством кишечных бактерий. Поэтому, принимая во внимание одно из основных требований к пребиотикам (специфическая стимуляция микробиоты), следует отметить, что эти термины не являются взаимозаменяемыми. Пребиотик может быть диетическим волокном, но диетическое волокно не всегда является пребиотиком [32].
Наиболее перспективными пребиотиками, о чем свидетельствуют исследования in vitro и in vivo, являются олигосахариды, в т. ч.: фруктоолигосахариды (FOS), галактоолигосахариды (GOS), изомальтоолигосахариды (ИМО), ксилоолигосахариды (XOS), трансгалактоолигосахариды (TOS) и олигосахариды сои (SBOS) [33].
Кроме того, полисахариды, такие как инулин, крахмал, целлюлоза, гемицеллюлоза или пектин, потенциально могут быть пребиотиками. Примеры пребиотиков, которые наиболее часто используются в питании человека, представлены в таблице 4. Использование глюкоолигосахаридов, гликоолигосахаридов, лактита, изомальтоолигосахаридов, стахиозы, рафинозы и сахарозы в качестве пребиотиков требует дальнейших исследований [34].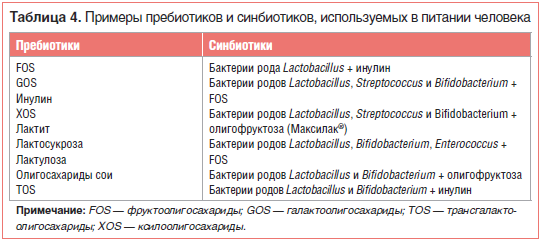
Насколько удалось установить на сегодняшний день, несмотря на разнообразие углеводов, которые проявляют пребиотическую активность, эффект приема любого из них заключается в увеличении количества полезных бактерий, в основном из рода Bifidobacterium [35].
Механизм положительного влияния пребиотиков на иммунитет остается неясным. Предложено несколько возможных моделей [36]:
Пребиотики регулируют действие печеночных липогенных ферментов, влияя на увеличение производства короткоцепочечных жирных кислот (КЦЖК), таких как пропионовая кислота.
Получаемые в результате ферментации КЦЖК (особенно масляная кислота) — модуляторы ацетилирования гистонов, что увеличивает доступность многочисленных генов для факторов транскрипции.
Регуляция производства муцина.
FOS и несколько других пребиотиков вызывают увеличение количества лимфоцитов и/или лейкоцитов в кишечно-связанных лимфоидных тканях (GALT) и в периферической крови.
Повышенная секреция IgA GALT может приводить к активации макрофагов.
Существует очень мало задокументированных результатов исследований, свидетельствующих о возможности прямого ингибирования развития патогенов пребиотиками. В 1997 и 2003 гг. Bovee-Oudenhoven et al. изучали использование лактулозы в профилактике инфекций, вызываемых Salmonella enteritidis, на модели крысы. Их результаты показали, что подкисление кишечника, возникающее в результате ферментации лактулозы, тормозило развитие патогенов и способствовало выведению патогенов из кишечника. Было также продемонстрировано, что прием пребиотиков приводит к усилению всасывания минералов, главным образом магния и кальция, в кишечнике [37, 38].
Спектр заболеваний, на течении которых благотворно сказывается прием пребиотиков, широк и во многом пересекается со сферой влияния пробиотиков [39–46].
Например, было доказано, что прием пребиотиков является эффективной профилактикой развития инфекционных заболеваний и аллергии у детей. В ходе исследования, проведенного группой итальянских ученых, здоровых новорожденных с родительской историей аллергии кормили смесью с добавлением пребиотика (8 г/л GOS/FOS) либо плацебо в течение первых 6 мес. жизни. Ученые отметили, что за период исследования у младенцев в группе пребиотика было меньше эпизодов инфекционных заболеваний всех типов (p=0,01), меньше эпизодов инфекции верхних дыхательных путей (р=0,07) и меньше инфекций, требующих лечения антибиотиками (р=0,10). Также в группе пребиотика значительно реже возникали рецидивирующие инфекции (3,9% в группе GOS/FOS против 13,5% в группе плацебо, p
Синбиотики
Синбиотик представляет собой комбинацию пробиотика и пребиотика. Он благотворно влияет на организм хозяина за счет улучшения выживаемости и имплантации бактерий пробиотика в ЖКТ путем избирательной стимуляции роста этих бактерий пребиотиком [3]. Таким образом, свойства синбиотика и его влияние на здоровье связаны с индивидуальной комбинацией пробиотика и пребиотика [2, 3]. В настоящее время наиболее популярна комбинация бактерий рода Bifidobacterium или Lactobacillus с фруктоолигосахаридами (табл. 4). С учетом огромного количества возможных комбинаций применение синбиотиков для модуляции кишечной микробиоты представляется многообещающим.
Идеальный синбиотик должен обладать следующими свойствами:
безопасность компонентов для хозяина;
доказанная польза компонентов синбиотика для хозяина;
избирательная стимуляция роста компонентов пробиотика на субстрате пребиотика;
повышенная выживаемость пробиотика при прохождении через гастроинтестинальный тракт;
устойчивость структуры при хранении.
В литературе есть указания на то, что из-за использования пребиотиков пробиотические микроорганизмы приобретают более высокую толерантность к условиям окружающей среды, в т. ч. устойчивость к окислению, воздействию низкого рН и температуры. Стимуляция пробиотиков пребиотиками способствует регуляции метаболической активности в кишечнике, развитию полезной микробиоты и ингибированию потенциальных патогенов, присутствующих в ЖКТ. Употребление синбиотиков приводит к снижению концентрации нежелательных метаболитов, инактивации нитрозаминов и канцерогенных веществ, а также значительному увеличению уровней КЦЖК, кетонов, дисульфидов углерода и метилацетатов, что может благоприятно отражаться на здоровье хозяина. Однако механизм взаимно поддерживающего действия компонентов синбиотика пока недостаточно изучен [26].
Главные эффекты, которыми обладают синбиотики [47]:
увеличение количества Lactobacillus и Bifido-bacterium и поддержание баланса кишечной микробиоты;
улучшение функции печени у пациентов, страдающих циррозом;
иммуномодулирующее воздействие;
профилактика бактериальной транслокации и снижение частоты нозокомиальных инфекций в послеоперационном периоде.
Транслокация продуктов метаболизма бактерий, таких как липополисахариды, этанол и КЦЖК, приводит к их проникновению в печень. КЦЖК, к примеру, стимулируют синтез и хранение триглицеридов в печени, что постепенно приводит к стеатогепатозу. Рандомизированное исследование по использованию синбиотика, содержащего 5 пробиотиков (Lactobacillus plantarum, Lactobacillus delbrueckii spp. Bulgaricus, Lactobacillus acidophilus, Lactobacillus rhamnosus, Bifidobacterium bifidum) и инулин в качестве пребиотика, у взрослых пациентов с НАЖБП продемонстрировало значительное сокращение запасов триглицеридов в печени в течение 6 мес. [48].
В 2013 г. Danq et al. опубликовали метаанализ исследований эффективности про- и пребиотиков для профилактики экземы у детей. Этот метаанализ показал, что пробиотики или синбиотики могут достоверно снизить частоту возникновения экземы у детей в возрасте младше 2 лет [49].
Примером соответствия всем современным требованиям, предъявляемым к синбиотику, является Максилак®. В его составе — сочетание лиофильно высу-
шенных штаммов пробиотических бактерий: 3 штаммов бифидобактерий (B. longum 6,75×108 КОЕ, B. breve 4,5×108 КОЕ, B. bifidum 2,25×108 КОЕ), 4 лактобактерий (L. helveticus 9×108 КОЕ, L. rhamnosus 4,5×108 КОЕ, L. plantarum 2,25×108 КОЕ, L. casei 2,25×108 КОЕ) и 2 штам-мов молочнокислых микроорганизмов (Lactococcus lactis 9×108 КОЕ, Streptococcus thermophilus 4,5×108 КОЕ). Пребиотическим компонентом в этом препарате выступает олигофруктоза, которая способствует быст-
рому размножению бифидобактерий и увеличению устойчивости микробиоты кишечника к инфекциям [50].
Особая форма препарата в виде саше с микрогранулами, разработанная специально для детей старше 4 мес., помогает преодолеть последствия нарушения микрофлоры, которое может возникнуть из-за кесарева сечения при родах, употребления молочных смесей и приема некоторых лекарственных препаратов. В состав синбиотика Максилак® Бэби входят те же 9 штаммов пробиотических бактерий, эффективность которых подтверждена в описанных выше исследованиях, в оптимальной для кишечника ребенка концентрации — 1 млрд (1×109) КОЕ.
Одно из ключевых свойств синбиотика — устойчивость к неблагоприятным условиям окружающей среды зависит от надежности капсулы препарата. Технология защиты капсулы MURE® (Multi Resistant Encapsulation) позволяет защитить бактерии, присутствующие в синбиотике Максилак®, от кислого содержимого желудочного сока, солей желчи и пищеварительных ферментов, а также делает возможным хранение препарата при комнатной температуре [51].
Сбалансированный состав, доказанная польза и безопасность компонентов препарата (наличие сертификата GRAS), устойчивая структура и удобная кратность приема (1 р./сут), а также отсутствие в составе лактозы и казеина (что обеспечивает возможность применения у пациентов с лактазной недостаточностью) выделяют Максилак® на фоне прочих средств, которые применяются в рамках коррекции патологических изменений микрофлоры кишечника, возникающих при заболеваниях ЖКТ и применении ряда лекарств (антибиотиков, гормональных и нестероидных противовоспалительных препаратов, противогрибковых средств) не только у взрослых, но и у детей.
Заключение
Многочисленные научные работы подтверждают положительное влияние пробиотиков на микробиоту кишечника и здоровье хозяина в целом. Пробиотические микроорганизмы обладают высоким терапевтическим потенциалом, например, при ожирении, инсулинорезистентности, СД 2, НАЖБП, лактозной непереносимости и атопическом дерматите. Также пробиотики могут быть полезны при лечении синдрома раздраженной кишки, энтерита, бактериальных инфекций и различных желудочно-кишечных расстройств. Пребиотики могут использоваться в качестве альтернативы пробиотикам или в качестве дополнительной поддержки для них. Наиболее перспективным представляется использование биотерапевтических формул, содержащих как пробиотические микробные штаммы, так и синергические пребиотики. Такие комбинации могут быть более эффективны, чем употребление их отдельно взятых компонентов [52]. Ожидается, что будущие исследования смогут объяснить механизмы комплементарного взаимодействия про- и пребиотиков в составе синбиотиков.
Литература
1. Hill C., Guarner F., Reid G. et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic // Nat. Rev. Gastroenterol. and Hepatol. 2014. Vol. 11 (8). P. 506–514.
2. Markowiak P., Śliżewska K. Effects of Probiotics, Prebiotics, and Synbiotics on Human Health // Nutrients. 2017. Vol. 9 (9). P. 1021–1051.
3. Pandey K. R., Naik S. R., Vakil B. V. Probiotics, prebiotics and synbiotics- a review // J. Food Sci. Technol. 2015. Vol. 52 (12). P. 7577–7587.
4. Introduction of a Qualified Presumption of Safety (QPS) approach for assessment of selected microorganisms referred to EFSA — Opinion of the Scientific Committee: Introduction of a Qualified Presumption of Safety (QPS) approach for assessment of selected microorganisms referred to EFSA — Opinion of the Scientifi // EFSA J. 2007. Vol. 587. P. 1–16.
5. Chapman C. M.C., Gibson G. R., Rowland I. Health benefits of probiotics: are mixtures more effective than single strains? // Eur. J. Nutr. 2011. Vol. 50 (1). P. 1–17.
6. Ricci A., Allende A., Bolton D. et al. Update of the list of QPS‐recommended biological agents intentionally added to food or feed as notified to EFSA 7: suitability of taxonomic units notified to EFSA until September 2017 // EFSA J. 2017. Vol. 16. Issue 1.
7. Vandenbergh P. Lactic acid bacteria, their metabolic products and interference with microbial growth // FEMS Microbiol. Rev. 1993. Vol. 12 (1–3). P. 221–237.
8. Simon O., Jadamus A., Vahjen W. Probiotic feed additives — effectiveness and expected modes of action // J. Anim. Feed. Sci. 2001. Vol. 10. Suppl. 1. P. 51–67.
9. Isolauri E., Sütas Y., Kankaanpää P. et al. Probiotics: effects on immunity // Am. J. Clin. Nutr. 2001. Vol. 73. Suppl. 2. P. 444S-450S.
10. Brandão R. L., Castro I. M., Bambirra E. A. et al. Intracellular signal triggered by cholera toxin in Saccharomyces boulardii and Saccharomyces cerevisiae // Appl. Environ. Microbiol. 1998. Vol. 64 (2). P. 564–568.
11. Borchers A. T., Selmi C., Meyers F. J. et al. Probiotics and immunity // J. Gastroenterol. 2009. Vol. 44 (1). P. 26–46.
12. Oelschlaeger T. A. Mechanisms of probiotic actions — A review // Int. J. Med. Microbiol. 2010. Vol. 300 (1). P. 57–62.
13. Chitapanarux I., Chitapanarux T., Traisathit P. et al. Randomized controlled trial of live lactobacillus acidophilus plus bifidobacterium bifidum in prophylaxis of diarrhea during radiotherapy in cervical cancer patients // Radiat. Oncol. 2010. Vol. 5. P. 31.
14. Liu Z., Qin H., Yang Z. et al. Randomised clinical trial: the effects of perioperative probiotic treatment on barrier function and post-operative infectious complications in colorectal cancer surgery — a double-blind study // Aliment. Pharmacol. and Ther. 2011. Vol. 33 (1). P. 50–63.
15. Wickens K., Black P. N., Stanley T. V. et al. A differential effect of 2 probiotics in the prevention of eczema and atopy: a double-blind, randomized, placebo-controlled trial // J. Allergy Clin. Immunol. 2008. Vol. 122 (4). P. 788–794.
16. Kotowska M., Albrecht P., Szajewska H. Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea in children: a randomized double-blind placebo-controlled trial // Aliment. Pharmacol. and Ther. 2005. Vol. 21 (5). P. 583–590.
17. Wang K.-Y., Li S.-N., Liu C.-S. et al. Effects of ingesting Lactobacillus and Bifidobacterium-containing yogurt in subjects with colonized Helicobacter pylori // Am. J. Clin. Nutr. 2004. Vol. 80 (3). P. 737–741.
18. Vajro P., Mandato C., Licenziati M. R. et al. Effects of Lactobacillus rhamnosus strain GG in pediatric obesity-related liver disease // J. Pediatr. Gastroenterol. Nutr. 2011. Vol. 52 (6). P. 740–743.
19. Hariri M., Salehi R., Feizi A. et al. A randomized, double-blind, placebo-controlled, clinical trial on probiotic soy milk and soy milk: effects on epigenetics and oxidative stress in patients with type II diabetes // Genes and Nutr. 2015. Vol. 10 (6). P. 52.
20. Brahe L. K., Le Chatelier E., Prifti E. et al. Dietary modulation of the gut microbiota — a randomised controlled trial in obese postmenopausal women // Br. J. Nutr. 2015. Vol. 114 (3). P. 406–417.
21. Agerholm-Larsen L., Raben A., Haulrik N. et al. Effect of 8 week intake of probiotic milk products on risk factors for cardiovascular diseases // Eur. J. Clin. Nutr. 2000. Vol. 54 (4). P. 288–297.
22. Gøbel R. J., Larsen N., Jakobsen M. et al. Probiotics to adolescents with obesity: effects on inflammation and metabolic syndrome // J. Pediatr. Gastroenterol. Nutr. 2012. Vol. 55 (6). P. 673–678.
23. Larsen N., Vogensen F. K., Gøbel R. J. et al. Effect of Lactobacillus salivarius Ls-33 on fecal microbiota in obese adolescents // Clin. Nutr. 2013. Vol. 32 (6). P. 935–940.
24. Hatakka K., Savilahti E., Pönkä A. et al. Effect of long term consumption of probiotic milk on infections in children attending day care centres: double blind, randomised trial // BMJ. 2001. Vol. 322, № 7298. P. 1327.
25. Corsello G., Carta M., Marinello R. et al. Preventive Effect of Cow’s Milk Fermented with Lactobacillus paracasei CBA L74 on Common Infectious Diseases in Children: A Multicenter Randomized Controlled Trial // Nutrients. 2017. Vol. 9 (7). E669. doi: 10.3390/nu9070669.
26. De Vrese M., Schrezenmeir J. Probiotics, prebiotics and synbiotics // Adv. Biochem. Eng. 2008. Vol. 111. P. 1–66.
27. Swennen K., Courtin C. M., Delcour J. A. Non-digestible Oligosaccharides with Prebiotic Properties // Crit. Rev. Food Sci. Nutr. Taylor and Francis Group. 2006. Vol. 46 (6). P. 459–471.
28. Wang Y. Prebiotics: Present and future in food science and technology // Food Res. Int. 2009. Vol. 42 (1). P. 8–12.
29. Chung W. S.F., Walker A. W., Louis P. et al. Modulation of the human gut microbiota by dietary fibres occurs at the species level // BMC Biol. 2016. Vol. 14. P. 3.
30. Pokusaeva K., Fitzgerald G. F., van Sinderen D. Carbohydrate metabolism in Bifidobacteria // Genes and Nutr. 2011. Vol. 6 (3). P. 285–306.
31. Handbook of Probiotics and Prebiotics / ed. Lee Y. K., Salminen S. John Wiley and Sons, Inc., 2008.
32. Ouwehand A. C., Derrien M., de Vos W. et al. Prebiotics and other microbial substrates for gut functionality // Curr. Opin. Biotechnol. 2005. Vol. 16 (2). P. 212–217.
33. Patterson J. A., Burkholder K. M. Application of prebiotics and probiotics in poultry production // Poult. Sci. 2003. Vol. 82 (4). P. 627–631.
34. Baurhoo B., Letellier A., Zhao X., Ruiz-Feria C. A. Cecal populations of lactobacilli and bifidobacteria and Escherichia coli populations after in vivo Escherichia coli challenge in birds fed diets with purified lignin or mannanoligosaccharides // Poult. Sci. 2007. Vol. 86 (12). P. 2509–2516.
35. Schiffrin E. J., Thomas D.R, Kumar V. B. et al. Systemic inflammatory markers in older persons: the effect of oral nutritional supplementation with prebiotics // J. Nutr. Health and Aging. 2007. Vol. 11 (6). P. 475–479.
36. Schley P. D., Field C. J. The immune-enhancing effects of dietary fibres and prebiotics // Br. J. Nutr. 2002. Vol. 87. Suppl 2. P. S221–S230.
37. Bovee-Oudenhoven I.M., Termont D.S, Heidt P.J, Van der Meer R. Increasing the intestinal resistance of rats to the invasive pathogen Salmonella enteritidis: additive effects of dietary lactulose and calcium // Gut. 1997. Vol. 40 (4). P. 497–504.
38. De Preter V., Hamer H. M., Windey K., Verbeke K. The impact of pre- and/or probiotics on human colonic metabolism: does it affect human health? // Mol. Nutr. and Food Res. 2011. Vol. 55 (1). P. 46–57.
39. Azcarate-Peril M.A., Ritter A. J., Savaiano D. et al. Impact of short-chain galactooligosaccharides on the gut microbiome of lactose-intolerant individuals // Proc. Natl. Acad. Sci. United States Am. 2017. Vol. 114 (3). P. E367–E375.
40. Costalos C., Kapiki A., Apostolou M., Papathoma E. The effect of a prebiotic supplemented formula on growth and stool microbiology of term infants // Early Hum. Dev. 2008. Vol. 84 (1). P. 45–49.
41. Munjal U., Glei M., Pool-Zobel B.L., Scharlau D. Fermentation products of inulin-type fructans reduce proliferation and induce apoptosis in human colon tumour cells of different stages of carcinogenesis // Br. J. Nutr. 2009. Vol. 102 (5). P. 663–671.
42. Luo J., Van Yperselle M., Rizkalla S. W. et al. Chronic consumption of short-chain fructooligosaccharides does not affect basal hepatic glucose production or insulin resistance in type 2 diabetics // J. Nutr. 2000. Vol. 130 (6). P. 1572–1577.
43. Daubioul C. A. Horsmans Y., Lambert P. et al. Effects of oligofructose on glucose and lipid metabolism in patients with nonalcoholic steatohepatitis: results of a pilot study // Eur. J. Clin. Nutr. 2005. Vol. 59 (5). P. 723–726.
44. Parnell J. A., Reimer R. A. Weight loss during oligofructose supplementation is associated with decreased ghrelin and increased peptide YY in overweight and obese adults // Am. J. Clin. Nutr. 2009. Vol. 89 (6). P. 1751–1759.
45. Arslanoglu S., Moro G. E., Boehm G. Early supplementation of prebiotic oligosaccharides protects formula-fed infants against infections during the first 6 months of life // J. Nutr. 2007. Vol. 137 (11). P. 2420–2424.
46. Scholtens P. A.M.J., Alliet P., Raes M. et al. Fecal secretory immunoglobulin A is increased in healthy infants who receive a formula with short-chain galacto-oligosaccharides and long-chain fructo-oligosaccharides // J. Nutr. 2008. Vol. 138 (6). P. 1141–1147.
47. Zhang K.-Y., Li S.-N., Liu C.-S. et al. Use of pre-, pro- and synbiotics in patients with acute pancreatitis: a meta-analysis // World J. Gastroenterol. 2010. Vol. 16 (31). P. 3970–3978.
48. Wong V. W.-S., Won G. L.-H., Chim A. M.-L. et al. Treatment of nonalcoholic steatohepatitis with probiotics. A proof-of-concept study // Ann. Hepatol. 2013. Vol. 12 (2). P. 256–262.
49. Dang D., Zhou W., Lun Z. J. et al. Meta-analysis of probiotics and/or prebiotics for the prevention of eczema // J. Int. Med. Res. 2013. Vol. 41 (5). P. 1426–1436.
50. Kolida S., Tuohy K., Gibson G. R. Prebiotic effects of inulin and oligofructose // Br. J. Nutr. 2002. Vol. 87. Suppl 2. P. S193–S197.
51. Piątek J., Gibas-Dorna M., Olejnik A. et al. The viability and intestinal epithelial cell adhesion of probiotic strain combination — in vitro study // Annals of agricultural and environmental medicine: AAEM. 2012. Vol. 19 (1). P. 99–102.
52. Bomba A., Nemcová R., Mudroňová D., Guba P. The possibilities of potentiating the efficacy of probiotics // Trends Food Sci. and Technol. 2002. Vol. 13 (4). Р. 121–126.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru





