Введение
Полиморбидность — это состояние, связанное с наличием у пациента нескольких заболеваний и обусловленное множеством патологических процессов, квалифицируемых как нозологические формы, синдромы, симптомы и клинико-диагностические признаки [1, 2].
Полиморбидность может быть обусловлена различными факторами: генетическими, системными метаболическими (нарушение липидного обмена, обмена глюкозы, минерального обмена, гормонального статуса), анатомо-физиологической взаимозависимостью, хроническими инфекциями, инволютивными, ятрогенными, социальными или экологическими изменениями [1, 3, 4].
Выделяют три формы взаимовлияния заболеваний друг на друга: синтропия («взаимное притяжение») — сочетание двух и более патологических состояний с общими этиопатогенетическими механизмами; дистропия («взаимное отталкивание») — невозможность сочетания болезней; нейтропия («нейтральное состояние», хронологическая коморбидность) — случайное сочетание болезней [2, 3].
Согласно данным литературы распространенность полиморбидности среди пожилых людей достигает 98%, среди пациентов среднего возраста — 93%, у молодых людей — 69% [1–5].
Полиморбидность — это группы заболеваний, в одних случаях объединенных общим патогенетическим механизмом, в других — причинно-следственной трансформацией [6]. Взаимное действие сочетанной патологии, возраста и лекарственного патоморфоза существенно изменяет клиническое течение основного патологического процесса, характер и степень тяжести осложнений, ограничивает или затрудняет диагностику и лечение нозологий [2–5, 7, 8].
Следствием полиморбидности нередко становится полипрагмазия — одновременное назначение большого количества лекарственных препаратов, что не всегда оправдано. Применение такого большого количества препаратов снижает эффективность лечения и может увеличивать число побочных эффектов [9], поэтому приоритетным является использование патогенетически обоснованных препаратов, имеющих плейотропный эффект [7, 10].
В доступных источниках литературы мы не встретили сведений о распространенности полиморбидности в дерматологии, однако данные литературы и наши наблюдения свидетельствуют о том, что часто среди сочетанных заболеваний кожи встречаются такие дерматозы, как витилиго и красный плоский лишай (КПЛ) [4, 5, 7, 11].
Ведущую роль в повреждении меланоцитов и нарушении процессов меланогенеза в коже больных витилиго отводят аутоиммунным механизмам [12]. Одним из актуальных вопросов является взаимосвязь витилиго с другими аутоиммунными заболеваниями и рядом врожденных синдромов [13]. Так, описаны случаи сочетания витилиго с такими аутоиммунными заболеваниями, как аутоиммунный тиреоидит, системная красная волчанка, псориаз, очаговая алопеция, атопический дерматит, склеродермия [5]. Около 20% пациентов с витилиго имеют как минимум одно аутоиммунное заболевание, а в 2,8% случаев оно сочетается с двумя и более нозологиями [14–17]. Сочетанию витилиго и КПЛ у одного больного посвящены лишь единичные сообщения [11, 18].
В настоящее время КПЛ также рассматривается как аутоиммунное заболевание, при котором экспрессия неидентифицированного до настоящего времени антигена кератиноцитами базального слоя приводит к активации и миграции в кожу Т-лимфоцитов с формированием иммунного ответа и воспалительной реакции [19]. В литературе приводятся описания сочетания синдрома Литтла — Ласюэра, бляшечной склеродермии, инверсных акне и болезни Шамберга, системной красной волчанки и КПЛ и др. [3–5, 7]. Такие случаи расцениваются как синтропия, что является одной из форм полиморбидности.
Давно известно о высокой встречаемости аутоиммунного тиреоидита среди больных хронической крапивницей, которая примерно в 30% наблюдений имеет аутоиммунный генез. Антитиреоидные антитела обнаруживались у 27% пациентов с идиопатической хронической крапивницей [20]. Кроме того, аутоиммунный тиреоидит может обусловливать тяжелое течение крапивницы [21].
Приводим пример развития у одного больного группы заболеваний (витилиго, КПЛ, аутоиммунного тиреоидита), объединенных общим патогенетическим механизмом и затем подвергшихся причинно-следственной трансформации (развитие карциноидного папилломатоза кожи Готтрона (КПГ)).
Клиническое наблюдение
Пациент Г., 64 года, обратился к врачу-дерматовенерологу в частный медицинский центр в марте 2019 г. с жалобами на множественные высыпания на коже лица, верхних и нижних конечностей, сопровождающиеся зудом и болью.
Анамнез заболевания
Впервые высыпания на верхних и нижних конечностях в виде белых пятен появились примерно в возрасте 14 лет. Обратился к дерматологу в поликлинику по месту жительства, где был выставлен диагноз: витилиго. Высыпания не имели тенденцию к распространению. После лечения препаратами, которые пациент затруднился назвать, отмечалось незначительное улучшение состояния кожных покровов в виде уменьшения площади депигментации.
В июне 2016 г. отметил появление папулезных высыпаний розово-красного цвета в периоральной области и на подбородке Обратился к дерматологу по месту жительства, был поставлен диагноз: дерматит и проведено лечение (название препаратов не помнит) без существенного эффекта. Через некоторое время на коже тыльной поверхности кистей и стоп, подмышечных впадин появились крупные гипертрофированные папулы синевато-красного цвета с бородавчатыми наслоениями на их поверхности. Продолжал лечение у дерматолога по месту жительства без видимого эффекта. В связи с ухудшением состояния обратился к другому дерматологу. Был поставлен диагноз: демодекоз (на лице) и дерматит (на верхних и нижних конечностях). Проведено лечение тридермом без видимого эффекта. Был направлен на консультацию к врачу-онкологу. Онкологических заболеваний выявлено не было. Биопсия кожи не проводилась. В феврале 2019 г. после появления затруднений при ходьбе, сопровождающихся болезненностью в области высыпаний на пальцах стоп, обратился в частный медицинский центр.
Анамнез жизни
Рос и развивался в соответствии с возрастом. Детских болезней не помнит. Наследственность не отягощена. Туберкулез, ВИЧ, вирусные гепатиты отрицает. Аллергологический анамнез не отягощен.
Сопутствующие заболевания: гипертоническая болезнь 2-й степени, I стадии; аутоиммунный тиреоидит (диагностирован в возрасте 42 лет); узел левой доли щитовидной железы; нарушение толерантности к глюкозе (гликированный гемоглобин 6,0%). Принимаемые лекарства: эналаприл 10 мг.
Status localis
На момент осмотра кожный патологический процесс имел распространенный симметричный характер. На коже лица в периоральной области и на подбородке наблюдалась эритема розового цвета с нечеткими границами с наличием единичных милиарных розово-красных папул и пустул диаметром 3 мм (рис. 1, А).
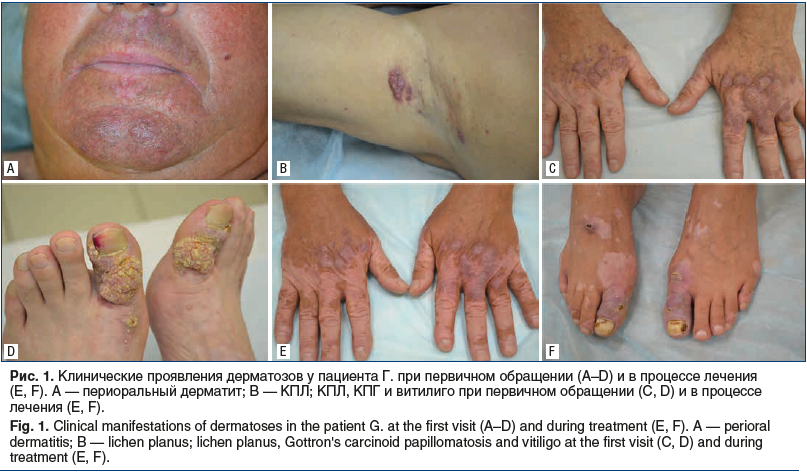
Вокруг красной каймы губ — свободный от высыпаний ободок. На коже подмышечных впадин определялись полигональные лентикулярные папулы с пупкообразным вдавлением в центре и инфильтрированные бляшки красно-синюшного цвета без шелушения (рис. 1, B). На коже тыльной поверхности кистей и стоп множественные депигментированные пятна молочно-белого и бледно-розового цвета, разной формы и величины от 1 до 10 см в диаметре, имеющие четкие границы. В очагах депигментации имелись отдельные участки пигментации (рис. 1, C, D). На поверхности некоторых папул определялась сетка Уикхема. Субъективно пациента беспокоил периодический зуд.
На тыльной поверхности кистей и I пальцев стоп в очагах депигментации и по их периферии на застойно-синюшном фоне визуализировались крупные опухолевидные бляшки, выступающие над уровнем кожи на 0,5 см, представляющие собой веррукозные разрастания желтовато-розового цвета плотной консистенции (рис. 1, C, D). В углублениях между сосочковыми разрастаниями борозды, покрытые чешуйками и корками, после удаления которых определялись мацерированные участки. При сдавлении бляшек с боков на их поверхность выделялось желтовато-белого цвета отделяемое с неприятным запахом.
Ногтевые пластины больших пальцев стоп утолщены, желтого цвета (рис. 1, D). На слизистой оболочке полости рта высыпаний не обнаружено.
Данные лабораторных
и инструментальных исследований
Общий анализ крови (01.03.2019): лейкоциты — 9,2×109/л, эритроциты — 5,32×1012/л, гемоглобин — 118 г/л, гематокрит — 46,5%, лимфоциты — 30%, моноциты — 1%, палочкоядерные — 4%, сегментоядерные — 61%, эозинофилы — 4%, СОЭ — 23 мм/ч.
Общий анализ мочи (01.03.2019): глюкоза — 50 мг/дл,
pH — 5,5 (5,0–7,0), относительная плотность — 1020, эпителий плоский — 3–2 в поле зрения, эпителий переходный — 1–2 в поле зрения, лейкоциты — 1–2 в поле зрения.
Биохимический анализ крови (01.03.2019): триглицериды — 1,12 ммоль/л (0,65–3,29), гликированный гемоглобин — 6,0% (норма 4,5–6,3%), С-пептид — 7,12 нмоль/л (0,17–0,90), холестерин — 5,1 ммоль/л (3,6–5,2), липопротеины очень низкой плотности — 0,51 ммоль/л (0,26–1,04), гомоцистеин — 11,48 мкмоль/л (5–12), цинк — 9,1 мкмоль/л (10,4–16,4), церулоплазмин — 290 мг/л (180–450), ферритин — 45,6 мкг/л (20–250), витамин D — 29 нг/мл (50–100), мочевая кислота — 387 ммоль/л (214,0–488,0), фибриноген — 5,03 г/л (2,0–4,0).
Гормоны (01.03.2019): тиреотропный гормон — 4,3964 мкМЕ/мл (0,35–4,94), Т4–11,55 пмоль/л (9,01–19,05), антитела к микросомальной тиреопероксидазе — 5044,82 МЕ/мл (0,0–34,0), тестостерон общий — 11,707 нмоль/л (8,6–23,4).
Соскоб на грибы с очагов на коже тыльной поверхности стоп (01.03.2019): грибы не обнаружены.
Ультразвуковое исследование щитовидной железы (21.03.2019). Заключение: диффузная гиперплазия щитовидной железы с диффузными изменениями паренхимы по типу хронического тиреоидита, узел левой доли.
Цитологическое исследование щитовидной железы (15.04.2019). Заключение: цитологическая картина более характерна для лимфоматозного тиреоидита, II категория по TBSRTC.
Консультация эндокринолога (30.03.2019). Диагноз: аутоиммунный тиреоидит, диффузно-узловая форма, нарушение толерантности к глюкозе. Рекомендовано: калия йодид 200 мкг 1 р./сут утром, метформин 500 мг 1 р./сут вечером.
С предварительными диагнозами: красный плоский лишай, веррукозная форма? Папилломатоз Готтрона? Периоральный дерматит? пациент был направлен на гистологическое исследование кожи (20.05.2019).
Результаты гистологического исследования биоптата из патологического очага, расположенного на коже подбородка (рис. 2, А). Участки паракератоза. Фолликулярный гиперкератоз. Устья волосяных фолликулов расширены, содержат множественные элементы клеща. Эпидермис нормальной толщины. Участки вакуольной дистрофии клеток мальпигиева слоя. В верхних отделах дермы просветы сосудов лакунарно расширены. Периваскулярные и перифолликулярные умеренно выраженные гистиолимфоцитарные инфильтраты с примесью нейтрофилов. В средней трети дермы умеренно выраженные склеротические изменения. Заключение: морфологическая картина с учетом клинических данных в большей степени соответствует периоральному дерматиту. В волосяных фолликулах — демодекс.
Результаты гистологического исследования биоптата из патологического очага, расположенного на коже подмышечной области (рис. 2, B): сетчатый гиперкератоз. Умеренно выраженный неравномерный акантоз. Небольшой папилломатоз. Гранулез. Вакуольная дистрофия клеток базального слоя. Под эпидермисом густой полосовидный лимфогистиоцитарный инфильтрат с меланофагами, тучными клетками и нейтрофилами, размывающий дермоэпидермальную границу. В верхней трети дермы стенки сосудов утолщены, их просветы расширены, эндотелий пролиферирует. Заключение: морфологическая картина с учетом клинических данных соответствует красному плоскому лишаю.

Результаты гистологического исследования (20.05.2019) биоптата из патологического очага, расположенного на коже тыльной поверхности большого пальца левой стопы (рис. 2, C, D): гиперкератоз. Паракератоз. Фолликулярный гиперкератоз. Выраженный акантоз по типу псевдоэпителиоматозной гиперплазии (см. рис. 2, D). Участки гранулеза. Множество митозов. Папилломатоз. В эпидермисе отмечается формирование трубчатых роговых масс. Сосочки дермы отечны, капилляры расширены. Под эпидермисом диффузные гистиолимфоцитарные инфильтраты с примесью плазмоцитов и нейтрофилов, местами размывающие дермо-эпидермальную границу. Заключение: в биопсийном материале выявляется морфологическая картина, характерная для формирующегося КПГ на фоне КПЛ.
На основании клинической картины, данных лабораторного и гистологического исследований выставлен окончательный диагноз: красный плоский лишай, веррукозная форма, осложненный карциноидным папилломатозом Готтрона. Периоральный дерматит, демодекоз. Витилиго, акральная форма.
Сопутствующие заболевания: гипертоническая болезнь 2-й степени, I стадии; аутоиммунный тиреоидит; узел левой доли щитовидной железы; нарушение толерантности к глюкозе (гликированный гемоглобин 6,0%).
Лечение
Базовая терапия — ре-ПУВА. Модальность включала применение локальной ПУВА-терапии по 3-дневной схеме в неделю на фоне приема изотретиноина в дозе 32 мг/сут. Для применения данной методики использовали аппараты фирмы Waldmann UV 181 AL, UV 200 AL c набором ламп УФА-спектра (длина волны 320–410 нм с максимальным пиком эмиссии на длине волны 351 нм). Назначали фотосенсибилизатор (Амми большой плодов фурокумарины) в дозе 80 мг (4 таблетки). Фотосенсибилизатор пациент принимал внутрь во время приема пищи за 1,5–2 ч до УФА-облучения. Начальная доза излучения составляла
1 Дж/см2. Дальнейшее наращивание дозы происходило на 1 Дж/см2 на каждую последующую процедуру до получения максимальной разовой дозы 12 Дж/см2. Курс лечения состоял из 36 процедур, суммарная курсовая доза УФ-облучения составила 366 Дж/см2, суммарная доза изотретиноина — 2880 мг на курс лечения (10 нед.).
Наружно: на лицо утром крем пимекролимус, вечером крем ивермектин; на руки, стопы — чередование следующих препаратов: мазь бетаметазон + салициловая кислота, крем с 10% мочевиной.
Немедикаментозная терапия: криодеструкция гиперкератотических очагов.
После проведенного лечения отмечена значительная положительная динамика в виде уменьшения площади депигментированных участков кожи, побледнения папулезных элементов, снижения выраженности инфильтрации папулезных и бородавчатых высыпаний, сглаженности вдавлений в центральной части папул (см. рис. 1, E, F).
Рекомендации по дальнейшему ведению пациента: наблюдение у дерматолога, выполнение рекомендаций эндокринолога, консультация кардиолога. Наружно: на область лица — крем пимекролимус утром, через день, крем ивермектин на ночь, ежедневно; на кожу ладоней и стоп — крем с клобетазолом утром и вечером 3 р./нед., а в остальные дни — 0,1% мазь такролимус. При нарастании гиперкератоза выполнить повторную криодеструкцию. Контрольный осмотр через 2 мес.
Обсуждение
Описанное клиническое наблюдение представляет значительный интерес, так как касается довольно распространенных в практике врача-дерматовенеролога нозологий, осложненных КПГ.
КПГ — редкое предраковое заболевание кожи, которое характеризуется псевдоэпителиоматозной гиперплазией эпидермиса в виде бородавчатых разрастаний и вегетаций, появляющихся на месте длительно существующих очагов хронических дерматозов (КПЛ, хронической экземы, нейродермита, туберкулезной волчанки, бластомикоза и т. д.) или рубцов [22–24]. В мировой литературе описано около 60 случаев заболевания [24]. Болеют люди в возрасте старше 40 лет, мужчины немного чаще, чем женщины [25].
Клинически КПГ характеризуется симметричными или односторонними опухолевидными образованиями, локализующимися на любом участке кожи. Процесс часто развивается на нижних конечностях в условиях нарушенного кровоснабжения [22, 23]. На коже появляются веррукозные разрастания плотной или тестоватой консистенции, цвета сырого мяса, выступающие над уровнем кожи на 1–2 см, что придает им сходство с цветной капустой, при сдавлении которых выделяется сливкообразный желтовато-белого цвета липкий гной с неприятным запахом. Очаги поражения покрываются чешуйками и кровянисто-гнойными корками, после их удаления обнажаются эрозивные поверхности [23–25]. Указанные изменения постепенно вытесняют признаки фонового процесса, которые можно наблюдать только по периферии очага поражения [24].
Выделяют три клинические формы заболевания: язвенно-инфильтративную (эндофитную), опухолевидную (экзофитную) и гиперкератотическую. Течение заболевания длительное, с возможной трансформацией в плоскоклеточный рак кожи [23].
Гистологически КПГ характеризуется папилломатозом и резко выраженной псевдоэпителиоматозной гиперплазией эпидермиса. При этом атипии клеток эпидермиса нет, базальная мембрана сохранена. Наряду с акантозом иногда наблюдается отшнуровка эпителиальных клеток, а также отмечается склонность к ороговению. В сосочковом слое дермы располагается массивный инфильтрат, состоящий из лимфоцитов с примесью эпителиоидных клеток, гистиоцитов, фибробластов и плазматических клеток [23, 24].
При оценке веррукозных высыпаний на пальцах нижних конечностей у пациента мы столкнулись с трудностями дифференциальной диагностики, поскольку КПГ и гипертрофическая форма КПЛ имеют схожие проявления. У рассматриваемого нами пациента КПГ на пальцах ног имел опухолевидную клиническую форму и практически полностью замещал первоначально имеющиеся папулезные высыпания, характерные для КПЛ. Это повлияло на клиническую картину кожного патологического процесса, усугубило его течение, что в свою очередь привело к трудностям своевременной диагностики заболеваний и необходимости назначения комплексной терапии. Для верификации заболеваний была выполнена биопсия кожи из разных очагов. Это позволило выявить гистологические признаки КПГ и КПЛ, а также исключить возможную онкологическую патологию.
Заключение
В представленном клиническом наблюдении полиморбидность проявилась наличием группы заболеваний (витилиго, аутоиммунного тиреоидита, КПЛ), объединенных общим патогенетическим механизмом и в дальнейшем подвергшихся причинно-следственной трансформации с развитием КПГ. Важной составляющей диагностического поиска явилось биопсийное исследование кожи, проведенное из нескольких локализаций патологического процесса, что позволило выявить все элементы сочетанной патологии.
Учитывая ведущую роль аутоиммунных нарушений в патогенезе как КПЛ, так и витилиго, можно предположить единый патогенетический механизм развития заболеваний кожи у больного. Возможно, имеющаяся патология эндокринной системы у нашего пациента также явилась фактором, способствовавшим развитию КПЛ и, в дальнейшем, КПГ.
Описанное клиническое наблюдение представляет интерес для клиницистов в связи с редким сочетанием КПЛ с витилиго на фоне аутоиммунного тиреоидита и подтверждает высказанные ранее предположения о возможности сочетания иммунозависимых заболеваний.
Сведения об авторах:
Тлиш Марина Моссовна — д.м.н., профессор, заведующая кафедрой дерматовенерологии, ФГБОУ ВО КубГМУ Минздрава России, 350063, Россия, г. Краснодар, ул. Седина, д. 4, ORCID iD 0000-0001-9323-4604.
Сычева Наталья Леонидовна — к.м.н., ассистент кафедры дерматовенерологии, ФГБОУ ВО КубГМУ Минздрава России, 350063, Россия, г. Краснодар, ул. Седина, д. 4, ORCID iD 0000-0002-5245-2987.
Старостенко Вячеслав Владимирович — ассистент кафедры кожных и венерических болезней, ФГБОУ ВО РостГМУ Минздрава России, 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29, ORCID iD 0000-0002-1755-366X.
Сидоренко Ольга Анатольевна — д.м.н., профессор кафедры кожных и венерических болезней, ФГБОУ ВО РостГМУ Минздрава России, 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29, ORCID iD 0000-0002-7387-2497.
Осмоловская Полина Сергеевна — ассистент кафедры дерматовенерологии, ФГБОУ ВО КубГМУ Минздрава России, 350063, Россия, г. Краснодар, ул. Седина, д. 4, ORCID iD 0000-0002-6764-0796.
Псавок Фатима Александровна — к.м.н., ассистент кафедры дерматовенерологии, ФГБОУ ВО КубГМУ Минздрава России, 350063, Россия, г. Краснодар, ул. Седина, д. 4, ORCID iD 0000-0002-9556-1956.
Контактная информация: Осмоловская Полина Сергеевна, e-mail: polina_osmolovskaya@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 06.07.2020, поступила после рецензирования 29.07.2020, принята в печать 10.08.2020.
About the authors:
Marina M. Tlish — Dr. of Sci. (Med), Professor, Head of the Department of Dermatology and Venerology, Kuban State Medical University: 4, Sedina str., Krasnodar, 350063, Russian Federation, ORCID iD 0000-0001-9323-4604.
Natalia L. Sycheva — Cand. of Sci. (Med), Assistant Professor of the Department of Dermatology and Venerology, Kuban State Medical University: 4, Sedina str., Krasnodar, 350063, Russian Federation, ORCID iD 0000-0002-5245-2987.
Vyacheslav V. Starostenko — Assistant Professor of the Department of Dermatology and Venerology, Rostov State Medical University: 29, Nakhichevanskiy prospect, Rostov-on-Don, 344022, Russian Federation, ORCID iD 0000-0002-1755-366X.
Olga A. Sidorenko — Dr. of Sci. (Med), Professor of the Department of Dermatology and Venerology, Rostov State Medical University: 29, Nakhichevanskiy prospect, Rostov-on-Don, 344022, Russian Federation, ORCID iD 0000-0002-7387-2497.
Polina S. Osmolovskaya — Assistant Professor of the Department of Dermatology and Venerology, Kuban State Medical University: 4, Sedina str., Krasnodar, 350063, Russian Federation, ORCID iD 0000-0002-6764-0796.
Fatima A. Psavok — Cand. of Sci. (Med), Assistant Professor of the Department of Dermatology and Venerology, Kuban State Medical University: 4, Sedina str., Krasnodar, 350063, Russian Federation, ORCID iD 0000-0002-9556-1956.
Contact information: Polina S. Osmolovskaya, e-mail: polina_osmolovskaya@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 06.07.2020, revised 29.07.2020, accepted 10.08.2020.
.
Информация с rmj.ru





