Ключевые слова: подагра, пирофосфатная артропатия, микрокристаллические артриты, нестероидные противовоспалительные препараты, доноры оксида азота, толметин, амтолметин гуацил, гастропротективный эффект.
Для цитирования: Елисеев М.С., Желябина О.В. Сочетание подагры и болезни депонирования пирофосфатов кальция: трудности диагностики и лечения // РМЖ. Медицинское обозрение. 2017. №1. С. 44-47
Eliseev M.S., Zhelyabina O.V.
Scientific Research Institute of Rheumatology named after V.A. Nasonova, Moscow
The study of crystal-induced arthritis attracts close attention, given the high frequency of the disease, the increase in its morbidity, as well as an undoubted social significance. Most often, crystal-induced arthritis is caused by crystals of urate (gout) and calcium pyrophosphate (calcium pyrophosphate deposition disease (CPDD)). Diagnosis of gout and CPDD often causes difficulties: frequent crossing of individual clinical symptoms in patients with crystal-induced arthritis does not allow to set a definite diagnosis only on the basis of the clinical picture of the disease. As a rule, at the beginning of the disease both gout, and, often, pyrophosphate arthropathy are manifested by attacks of acute arthritis, characterized by severe pain, swelling of surrounding tissues, hyperemia and hyperthermia of the skin over the affected joint, which are replaced by attack-free intervals. Epidemiological studies on the combination of gout and CPDD were not conducted. However, in clinical practice, the combination of two crystal-induced arthritides is quite common. Diagnosis and treatment of crystal-induced arthritides, despite their widespread distribution, still causes difficulty. The article presents a clinical case of diagnosing two crystal-induced arthritides in a patient. The application of modern diagnostic methods used for verification of diseases similar in clinical picture is described. The selection of adequate anti-inflammatory therapy for acute, including often recurrent arthritis, in the patient, taking into account contraindications and concomitant diseases, is discussed.
Key words: gout, pyrophosphate arthropathy, crystal-induced arthritis, non-steroidal anti-inflammatory drugs, nitric oxide donors, amtolmethine guacyl, gastroprotective effect.
For citation: Eliseev M.S., Zhelyabina O.V. The combination of gout and calcium pyrophosphate deposition disease: the difficulties of diagnosis and treatment // RMJ. MEDICAL REVIEW. 2017. № 1. P. 44–47.
В статье рассмотрены трудности диагностики и лечения сочетания подагры и болезни депонирования пирофосфатов кальция. Описано применение современных методов диагностики. Обсужден подбор адекватной противовоспалительной терапии при остром, в т. ч. часто рецидивирующем, артрите у пациента с учетом противопоказаний и сопутствующих заболеваний.
Микрокристаллические артриты – группа заболеваний, обусловленных воспалением в местах отложения образующихся in vivo кристаллов. К ним относятся заболевания с принципиально различной этиологией и патогенезом. И хотя провоспалительный потенциал для различных кристаллов отличается (кристаллов моноурата натрия, пирофосфата кальция, гидроксиапатита и др.), все они клинически могут проявляться острым воспалением, чаще артритом или периартикулярным поражением одного или нескольких суставов. Наиболее часто микрокристаллические артриты вызываются кристаллами уратов (подагра) и пирофосфата кальция (болезнь депонирования пирофосфатов кальция (БДПК)).
Подагра является наиболее частой причиной артритов у взрослых, не реже, по крайней мере в пожилом и старческом возрасте, выявляется БДПК. Клиническая картина БДПК нередко напоминает подагру – примерно в четверти случаев клинически она проявляется острыми приступами артрита, практически неотличимыми от таковых при подагре, полностью оправдывая один из исторических вариантов названия заболевания – «псевдоподагра» [1]. Кроме того, возможно сочетание двух заболеваний, что значительно затрудняет не только диагностику, но и подбор терапии [2–4]. Более того, по некоторым данным, подагра может быть также фактором риска развития БДПК [5].
Эпидемиологических исследований сочетания подагры и БДПК не проводилось. Однако в клинической практике сочетание двух микрокристаллических артритов – довольно частое явление [3, 6]. Ниже приведен клинический случай выявления у пациента двух микрокристаллических артритов.
Пациент Е., 56 лет, дебют заболевания в 2011 г. с развития острого олигоартрита (1-го плюснефалангового и голеностопного суставов). Артрит купировался самостоятельно в течение 8 дней. В последующем отмечались рецидивы артрита 1-х плюснефаланговых, голеностопных, предплюсны с частотой до 3–4 раз в год, при обострении с успехом применял НПВП (диклофенак натрия в/м). Уровень мочевой кислоты (МК) стойко превышал 500 мкмоль/л. С 2014 г. – резкое учащение частоты приступов (ежемесячно), стали вовлекаться коленные суставы, применение диклофенака стало менее действенным, потребность в нем увеличилась. Тогда же появились боли в эпигастрии после приема пищи, по результатам эзофагогастродуоденоскопии впервые выявлен эрозивный гастрит. Вскоре (в ноябре 2014 г.) был консультирован в ФГБНУ НИИР им. В.А. Насоновой, где был верифицирован диагноз подагры, подтвержденный результатами поляризационной микроскопии, выявившей кристаллы моноурата натрия в синовиальной жидкости. Сывороточный уровень МК составил 585 мкмоль/л. После купирования артрита была инициирована уратснижающая терапия – аллопуринол в стартовой дозе 100 мг/сут с последующим постепенным увеличением до 600 мг/сут, к апрелю 2015 г. был достигнут целевой уровень МК (360 мкмоль/л). Низкий сывороточный уровень МК, не превышающий целевой, сохранялся и в дальнейшем. Приступы артрита сохранялись вплоть до июня 2015 г., от профилактики приступов и противовоспалительной терапии воздерживался, т. к. прием НПВП приводил к возникновению болей в эпигастральной области.
В декабре 2015 г., при сохраняющейся нормоурикемии, было отмечено последовательное развитие артритов коленных, затем плечевых суставов, суставов кистей. Пациент самостоятельно принимал НПВП (эторикоксиб 120 мг), боли уменьшались, но при этом происходило неконтролируемое повышение АД, требующее назначения антигипертензивной терапии. В апреле 2016 г. пациент повторно обратился в НИИ ревматологии с жалобами на боль, припухлость в плечевых, коленных суставах, суставах кистей. При осмотре были определены артриты проксимальных межфаланговых суставов обеих кистей, плечевого сустава справа, коленного сустава справа. Уровень МК сыворотки сохранялся стабильно ниже 300 мкмоль/л. C целью исключения дебюта ревматоидного артрита (РА) проведено иммунологическое исследование, по результатам РФ и АЦЦП – в норме, СРБ – 23 мл/мл, СОЭ –27 мм/ч, число болезненных суставов – 6, число припухших суставов – 4. В диагностический поиск был включен среди возможных и диагноз БДПК. В результате обследования проведена также рентгенография коленных суставов, выявившая типичные признаки БДПК (хондрокальциноз) (рис. 1). 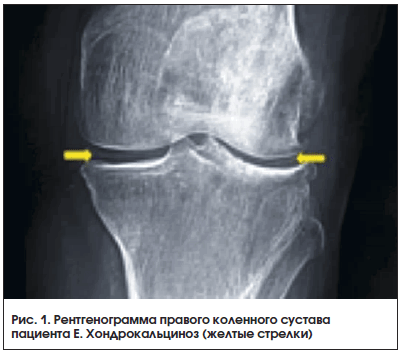
При повторном исследовании синовиальной жидкости были выявлены кристаллы пирофосфатов кальция, тогда как кристаллы моноурата натрия не определялись. Таким образом, был верифицирован диагноз второго микрокристаллического заболевания – БДПК. С целью купирования артрита пациенту был назначен колхицин в дозе 1 мг/сут, эффект расценен как недостаточный, повышение дозы до 1,5 мг/сут привело к выраженной диарее, потребовавшей отмены препарата. Несмотря на анамнестические данные о нежелательных явлениях при приеме НПВП (диклофенак – эрозивный гастрит, эторикоксиб – повышение АД), был назначен амтолметин гуацин (Найзилат) в суточной дозе 1200 мг (600 мг 2 р./сут). В течение 1 нед. артрит был полностью купирован, однако менее через 1 мес. развился рецидив артрита коленных суставов, прием Найзилата был возобновлен в прежней дозе, со столь же хорошим эффектом. После купирования приступа через 7 дней приема доза препарата была снижена до поддерживающей (600 мг/сут). При дальнейшем динамическом наблюдении на протяжении 6 мес. приступов артрита зарегистрировано не было, боли в суставах не беспокоили.
Обсуждение
Диагностика подагры и БДПК нередко вызывает затруднения – частое пересечение отдельных клинических симптомов у пациентов с микрокристаллическими артритами не позволяет выставить определенный диагноз только на основании клинической картины заболевания. Как правило, в начале болезни и подагра, и, нередко, пирофосфатная артропатия проявляются приступами острого артрита, характеризующимися сильнейшей болью, припуханием окружающих тканей, гиперемией и гипертермией кожного покрова над пораженным суставом, которые сменяются межприступными периодами. Кроме того, и подагра, и БДПК могут часто сочетаться как между собой, так и с другими ревматическими заболеваниями, что также затрудняет установление достоверного диагноза [3, 6–10].
У данного пациента трудности при верификации диагноза БДПК возникли не только из-за наличия у него достоверного диагноза подагры, на который при желании можно было бы списать новые приступы артрита, но и из-за возможности симулирования БДПК еще одного ревматического заболевания – РА. Так, наличие стойких симметричных артритов суставов верхних конечностей, в т. ч. кистей, повышение сывороточного уровня СРБ потребовало включения в диагностический поиск РА. Однако число вовлеченных суставов не превышало шести, а мелких суставов кистей – двух; повышение уровня СРБ было незначительным (менее чем 2-кратным). И даже если брать за основу диагностические критерии АСR/EULАR, то диагноз РА выставлен быть не может [11–13].
Напротив, диагноз подагры сомнению не подлежал исходно, кроме того, был подтвержден выявлением кристаллов моноурата натрия в синовиальной жидкости, а после подбора уратснижающей терапии пациент находился в состоянии ремиссии (полное отсутствие клинических проявлений заболевания). При подагре это отсутствие приступов острого артрита может быть достигнуто только при достижении стойкой нормоурикемии, под которой подразумевается уровень МК менее 360 мкмоль/л [14].
Именно факт наличия стойкой нормоурикемии позволил предположить наличие второго заболевания, вызвавшего обострение. Решающее значение в диагностике этих заболеваний имело выявление соответствующих кристаллов в синовиальной жидкости [1, 15]. И если исчезновение кристаллов моноурата натрия объясняется стойкой нормоурикемией, при которой имеющиеся кристаллы рассасываются, то, напротив, появление кристаллов пирофосфата кальция связано с «выходом» их в синовиальную жидкость из постепенно разрушающегося хряща в достаточном количестве, т. к. насыщаемость ими синовиальной жидкости не столь велика. Таким образом, сочетание двух основных признаков БДПК: выявление кристаллов пирофосфата кальция в синовиальной жидкости и типичные признаки хондрокальциноза по результатам рентгенологического исследования суставов позволили выставить пациенту диагноз достоверной БДПК. При этом даже при отсутствии рентгенологических признаков хондрокальциноза диагноз БДПК этому пациенту не исключался бы, т. к. рентгенография обладает низким разрешением при выявлении небольших депозитов кристаллов. В этом отношении более информативным является УЗИ, использование которого для выявления депозитов кристаллов пирофосфатов кальция может быть дополнительным инструментом ранней диагностики (табл.1) [1, 16]. 
Другим вопросом, который предстояло решить, был выбор оптимальной симптоматической терапии. Несмотря на высокую частоту БДПК, полиморфизм симптомов, диктующий необходимость дифференцированного подхода к выбору оптимальной схемы терапии, исследования, посвященные изучению эффективности и безопасности лекарственных препаратов при БДПК, крайне малочисленны, а рандомизированные контролируемые исследования и вовсе отсутствуют. В то же время список лекарственных средств, применяемых при БДПК, достаточно широк: НПВП, колхицин, низкие дозы глюкокортикоидов, гидроксихлорохин, метотрексат, биологические агенты (ингибиторы интерлейкина 1) [17]. Согласно рекомендациям, при остром приступе возможно назначение НПВП, колхицина [1, 18]. Однако назначение колхицина в необходимых дозах вызывало у пациента развитие нежелательных явлений, ограничивающих его применение (как и использовавшиеся ранее НПВП).
Очевидно, что когда НПВП используются в течение короткого или относительно короткого времени, в большей степени важен контроль побочных эффектов, связанных с ЖКТ. Хорошо известно, что опасная патология ЖКТ (язвы, кровотечение, перфорация) может возникать в первые дни или даже часы после парентерального введения или перорального приема НПВП. В этом плане очень показательны данные финских исследователей A. Helin-Salmivaara et al., которые оценили зависимость риска развития ЖК-осложнений от длительности приема НПВП. Материалом для анализа стало популяционное исследование по типу «случай/контроль», в котором в основную группу был включен 9191 больной с ЖК-кровотечением, язвой или перфорацией, а в контрольную группу – 41 780 лиц без данной патологии. Оказалось, что опасность развития данных осложнений была максимальной в первые 2 нед. приема НПВП (ОШ 3,2), а затем существенно снижалась [19].
У данного пациента упорный рецидивирующий артрит обусловил необходимость постоянного приема НПВП, с одной стороны, обладающих достаточно выраженной противовоспалительной активностью, с другой – не вызывающих нежелательных явлений со стороны ЖКТ. Для лечения требовался препарат, который обладал бы анальгетической и противовоспалительной активностью традиционных представителей этой лекарственной группы, но не имел бы при этом свойственных им специфических недостатков. К сожалению, ни одно из предложенных на сегодня решений этой проблемы нельзя признать идеальным [20].
Наш выбор пал на амтолметин гуацил (Найзилат). Амтолметин гуацил как молекула был синтезирован в Италии в 1985 г. Его предшественник толметин – это хорошо изученный неселективный НПВП, который никогда не был представлен в России, однако широко применялся во всем мире. Толметин характеризуется хорошим обезболивающим и противовоспалительным эффектом, а дополнительное его преимущество заключается во влиянии на таламические центры болевой чувствительности. Амтолметин гуацил унаследовал все положительные свойства толметина, при этом получив дополнительные преимущества. Основное отличие этого препарата от всей группы НПВП – наличие в составе ванилиновой группы, которая имеет высокую аффинность к капсаициновым рецепторам слизистой оболочки желудка, двенадцатиперстной и тонкой кишки. В результате раздражения последних запускается локальная выработка оксида азота, который наравне с физиологическими простагландинами играет значимую роль в системе гастропротекции. Последующее неизбежное снижение выработки физиологических простагландинов в результате действия неселективного НПВП в значимой степени компенсируется данным механизмом, что позволяет заметно уменьшить частоту побочных эффектов со стороны ЖКТ при применении данного препарата. Таким образом, амтолметин гуацил совмещает в себе, казалось бы, несочетаемые свойства: положительные качества неселективного НПВП (хорошее обезболивающее и противовоспалительное действие) и протективный эффект в отношении слизистой оболочки ЖКТ [21]. Клинические исследования, проведенные в различных странах Европы, показали, что по своим основным свойствам амтолметин гуацил не уступает таким препаратам, как диклофенак и индометацин, в то время как частота развития поражения ЖКТ при применении амтолметина гуацила значительно ниже [20–22].
Назначение Найзилата пациенту с сочетанием двух микрокристаллических артритов в течение 6 мес. оказалось эффективным и безопасным как для купирования обострения, так и для длительного приема.
Диагностика и лечение микрокристаллических артритов, несмотря на их широкое распространение, до сих пор вызывают затруднение. На практике невозможно создать оптимальный алгоритм диагностики микрокристаллических артритов, который позволил бы поставить достоверный диагноз у каждого пациента. Однако при использовании современных методов диагностики верификация сходных по клинической картине заболеваний максимально вероятна. Подбор адекватной противовоспалительной и анальгетической терапии при остром, в т. ч. часто рецидивирующем, артрите должен осуществляться индивидуально у каждого пациента с учетом противопоказаний и сопутствующих заболеваний.
Литература
1. Zhang W., Doherty M., Bardin T. et al. EULAR recommendations for calcium pyrophosphate deposition. Part I: terminology and diagnosis // Ann. Rheum. Dis. 2011. Vol. 70. Р. 563–570.
2. Louthrenoo W., Sukitawut W. Calcium pyrophosphate dihydratecrystal deposition: a clinical and laboratory analysis of 91 Thai patients // J Med Asoc Thai. 1999. Vol. 82(6). Р. 569–576.
3. Владимиров С.А., Елисеев М.С., Божьева Л.А., Смирнов А.В., Северинова М.В., Волков А.В. Информативность различных методов лучевой диагностики при сочетании подагры и болезни депонирования пирофосфата кальция // Доктор РУ. 2015. № 8 (109) – 9 (110). [Vladimirov S.A., Eliseev M.S., Bozh’eva L.A., Smirnov A.V., Severinova M.V., Volkov A.V. Informativnost’ razlichnyh metodov luchevoj diagnostiki pri sochetanii podagry i bolezni deponirovanija pirofosfata kal’cija // Doktor RU. 2015. № 8 (109) – 9 (110) (in Russian)].
4. Елисеев М.С., Владимиров С.А. Распространенность и клинические особенности подагры и БДПК у пациентов с острым артритом // Научно-практическая ревматология. 2015. Т. 53. № 4. С. 375–378 [Eliseev M.S., Vladimirov S.A. Rasprostranennost’ i klinicheskie osobennosti podagry i BDPK u pacientov s ostrym artritom. Nauchno-prakticheskaja revmatologija. 2015. T. 53. № 4. S. 375–378 (in Russian)].
5. Richette P., Bardin T., Doherty M. An update on the epidemiology of calcium pyrophosphate dihydrate deposition disease // Rheumatology. 2009. Vol. 48(7). Р. 711–715.
6. Ильиных Е.В., Владимиров С.А., Кудаева Ф.М., Осипянц М.А., Божьева Л.А. Маска пирофосфатной артропатии: разоблачение // Современная ревматология. 2011. № 2. С. 35–36 [Il’inyh E.V., Vladimirov S.A., Kudaeva F.M., Osipjanc M.A., Bozh’eva L.А. Maska pirofosfatnoj artropatii: razoblachenie. Sovremennaja revmatologija. 2011. № 2. S. 35–36 (in Russian)].
7. Yoo Y., Seo Y.J., Huh M. et al. Gout andcoexisting pseudogout in the knee joint // Knee Surg Sports Traumatol Arthrosc. 2011. Vol. 19(4). Р. 553–555.
8. Resnick D., Williams G., Weisman M.H. et al. Rheumatoid arthritis and pseudo-rheumatoid arthritis in calcium pyrophosphate dihydrate crystal deposition disease // Radiology. 1981. Vol. 140(3). Р. 615–621.
9. Caramaschi P., Biasi D., Carletto A. et al. Calcium pyrophosphate dihydrate crystal deposition disease and primary hyperparathyroidism associated with rheumatoid arthritis: description of 3 cases // Clin Exp Rheum. 2000. Vol. 18(1). Р. 110.
10. Барскова В.Г., Ильина A.E., Семенова Л.А., Раденска-Лоповок С.Г., Осипянц M.A., Смирнов А.В., Макаров М.А. Пирофосфатная артропатия – ревматологический синдром «айсберга»: время для переоценки значения в патологии суставов // Современная ревматология. 2010. № 4(2). Р. 5–11 [Barskova V.G., Ilyina A.E., Semenova L.A., Radenska-Lopovok S.G., Osipyants M.A., Smirnov A.V., Makarov M.A. Pirofosfatnaja artropatija — revmatologicheskij sindrom «ajsberga»: vremja dlja pereocenki znachenija v patologii sustavov // Sovremennaja revmatologija. 2010. № 4(2). S. 5–11 (in Russian)]. doi:10.14412/1996-7012-2010-595.
11. Smolen J.S., Aletaha D., Bijlsma J.W. et al. Treating rheumatoid arthritis to target: recommendations of an international task force // Ann Rheum Dis. 2010 Apr. Vol. 69(4). Р. 631–637. doi: 10.1136/ard.2009.123919.Epub 2010 Mar 9.
12. Smolen J.S., Breedveld F.C., Burmester G. et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force // Ann Rheum Dis. 2016 Jan. Vol. 75(1). Р. 3–15. doi: 10.1136/annrheumdis-2015-207524. Epub 2015 May 12.
13. Владимиров С.А., Елисеев М.С., Раденска-Лоповок С.Г., Барскова В.Г. Дифференциальная диагностика ревматоидного артрита и подагры // Современная ревматология. 2008. № 4. С. 39–41 [Vladimirov S.A., Eliseev M.S., Radenska-Lopovok S.G., Barskova V.G. Differencial’naja diagnostika revmatoidnogo artrita i podagry. // Sovremennaja revmatologija. 2008. № 4. S. 39–41 (in Russian)]).
14. Zhang W., Doherty M., Bardin T. et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) // Ann Rheum Dis. 2006. Vol. 65(10). Р. 312–324.
15. Барскова В.Г. Рекомендации Европейской антиревматической лиги по терминологии и диагностике болезни депонирования кристаллов пирофосфата кальция: комментарии эксперта // Современная ревматология. 2011. № 5(2). С. 6–8 [Barskova V.G. Rekomendacii Evropejskoj antirevmaticheskoj ligi po terminologii i diagnostike bolezni deponirovanija kristallov pirofosfata kal’cija: kommentarii jeksperta // Sovremennaja revmatologija. 2011. № 5(2). S. 6–8 (in Russian)]. doi:10.14412/1996-7012-2011-661.
16. Барскова В.Г., Елисеев М.С., Владимиров С.А. Диагностика микрокристаллической патологии суставов методом поляризационной микроскопии (трактовка и методические рекомендации к исследованию) // Современная ревматология. 2010. № 4(1). С. 84–88 [Barskova V.G., Eliseev M.S., Vladimirov S.A. Diagnostika mikrokristallicheskoj patologii sustavov metodom poljarizacionnoj mikroskopii (traktovka i metodicheskie rekomendacii k issledovaniju) // Sovremennaja revmatologija. 2010. № 4(1). S. 84–88 (in Russian)]. doi:10.14412/1996-7012-2010-594. DOI:10.14412/1996-7012-2010-594.
17. Abhishek A., Doherty M. Update on calcium pyrophosphate deposition // Clin Exp Rheumatol. 2016 Jul-Aug. Vol. 34(4 Suppl 98). Р. 32–38. Epub 2016 Jul 22.
18. Eliseev M.S., Vladimirov S.A., Nasonov E.L. The Frequency OF Calcium Pyrophosphate Deposition Disease in Patients With Acute Arthritis // Annals of the Rheumatic Diseases. 2014. Vol. 73(2). Р. 781.
19. Helin-Salmivaara A., Saarelainen S., Gronroos J. et al. Risk of upper gastrointestinal events with the use of various NSAIDs: A case-control study in a general population // Scand J Gastroenterol. 2007. Vol. 42. Р. 923–932.
20. Каратеев А.Е. Амтолметин гуацил: можно ли создать ≪улучшенный≫ НПВП? // Медицинский cовет. 2013. № 12. С. 84–86 [Karateev A.E. Amtolmetin guacil: mozhno li sozdat’ ≪uluchshennyj≫ NPVP? // Medicinskij sovet. 2013. № 12. S. 84–86 (in Russian)].
21. Li Y.H., Li J., Huang Y. et al. Gastroprotective effect and mechanism of amtolmetin guacyl in mice // World J. Gastroenterol. 2004. Vol. 10. № 24. P. 3616–3620.
22. Каратеев А.Е. На пути к созданию новой̆ генерации нестероидных противовоспалительных препаратов: амтолметин гуацил // Современная ревматология. 2014. № 8(2). С. 83–89 [Karateev A.E. Na puti k sozdaniju novoĭ generacii nesteroidnyh protivovospalitel’nyh preparatov: amtolmetin guacil // Sovremennaja revmatologija. 2014. № 8(2). S. 83–89 (in Russian)]. doi:10.14412/1996-7012-2014-2-83-89.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru