Содержание статьи
Синдром раздраженной кишки (СРК): новые представления об
этиопатогенезе и лечении
В. И. Немцов, докор медицинских наук, профессор
ГБОУ ВПО СПбГМУ им. акад. И. П. Павлова МЗ РФ, Санкт-Петербург
До настоящего времени общепринято, что синдром раздраженного кишечника (СРК)
— функциональное расстройство кишечника, при котором боль или неприятные
ощущения в животе связаны с дефекацией, изменениями частоты и характера стула
или другими признаками нарушения опорожнения кишечника.
Для диагностики СРК сейчас рекомендуют использовать так называемые Римские
критерии III [1], по которым СРК диагностируется, если у больного имеются
рецидивирующие боли или дискомфорт в животе по меньшей мере три дня в течение
месяца на протяжении последних трех месяцев и эти проявления сочетаются с двумя
из трех следующих признаков:
1) боли (или дискомфорт) уменьшаются после акта
дефекации;
2) боли сопровождаются изменениями стула;
3) боли связаны с изменениями консистенции стула.
Предлагается также оценивать кал по Бристольской шкале, которая определяет
семь его вариантов (рис. 1).
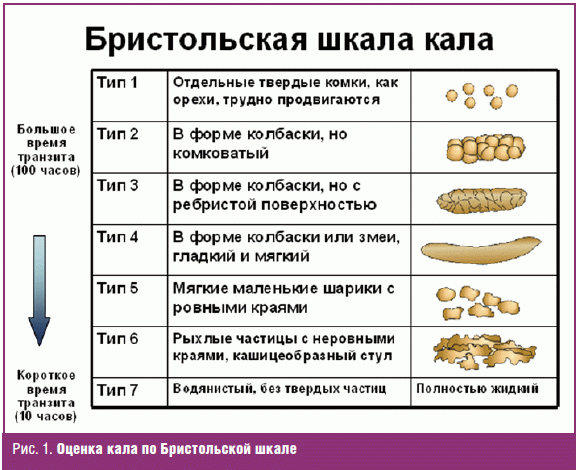
Тип кала 1 и 2 определяет запор, тип кала 6 и 7 — понос.
По Римским критериям III выделяют следующие варианты СРК:
1) СРК с запорами (стул 1-го или 2-го типа > 25%,
а жидкий стул < 25% всех опорожнений кишечника;
2) СРК с диареей (стул 6-го или 7-го типа > 25%, а твердый стул < 25% всех
опорожнений кишечника;
3) смешанный вариант СРК (стул 1-го, 2-го, 6-го или 7-го типов > 25% всех
опорожнений кишечника;
4) неклассифицируемый (неспецифический) вариант СРК — нарушения стула,
несоответствующие другим вариантам СРК.
Этим заболеванием чаще болеют женщины (2:1). Пик заболеваемости приходится на
возраст 21–40 лет, однако болеть этим заболеванием могут и дети в возрасте 14–17
лет (чаще — девочки). Значительно реже СРК возникает после 40–50 лет, а первое
появление отдельных его симптомов у людей старше 60 лет делает диагноз СРК
маловероятным и требует исключения органических заболеваний желудочно-кишечного
тракта (ЖКТ). Статистические данные о распространенности СРК в разных странах
показывают, что этим заболеванием страдает приблизительно 20% всего населения,
причем распространенность СРК может варьировать в различных популяциях в
пределах одной страны [2, 3].
Вопросы этиологии и патогенеза СРК и понятие о функциональных заболеваниях
Конечно, термин «функциональное заболевание» условен, поскольку за любой
функцией стоит та или иная структура, нарушение которой и приводит к нарушению
функции. Поэтому многие клиницисты и морфологи выступали и выступают против
термина «функциональные заболевания». В последние годы наиболее последовательным
критиком этого понятия, в частности в отношении СРК, выступает Я. С. Циммерман
[4].
При выделении всей группы так называемых «функциональных заболеваний», в том
числе и СРК, обычно имеют в виду отсутствие явных органных изменений при
визуальном обследовании органа (по отношению к СРК — данные колоноскопии) и (в
идеале) отсутствие специфических для какого-либо органического заболевания
гистологических изменений (на уровне светового микроскопа). Иначе говоря,
функциональные заболевания ЖКТ — это группа заболеваний, при которых
специфическая структурная причина желудочных и кишечных недомоганий не
определяется обычными методами исследования [5]. Вместе с тем в настоящее время
показано, что в слизистой оболочке кишки у больных СРК может возникать
воспаление с выделением различных биологически активных соединений, которые, в
частности, стимулируют пролиферацию гладких мышц, что изменяет перистальтику
кишки. Иногда такие изменения вторичны и возникают из-за присоединившегося
дисбиоза, но иногда они могут ему предшествовать. Обнаружены также
ультраструктурные изменения слизистой оболочки толстой кишки (электронная
микроскопия): утолщение и разрыхление базальной мембраны, избыточное отложение
коллагеновых волокон в субэпителиальной зоне, дистрофические изменения отдельных
клеток эпителия и ряд других находок. Почти у половины больных с СРК повышена
активность и количество воспалительных клеток в слизистой оболочке кишки [6],
повышена экспрессия провоспалительных и понижена экспрессия
противовоспалительных цитокинов [7, 8]. Иногда у больных СРК обнаруживают
следующие особенности воспалительного инфильтрата слизистой оболочки кишки:
преобладание энтерохромаффинных клеток, секретирующих серотонин (это вызывает
усиление моторики), а также скопление тучных клеток и их дегрануляция в зоне
нервных окончаний (это изменяет восприятие боли) [9–12].
Все это еще раз подчеркивает условность выделения группы «функциональных
заболеваний».
Если один из главных авторов внедрения в клиническую практику диагноза СРК
профессор Douglas A. Drossman в 1998 г. однозначно высказался, что СРК —
биопсихосоциальное заболевание [13], то в 2006 г. он же писал: «В последние годы
гистологические находки показали, что различия между функциональными и
органическими изменениями стали размытыми» [14], а в 2013 году: «СРК —
совокупность симптомов с гетерогенными определяющими факторами» [15].
Существует много факторов, способствующих развитию СРК. Как и при всех
хронических заболеваниях, существенную роль в развитии СРК играет
наследственность. Обнаружено, что 1/3 больных СРК имеют кровных родственников со
сходной симптоматикой, а конкордантность в развитии СРК у разнояйцевых близнецов
составляет 13%, а у однояйцевых — 33% [16]. Выявлена роль генетического
полиморфизма генов, ответственных за синтез противовоспалительных и
провоспалительных цитокинов (соответственно интерлейкина-10 и фактора некроза
опухоли альфа), а также генов ферментов обратного захвата серотонина [17, 18].
Установлена роль генетического полиморфизма генов g-протеина, влияющего на
центральную нервную систему и местную регуляцию моторной функции кишки, а также
полиморфизм генов альфа-2-адренорецепторов кишки [19].
Нарушение моторики кишечника само по себе способствует развитию дисбиоза, в
частности, снижению содержания полезной сахаролитической микрофлоры. Впрочем,
следует иметь в виду, что возможен не только так называемый таксономический
дисбиоз, при котором меняется видовой состав микрофлоры, не только
количественные сдвиги в составе индигенной микрофлоры, например, при СИБР —
синдроме избыточного бактериального роста в тонкой кишке, но и метаболический
дисбиоз, при котором из-за неблагоприятных условий меняется метаболическая
активность индигенных видов микроорганизмов [62].
Микробиота способна управлять моторикой кишечника: Bifidobacterium
bifidum и Lactobacillus acidophilus усиливают пропульсивную
моторику, а Escherichia ssp. ее угнетают [20].
У больных СРК практически всегда имеет место дисбиоз толстой кишки, а синдром
избыточного бактериального роста в тонкой кишке (уровень обсеменения более 105
КОЕ) выявляется у большинства больных. При развитии дисбиоза кишечника
практически всегда страдает сахаролитическая микрофлора, синтезирующая в
процессе метаболизма короткоцепочечные жирные кислоты (КЖК), которые необходимы
для нормальной функции колоноцитов и которые не образуются макроорганизмом.
Масляная кислота (бутират), ацетоуксусная кислота (ацетат) и пропионовая кислота
(пропионат) составляют около 83% КЖК, образующихся в кишечнике [21].
Концентрация этих КЖК в кишечнике колеблется от 60 до 150 ммоль/кг [22], а
соотношение ацетат/пропионат/бутират обычно постоянно и составляет 60:25:10
[23]. КЖК быстро всасываются эпителием кишечника — пик абсорбции в слепой кишке
и восходящей кишке [24]. Одной из важнейших КЖК является бутират — важнейший
источник энергии для колоноцитов [25]. Помимо этого, бутират оказывает
многообразное действие по обеспечению гомеостаза толстой кишки (см. рис. 2 — по
Н. Hamer и соавт. с изменениями) [26].
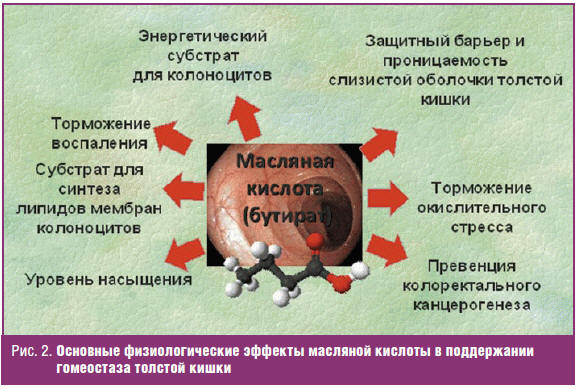
Основными продуцентами бутирата являются Clostridium spp., Eubacterium
spp., Fusobacterium spp., Butyrivibrio spp., Megasphaera elsdenii, Mitsuokella
multiacida, Roseburia intestinalis, Faecalibacterium prausnitzii и Eubacterium
hallii [27]. В последние годы многие авторы выявили изменения экспрессии
toll-like-рецепторов (TLR) слизистой оболочки кишечника, что подчеркивает
принципиальную роль дисбиоза кишечника и умеренно выраженного иммунного
воспаления в развитии СРК [28, 29]. TLR в физиологических условиях
взаимодействуют с лигандами нормальной микрофлоры кишечника. Такое распознавание
комменсальной микрофлоры необходимо для поддержания нормального гомеостаза — это
обеспечивает баланс функций кишечного эпителия и других клеток, баланс синтеза
про- и противовоспалительных цитокинов и различных протективных факторов [30].
Например, в ряде исследований у больных СРК выявлено снижение концентрации в
сыворотке крови антивоспалительного цитокина интерлейкина-10 и повышение
провоспалительного цитокина — фактора некроза опухоли альфа [31].
При целом ряде патологических состояний выявлена активация различных TLR и
повышение количества выделяемых провоспалительных цитокинов и других
биологически активных веществ [32]. У больных СРК обнаружена повышенная
экспрессия TLR-4 и TLR-5, ответственных за распознавание соответственно
липополисахарида и флагеллина, и оба эти вещества определяют грамотрицательные
бактерии [33]. При этом в крови определяется повышенный уровень
антифлагеллиновых антител, и это коррелирует с повышенной проницаемостью
слизистой оболочки кишки [34]. Высказано предположение о существовании в ряде
случаев синдрома перекреста между СРК и воспалительными заболеваниями кишечника
(ВЗК) (overlap of IBD and IBS). В частности, возможно сохранение симптомов,
укладывающихся в клиническую картину СРК (по Римским критериям) у больных с
почти полной гистологической ремиссией язвенного колита (ЯК) [35]. Существует
мнение, что наличие персистирующего воспаления слизистой оболочки толстой кишки
более 6 месяцев у больных с симптомами СРК позволяет ставить диагноз ЯК легкого
течения [11].
Все эти находки не противоречат тезису о значимости эмоциональных и
когнитивных нарушений в генезе различных вариантов СРК. С этой точки зрения
важно подчеркнуть, что факторами риска развития СРК являются некоторые
личностные особенности — склонность к истероидным реакциям, ипохондрии,
агрессивность, канцерофобия. Иногда имеет место синдром маскированной депрессии.
В последние годы нарушения со стороны центральной нервной системы (ЦНС)
подтверждены с помощью позитронно-эмиссионной томографии и магнитно-резонансной
томографии головного мозга [36, 37]. В частности, показана повышенная активность
anterior cingulate cortex [38]. Эти находки коррелируют с нарушением тонуса
прямой кишки и рядом нервно-психических расстройств. Показано, что нормальная
микробиота контролирует эмоции и стрессовые реакции [39]. В моделях на животных
показано влияние микробиоты на сигнальные процессы в ЦНС и аффективное
поведение; в отсутствии нормальной микробиоты нарушается обмен серотонина в ЦНС,
и это может носить необратимый характер [40].
Все биологические ритмы находятся в строгой зависимости от основного водителя
циркадианных ритмов, который расположен в супрахиазматических ядрах
гипоталамуса, а посредником, доносящим регулирующие сигналы до органов, является
мелатонин. Продукции мелатонина подчинены все эндогенные ритмы нашего организма
[41]. Мелатонин регулирует моторику, секрецию и микроциркуляцию кишечника в
соответствии с биоритмами пищеварительных функций [42], и при СРК снижается его
секреция.
Гетерогенность СРК
Гетерогенность этиологии и патогенеза СРК позволяет в настоящее время
выделить несколько клинико-патогенетических вариантов СРК (фенотипов). Одним из
первых был выделен постинфекционный вариант СРК (ПИ-СРК) — развитие болезни
после перенесенной острой кишечной инфекции (чаще — бактериальной). Считается,
что почти у трети больных с СРК развитию этого синдрома предшествовала острая
кишечная инфекция и почти у 25% больных, перенесших острую кишечную инфекцию,
возникает после этого СРК [43]. По многочисленным исследованиям различных
авторов частота развития ПИ-СРК после перенесенной бактериальной кишечной
инфекции колеблется от 4% до 31% [44]. К факторам риска развития ПИ-СРК относят
женский пол, молодой возраст, длительное лечение острой кишечной инфекции
антибиотиками, возможно, характер возбудителя (Salmonella spp.,
Shigella spp., Compylobacter spp. и ряд других возбудителей),
тяжесть течения острой инфекции (степень выраженности интоксикационного
синдрома) и психологические расстройства [45]. В последнее время показано, что
после некоторых острых вирусных гастроэнтеритов, в частности, вызванных
норовирусами, может также возникать ПИ-СРК [46]. Считается, что риск развития
СРК в течение одного года после перенесенной кишечной инфекции возрастает в 12
раз. Чаще при этом возникает СРК с преобладанием диареи.
Важным фактором патогенеза постинфекционного СРК являются нарушения
интрамуральной нервной системы кишки, приводящие к повышенной висцеральной
чувствительности, а также расстройства регуляторных воздействий со стороны ЦНС
[2]. Также после перенесенной кишечной инфекции воспалительный процесс может
персистировать в слизистой оболочке толстой кишки (ТК) и соседних лимфатических
узлах и имеет место гиперплазия и гиперфункция тучных клеток, активация
моноцитов — это индуцирует иммунное воспаление [47].
В последние годы выделен еще один вариант СРК (фенотип), при котором доказана
роль некоторых пищевых компонентов как триггеров возникновения симптомов СРК — в
частности, сенсибилизация к глютену [48–50]. У этих больных нет целиакии — у них
отсутствуют антитела к тканевой трансглютаминазе и нет атрофических изменений
слизистой оболочки тонкой кишки, но присутствуют антиглиадиновые антитела.
Авторы применили у этих больных аглютеновую диету, и все симптомы СРК были
купированы. Они вполне справедливо задаются вопросом — нет ли среди больных СРК
лиц с сенсибилизацией к каким-то другим пищевым антигенам?
Недавно был предложен еще один вариант СРК, связанный с дивертикулярной
болезнью (ДБ), причем замечена достоверная связь возникновения симптомов СРК с
преобладанием диареи при локализации дивертикулов в левой половине ТК или
билатерально (но не при дивертикулах только в правой половине ТК!) [51]. Еще
раньше было показано, что после перенесенного острого дивертикулита риск
развития симптомов СРК возрастает почти в 5 раз в течение последующих 6 лет
[52]. Впрочем, в этих ситуациях некоторые авторы предлагают говорить не о особом
варианте СРК, а об СРК-подобной дивертикулярной болезни [53].
В возникновении многих симптомов (болевой синдром, метеоризм, урчание) СРК
играет роль повышенное газообразование и висцеральная гиперчувствительность к
избыточному количеству кишечного газа. Существенную роль в нарушении моторики ТК,
приводящей к запору, играют метансинтезирующие микроорганизмы, в частности
Methanobrevibacter smitbii (они составляют 10% всех прокариот в кишечном
микробиоме). Метан тормозит моторику кишки, и у больных с запором часто находят
избыточную продукцию метана [54].
При любом из вариантов СРК часто встречаются сопутствующие симптомы,
относящиеся к другим отделам ЖКТ:
- симптомы функциональной желудочной диспепсии (до 87% больных);
- симптомы нарушения функции желчевыводящих путей (дисфункция желчного
пузыря и/или сфинктера Одди).
Часто встречаются также внекишечные сопутствующие симптомы и коморбидные
состояния (70–95% пациентов с СРК): боли в поясничной области, хроническая
тазовая боль (50%), дизурия, дисменорея, синдром хронической усталости (51%),
фибромиалгия (20–50%), патология височно-нижнечелюстного сустава (64%),
гастроэзофагеальная рефлюксная болезнь (ГЭРБ) [2]. Очень часто встречаются
изменения со стороны ЦНС: нарушения сна, синдром тревоги,
тревожно-ипохондрический синдром, тревожно-депрессивный синдром.
Диагноз СРК является диагнозом «исключения» — необходимо установить, что у
больного нет других (органических) заболеваний пищеварительной трубки. Для этого
следует помнить так называемые «сигналы тревоги», которые делают сомнительным
диагноз СРК и требуют тщательного лабораторно-инструментального обследования. К
«сигналам тревоги» относятся: примесь крови в кале, полифекалия, появление
симптомов в ночные часы, лихорадка, немотивированное похудание, стойкое снижение
аппетита, локализованные стойкие боли, анемия, повышение СОЭ, начало заболевания
в пожилом возрасте. При типичном течении СРК ни одного из этих симптомов не
должно быть. При наличии хотя бы одного из них необходимо дополнительное
обследование кишечника и при необходимости — других органов и систем.
Лечение СРК
При всей гетерогенности СРК существуют по крайней мере три момента, которые
объединяют различные варианты этого заболевания и которые встречаются у всех
больных и требуют терапевтической коррекции: психосоциальная компонента,
нарушение моторики ТК и дисбиоз кишечника. Соответственно, лечебные мероприятия
должны быть направлены на коррекцию всех этих нарушений. Изменения со стороны
ЦНС могут быть достаточно стойкими и часто требуют привлечения к лечебным
мероприятиям как медикаментозной терапии, так и различных психотерапевтических
методик. Для лечения нарушенной моторики кишки используются современные
селективные спазмолитики и нормокинетики. В этой статье мы уделим основное
внимание коррекции ключевых нарушений кишечной микробиоты. Уже давно
используются пребиотики и пробиотики, точнее, симбиотики, то есть препараты,
содержащие не один вид микроорганизмов, а комбинацию живых культур
микроорганизмов нескольких видов. Следует иметь в виду, что пробиотики действуют
только во время курсового лечения ими и в течение нескольких дней после
прекращения приема отмирают, так как являются чужеродными для макроорганизма.
Помимо этого, действие пробиотиков не является строго направленным, поскольку
микроорганизмы выделяют огромное количество биологически активных веществ
разнонаправленного действия.
В связи с этим более перспективным является использование пребиотиков,
которые создают благоприятные условия для роста и деятельности индигенной
микрофлоры, восстанавливая тем самым ее количественные и качественные
характеристики. Среди большого количества имеющихся пребиотиков широкое
распространение получили пищевые волокна, в частности — гидрофильные волокна из
наружной части семян подорожника овального (plantago ovata, или psyllium) —
препарат Мукофальк. Это средство за счет гель-формирующей фракции оказывает
цитопротективное и противовоспалительное действие на эпителий кишечника,
усиливает желчеобразование и снижает уровень холестерина, за счет
неферментируемой фракции нормализует моторику кишечника, а за счет
быстроферментируемой кишечными бактериями фракции оказывает пребиотическое
действие [55, 56].
В последние годы мы также получили возможность использовать сравнительно
новый класс веществ, которые получили название метабиотиков — аналогов
метаболитов кишечной микрофлоры.
Одним из первых таких препаратов является Закофальк, в состав которого входит
бутират (в виде соли масляной кислоты — бутирата кальция — 250 мг) и пребиотик
инулин (250 мг). Препарат является инновационной лекарственной формой на основе
полимерной матриксной структуры, которая обеспечивает непосредственную доставку
и высвобождение действующих веществ на всем протяжении толстой кишки.
Оптимальным является прием повторными месячными курсами по три таблетки в сутки
до еды. Следует также подчеркнуть, что в состав современных симбиотиков не
входят наиболее активные продуценты бутирата, о принципиальной роли которого в
гомеостазе было ранее сказано.
Доказано прямое противоспалительное действие бутирата — под его влиянием
снижается секреция провоспалительных цитокинов, таких как ФНО-α, оксид азота,
гамма-интерферон, ИЛ-2, ИЛ-12, ИЛ-8, снижается кишечная экспрессия TLR-4,
который считается важным компонентом врожденного иммунитета и который, при
избыточной продукции, приводит к развитию воспаления кишечника. Бутират также
стимулирует высвобождение противовоспалительного цитокина ИЛ-10 из моноцитов
[26]. С учетом обнаруженных у многих больных СРК воспалительных изменений в
толстой кишке назначение Закофалька при этом заболевании представляется весьма
перспективным. В литературе имеются данные об эффективности Закофалька. Так, по
данным одного двойного, слепого, рандомизированного и плацебо-контролируемого
исследования показана статистически достоверная эффективность препарата по
сравнению с плацебо в отношении купирования болевого синдрома и нормализации
стула [57]. Помимо противовоспалительного действия бутират, возможно, снижает
висцеральную гиперчувствительность толстой кишки [58], что еще больше расширяет
возможности его применения при СРК. Снижение висцеральной гиперчувствительности
при использовании бутирата, возможно, происходит путем модуляции активности
5-окситриптамина (серотонина) — важного нейротрансмиттера, выделение которого
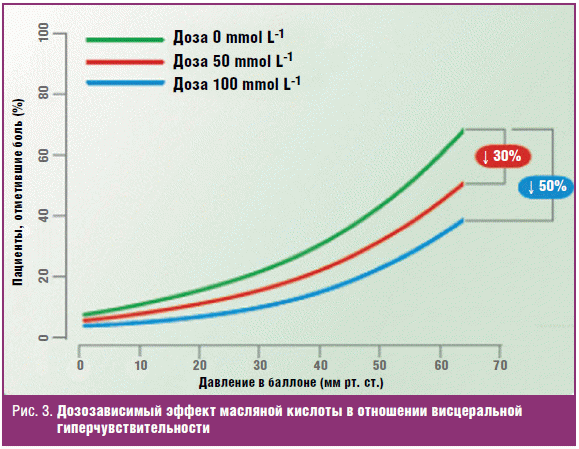
стимулирует бутират [59]. В двойном слепом плацебо-контролируемом перекрестном
исследовании S. A. Vanhoutvin и соавт. [60] изучали эффект ректального введения
масляной кислоты на висцеральную гиперчувствительность у здоровых добровольцев.
Каждый участник исследования ежедневно вводил себе перед сном бутират (50 и 100
ммоль) или физиологический раствор (плацебо) с помощью ректальных клизм.
Соответственно, три режима — три периода по одной неделе. Эффект масляной
кислоты на боль и дискомфорт, вызванные раздуванием ректального баллона,
оценивали по визуальной аналоговой шкале. Результаты исследования показали, что
введение масляной кислоты повышало пороги болевой чувствительности и снижало
дискомфорт. При этом отмечено, что введение бутирата имело дозозависимый эффект:
чем выше была доза бутирата, тем больше снижалась висцеральная чувствительность
(рис. 3). В настоящее время применение масляной кислоты в качестве
лекарственного средства для снижения висцеральной чувствительности запатентовано
в Евросоюзе.
С целью оценки эффективности Закофалька в комплексной терапии пациентов с СРК
мы провели собственное открытое исследование. Нами были обследованы 37 больных
СРК в фазе обострения в возрасте от 19 до 40 лет, среди них женщин было 29
человек, мужчин — 8. Все больные соответствовали по клинической картине Римским
критериям III, и у всех было нарушение стула — чаще двух раз в сутки,
преимущественно 5-й тип кала по Бристольской шкале. У всех больных в той или
иной степени страдало качество жизни. При этом в период обследования у больных
не было клинических проявлений какой-либо другой острой или хронической
патологии, кроме СРК, которая могла бы влиять на качество жизни. Больные были
разделены на две группы по 18 и 19 человек соответственно. Больные обеих групп
получали нормокинетики или селективные спазмолитики в сочетании с пробиотиком.
Больным 2-й группы дополнительно назначался препарат Закофальк по 1 таблетке 3
раза в сутки. Длительность курса терапии была 1 месяц. До начала лечения и в его
конце больные заполняли анкету оценки качества жизни (SF-36), несколько
измененную в соответствии с целями исследования — учитывался характер стула, его
кратность и степень выраженности болевого синдрома в брюшной полости. Больные
дважды посещали врача — до начала лечения и через 1 месяц. Анкеты заполнялись в
период посещения. Анализировалось качество жизни до и после месячного курса
терапии.
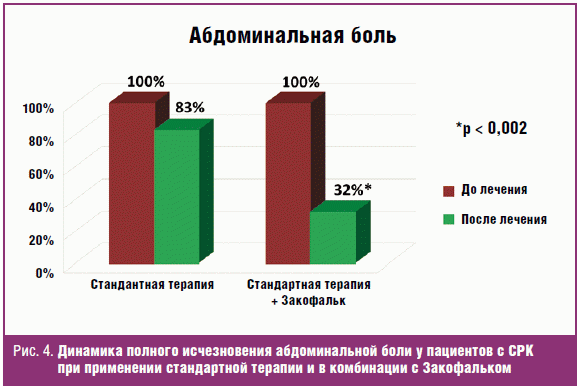
В результате лечения у всех больных обеих групп было достигнуто клиническое
улучшение — урежение частоты стула и нормализация его типа — почти у всех
больных он стал соответствовать 3-му или 4-му типу по Бристольской шкале кала (у
34 больных из 37 — 91,8%), а также произошло значительное уменьшение (у 21
больного) или полное исчезновение болевого синдрома (у 16 больных). При этом в
первой группе больных полное прекращение болей было у 3 человек, а во второй
группе (больные, принимавшие Закофальк) — у 13 человек (рис. 4). Разница
статистически достоверна: р < 0,002 (непараметрический критерий Фишера).
У остальных больных болевой синдром сохранялся, но оценивался ими как «очень
слабый» и мало влиял на качество жизни, при том, что до курса лечения болевой
синдром как «сильный» оценивался 18 больными и как «умеренный» — 19 больными. 11
пациентов первой группы отмечали в анкете свое самочувствие после курса терапии
как «хорошее» (70,5% больных), среди пациентов второй группы таких было 15
(88,2%) (статистической достоверности нет), однако частое ощущение «бодрости»
отметили все пациенты второй группы (19 человек — 100%) и 12 человек (66,6%) из
первой группы (р < 0,001 — непараметрический критерий Фишера). Создается
впечатление (в тексте анкеты это не получило отражения), что при комплексной
терапии с применением препарата Закофальк положительный эффект возникает
быстрее, чем при использовании терапии, в состав которой входят только
спазмолитик и пробиотик. Мы считаем, что, несмотря на небольшое количество
обследованных больных, можно сделать вывод об эффективности применения препарата
Закофальк как в целях колонопротекции и нормализации состава кишечной микробиоты
за счет его пребиотического действия, так и в целях снижения
гиперчувствительности кишечника, что особенно полезно в лечении больных СРК.
Статистически достоверное более частое полное исчезновение болевого синдрома у
больных, получивших месячный курс терапии Закофальком, подтверждает этот тезис.
В связи с частым развитием у больных СРК иммунного воспаления слабой
активности (Low Grade Immune Inflammation) мы считаем целесообразным в случаях
упорного течения заболевания и отсутствия полноценного клинического ответа на
проводимую терапию добавлять к лечению препараты группы 5-АСК (месалазина) —
гранулированный Салофальк в дозе 1,5–2,0 г/сутки в среднем на 2 недели [63, 64].
Хотя в опубликованном недавно консенсусе по диагностике и лечению СРК препараты
этой группы не получили отражения [61], в нашей практике мы видели положительные
результата такой комбинации. Таким образом, лечение больных СРК с целью
нормализации индигенной микрофлоры, снижения висцеральной гиперчувствительности,
уменьшения болевого синдрома и реализации нормокинетического эффекта можно
представить как этапный процесс: использование пребиотика (Мукофальк) —
добавление метабиотика (Закофальк) — добавление препарата группы 5-АСК (Салофальк).
Литература
- http://www.romecriteria.org/criteria.
-
Маев И. В., Кучерявый Ю. А., Черемушкин С. В. Эволюция
представлений о синдроме раздраженной кишки. М.: Форте-Принт, 2013. -
Canavan C., West J., Card T. The epidemiology of irritable bowel
syndrome // Clin Epidemiol. 2014; 6: 71–80. -
Циммерман Я. С. Синдром раздраженной кишки: какова его истинная
сущность? // Клинич. мед. 2014; 7: 19–28. -
El-Serag H., Talley N. Systematic review: health related quality
of life in functional dyspepsia // Aliment Pharmacol Ther. 2003; 18: 387–393. -
Chadwick V. S., Chen W., Shu D., Paulus B., Bethwaite P., Tie A.
et al. Activation of the mucosal immune system in irritable bowel syndrome //
Gastroenterology. 2002; 122: 1778–1783.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru





