Введение
Синдром раздраженного кишечника (СРК) является одним из наиболее распространенных функциональных заболе-ваний пищеварительного тракта. Доля лиц, испытывающих симптомы СРК, среди взрослого населения развитых стран достигает 10–20% [1, 2]. Несмотря на отсутствие осложнений и увеличения риска смерти, заболевание существенно снижает качество жизни больных, что приводит к значительным прямым и непрямым затратам на обследование и лечение.
В клинической практике доступен широкий перечень препаратов для симптоматического лечения, однако предлагаемая терапия часто недостаточна для того, чтобы эффективно купировать симптомы и предотвращать рецидивы СРК [3].
Перспективным представляется поиск новых терапевтических мишеней с целью индивидуализации назначаемой терапии и повышения эффективности лечения больных СРК. В условиях высокой распространенности факторов риска формирования СРК особый интерес для изучения механизмов формирования симптомов представляет когорта больных, страдающих избыточной массой тела и ожирением, которая характеризуется более тяжелым течением заболевания [4, 5].
В качестве одной из мишеней терапевтических вмешательств может выступать синдром повышенной эпителиальной проницаемости, который не только ассоциирован с наличием ожирения, но и играет значимую роль в формировании симптомов СРК [6, 7].
Феномен повышения эпителиальной проницаемости кишечника зарубежные специалисты называют синдромом «дырявого кишечника» [8]. Эпителиальная проницаемость кишечника отражает активность парацеллюлярного транспорта молекул между просветом и стенкой кишки. Степень проницаемости эпителиального барьера регулируется белками межклеточных плотных контактов как в физиологических условиях, так и в условиях патологического процесса [9].
Имеются данные о возможных ассоциациях степени нарушения проницаемости эпителиального барьера кишечника с выраженностью висцеральной гиперчувствительности и тяжестью течения СРК [9]. Кроме того, установлено, что эпителиальная проницаемость повышается при тревожно-депрессивных состояниях, часто провоцирующих появление симптомов СРК [10].
Одним из методов оценки проницаемости эпителиального барьера является определение экспрессии белков плотных контактов (tight junction, TJ) при исследовании биоптатов слизистой оболочки кишечника. Известно более 150 белков в составе TJ, среди них окклюдины, клаудины, ангулины, молекулы адгезии плотных контактов [8, 9, 11].
В клинической практике наиболее часто для оценки состояния эпителиального барьера кишечника используется определение концентрации зонулина в кале. Зонулин является одним из наиболее известных физиологических медиаторов, которые обратимо регулируют кишечную проницаемость путем модуляции межклеточных плотных контактов, в связи с чем в настоящем исследовании концентрация данного маркера в кале была использована для оценки проницаемости эпителия кишечника [12].
Цель исследования: изучение состояния эпителиального барьера кишечника и проведение сопоставлений с клиническими проявлениями СРК, качеством жизни, пищевыми привычками, признаками наличия тревоги и депрессии по результатам использования специального опросника и уровнем адипокинов (лептин и адипонектин) у больных СРК, ассоциированным с избыточной массой тела и ожирением.
Содержание статьи
Материал и методы
Проведено открытое исследование методом поперечного среза с участием 175 человек. Всеми участниками исследования было подписано информированное согласие на участие. Протокол исследования одобрен локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России № 11 от 16 сентября 2022 г.
Критериями включения в группу 1 являлись:
возраст старше 18 лет;
установленный диагноз СРК в соответствии с клиническими рекомендациями Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению СРК;
наличие подписанного информированного согласия на участие в исследовании.
Критериями включения в группу 2 являлись:
возраст старше 18 лет;
отсутствие установленного диагноза СРК;
наличие подписанного информированного согласия на участие в исследовании.
Критериями невключения являлись:
индекс массы тела (ИМТ) менее 18,5 кг/м2;
заболевания пищеварительного тракта, сопровождающиеся симптомами СРК;
прием лекарственных препаратов, действие которых может сопровождаться симптомами СРК;
наличие пищевой аллергии;
беременность, период грудного вскармливания или неиспользование методов контрацепции у женщин репродуктивного возраста;
оперативные вмешательства на кишечнике или полостные операции на желудочно-кишечном тракте в анамнезе (за исключением аппендэктомии);
наличие злокачественных новообразований любой локализации;
наличие в анамнезе онкологических заболеваний, туберкулеза или положительной реакции на ВИЧ-инфекцию, гепатит В и С, сифилис;
тяжелое течение сопутствующих заболеваний (неконтролируемая артериальная гипертензия, клинически значимые нарушения ритма и проводимости сердца, хроническая болезнь почек, тяжелое течение бронхиальной астмы и пр.);
наличие любых сопутствующих заболеваний, которые могут исказить результаты исследования (системные заболевания соединительной ткани и системные аутоиммунные заболевания, наличие эндокринных расстройств, врожденных дефектов, ведущих к нарушению нормальной жизнедеятельности и требующих коррекции);
занятия видами спорта, ассоциированными с набором мышечной массы.
В каждой из групп были выделены 2 подгруппы в зависимости от значения ИМТ. В подгруппах А пациенты имели ИМТ равный или выше 25 кг/м2, в подгруппах Б — ИМТ меньше 25 кг/м2, но выше 18,5 кг/м2. Таким образом, подгруппа 1А включала в себя пациентов с СРК, ассоциированным с избыточной массой тела или ожирением, подгруппа 1Б — пациентов с СРК и нормальной массой тела, подгруппа 2А — лиц без СРК с избыточной массой тела или ожирением, подгруппа 2Б — лиц без СРК с нормальной массой тела.
Оценка симптомов СРК (абдоминальная боль, диарея, запоры, метеоризм) осуществлялась по 10-балльной шкале, где 0 — отсутствие симптома, 10 — наибольшая выраженность симптома.
Оценка выраженности гастроэнтерологических симптомов осуществлялась с использованием шкалы оценки желудочно-кишечных симптомов GSRS (Gastrointestinal Symptom Rating Scale). Опросник состоит из 15 пунктов, которые объединены в 6 шкал: абдоминальная боль, гастроэзофагеальный рефлюкс (или рефлюкс-синдром), диарейный синдром, диспепсический синдром, синдром запора. Оценка показателей проводилась по 7-балльной шкале, при этом более высокие значения соответствовали большей выраженности симптомов [13]. Оценка встречаемости и выраженности тревоги и депрессии осуществлялась с использованием госпитальной шкалы тревоги и депрессии HADS (The Hospital Anxiety and Depression Scale), разработанной для первичного выявления депрессии и тревоги в условиях общемедицинской практики. Сумма набранных баллов, составившая от 0 до 7 баллов, считалась нормой, сумма от 8 до 10 баллов свидетельствовала о наличии признаков субклинически выраженных симптомов, сумма от 11 баллов и более — о наличии признаков клинически выраженных симптомов расстройства [14]. Уровень висцеральной гиперчувствительности VSI (Visceral Sensitivity Index) оценивался при помощи соответствующей анкеты. Опросник VSI представлен 15 вопросами-утверждениями, которые оцениваются по 5-балльной шкале Лайкерта от «совершенно не согласен» — 1 балл до «полностью согласен» — 5 баллов. В результате тестирования респондент получал итоговый балл от 0 (отсутствие тревоги по поводу симптомов заболевания) до 75 (высокая степень тревоги по поводу симптомов заболевания) [15]. Для оценки качества жизни был использован специфический опросник оценки качества жизни пациентов с СРК IBS-QoL (Irritable Bowel Syndrome Quality of Life), состоящий из 34 утверждений, касающихся проявлений заболевания и степени их влияния на жизнь самого пациента за прошедший месяц, с пятью вариантами ответов, где 1 балл — минимальная выраженность определенного аспекта, а 5 баллов — максимальная, а также с помощью неспецифического опросника оценки качества жизни SF-36 [16, 17]. Для оценки характера питания и пищевых пристрастий использовался опросник, разработанный на кафедре гигиены, питания человека ФГБОУ ВО ОмГМУ Минздрава России [18].
Выполнена сравнительная оценка уровня зонулина в кале в подгруппах, а также среди больных СРК в зависимости от степени тяжести течения и преобладающего типа нарушения стула (СРК с преобладанием диареи (СРК-Д), СРК с преобладанием запора (СРК-З), СРК со смешанным вариантом нарушения моторики (СРК-М)).
У всех участников исследования был определен уровень зонулина в кале методом иммуноферментного анализа с помощью тест-системы IDK Zonulin ELISA (Immundiagnostik AG, Германия), лептина и адипонектина в сыворотке крови с использованием коммерческих тест-систем LEPTIN ELISA KIT (DBC, Канада) и Adiponectin ELISA (MEDIAGNOST GmbH, Германия) для проведения твердофазного иммуноферментного анализа на планшетном фотометре iMark (BIORAD, США). Исследование материала выполняли на базе Центральной научно-исследовательской лаборатории ФГБОУ ВО ОмГМУ Минздрава России.
Статистический анализ выполнен в программном пакете StatSoft Statistica for Windows 10 с использованием Microsoft Excel. Проверка нормальности распределения проводилась с использованием критериев Колмогорова — Смирнова и Шапиро — Уилка. Распределение в обеих выборках не удовлетворяло требованиям параметрического анализа, в связи с чем для статистической обработки данных применялись непараметрические методы (критерий χ2 Пирсона, U-тест Манна — Уитни для независимых выборок). Взаимосвязь между показателями оценивалась при помощи корреляционного анализа Spirmen (rs). Сила связи между признаками при значениях коэффициентов корреляции от 0,0 до -0,25 и до +0,25 оценивалась как ее отсутствие или слабая; от 0,26 до 0,5 (от -0,26 до -0,5) — как умеренная; от 0,51 до 0,75 (от -0,5 до -0,75) — как средняя; более 0,75 (-0,75) — как сильная. Во всех процедурах статистического анализа критический уровень значимости р принимался равным 0,05. Для всех количественных признаков в сравниваемых группах использовались значения медианы, 1-й и 3-й квартили — Ме [Р25; Р75], для качественных показателей — значения доли.
Результаты исследования
Возраст участников исследования составил 29 [26; 35] лет, ИМТ — 26,4 [20,7; 31,2] кг/м2.
В группу 1 было включено 100 пациентов с СРК (возраст 30 [26; 36] лет, ИМТ 24,95 [20,2; 30,7] кг/м2): подгруппу 1А составили 50 человек с СРК, ассоциированным с избыточной массой тела или ожирением (возраст 29 [25; 34] лет, ИМТ 30,7 [27,9; 34,8] кг/м2); подгруппу 1Б — 50 человек, страдающих СРК, с нормальной массой тела (возраст 33 [27; 26] года, ИМТ 20,15 [19,1; 21,4] кг/м2).
В группу 2 было включено 75 человек, не страдающих СРК (возраст 29 [25; 34] лет, ИМТ 28,1 [21,2; 32,3] кг/м2): подгруппу 2А составили 50 участников, не страдающих СРК (возраст 29 [26; 34] лет) с ИМТ больше или равным 25 кг/м2 (ИМТ 30,7 [28,1; 34,8] кг/м2); подгруппу 2Б — 25 человек, не страдающих СРК (возраст 29 [23; 33] лет) с ИМТ менее 25 кг/м2 (ИМТ 20,4 [19,4; 21,2] кг/м2).
Подгруппы статистически значимо не различались по возрасту и половому составу.
Уровень зонулина в кале в подгруппах представлен на рисунке 1.
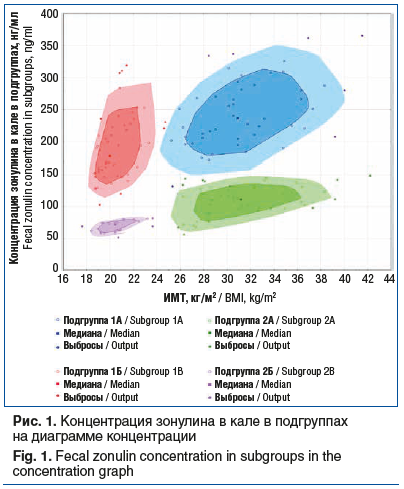
При оценке проницаемости эпителиального барьера кишечника в исследуемой выборке концентрация зонулина в кале составила 147 [102,5; 221] нг/мл, в том числе в группе 1 — 210,65 [167,75; 254,75] нг/мл, в группе 2 — 97 [73,5; 122] нг/мл (p=0,01).
Уровень зонулина в кале в подгруппе больных СРК с избыточной массой тела и ожирением оказался статистически значимо выше, чем в подгруппе пациентов с нормальной массой тела (231,75 [204; 281,5] нг/мл в подгруппе 1А против 188,75 [150,4; 226] нг/мл в подгруппе 1Б, p=0,01).
Среди лиц, не страдающих СРК, уровень зонулина также оказался статистически значимо выше в подгруппе участников, имеющих ИМТ равный или более 25 кг/м2 (114 [97; 132] нг/мл в подгруппе 2А против 73,5 [62,3; 78] нг/мл в подгруппе 2Б, p<0,01).
Концентрация зонулина в кале в подгруппе 1А оказалась статистически значимо выше, чем в подгруппе 2А, в подгруппе 1Б — статистически значимо выше, чем в подгруппе 2Б (в обоих случаях p=0,01).
Уровень зонулина в кале по преобладающему нарушению стула у больных СРК представлен в таблице 1.
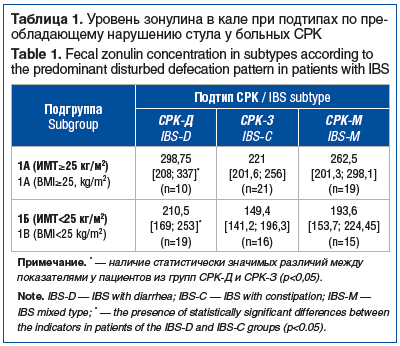
При оценке концентрации зонулина у пациентов с СРК по преобладающему типу нарушения стула установлен статистически значимо более высокий уровень проницаемости эпителиального барьера у больных СРК-Д в сравнении с пациентами, страдающими СРК-З (p=0,01). Значимых статистических различий между группами пациентов, страдающих СРК-Д и СРК-М, а также СРК-З и СРК-М, в обеих подгруппах установлено не было (во всех случаях p>0,05).
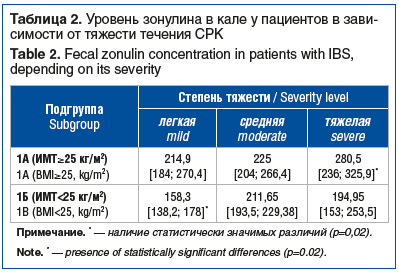
В подгруппе 1А пациенты с тяжелым течением заболевания характеризовались более высоким уровнем проницаемости эпителиального барьера кишечника, чем больные СРК легкой и средней степени тяжести (p=0,02). В подгруппе 1А концентрация зонулина в кале больных СРК легкой и средней степени тяжести существенно не различалась (p=0,21).
В подгруппе 1Б больные СРК легкой степени тяжести имели значимо меньшую концентрацию зонулина в кале, чем пациенты со среднетяжелым и тяжелым течением заболевания (p=0,02). Проницаемость эпителиального барьера кишечника у больных со среднетяжелым и тяжелым течением СРК в подгруппе 1Б не различалась (p=0,68).
Концентрация зонулина в кале в зависимости от тяжести течения СРК представлена в таблице 2.
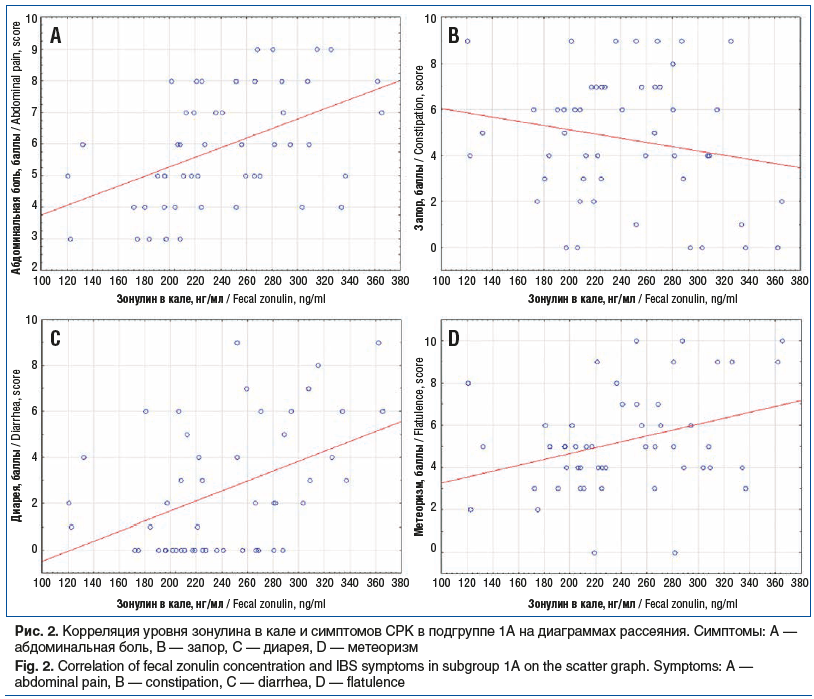
В подгруппе больных СРК, имеющих избыточную массу тела и ожирение, установлена статистически значимая положительная связь выраженности абдоминальной боли (средней силы), диареи и метеоризма (умеренной силы) с выраженностью нарушения эпителиальной проницаемости кишечника (p<0,05). Корреляция уровня зонулина в кале и симптомов СРК в подгруппе 1А представлена на диаграммах рассеяния на рисунке 2. В подгруппе больных СРК с нормальной массой тела выявлены положительные корреляции умеренной силы между концентрацией зонулина в кале и выраженностью абдоминальной боли и диареи (p<0,05).
При анализе ассоциаций между выраженностью нарушений эпителиальной проницаемости кишечника и показателями качества жизни установлено, что в подгруппе больных СРК, имеющих избыточную массу тела и ожирение, имелась отрицательная связь концентрации зонулина в кале с показателями качества жизни по шкалам: физическое функционирование, ролевое функционирование, обусловленное физическим состоянием, общее состояние здоровья, ролевое функционирование, обусловленное эмоциональным состоянием, психическое здоровье, психологический компонент здоровья (во всех случаях p<0,05).
В подгруппе больных СРК, имеющих нормальную массу тела, имелась отрицательная связь концентрации зонулина в кале с показателями качества жизни по шкалам: физическое функционирование, ролевое функционирование, обусловленное физическим состоянием, общее состояние здоровья, социальное функционирование, ролевое функционирование, обусловленное эмоциональным состоянием, психическое здоровье, психологический компонент здоровья (во всех случаях p<0,05).
В подгруппах 2А и 2Б статистически значимых корреляций между выраженностью нарушений эпителиальной проницаемости кишечника и показателями качества жизни, оцененными с использованием опросника SF-36, не выявлено (во всех случаях p>0,05).
Установлена отрицательная связь умеренной силы (p<0,05) между уровнем зонулина в кале и показателем качества жизни, установленным с использованием опросника IBS-QOL, в обеих подгруппах больных СРК.
Больные СРК в подгруппах 1А и 1Б, имевшие признаки наличия тревоги и депрессии по результатам использования специального опросника, характеризовались более выраженными нарушениями эпителиальной проницаемости (p<0,05).
Среди больных СРК с избыточной массой тела и ожирением с более высоким уровнем зонулина в кале было ассоциировано наличие тяги к жирному, мучному и соленому (p<0,05).
В подгруппе больных СРК с нормальной массой тела установлена ассоциация высокого уровня зонулина в кале с наличием тяги к соленым продуктам (p<0,05).
Среди участников с ИМТ≥25 мг/м2, не страдающих СРК, статистически значимо более высокий уровень кишечной проницаемости был установлен среди заявивших о пристрастии к жирному, мучному и соленому (p<0,05).
В подгруппе участников с нормальной массой тела, не страдающих СРК, наличие тяги к сладкому не ассоциировалось со статистически значимо более высоким уровнем зонулина в кале (p>0,05). О пристрастии к жирной пище или к соленой пище заявили по одному участнику в подгруппе 2Б. О наличии тяги к мучному сообщили 3 человека, пристрастие к мясной пище отметили 4 участника в подгруппе 2Б. Таким образом, оценка наличия ассоциаций тяги к жирной, соленой и мучной пище с уровнем зонулина в кале в данной подгруппе была затруднена.
При оценке выраженности висцеральной гиперчувствительности установлены прямые корреляции умеренной силы между степенью проницаемости эпителиального барьера кишечника и значением индекса VSI в подгруппе больных СРК с избыточной массой тела и ожирением (rs=0,36, p<0,05) и в подгруппе СРК с нормальной массой тела (rs=0,34, p<0,05).
При сопоставлении выраженности проницаемости эпителиального барьера кишечника с концентрацией адипокинов в сыворотке крови в подгруппе 1А установлена связь средней силы уровня зонулина в кале с уровнем адипонектина (rs=-0,73, p<0,05) и лептина (rs=0,59, p<0,05) сыворотки крови. Корреляция уровня зонулина в кале и уровня адипокинов в сыворотке крови в подгруппе 1А представлена на диаграммах рассеяния на рисунке 3.
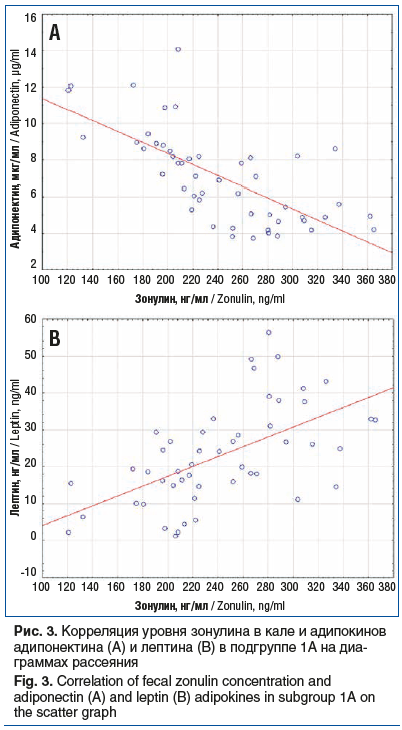
В подгруппе 1Б не установлено статистически значимых ассоциаций уровня зонулина в кале с уровнем адипонектина (rs=-0,24, p>0,05) и лептина (rs=0,25, p>0,05) сыворотки крови.
В подгруппе 2А установлена связь средней силы уровня зонулина в кале с уровнем адипонектина (rs=-0,75, p<0,05) и лептина (rs=0,67, p<0,05) сыворотки крови. Корреляция уровня зонулина в кале и уровня адипокинов в сыворотке крови в подгруппе 2А представлена на диаграммах рассеяния на рисунке 4.
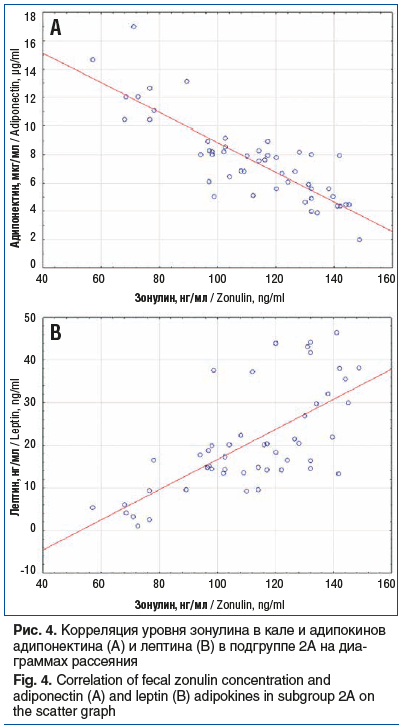
В подгруппе 2Б не установлено статистически значимых ассоциаций уровня зонулина в кале с уровнем адипонектина (rs=-0,04, p>0,05) и лептина (rs=0,13, p>0,05) сыворотки крови.
Обсуждение
В исследовании установлена более высокая проницаемость эпителиального барьера кишечника в когорте больных СРК, чем у участников, не страдающих СРК. В настоящее время сохраняет актуальность дискуссия о механизмах формирования феномена повышенной эпителиальной проницаемости кишечника у больных СРК. Значимая роль отводится модуляции микробиоты с нарушением выработки короткоцепочечных жирных кислот и возникновением дистрофических изменений эпителиоцитов, нарушению синтеза белков плотных контактов, гормонального дисбаланса и нарушений трофики эпителиальной стенки [19–21]. Указанные нарушения могут стать причиной снижения порога возбудимости ноцицепторов с формированием висцеральной гиперчувствительности и модуляцией нарушения моторики толстой кишки у больных СРК [22].
Выявлено, что среди пациентов с СРК статистически значимо более выраженные нарушения проницаемости эпителиального барьера кишечника имели пациенты с избыточной массой тела и ожирением. Следует учесть, что повышение проницаемости стенки кишечника, сопровождаемое изменением состава кишечной микробиоты и формированием хронического низкоуровневого воспаления, тесно ассоциировано с развитием и прогрессированием ожирения [23].
Независимо от наличия избыточной массы тела и ожирения больные СРК-Д имели статистически значимо более высокие значения зонулина в кале, чем пациенты с СРК-З,
Более высокий уровень кишечной проницаемости был ассоциирован с большей выраженностью абдоминальной боли и диареи у всех больных СРК. Корреляция с выраженностью метеоризма установлена у больных СРК с ИМТ≥25 кг/м2. Концентрация зонулина в кале обратно коррелировала с показателями качества жизни пациентов и прямо коррелировала со значением индекса висцеральной гиперчувствительности VSI в обеих подгруппах больных СРК.
Более высокая проницаемость кишечного барьера у участников, страдающих избыточной массой тела и ожирением, была ассоциирована с тягой к жирному, мучному и соленому независимо от наличия СРК. В подгруппе пациентов с нормальной массой тела высокая концентрация зонулина в кале была более характерна для лиц, имеющих пристрастие к соленой пище. Известно, что диета с высоким содержанием жиров и низким содержанием пищевых волокон оказывает негативное влияние на качественный и количественный состав кишечного микробиоценоза, что, вероятно, является значимой причиной повышения проницаемости эпителиального барьера кишечника у лиц, потребляющих жирную, мучную и соленую пищу [24].
Наличие признаков тревоги и депрессии по результатам использования специального опросника у больных СРК также было ассоциировано с более высоким уровнем проницаемости кишечного барьера. В условиях психоэмоционального стресса повышается активность гипоталамо-гипофизарной системы, что сопровождается дегрануляцией тучных клеток, находящихся в том числе в большом количестве в стенке толстой кишки пациентов с СРК [25]. Модификация состава кишечной микробиоты в условиях стресса изменяет выработку энтероэндокринными клетками галанина и грелина, принимающих участие в регуляции секреции кортикотропного рилизинг-гормона, аденокортикотропного гормона и глюкокортикоидов [26].
В исследовании установлены ассоциации уровня зонулина в кале и адипокинов лептина и адипонектина в подгруппах участников, страдающих избыточной массой тела и ожирением, независимо от наличия СРК, что может свидетельствовать о влиянии адипокинов на течение СРК путем повышения выраженности нарушений целостности эпителиального барьера у таких больных. Участники исследования с нормальной массой тела не имели ассоциаций между степенью проницаемости эпителиального барьера кишечника и уровнем адипокинов в сыворотке крови.
Следует помнить, что повышенная эпителиальная проницаемость кишечника в исследуемой когорте оказывает влияние не только на течение СРК и прогрессирование ожирения, но и является одним из ключевых механизмов формирования эндотелиальной дисфункции, что повышает риски развития хронических и острых заболеваний сердечно-сосудистой системы у больных СРК с избыточной массой тела и ожирением [27].
Перспективной является оценка потенциала использования цитопротекторов у больных СРК-Д с избыточной массой тела и ожирением с целью патогенетического воздействия на механизмы формирования симптомов СРК и снижения рисков развития эндотелиальной дисфункции.
Заключение
Таким образом, больные СРК с избыточной массой тела и ожирением характеризуются более выраженным нарушением проницаемости кишечного барьера, чем пациенты с нормальной массой тела. Больные СРК, имеющие признаки наличия тревоги и депрессии по результатам использования специального опросника, характеризуются более выраженными нарушениями эпителиальной проницаемости. Концентрация зонулина в кале в исследуемой когорте пациентов прямо коррелирует с выраженностью симптомов СРК, уровнем висцеральной гиперчувствительности и обратно коррелирует с показателями качества жизни больных. У больных СРК с ожирением и избыточной массой тела более выраженное нарушение проницаемости кишечного барьера ассоциировано с тяжелым течением заболевания и характерно для пациентов, испытывающих тягу к жирным, мучным и соленым продуктам. Более высокая концентрация зонулина в кале ассоциирована с более высоким уровнем лептина и низким уровнем адипонектина в сыворотке крови у лиц с избыточной массой тела и ожирением. Наиболее выраженные нарушения проницаемости эпителиального барьера толстой кишки установлены у больных СРК-Д, страдающих избыточной массой тела и ожирением.
Сведения об авторах:
Федорин Максим Михайлович — ассистент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-0238-4664.
Ливзан Мария Анатольевна — д.м.н., профессор, член-корреспондент РАН, заведующая кафедрой факультетской терапии и гастроэнтерологии, ректор ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6581-7017.
Гаус Ольга Владимировна — к.м.н., доцент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-9370-4768.
Контактная информация: Федорин Максим Михайлович, e-mail: mail.maxim.f@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.05.2023.
Поступила после рецензирования 01.06.2023.
Принята в печать 22.06.2023.
About the authors:
Maxim M. Fedorin — Assistant of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin Street, Omsk, 644099, Russian Federation; ORCID iD 0000-0002-0238-4664.
Maria A. Livzan — Dr. Sc. (Med.), Professor, Corresponding Member of the Russian Academy of Sciences, Head of the Department of Faculty Therapy and Gastroenterology; Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017.
Olga V. Gaus — C. Sc. (Med.), Assistant Professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9370-4768.
Contact information: Maxim M. Fedorin, e-mail: maxim.f@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 11.05.2023.
Revised 01.06.2023.
Accepted 22.06.2023.
Информация с rmj.ru





