Сепсис в практике инфекциониста
Ю. Я. Венгеров*, доктор медицинских наук, профессор
М. В. Нагибина*, кандидат медицинских наук
А. П. Угринова*
А. П. Сафонова**
С. В. Матосова**
Т. С. Свистунова***, кандидат медицинских наук
О. Ю. Шипулина**
Т. М. Коваленко***
Т. Н. Молотилова***
Д. В. Чернышов***
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ФБУН ЦНИИЭ Роспотребнадзора, Москва
*** ГБУЗ ИКБ № 2 ДЗМ, Москва
Проблема сепсиса актуальна в связи с тенденцией к росту заболеваемости,
трудностями диагностики и высокой летальностью [1–11]. В течение XIX–XХ веков
сформировались достаточно обоснованные представления о сепсисе как
самостоятельной бактериальной инфекционной болезни, развивающейся на фоне
нарушений специфических защитных антибактериальных систем защиты организма,
которая характеризуется бактериемией, формированием в большинстве случаев
септических очагов и прогредиентным ациклическим течением болезни с фатальным
исходом. В США состоялась согласительная конференция «консенсус» по диагностике
сепсиса, тяжелого сепсиса и септического шока, основанной на критериях,
предложенных R. Bone в 1991 г., и руководствах SSC 2004, 2008, 2012 гг. [1–5],
на которой постулировано совершенно новое определение понятия «сепсис», новые
положения о его этиологии, патогенезе, клинических и лабораторных критериях его
диагностики. Эти опорные положения создают реальные проблемы для практикующих
врачей прежде всего в плане диагностики. Спорность «постулатов» консенсуса в
значительной степени обусловлена тем, что они были сформулированы пульмонологами
и специалистами по интенсивной терапии без участия иммунологов, патоморфологов,
представителей большинства клинических дисциплин, сталкивающихся с данной
проблемой в практике (педиатры, инфекционисты и т. д.). Согласно консенсусу,
сепсис определяется как синдром системной воспалительной реакции (ССВР) в ответ
на инфекцию, вызванную бактериями, вирусами и грибами (в некоторых публикациях и
простейшими). Наличие очага инфекции и ССВР, критерии которого очень просты: 1)
температура тела ≥ 38,0 °С или ≤ 36,0 °С; 2) частота сердечных сокращений (ЧСС)
≥ 90 в минуту; 3) Частота дыхательных движений (ЧДД) > 20 в минуту или PaCO2
≤ 32 мм рт. ст.; 4) количество лейкоцитов ≥ 12 × 109/мл, или ≤ 4 × 109/мл,
или незрелые > 10%. Причем для постановки предварительного диагноза достаточно
двух критериев из четырех. Поскольку бактериемия необязательна, по мнению
сторонников новых концепций, основным лабораторным тестом является уровень
прокальцитонина (выше 10 ед.). Таким образом, согласно новой концепции сепсис не
является самостоятельной нозологией, а синдромом. ССВР является неспецифической
защитной реакцией и наблюдается при гемато-, онкологических, аутоиммунных
заболеваниях, в частности, системных заболеваниях соединительной ткани и других
заболеваниях. В то время как при инфекционных заболеваниях основу защиты
организма составляют специфические факторы защиты: фагоцитоз, гуморальный и
клеточный иммунитет. Что касается возбудителей сепсиса, то реальный анализ его
этиологической структуры свидетельствует, что доминирующую роль играют
условно-патогенные грамположительные и грамотрицательные бактерии, которые
входят в состав нормальной флоры наружных покровов: плазмокоагулирующий
стафилококк, пневмококк, β-гемолитический стрептококк, кишечная палочка,
клебсиелла, синегнойная палочка и протей. Значительно реже, на фоне тяжелой
патологии (лучевая, ожоговая болезнь, терминальное состояние), сепсис могут
вызвать и сапрофиты: эпидермальный стафилококк, бактероиды и другие. Также редко
сепсис вызывается патогенной флорой: сальмонеллами, иерсиниями, легионеллой,
возбудителями чумы и сибирской язвы при аэрогенном заражении и возбудителем сапа
[6–14]. Наиболее частым возбудителем сепсиса является менингококк, вызывающий
молниеносный менингококковый сепсис (фульминантная менингококкемия) [15–17].
Наблюдается у 5–10% госпитализированных больных менингококковой инфекцией. Что
же общего между возбудителями сепсиса при всех их морфологических и
биологических различиях? Все они являются внеклеточными паразитами и способны
поражать различные органы и ткани, вызывая гнойное воспаление, т. е. являются
возбудителями гнойно-септических заболеваний. В отличие от них внутриклеточные
паразиты — бактерии и вирусы обладают четким тканевым тропизмом и вызывают
серозное воспаление. Например, риккетсии вызывают генерализованный васкулит,
вирусы гепатитов поражают гепатоциты, вирус гриппа — цилиндрический эпителий
верхних дыхательных путей и т. д., т. е. не могут быть возбудителями сепсиса.
Возбудители сепсиса при локальных инфекциях и начальном этапе сепсиса
стимулируют фагоцитоз, иммунные реакции, т. е. специфические факторы защиты
системной воспалительной реакции (СВР) при сепсисе направлены на активацию
специфических факторов защиты. Важно подчеркнуть, что местный воспалительный
процесс всегда носит гнойный или гнойно-геморрагический характер, причем
характерно преобладание некротических процессов, деструкция тканей и органов при
слабой выраженности клеточно-пролиферативных процессов, инфильтрации тканей. Эта
особенность имеет важнейшее значение в патогенезе сепсиса, т. к. в отличие от
локальных нагноительных процессов при сепсисе воспалительный инфильтрат не
препятствует поступлению возбудителя в кровь и дальнейшей его диссеминации.
Важно также отметить, что все возбудители сепсиса являются аэробами, поэтому при
локальной анаэробной инфекции (например, раневой гангрене) клостридии поступают
в кровь, но размножаться не могут, хотя клиническая картина схожа с сепсисом:
гипертермия, нейротоксикоз, острая почечная недостаточность, шок, что
обусловлено действием токсинов клостридий. Анаэробный сепсис развивается
вторично, при присоединении бактериального, чаще стафилококкового сепсиса,
формирования деструктивных септических очагов, что было доказано еще во времена
Великой Отечественной войны [12, 18, 19]. В последние годы мы наблюдали три
подобных случая: на аутопсии у трех умерших пациентов обнаружена обильная
стафилококковая флора (стафилококковый сепсис), на фоне которой развился
вторичный клостридиозный сепсис. Что касается грибов, то следует подчеркнуть,
что патогенные грибы не содержат компонентов, инициирующих ССВР, поэтому
генерализованные микозы не сопровождаются ССВ, который развивается только при
присоединении бактериальной флоры. Так, у больных ВИЧ-инфекцией кандидозная
фунгемия может протекать длительно бессимптомно, но в то же время в ряде случаев
развивается картина сепсиса, однако на аутопсии выявляется сочетание
бактериального сепсиса и кандидоза, так что возможность чистого кандидозного
сепсиса является спорной. Таким образом, представленная «консенсусом» и
дальнейшими публикациями [1–5] концепция об этиологии сепсиса является неверной.
Что касается клинических критериев ССВР, то они также не состоятельны. Мы
проанализировали с этих позиций 168 больных, поступивших с подозрением на
сепсис. Причем два и более критериев сепсиса обнаружены у 66,7% больных, у
которых диагноз сепсиса не подтвержден (66 больных), и у 97,6% больных сепсисом
(42 больных). Средняя частота положительных критериев у больных сепсисом
составила 3,0 ± 0,93, у больных контрольной группы 2,0 ± 1,15, т. е. различия не
достоверны (р > 0,05). Как говорилось выше, сепсис не имеет этиологической
специфики. Что же позволяет его рассматривать не как синдром, а как
самостоятельную нозоформу? Ответ известен давно — реакция макроорганизма.
Недаром ведущие клиницисты рассматривали сепсис как болезнь, обусловленную
состоянием макроорганизма [6–9]. Основу патогенеза сепсиса по нашим наблюдениям
представляет бактериемия, которая в отличие от всех бактериемических инфекций
является неконтролируемой защитными системами организма. Неэффективность систем
защиты при бактериемии обусловлена предшествующей патологией, приводящей к
подавлению фагоцитоза, иммуногенеза. В этих случаях, например при ВИЧ-инфекции,
сепсис с наличием септических очагов (эндокардит, пневмония, менингит)
развивается при уровне бактериемии 1 × 102–1 × 105 (по
данным полимеразной цепной реакции (ПЦР)). Причем септический шок, как правило,
не наблюдается. В то время как при молниеносном менингококковом сепсисе уровень
бактериемии составляет 1 × 107–1 × 108, т. е. на несколько
порядков выше. При такой высокой бактериемии течение сепсиса осложняется
инфекционно-токсическим шоком (ИТШ), полиорганной недостаточностью и высокой
летальностью. В этих случаях септические очаги не успевают сформироваться и есть
только их предвестник — скопление возбудителя в сосудах микроциркуляторного
русла. В этом плане представляют интерес два наших наблюдения.
- Не страдавший какой-либо патологией мужчина 32 лет заболевает острым
респираторным заболеванием, на этом фоне получает физическую травму. Через
несколько часов у него появляется потрясающий озноб, гипертермия, затем резкое
падение артериального давления, и больной госпитализируется в стационар в
состоянии некупируемого шока. На аутопсии макроскопически какой-либо патологии
не выявлено. При гистологическом исследовании в сосудах микроциркуляторного
русла печени, селезенки, почек, легких обнаружены скопления стафилококка. - Девушка 15 лет, после кратковременной гипертермии поступила в стационар в
состоянии некупируемого шока. На аутопсии обнаружена перфорация матки после
внебольничного аборта, с незначительной местной воспалительной реакцией. При
гистологическом исследовании, также как и в первом примере, обнаружены
скопления стафилококка в сосудах микроциркуляторного русла.
Таким образом, сепсис протекает по-разному у лиц с отягощенным и
неотягощенным преморбидным фоном, поэтому патогенез и танатогенез у этих двух
групп больных принципиально различается и предложенная консенсусом концепция
развития сепсиса (ССВР → сепсис → тяжелый сепсис → септический шок →
рефрактерный септический шок → полиорганная недостаточность) не состоятельна,
поэтому мы предлагаем свою концепцию генеза сепсиса (рис.) в зависимости от
преморбидного фона.
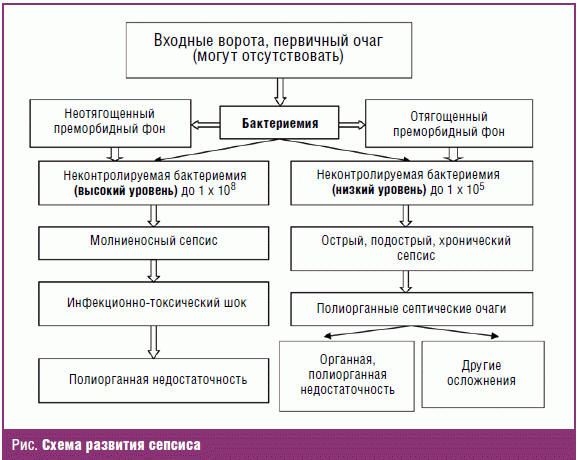
Следует отметить, что в первом случае формируется «шоковые» органы, во втором
— гнойные, септические очаги. Конечно, между этими крайними позициями существуют
и промежуточные, что и определяет многообразие клинических проявлений сепсиса.
Важно еще раз подчеркнуть, что специфику, определяющую нозологическую
самостоятельность сепсиса, составляет неконтролируемая системами защиты
бактериемия. Клиническая диагностика сепсиса не может ограничиваться
малоэффективными критериями СВР. Имеет значение анамнез, предшествующий фон,
наличие первичного очага, входных ворот, но главное — сочетание септического
синдрома и полиорганных поражений. Септический синдром включает высокую
неправильную лихорадку с большими (более 2 °C) колебаниями уровня температуры,
которая сопровождается при повышении выраженным ознобом, при снижении — обильным
потоотделением, резко выраженной интоксикацией, которая проявляется миастенией
(больной даже при нормальной температуре сохраняет горизонтальное положение),
анорексией, бессонницей, заторможенностью, бредом, неадекватной тахикардией,
артериальной гипотензией, одышкой. Характерным проявлением септического синдрома
является увеличение печени и селезенки. Среди органных поражений чаще всего
наблюдаются: гнойничковые и геморрагические высыпания на коже, артриты и
полиартриты, полисегментарная пневмония, эндокардит с поражением 2–4 клапанов,
формированием абсцессов. Поражение почек различного характера является
постоянным проявлением сепсиса. Из неспецифических тестов имеет диагностическое
и прогностическое значение картина крови. В течение нескольких дней болезни
развивается гипохромная анемия. При развитии ИТШ и остром сепсисе наблюдается
тромбоцитопения — количество тромбоцитов менее 20 тыс. в мкл прогностически
неблагоприятно. При бурном течении сепсиса, особенно вызванном грамотрицательной
флорой, возможна лейкопения. При неосложненном течении — нейтрофильный
лейкоцитоз со сдвигом влево, увеличение СОЭ. Следует обращать внимание на
абсолютное количество лимфоцитов. При его снижении ниже 1000 в мкл необходима
иммунологическая поддержка. Снижение общего уровня белка, особенно альбумина,
требует коррекции. Для оценки состояния почек необходим постоянный контроль
уровня креатинина. Наличие лактат-ацидоза более 5 ммоль/л при отсутствии шока
указывает на сохранение возбудителями биологической активности.
В настоящее время в лабораторном подтверждении диагноза наибольшее значение
предается уровню прокальцитонина. Действительно, прокальцитониновый тест у
больных сепсисом, подтвержденным выделением гемокультуры и/или ПЦР, был
положительным у 86,7% больных (10 и более нг/л). У больных с тяжелым течением
инфекции, при отрицательных результатах бактериологического исследования и ПЦР
прокальцитониновый тест был положительным у 43,7% больных. Полученные данные
позволяют рассматривать этот тест как критерий тяжести инфекционного процесса.
При эффективной антибактериальной терапии уровень прокальцитонина в течение 2–3
суток резко снижается, что позволяет его использовать как надежный критерий
эффективности антибактериальной терапии. Для лабораторного подтверждения
диагноза сепсиса мы по-прежнему, прежде всего, придаем значение выделению
гемокультуры возбудителя, что позволяет определить чувствительность возбудителя
к антимикробным препаратам, а также проводить мониторирование динамики
чувствительности возбудителя. Недостатками метода являются: отрицательный
результат при начатой антибактериальной терапии, возможность экзогенного
загрязнения, возможность транзиторной бактериемии. Для повышения эффективности
бактериологического метода следует исследовать содержимое гнойных очагов
(содержание пустул, пунктата гнойных очагов, спинномозговой жидкости, мочи,
мокроты и т. д.). Важнейшую роль в подтверждении диагноза сепсиса имеет ПЦР,
которая обладает 100% специфичностью, позволяет определить интенсивность
бактериемии (микробную нагрузку), получить положительный результат в первые 1–2
суток лечения антибиотиками. Отрицательный результат ПЦР при выделении
гемокультуры свидетельствует об экзогенном загрязнении. При обследовании 40
ВИЧ-инфицированных больных со стафилококковым сепсисом мы во всех случаях
получили положительный результат ПЦР, причем микробная нагрузка варьировала от 8
× 102 до 1,38 × 105.
Лечение сепсиса должно быть комплексным и включать антибактериальную,
детоксикационную терапию, иммунотерапию, интенсивную терапию и реанимацию,
нутритивную поддержку, по показаниям — хирургическое вмешательство, профилактику
и лечение дисбиоза.
Подробные рекомендации по антибактериальной терапии даны в практических
руководствах по сепсису [20, 21]. Следует остановиться только на отдельных
аспектах проблемы. Во-первых, антибактериальная терапия должна проводиться
поэтапно. Целью первого этапа является купирование бактериемии, что достигается
постоянным поддерживанием высоких концентраций препарата в крови (минимальные
промежутки между введением разовых доз препарата или непрерывное капельное
введение). После купирования бактериемии стоит задача эрадикации возбудителя из
септических очагов, где его биодоступность значительно ниже (воспалительный
инфильтрат, биопленка на поверхности колонии возбудителя), поэтому интервалы
между введением препарата и разовые дозы следует максимально увеличить [6]. При
этом в крови достигаются пиковые концентрации препарата и происходит его пассаж
в септический очаг. В качестве этиотропного средства не следует забывать о
бактериофагах (стафилококковый, пиофаг и другие). Особенно эффективно применение
индивидуальных фагов, полученных против культуры возбудителя, выделенной у
больного. Важно то, что бактериофаги не обладают побочным действием и не имеют
противопоказаний для применения. Иммунотерапия включает специфические (антистафилококковый
иммуноглобулин) и неспецифические иммуноглобулины. При этом следует иметь в
виду, что большинство препаратов иммуноглобулинов содержат IgG, которые обладают
преимущественно протективным действием. Кроме того, они при избыточном введении
блокируют рецепторы иммунокомпетентных клеток и подавляют продукцию собственных
антител, обладающих большей овидностью к возбудителю. Эффективен только
пентаглобин и его аналоги, в меньшей степени нормальный человеческий
иммуноглобулин, которые содержит IgM. Важное значение имеет детоксикация,
особенно экстракорпоральная. Наиболее эффективна ультрафильтрация плазмы.
Хирургическая санация доступных септических очагов является важным звеном в
комплексном лечении сепсиса, хотя не гарантирует полного эффекта. Методы
интенсивной терапии, искусственная вентиляция легких снижают летальность при
наиболее тяжелой молниеносной форме сепсиса. Интенсивность катаболических
процессов, невозможность или малая эффективность, из-за ферментативной
недостаточности энтерального питания, требуют полноценного парентерального
питания с использованием расчетных доз белковых, аминокислотных, липидных,
углеводных растворов, витаминов. Массивная антибактериальная терапия вместе с
нарушениями питания приводит к развитию тяжелого дисбиоза кишечника и требует
применения с первых дней лечения пробиотиков, не подверженных действию
антибактериальных препаратов.
Рациональная комплексная терапия сепсиса приводит к резкому снижению
летальности, хотя она остается достаточно высокой (10–20% и выше) [24–26].
Приведенные сведения свидетельствуют о необходимости дальнейшего изучения
всех аспектов проблемы сепсиса, особенно патогенеза, диагностики и лечения.
Литература
-
Bone R. C., Balk R. A., Cerra F. B. et al. ACCP/SCCM consensus
conference. Definitions for sepsis and organ failure and guidelines for
innovative therapies in sepsis // Chest. 1992. Vol. 101. P. 1644–1655. -
Levy M. M., Fink M. P., Marshall J. C. et al. SCCM/ESICM/ACCP/ATS/SIS:
2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference //
Crit Care Med. 2003. Vol. 31. P. 1250–1256. -
Dellinger R. P., Carlet J. M., Masur H. et l. Surviving Sepsis
Campaign guidelines for management of severe sepsis and septic shock // Crit.
Care Med. 2004. Vol. 32. P. 858–873. -
Dellinger R. P., Levy M. M., Carlet J. M. et al. Surviving Sepsis
Campaign: International guidelines for management of severe sepsis and septic
shock 2008 // Crit Care Med. 2008. Vol. 36. P. 296–327. -
Dellinger R. P., Levy M. M., Rhodes A. et al. Surviving Sepsis
Campaign: International Guidelines for Management of Severe Sepsis and Septic
Shock: 2012 // Crit Care Med. 2013. Vol. 41. P. 580–637. -
Венгеров Ю. Я. Сепсис. В кн.: Лекции по инфекционным болезням/Ющук
Н. Д., Венгеров Ю. Я. Переизд., испр. М., 2008. С. 478–500. -
Бочоришвили В. Г. Сепсисология с основами инфекционной патологии.
Тбилиси: Мецниереба, 1988. 807 с. -
Gamaguchi T., Hirakata Y., Isumikawa K. et al. Prolonged survival
of mice with Ps. aeruginosa — inducid sepsis by IL-12 modulator of IL-10 and
interferon-gamma // I. Med. Microbiol. 2000. Vol. 49. № 8. P. 701–707. -
Козлов В. К. Сепсис: этиология, иммунопатогенез, концепция
современной иммунотерапии. СПб: Диалект, 2008. 296 с. -
Нагибина М. В., Тишкевич О. А., Кадышев В. А. и др. Редкий случай
генерализованного легионеллеза в практике инфекциониста // Эпидемиология и
инфекционные болезни. 2012, № 5, с. 54–57. -
Покровский В. И., Черкасский Б. Л. Сибирская язва //
Эпидемиология и инфекционные болезни. 2002, № 2, с. 57–60. -
Нагибина М. В., Венгеров Ю. Я., Тишкевич О. А. и др.
Нетравматическая анаэробная газовая инфекция в современных условиях //
Хирургия. 2013, № 2, с. 43–48. -
Cohen I. Патологические процессы при грамм (-) сепсисе // Сепсис
и антибактериальная терапия. Киев: Нора-принт, 1997. С. 8–11. Procedings of
satellite symposium held March 26, 1995, in Viena, Austria, in cojunction with
the 7 th European Congress of Clinical Microbiology and infections Diseases,
P. 4–7. -
Li Y., Cui Y., Hauck Y., Platonov M. E., Dai E., Song Y., Guo Z.,
Pourcel C., Dentovskaya S. V., Anisimov A. P., Yang R., Vergnaud G.
Genotyping and phylogenetic analysis of Yersinia pestis by MLVA: insights into
the worldwide expansion of Central Asia plague foci // PLoS One. 2009, Jun 22;
4 (6): e6000. -
Шляпников С. А. Проблемы классификации, диагностики и лечения
сепсиса // Инфекции и антимикробная терапия // 2002, т 4, № 1, с. 18–23. -
Миронов К. О., Шипулин Г. А., Королева И. С., Платонов А. Е.
Генотипирование Neisseria meningitidis // Эпидемиология и инфекционные
болезни. 2009, № 4, 18–21. -
Ребенок Ж. А. Менингококковая инфекция — инфекционно-токсический
шок: пенициллин или левомицетин? // Рецепт. 2003, приложение, изданное к V
съезду инфекционистов Беларуси. С. 113–118. - Арапов Д. А. Анаэробная газовая инфекция. М., 1972. С. 216.
-
Богомолов Б. П., Ефимов Л. Л., Девяткин А. В. и др. Эндогенная
анаэробная инфекция / 1-й Всероссийский Ежегодный конгресс по инфекционным
болезням. М., 2009. С. 30. -
Яковлев С. В., Сидоренко С. В., Зайцев А. А., Белобородов В. Б.
Антимикробная терапия сепсиса // Инфекции в хирургии. 2004, т. 2, № 2, с.
23–33. -
Савельев В. С., Гельфанд Б. Р. Сепсис: классификация,
клинико-диагностическая концепция, лечение. М.: ООО Издательство «Медицинское
информационное агентство», 2013. 360 с. -
Аверьянов А. В., Гельфанд Б. Р. Сепсис: состояние проблемы и
перспективы // Анналы хир. 2010, № 5, с. 5–9. -
Гучев И. А., Клочков О. И. Оптимизация терапии сепсиса // Воен.
мед. журн. 2003, № 9, с. 23–30. -
Козлов В. К. Сепсис: этиология, иммунопатогенез, концепция
современной иммунотерапии. СПб: Диалект, 2008. 296 с. -
Cheung W. K., Chau L. S., Mak I. I., Wong M. Y., Wong S. L., Tiwari A.
F. Bifidobacterium breve Sepsis in Child with High-Risk Acute
Lymphoblastic Leukemia // Intensive Crit Care Nurs. 2015, Aug 17, pii:
S0964–3397. -
Kuiper J. W., Groeneveld A. B., Haitsma J. J., Smeding L., Begieneman
M. P., Jothy S., Vaschetto R., Plötz F. B. Soluble adhesion molecules as
markers for sepsis and the potential pathophysiological discrepancy in
neonates, children and adults // BMC Nephrol. 2014, Jul 29, 15, 126. doi:
10.1186/1471–2369–15–126.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru







