Введение
Хроническая ишемия головного мозга (ХИГМ) — это прогредиентная форма цереброваскулярной патологии, проявляющаяся множественным или диффузным ишемическим поражением головного мозга и постепенным развитием комплекса неврологических и нейропсихологических расстройств. Множество исследований свидетельствуют о раннем появлении когнитивных нарушений при ХИГМ. Вследствие анатомических и физиологических особенностей кровообращения головного мозга глубинные отделы белого вещества и подкорковые серые узлы наименее устойчивы к ишемии, что приводит к изменению белого вещества (лейкоареоз) в глубоких областях полушарий и перивентрикулярной зоне. Поражение белого вещества приводит к дезинтеграции различных отделов коры головного мозга, что, в свою очередь, влияет на скорость познавательной деятельности и концентрацию внимания. Таким образом, наличие когнитивных нарушений является одним из ранних признаков ХИГМ и важно в диагностическом плане [1].
Причины этой патологии могут быть разнообразны, многие из них хорошо изучены. Особое внимание следует уделить состояниям, характеризующимся нарушением системной гемодинамики, что приводит к постоянному снижению кровоснабжения головного мозга — хронической гипоперфузии. Среди таких состояний особо выделяются атеросклеротическое поражение сосудов головного мозга, артериальная гипертензия, сахарный диабет, патологии сердца [2]. Малоизученным, но патогенетически значимым фактором риска ХИГМ является синдром обструктивного апноэ сна (СОАС) [3].
Синдром обструктивного апноэ сна характеризуется эпизодами нарушений дыхания во сне или существенного уменьшения дыхательного потока в результате обструкции верхних дыхательных путей, что приводит к интермиттирующей ночной гипоксии, фрагментации сна и избыточной дневной сонливости [4]. «Гипоксия» — часто используемый термин, требующий, однако, предварительного определения. Он подразумевает под собой патологический процесс, характеризующийся абсолютной или относительной недостаточностью снабжения кислородом органов и тканей организма для их нормального функционирования и интенсивности пластических процессов в них. Это состояние приводит к расстройству жизнедеятельности организма в целом [5].
В большинстве исследований выражение «хроническая гипоксия» соответствует временному интервалу, необходимому для запуска патофизиологической реакции, который может варьировать от нескольких недель до нескольких месяцев. Механизмы повреждения головного мозга и выработки адаптационного механизма определяются длительностью воздействия: остро развившаяся гипоксия (острая дыхательная недостаточность, гипоксически-ишемическая энцефалопатия), подострая или хроническая — при хронической обструктивной болезни легких (ХОБЛ) или интерстициальных заболеваниях легких, интермиттирующая или перемежающаяся гипоксия (СОАС) [6].
Являясь одним из патофизиологических процессов ХИГМ, ночная хроническая периодическая гипоксия при СОАС вызывает структурное повреждение нейронов и дисфункцию ЦНС, ведущим клиническим проявлением которой является нейрокогнитивный дефицит. Современные исследования показали, что патогенез повреждения мозговой ткани при СОАС может быть связан с изменениями функционирования ионных каналов, глутаматной эксайтотоксичностью, усилением продукции провоспалительных цитокинов и, соответственно, формированием хронического нейровоспаления [7, 8].
Изучение дыхательных нарушений у пациентов с хроническими цереброваскулярными заболеваниями является актуальным с клинической точки зрения и важным для разработки комплексной терапии. В настоящее время имеется ограниченное количество исследований, посвященных вкладу СОАС в развитие когнитивного дефицита у пациентов с ХИГМ. Так как на данном этапе развития науки не существует нейрометаболических препаратов и нейропротекторов, достоверно улучшающих качество жизни и восстанавливающих нейронные связи у пациентов с ХИГМ, то логично предположить, что необходимо максимально отсрочить или предотвратить возникновение данного заболевания. С учетом возрастных особенностей и полиморбидности этих пациентов необходим комплексный подход к диагностике и лечению состояний, прямо или косвенно влияющих на мозговую ткань. Изучение вклада дыхательных нарушений, вызывающих гипоксическое повреждение головного мозга у пациентов с хроническими цереброваскулярными заболеваниями, в развитие когнитивной дисфункции является актуальным с клинической точки зрения и важным для разработки комплексной терапии.
Цель исследования: выявить особенности когнитивного статуса у пациентов с ХИГМ в зависимости от уровня ночной десатурации.
Материал и методы
Дизайн исследования: аналитическое исследование типа «случай — контроль». На базе пульмонологического, кардиологического и неврологического отделений ОГБУЗ СОКБ обследованы 32 пациента, из них 21 мужчина, в возрасте от 50 до 78 лет с верифицированным диагнозом «хроническая ишемия головного мозга 1–2-й степени». Все пациенты находились на плановой госпитализации.
Все пациенты подписывали информированное добровольное согласие на участие в исследовании. Были соблюдены все санитарно-гигиенические правила и нормы при проведении диагностических мероприятий. Протокол исследования был одобрен локальным этическим комитетом ФГБОУ ВО СГМУ Минздрава России (протокол № 2 от 09.09.2023) и соответствовал принципам Хельсинкской декларации.
Критерии включения: установленный диагноз ХИГМ 1–2-й степени, подтвержденный характерной клинической картиной, данными магнитно-резонансной томографии (согласно шкале Fazekas) или результатами мультиспиральной компьютерной томографии, наличие одного или нескольких факторов риска ХИГМ (дислипидемия, артериальная гипертензия, атеросклеротическое поражение сосудов, курение и др.).
Критерии невключения: черепно-мозговые травмы и операции на головном мозге в анамнезе, очаговые заболевания головного мозга, деменция, нейродегенеративные заболевания ЦНС, острое нарушение мозгового кровообращения в анамнезе, прием лекарственных средств, воздействующих на дыхательный центр и влияющих на когнитивную сферу пациента, тяжелые соматические заболевания в стадии обострения.
У всех пациентов использован метод кардиореспираторного мониторирования прибором SomnoCheck Micro Cardio (Loewenstein Medical (Weinmann), Германия) для оценки параметров СОАС. Запись данных осуществляли во время ночного сна с 23:00 до 07:00 следующего дня, время записи у всех больных составляло 8 ч. Анализ данных проводили с использованием программного обеспечения SOMNOlab v2.19. Оценивали показатели респираторных событий: AHI (индекс апноэ/гипопноэ); oAHI, cAHI (AHI обструктивного типа, AHI центрального типа соответственно); кардиологические показатели: связанные с дыханием колебания частоты сердечных сокращений (ЧСС; ЧССmin — минимальная зафиксированная ЧСС, ЧССmax — максимальная ЧСС в течение ночи, ЧССmean — средняя ЧСС в течение ночи); уровень сатурации (SpO2): средняя сатурация в течение ночи (SpO2mean), минимально зафиксированная сатурация (SpO2min).
Клиническую оценку выраженности дневной сонливости проводили по шкале сонливости Эпворта (Epworth Sleepiness Scale, ESS, 1991 г.).
Когнитивную сферу оценивали с помощью Монреальской шкалы оценки когнитивных функций (MoCA, 2005 г.), разбитой на субшкалы. Несмотря на многообразие клинических шкал для оценки выраженности когнитивного снижения, была выбрана именно шкала MoCA, так как она лучше других позволяет отличить нормальные когнитивные способности и легкий или умеренный когнитивный дефицит. Тест малоинформативен у пациентов с деменцией ввиду сложности его выполнения (в нашем исследовании деменция была критерием невключения). Тест MoСa включает в себя дополнительные, более сложные задачи по сравнению с другими тестами, такие как оценка исполнительной функции, рисования фигур, скорости обработки информации, краткосрочной и отсроченной памяти, внимания, способности к называнию, абстракции и беглости речи [9].
Также всем пациентам проводили тест с двойной когнитивной задачей TUG (Timed Up and Go) — ходьба без когнитивной задачи, ходьба с одновременным выполнением простых математических заданий. Отличием от нормы считалось изменение скорости ходьбы более чем на 10% в сравнении с этим же тестом, но без двойной задачи [10].
Статистическую обработку данных проводили с использованием программного обеспечения MS Office Excel (Microsoft 365) и Statistica 10. Для анализа применяли методы непараметрической статистики: U-критерий Манна — Уитни, коэффициент ранговой корреляции Спирмена (rs), точный критерий Фишера. Доверительный интервал принят равным 95%. Проверку статистических гипотез проводили на уровне значимости α=0,05. Все количественные показатели представлены в виде медианы и 1-го и 3-го квартилей (Me [Q1; Q3]).
Результаты и обсуждение
Пациенты были разделены на 2 группы на основании параметров кардиореспираторного мониторинга (табл. 1). В 1-ю группу были включены 13 пациентов с выраженной ночной десатурацией (SpO2mean<90%), во 2-ю группу — 19 пациентов с SpO2mean>90%. Группы были сопоставимы по возрасту (55 [50; 61] и 55 [50; 64] лет соответственно) и наличию сопутствующих заболеваний. Все пациенты имели артериальную гипертензию. В 1-й группе сахарный диабет имели 6 (46%) человек, во 2-й — 8 (42%). Пациентов с ХОБЛ и бронхиальной астмой в 1-й группе было 2 (15%) и 6 (46%) человек, во 2-й — 3 (15%) и 5 (26%) соответственно. Ишемическая болезнь сердца была диагностирована у 10 (75%) пациентов 1-й группы и у 10 (53%) — 2-й.
![Таблица 1. Основные параметры кардиореспираторного мониторинга, Me [Q1; Q3] Таблица 1. Основные параметры кардиореспираторного мониторинга, Me [Q1; Q3]](https://medblog.su/wp-content/uploads/2024/05/Rol-intermittiruyushhej-nochnoj-gipoksii-v-razvitii-kognitivnyh-narushenij-u-patsientov.png)
Среди пациентов 1-й группы тяжелую степень СОАС (AHI>30/ч) имели 12 человек, и лишь 1 обследованный имел СОАС средней степени тяжести (15/ч
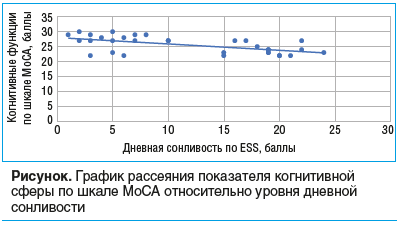
Как видно из данных, представленных в таблице 2, пациенты с более низкими показателями SpO2mean имели статистически значимо меньше баллов по шкале MoCA (p=0,029), чем пациенты 2-й группы. Связь между СОАС и нарушением когнитивных функций является доказанной и нашла отражение в ряде научных работ. Так, A.E. Beaudin et al. [11] в своем многоцентровом исследовании на 1084 пациентах выявили достоверную связь между критериями тяжести СОАС — AHI, SpO2mean и степенью когнитивного дефицита (p<0,01), но не выявили статистически значимой разницы по шкале ESS. В нашем же исследовании установлена умеренная обратная корреляционная зависимость между выраженностью когнитивного дефицита и уровнем дневной сонливости (rs=-0,59, p<0,01) при анализе всей когорты пациентов (n=32). Графически выявленная закономерность представлена на рисунке.
Противоречивость полученных данных можно объяснить более низкими показателями SpO2mean ввиду наличия коморбидной патологии, а соответственно, и более высоким баллом по шкале ESS у наших пациентов. При изучении биологических основ дневной сонливости выяснилось, что ее развитие имеет тесную связь с функцией нескольких нейротрансмиттерных систем головного мозга. Наиболее исследованы системы, активность которых зависит от орексина, гистамина, ацетилхолина, норадреналина, серотонина и дофамина. В период бодрствования цереброспинальная жидкость содержит определенные медиаторы, которые преимущественно вызывают активацию (деполяризацию) постсинаптической мембраны. К таким медиаторам относятся глутамат, ацетилхолин, мозговые амины (гистамин, норадреналин, серотонин, дофамин) и пептид орексин (или гипокретин). Патогенетическим механизмом появления сонливости и наступления сна является уменьшение производства данных нейромедиаторов. В то же время снижение концентрации этих нейромедиаторов днем также связано с возникновением когнитивного дефицита и аффективных расстройств [11]. Следовательно, ввиду общности патогенеза данных процессов следует ожидать снижение умственных способностей у лиц, испытывающих избыточную дневную сонливость.
При исследовании отдельных слагаемых когнитивной сферы по субшкалам MoCA (см. табл. 2) было выявлено достоверное снижение внимания и беглости речи в группе с SpO2mean<90%. Статистически значимой межгрупповой разницы в способностях к отсроченному воспроизведению (нарушение памяти), в конструктивно-исполнительных функциях и абстрактном мышлении не установлено. Нарушений ориентации во времени, пространстве, собственной личности и потери способности к называнию не было выявлено ни у одного пациента в обеих группах, так как данные явления характерны для пациентов с грубым когнитивным дефицитом, т. е. деменцией, а данная когорта больных не включалась в наше исследование.
![Таблица 2. Показатели когнитивной сферы по шкале MoCA и уровень дневной сонливости по ESS в группах в зависимости от SpO2mean, Me [Q1; Q3] Таблица 2. Показатели когнитивной сферы по шкале MoCA и уровень дневной сонливости по ESS в группах в зависимости от SpO2mean, Me [Q1; Q3]](https://medblog.su/wp-content/uploads/2024/05/1715918503_298_Rol-intermittiruyushhej-nochnoj-gipoksii-v-razvitii-kognitivnyh-narushenij-u-patsientov.png)
При выполнении теста с двойной когнитивной задачей пациенты из группы с SpO2mean<90% показали достоверно худшие результаты: не справились с заданием 11 (84,6%) человек из 1-й группы и лишь 2 (10,5%) человека из 2-й группы (p<0,01). TUG-тест (шагание с одновременным серийным вычитанием) показал, что лица, имевшие более низкие уровни средней ночной сатурации, перераспределяют ресурсы внимания в пользу выполнения вычислительной задачи за счет ходьбы. В то время как субъекты с SpO2mean>90% могут сохранять надлежащее внимание как для математических задач, так и для шагания.
Обращаясь к патогенетической основе когнитивных нарушений при СОАС, исследователи установили связь между когнитивной дисфункцией в целом и тяжестью гипоксии, а также между показателями внимания и степенью фрагментации сна [12]. Изучение структурных, функциональных и метаболических данных нейровизуализации позволило объективизировать влияние СОАС на высшие когнитивные функции. Хроническая гипоперфузия приводит к дезинтеграции нейронов «сети внимания»: дорсальной (DAN), вентральной (VAN) сети и сети приоритизации сигналов (SN); кроме того, при этом обнаруживаются диффузные паттерны атрофии серого вещества, особенно лобно-теменных зон. Поражение любого из компонентов данной сети или связей друг с другом, включая пучки волокон белого вещества, может приводить к феномену игнорирования [13].
K. Makanikas et al. [14] выявили корреляционную связь между уровнем ночной десатурации и результатами теста на беглость речи у больных с СОАС и АГ, но не смогли продемонстрировать прямую зависимость между показателями беглости речи и характеристиками сна, такими как фрагментарность сна и индекс пробуждений [14]. Результаты нашего исследования согласуются с возможностью того, что гипоксия во время сна может влиять на дневную бдительность, концентрацию внимания и вторично оказывать влияние на беглость речи.
Отсутствие очевидной взаимосвязи между нарушениями памяти и тяжестью СОАС согласуется с предыдущими исследованиями, где также не было обнаружено увеличения тяжести мнестических нарушений с увеличением степени тяжести СОАС и ростом уровня ночной десатурации [15, 16]. В работах [17, 18] оценивали эффект 2–4-недельной экспериментальной ночной гипоксии у здоровых добровольцев. Две недели ночной гипоксии не вызывали ни субъективной дневной сонливости, ни снижения концентрации внимания, ни нарушения рабочей памяти, ни нарушений со стороны конструктивно-исполнительных функций. Вероятнее всего, когнитивный дефицит у больных СОАС является следствием многолетнего течения заболевания, наличия коморбидной патологии, обусловливающих хроническую ишемизацию мозговой ткани.
Ограничения исследования: исследование выполнено на базе трех отделений (неврологическое, пульмонологическое, кардиологическое) с ограничением расширения контингента больных вследствие специализации областной клинической больницы. Исследование было сознательно ограничено возрастным диапазоном исследуемой группы с нижней границей 50 лет.
Заключение
Данные настоящего исследования свидетельствуют о значительном вкладе периодической ночной гипоксии в развитие более грубого когнитивного дефицита у пациентов с ХИГМ. При анализе всей выборки пациентов была установлена обратная корреляционная связь умеренной силы между уровнем дневной сонливости, которую часто испытывают пациенты с СОАС, и баллами по шкале MoCA. У пациентов с более низкой ночной сатурацией отмечается более низкий балл по шкале MoCA за счет снижения уровня внимания и беглости речи. Не было обнаружено статистически значимых различий в способностях к отсроченному воспроизведению, конструктивно-исполнительных функциях и абстрактном мышлении. Данная группа пациентов также хуже справилась с тестом с двойной когнитивной задачей, чем группа с менее выраженной ночной десатурацией. Таким образом, несмотря на очевидное влияние ночной десатурации на мыслительную и познавательную деятельность, природа этих нарушений все еще остается сложной и неоднозначной.
Информация с rmj.ru



