Статья посвящена вопросам использование нестероидных противовоспалительных препаратов у больных ревматоидным артритом с точки зрения сердечно-сосудистой безопасности
Содержание статьи
Сердечно-сосудистые осложнения у больных ревматоидным артритом
Ревматоидный артрит (РА) — иммуновоспалительное (аутоиммунное) ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов, приводящее к ранней инвалидности и сокращению продолжительности жизни на 8–15 лет. В России РА страдают около 800 тыс. человек — почти 1% взрослого населения. Наиболее часто РА поражает людей в возрасте 40–55 лет, женщины заболевают в 3 раза чаще мужчин. Смертность при РА на 47% выше, чем в общей популяции [1]. РА ассоциируется с широким спектром сердечно-сосудистых заболеваний (ССЗ), включающих атеросклероз, тромбоз, хроническую сердечную недостаточность (ХСН), патологию клапанного аппарата, нарушения ритма сердца, аневризму аорты, мио-, пери- и эндокардит, васкулит, ревматоидные узелки в сердце, амилоидоз сердца. Основными причинами преждевременной смерти от сердечно-сосудистых осложнений (ССО) являются прогрессирование атеросклероза, развитие ХСН и внезапная сердечная смерть. Риск развития ишемической болезни сердца (ИБС) и инфаркта миокарда (ИМ) при РА повышен в 1,4–4 раза, мозгового инсульта (МИ) — в 1,7 раза, ХСН — в 1,5–2,6 раза, заболеваний периферических артерий — в 1,7 раза, аневризмы аорты — в 1,5 раза по сравнению с общей популяцией [2–4]. Величина сердечно-сосудистого риска (ССР) выше при РА, чем при сахарном диабете (СД) 2 типа [5], что определяет необходимость своевременной профилактики и эффективного лечения ССЗ. К основным причинам ускоренного развития ССО у больных РА относят накопление традиционных факторов риска (ТФР) ССЗ (артериальная гипертензия (АГ), ожирение, курение, дислипидемия, малоподвижный образ жизни, нарушения углеводного обмена и др.), хроническое воспаление и аутоиммунные нарушения (высокая активность заболевания, выраженная функциональная недостаточность суставов; высокопозитивные уровни ревматоидного фактора и антител к циклическому цитруллинированному пептиду). Также глюкокортикоиды (ГК) и нестероидные противовоспалительные препараты (НПВП) могут ускорять развитие ССЗ [2–4].
Хроническое аутоиммунное воспаление — один из ведущих факторов риска развития ССО при РА [2–4]. Течение атеросклероза при РА имеет ряд особенностей, таких как низкий процент критических стенозов коронарных артерий, высокая частота «ранимых» бляшек и выраженные признаки воспаления сосудистой стенки; высокая частота и ранние рецидивы острого коронарного синдрома; высокая частота бессимптомного ИМ и внезапной сердечной смерти. Клиническая диагностика ангинозных болей и оценка переносимости физической нагрузки у пациентов с РА может быть затруднена в связи с выраженными болями в суставах и малоподвижным образом жизни. Кроме того, большая доля женщин среди больных РА и использование НПВП могут отчасти объяснять атипичные симптомы ССЗ [3].
В обновленной версии рекомендаций Европейской антиревматической лиги (European League Against Rheumatism, EULAR) по снижению кардиоваскулярного риска у пациентов с хроническими воспалительными артритами подчеркивается важность эффективного контроля активности РА для снижения ССР [2]. Адекватный контроль воспаления позволяет снижать риск ССО при РА [6–8], хотя результаты исследований неоднозначны. Так, в датском 21-летнем популяционном исследовании РА ассоциируется с увеличением риска развития ХСН и ИБС, особенно в первый год после постановки диагноза РА (относительный риск (ОР) 2,28 и 1,93 в течение первого года, 1,39 и 1,26 — при длительности заболевания 1–5 лет, 1,38 и 1,31 — при длительности заболевания от 5 до 10 лет соответственно) [9]. Современная терапия РА (более раннее и агрессивное начало терапии) не влияла на частоту возникновения ХСН и ИБС [9]. Однако в проспективном 10-летнем наблюдательном исследовании подчеркивается важность достижения ремиссии РА для снижения риска ССО, независимо от вида проводимой терапии [10]. Достижение низкой активности заболевания (индекс DAS28≤3,2) ассоциировалось со снижением ССО (острого коронарного синдрома, МИ и транзиторной ишемической атаки [ТИА], заболеваний периферических артерий, ХСН) на 35% [10].
По данным рандомизированного клинического исследования (РКИ), применение стратегии «лечение до достижения цели» ассоциируется со значительным замедлением прогрессирования субклинического атеросклероза и снижением риска ССО (смерти от сердечно-сосудистых причин, нефатальных ИМ и МИ, реваскуляризации коронарных и периферических артерий) [11]. Применение базисных противовоспалительных препаратов (БПВП), в частности метотрексата, а также генно-инженерных биологических препаратов (ГИБП), таких как ингибиторы фактора некроза опухоли-α, связано со значительным снижением риска ССЗ у пациентов с РА [2, 3].
Применение НПВП и риск сердечно-сосудистых осложнений
Применение БПВП и ГИБП уже на ранней стадии РА снизило процент использования НПВП и ГК, но он до сих пор остается достаточно высоким. Эксперты EULAR и российские эксперты подчеркивают, что НПВП эффективны в качестве симптоматической терапии у пациентов с РА, но должны использоваться в минимальных эффективных дозах и в течение как можно более короткого времени, после оценки желудочно-кишечных, почечных и кардиоваскулярных факторов риска [12]. ССО являются одной из основных проблем, связанных с регулярным использованием НПВП [13]. В 2016 г. американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (Food and Drug Administration, FDA) выпустило повторное предупреждение о том, что НПВП повышают вероятность развития ИМ и МИ, развития и дестабилизации АГ, мерцательной аритмии, ХСН [14]. Подчеркивается, что риск ССО при длительном приеме селективных и неселективных НПВП сопоставим. Риск увеличивается дозозависимо, с первых недель терапии. Особенно высок риск ССО у пациентов с ССЗ в анамнезе (ИМ, МИ/ТИА, артериальная реваскуляризация, аневризма аорты, заболевания периферических артерий, наличие атеросклеротической бляшки со значимым стенозом ≥50%); СД с поражением органов-мишеней, тяжелой ХБП (СКФ <30 мл/мин/1,73 м2), 10-летним риском по шкале SCORE ≥10% [14, 15].
НПВП подразделяют на селективные (сНПВП, коксибы) и неселективные (нНПВП). Представителями сНПВП являются два препарата — целекоксиб и эторикоксиб. Ряд российских и зарубежных экспертов выделяют НПВП ЦОГ-2 — мелоксикам, нимесулид, набуметон и этодолак. Остальные представители этой лекарственной группы относятся к нНПВП [13]. Несмотря на различия в химической структуре, все НПВП обладают схожим механизмом действия [13]. Они оказывают жаропонижающее, противовоспалительное и обезболивающее действие путем ингибирования циклооксигеназы (ЦОГ) — основного фермента, под действием которого осуществляется синтез из арахидоновой кислоты простагландина (ПГ) Е2, простациклина (ПГI2) и тромбоксана А2. ЦОГ представлена двумя изоформами — ЦОГ-1 и ЦОГ-2. ЦОГ-1 постоянно присутствует в большинстве тканей и регулирует физиологические эффекты ПГ. Конституциональная ЦОГ-2 в норме присутствует в организме в незначительном количестве и играет роль в функционировании головного мозга, тимуса, почек и желудочно-кишечного тракта. Помимо ряда физиологических функций, ЦОГ-2 играет важную роль в развитии и поддержании воспаления, боли и лихорадки. Ингибирование конституциональной ЦОГ-2 также может сопровождаться развитием серьезных нежелательных реакций со стороны сердечно-сосудистой системы и почек.
Патофизиологические механизмы, лежащие в основе кардиотоксичности НПВП, изучены недостаточно. Развитие ССО при приеме НПВП большинство экспертов связывают с нарушением тромбоцитарно-сосудистого гомеостаза метаболитов ЦОГ — тромбоксана A2 и ПГI2. Выраженность ингибирования ЦОГ-2 относительно ингибирования ЦОГ-1 может влиять на риск ССЗ, связанный с отдельными НПВП. Представители данного класса лекарственных препаратов способны повышать риск развития сосудистых тромбозов, что связано с подавлением ЦОГ-2-зависимого синтеза ПГI2 клетками сосудистого эндотелия [16]. Синтез ПГI2 усиливается на фоне атеросклероза сосудов и препятствует активации, агрегации и адгезии тромбоцитов в области атеросклеротической бляшки. НПВП блокируют этот процесс, оказывая протромботическое действие. Следует четко понимать, что селективность ЦОГ-2 является непрерывной переменной, поэтому дихотомическое деление на «селективные» и «неселективные» ингибиторы ЦОГ-2 не оправдано (например, высокоселективный ингибитор ЦОГ-2 эторикоксиб в высокой концентрации может ингибировать и ЦОГ-1). Все НПВП являются ингибиторами ЦОГ-2. Для реализации анальгетических и противовоспалительных эффектов НПВП достаточно 50–80% ингибирования активности ЦОГ-2. Умеренная селективность в отношении ЦОГ-2, установленная in vitro, может быть в значительной мере утеряна in vivo при повышении дозы НПВП и/или при индивидуальном ответе на препарат. При этом взаимосвязь между ингибированием ЦОГ-1 в тромбоцитах и их активацией не линейна. Для подавления функции тромбоксана активность ЦОГ-1 в тромбоцитах должна быть заблокирована на 97–100%. Ацетилсалициловая кислота (АСК) вследствие своей уникальной фармакокинетики и фармакодинамики является единственным ковалентным, необратимым ингибитором ЦОГ-1, остальные НПВП могут вызывать лишь преходящее ингибирование ЦОГ-1 тромбоцитов. Только высокие дозы напроксена при двукратном приеме оказывают аспириноподобный эффект in vivo (вследствие его способности умеренно блокировать ЦОГ-1 и длительного периода полувыведения) [16].
Риск развития ССО может возрастать из-за прогипертензивного действия НПВП [13]. АГ является общепризнанным ТФР ССЗ [17], в т. ч. при РА [18]. Негативное влияние НПВП на артериальное давление (АД) связано с блокадой ЦОГ-2 и снижением синтеза ПГЕ2 и ПГI2. В ткани почек экспрессия ЦОГ-2 происходит в ответ на повышение системного АД, а усиление синтеза ПГЕ2 и ПГI2 в этой ситуации является элементом естественного контроля, препятствующего развитию стойкой АГ.
Обсуждаются несколько взаимосвязанных механизмов, определяющих способность НПВП повышать АД [13]: снижение выведения натрия за счет влияния на клубочковую фильтрацию и усиление его проксимальной канальцевой реабсорбции; сужение сосудов за счет подавления сосудорасширяющего эффекта ПГЕ2 и ПГI2; усиление высвобождения норадреналина из нервных окончаний, а также увеличение чувствительности сосудистой стенки к действию вазоконстрикторных субстанций; снижение почечного кровотока и клубочковой фильтрации и увеличение секреции эндотелина 1.
Прогипертензивное действие НПВП может быть также связано с токсическим влиянием на ткань почек и развиваться в рамках так называемой НПВП-нефропатии. Кроме того, хроническое воспаление может приводить к снижению клубочковой фильтрации и нарушать фармакокинетику НПВП. В исследованиях in vivo показано, что воспаление повышает концентрацию рофекоксиба, но не влияет на концентрацию других НПВП, например мелоксикама [16]. По данным популяционных исследований, НПВП назначают 15–36% больных, страдающих АГ [13]. Частота развития или дестабилизации АГ, потребовавших прерывания лечения или госпитализации на фоне приема различных НПВП, колеблется от 0,3 до 6%. К факторам риска повышения АД на фоне приема НПВП относят наличие АГ в анамнезе, неадекватное лечение АГ, возраст 65 лет и старше, ожирение, СД и хроническую болезнь почек [13, 19]. В связи с тем что почечная регуляция АД преимущественно определяется активностью ЦОГ-2, сНПВП и нНПВП способны оказывать прогипертензивное действие как у пациентов с АГ, так и у нормотоников [16, 20]. Это также верно для высоких доз парацетамола [21]. Для рофекоксиба и эторикоксиба риск развития АГ выше по сравнению не только с плацебо, но и с другими НПВП [22]. Повышение АД связано также с тем, что все НПВП могут снижать антигипертензивное действие ингибиторов ангиотензин-превращающего фермента (иАПФ), антагонистов рецепторов к ангиотензину II (АРА), β-адреноблокаторов и диуретиков, но они в меньшей степени влияют на эффект блокаторов медленных кальциевых каналов (БМКК). Комбинация мочегонных препаратов, иАПФ/АРА и НПВП увеличивает риск острой почечной недостаточности [23].
Использование НПВП ассоциируется с повышением риска развития и декомпенсации ХСН [13, 15, 24]. Патогенез этого осложнения связан со способностью НПВП вызывать задержку воды и натрия, повышение тонуса периферических сосудов, дестабилизацию АГ и нарастание постнагрузки на сердце [13, 16]. По данным метаанализа наблюдательных исследований, риск развития ХСН выше у пациентов, принимавших НПВП, чем у тех, кто их не получал (ОР 1,17; 95% ДИ 1,01–1,36) [24]. В недавно опубликованном наблюдательном исследовании (92 163 больных ХСН
и 8 246 403 человека — контрольная группа) прием НПВП ассоциировался с умеренным нарастанием риска ХСН (ОР 1,19; 95% ДИ 1,17–1,22). Наибольшее ОР отмечено у кеторолака — 1,83; эторикоксиба — 1,51 и индометацина — 1,51; наименьшее — у целекоксиба и мелоксикама (0,96 и 1,02 соответственно) [25].
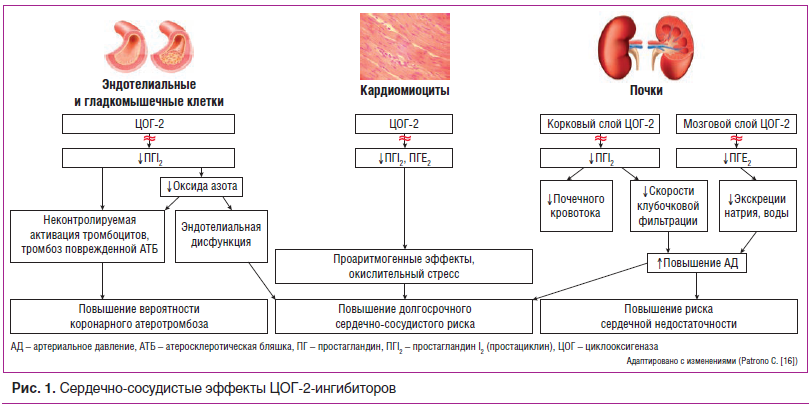
Таким образом, можно ожидать, что увеличение активации тромбоцитов в местах повреждения атеросклеротических бляшек, повышение АД, задержка натрия и воды, повышение тонуса периферических сосудов будут способствовать неблагоприятным сердечно-сосудистым последствиям ингибирования ЦОГ-2. Также можно предположить, что протромботические эффекты ингибирования ЦОГ-2 будут ослаблены благодаря постоянному подавлению активности ЦОГ-1 тромбоцитов (особенность АСК и высоких доз напроксена), в то время как ингибирование ЦОГ-1 не будет влиять на долгосрочные последствия ингибирования ЦОГ-2 (повышение АД, задержка натрия и воды, вазоконстрикция, почечная дисфункция) (рис. 1). Имеются данные крупнейшего метаанализа (280 РКИ, где НПВП сравнивались с плацебо (124 513 пациентов), и 474 РКИ, где НПВП сравнивались между собой (229 296 пациентов)) [26], которые согласуются с теоретическими предпосылками, изложенными выше. Риск ССО (нефатальный ИМ, МИ и сердечно-сосудистая смерть) для коксибов и нНПВП (диклофенака, ибупрофена) в сравнении с плацебо сопоставим: 1,37 (95% ДИ 1,14–1,66), 1,41 (95% ДИ 1,12–1,78) и 1,44 (95% ДИ 0,89–2,33) соответственно. Низкая вероятность ССО была показана лишь для напроксена (ОР 0,93; 95% ДИ 0,69–1,27). Использование коксибов и диклофенака ассоциировалось с увеличением на 60% сердечно-сосудистой смертности, у напроксена подобного эффекта не выявлено. Применение НПВП увеличивало риск развития ХСН [26]. Одним из важных ограничений этого анализа является то, что только 3 нНПВП (диклофенак, ибупрофен и напроксен) использовались в качестве препаратов сравнения в исследованиях с коксибами, и адекватно исследованы были только схемы с высокими дозами любого НПВП.
Мовалис® — НПВП, безопасный в отношении сердечно-сосудистой системы
Мовалис® (международное непатентованное наименование: мелоксикам) — один из наиболее широко применяемых представителей группы НПВП, используемых в нашей стране. Он применяется в российской клинической практике в течение 20 лет и зарекомендовал себя как эффективный и достаточно безопасный анальгетический и противовоспалительный препарат [27]. Высокая клиническая эффективность препарата Мовалис® продемонстрирована у пациентов с РА, анкилозирующим спондилитом, остеоартритом (ОА), при болях в нижней части спины и при многих других ревматических и неревматических заболеваниях. Помимо низкого риска развития побочных реакций со стороны пищеварительной системы, Мовалис® также достаточно безопасен в отношении органов сердечно-сосудистой системы и почек. Это может быть обусловлено наличием у оксикамов как минимум двух механизмов действия: первый механизм, характерный и для других НПВП, заключается в воздействии на ЦОГ, а второй — связан с ингибированием микросомальной ПГЕ2-синтетазы 1, приводящим к предупреждению избыточного образования ПГЕ2 [28]. В метаанализе 19 исследований (131 755 пациентов) сравнивалась частота развития ИМ, МИ и тромбоэмболии легочной артерии, а также ренальных осложнений на фоне приема различных НПВП [29]. Вероятность развития ССО и нарушения функции почек при назначении мелоксикама была наименьшей среди других НПВП (ОР 1,14; 95% ДИ 1,04–1,25), в основном за счет сосудистого компонента (ОР 1,35; 95% ДИ 1,18–1,55), без повышения риска развития кардиальных (ОР 1,13; 95% ДИ 0,98–1,32) и почечных (ОР 0,99; 95% ДИ 0,72–1,35) осложнений. По степени увеличения риска другие НПВП располагаются в такой последовательности: рофекоксиб>индометацин>диклофенак>целекоксиб>напроксен>ибупрофен. Не выявлено различий в частоте развития ССО при использовании мелоксикама в дозах 7,5 и 15 мг в отличие от других НПВП, которые демонстрировали увеличение риска развития осложнений с увеличением дозы [29].
В систематическом обзоре и метаанализе обсервационных исследований C. Varas-Lorenzo et al. [30] было показано, что наиболее часто используемые в клинической практике НПВП, за исключением напроксена, связаны с повышенным риском развития ИМ. Так, ОР было самым низким для напроксена (1,06), далее следуют целекоксиб (1,12), ибупрофен (1,14), мелоксикам (1,25), рофекоксиб (1,34), диклофенак (1,38), индометацин (1,40), этодолак (1,55) и эторикоксиб (1,97). K. Thöne et al. [31] в исследовании «случай-контроль» (17 236 пациентов с ИМ, 1 714 006 пациентов — группа контроля) оценили относительный риск ИМ на фоне приема НПВП у пациентов с сердечно-сосудистым анамнезом и без такового. Повышение ОР ИМ выявлено у пациентов, принимавших фиксированную комбинацию диклофенака с мизопростолом (ОР 1,76; 95% ДИ 1,26–2,45), индометацин (ОР 1,69; 95% ДИ 1,22–2,35), ибупрофен (ОР 1,54; 95% ДИ 1,43–1,65),
эторикоксиб (ОР 1,52; 95% ДИ 1,24–1,87) и диклофенак (ОР 1,43; 95% ДИ 1,34–1,52), по сравнению с применением НПВП в прошлом. Самая высокая вероятность развития ИМ наблюдалась у лиц моложе 60 лет, независимо от наличия ТФР ССЗ. Прием напроксена, целекоксиба и мелоксикама не приводил к увеличению риска ИМ.
F. Lapi et al. [32] в исследовании «случай-контроль» (1566 случаев МИ/ТИА в когорте из 29 722 пациентов с ОА) показали, что только диклофенак и кетопрофен ассоциировались с повышенной частотой цереброваскулярных событий (ОР 1,53; 95% ДИ 1,04–2,24 и ОР 1,62; 95% ДИ 1,02–2,58 соответственно). Терапия целекоксибом, нимесулидом и мелоксикамом не влияла на увеличение риска МИ/ТИА.
Сопоставим ли риск ССЗ на фоне применения НПВП у больных РА и в общей популяции? Исследование VIGOR — первое РКИ, сравнивающее желудочно-кишечную безопасность рофекоксиба и напроксена у больных РА, где было показано увеличение риска развития ИМ у пациентов, получающих рофекоксиб [33]. Последующий обзор данных FDA выявил более высокую частоту ССО, чем первоначально сообщалось в VIGOR [34]. В других РКИ не выявлено различий в частоте ССО у пациентов с РА, получающих сНПВП и нНПВП, но мощность большинства этих работ была недостаточной для выявления ССР [35–39]. В некоторых исследованиях не было группы плацебо, что позволяет сравнивать только коксибы и нНПВП [40, 41].
В метаанализе РКИ и наблюдательных исследований показано, что НПВП увеличивают риск всех ССО и МИ у пациентов с РА, хотя этот эффект в основном обусловлен сНПВП, преимущественно рофекоксибом (ОР 1,58; 95% ДИ 1,24–2,00) [42]. D.H. Solomon et al. [43] сообщили о более высоком риске ИМ, МИ, ХСН и смертности от ССЗ среди пожилых людей, в т. ч. пациентов с РА, начавших лечение коксибами или нНПВП. По данным ретроспективного когортного исследования (7102 больных РА+ССЗ; 27 018 больных РА без ССЗ) отмечено снижение риска ССЗ на фоне терапии БПВП (ОР 0,79), ГИБП достоверно не влияли на риск ССЗ (ОР 0,85), тогда как ГК (ОР 1,26) и НПВП (нНПВП: OР 1,32, коксибы: ОР 1,31) ассоциировались с его увеличением [44]. Ограничением данной работы являются ее ретроспективный характер, отсутствие данных о длительности и активности болезни, сочетанное использование ГК и НПВП, что затрудняет интерпретацию повышенного риска ССО на фоне терапии ГК и НПВП. В недавнем исследовании (779 пациентов с РА, средняя длительность наблюдения 10 лет) использование ГК было связано с дозозависимым увеличением общей смертности и смертности от ССЗ [45].
A. Grigoriou et al. [46], используя данные анализа электронных медицинских карт госпиталя Королевского колледжа в Лондоне (1089 пациентов с РА, средняя длительность наблюдения 3,7 года), продемонстрировали более низкую абсолютную частоту ССО у лиц, получающих НПВП (ОР 0,77; 95% ДИ 0,39–1,51). Однако только 10% пациентов получали коксибы. Анализ данных Норфолкского регистра (800 пациентов с дебютом воспалительного полиартрита, средняя длительность наблюдения 7 лет) показал, что риск госпитализации по поводу ССЗ у пациентов с полиартритом был в 2 раза выше, чем в общей популяции. Интересно, что пациенты, которые принимали НПВП в начале исследования, госпитализировались в 2 раза реже, чем те, кто не получал НПВП, тогда как любые БПВП и ГК не влияли на риск госпитализации по поводу ССЗ [47]. N.J. Goodson et al. [48] (923 пациента с дебютом воспалительного полиартрита, средняя длительность наблюдения 10,7 года) выявили более низкий риск общей смертности и смертности от ССЗ у пациентов, когда-либо получавших НПВП, по сравнению с теми, кто их не получал (ОР 0,70; 95% ДИ, 0,50–1,00 и 0,54; 95% ДИ 0,33–0,88 соответственно). Среди пациентов, когда-либо получавших НПВП (61% из них удовлетворяли критериям диагноза РА), отмечено 2,5-кратное снижение риска сердечно-сосудистой смерти. При этом нельзя исключить, что врачи реже назначали НПВП ослабленным больным и пациентам с ТФР ССЗ. Однако даже с поправкой на применение сердечно-сосудистых препаратов сохранялась связь приема НПВП с более низкой смертностью.
В исследовании «случай-контроль» (n=558 больных РА с ИМ и 5580 больных РА без ИМ) было продемонстрировано, что риск развития ИМ был значительно ниже у пациентов, получавших БПВП, выше — у пациентов, получавших ГК, и не увеличивался при использовании нНПВП или коксибов [49]. В испанской когорте больных РА не выявлено связи ИБС, МИ, ХСН с приемом НПВП (ОР 0,78; ДИ 95% 0,47–1,30). Однако в этом исследовании пациенты, принимавшие НПВП, были моложе, имели меньше сопутствующих ССЗ и заболеваний желудка, чем пациенты, которые никогда не использовали НПВП [50].
В датском крупномасштабном когортном исследовании (17 320 больных РА, 69 280 человек — группа контроля) риск комбинированной конечной точки (ИМ, МИ, сердечно-сосудистая смерть) у пациентов с РА, принимавших НПВП, был значительно ниже по сравнению с таковым в общей популяции (ОР 1,22; 95% ДИ 1,09–1,37 и 1,51; 1,36–1,66 соответственно, p<0,01) [51]. Риск ССО у больных РА был повышен только на фоне приема рофекоксиба и диклофенака, тогда как другие изученные НПВП (ибупрофен, целекоксиб, напроксен, кетопрофен) оказались более безопасными при РА, чем в группе контроля. Несколько других наблюдательных исследований подтвердили повышенный риск МИ [52] и ХСН [53] у больных РА только на фоне приема рофекоксиба. В исследовании SCOT [54] (7297 больных ОА и РА старше 60 лет без ССЗ) частота серьезных ССО была сопоставима у пациентов, получавших целекоксиб (5,2%) и нНПВП (5,8%).
По данным двухлетнего РКИ PRECISION (24 081 пациент с ОА и РА и исходно высоким ССР) частота ССО (нефатальный ИМ, МИ, сердечно-сосудистая смерть) была невысока и сопоставима у пациентов, принимающих целекоксиб (2,3%), напроксен (2,5%) и ибупрофен (2,7%) [55]. Данная работа показала, что при хронических артритах эти НПВП обладают хорошим профилем безопасности со стороны сердечно-сосудистой системы даже при наличии сопутствующей кардиоваскулярной патологии. Однако надо учитывать несопоставимость дозировок НПВП в исследовании и высокий процент пациентов, прекративших лечение (68,8%). В.И. Мазуров и соавт. [56] оценили влияние мелоксикама на течение стабильной ИБС (24 больных РА и 22 больных ОА) в сравнении с диклофенаком 100 мг/сут (64 больных РА и 46 больных ОА) при средней длительности наблюдения 9 мес. К концу наблюдения в группах больных РА и ОА с ИБС, принимавших мелоксикам, по сравнению с больными, использовавшими диклофенак, отмечена тенденция к уменьшению продолжительности ишемии миокарда, меньшая частота возникновения желудочковых аритмий, отеков, высоких функциональных классов ХСН [57]. R. Altman et al. показали, что у больных с острым коронарным синдромом без подъема сегмента ST применение мелоксикама в сочетании с антитромботической терапией (ацетилсалициловая кислота (АСК) и гепарин) приводит к снижению частоты развития тяжелых ССО, приступов стенокардии и потребности в реваскуляризации миокарда по сравнению с пациентами, получающими только АСК и гепарин [57]. Необходимо отметить, что в данном исследовании [57], несмотря на одновременный прием мелоксикама, АСК и гепарина, у пациентов отсутствовали тяжелые кровотечения, хотя в целом комбинация антиагрегантов, антикоагулянтов и НПВП увеличивает риск кровотечений [15].
Некоторые нНПВП могут конкурировать с АСК за связывание с активным центром ЦОГ-1 и снижать его антиагрегантный эффект [13]. Z. Alqahtani et al. [58] провели систематический обзор исследований in vitro, in vivo, ex vivo и показали, что обнаруженное в экспериментальных работах снижение антиагрегантного действия АСК на фоне совместного приема с напроксеном или ибупрофеном не приводит к утере его кардиопротективных эффектов в клинических исследованиях. Мелоксикам не взаимодействует с АСК и не снижает ее кардиопротективные эффекты. По данным перекрестного исследования, проведенного на основе Национальной базы данных медицинского страхования Тайваня (5921 больной РА, впервые госпитализированные по поводу ИМ или МИ), использование НПВП увеличивает риск МИ в 1,4 раза, ИМ — в 1,73 раза [59]. При сопоставлении сНПВП и нНПВП только последние значительно повышали риск МИ (ОР 1,39; 95% ДИ 1,25–1,55) и ИМ (ОР 1,82; 95% ДИ 1,37–2,41). Среди 5 наиболее часто употребляемых НПВП (целекоксиб, ибупрофен, диклофенак, мефенамовая кислота и мелоксикам) диклофенак и мефенамовая кислота значительно повышали риск МИ и ИМ, ибупрофен — МИ, при этом целекоксиб и мелоксикам не ассоциировались с увеличением риска ССО [59].
Данные большинства исследований свидетельствуют о том, что НПВП (за исключением рофекоксиба) при РА связаны с более низким риском ССЗ, чем при ОА и в общей популяции. НПВП модифицируют риск ССЗ у пациентов с РА за счет снижения боли в суставах и отека, уменьшая функциональную недостаточность суставов и депрессию, которые связаны с повышенным ССР [60, 61]. Системное и локальное (на уровне атеросклеротической бляшки) противовоспалительное действие НПВП также может вносить вклад в снижение риска ССЗ у пациентов с выраженным воспалением. Напротив, в общей популяции НПВП могут существенно повышать ССР посредством торможения конституциональной ЦОГ-2, экспрессирующейся в эндотелии сосудов и поддерживающей гомеостаз и целостность артериальной стенки. Так, W. Asghar et al. [62] в исследовании in vivo показали, что воспаление в суставах вызывает вазоконстрикцию вследствие дисбаланса ренин-ангиотензиновой системы, а снижение выраженности воспаления на фоне терапии НПВП (мелоксикамом и целекоксибом) приводит к восстановлению этого баланса.
В настоящее время отсутствуют алгоритмы оценки риска развития осложнений, в т. ч. кардиоваскулярных, при применении НПВП. D.H. Solomon et al. [63], используя данные субанализа исследования PRECISION, предложили модель оценки риска токсичности НПВП у пациентов с РА и ОА, которая включает возраст, мужской пол, курение, ССЗ в анамнезе, наличие АГ, СД, использование АСК, статинов, повышение уровня креатинина, гематокрита, диагноз РА и позволяет выделить 3 группы риска (низкий, средний и высокий). В настоящее время планируется проведение внешней валидации этой шкалы. Несмотря на ряд ограничений данной модели, ее применение может привести к более рациональному использованию НПВП и станет важным шагом на пути к персонализированной медицине.
Заключение
РА — заболевание с высоким ССР. К основным причинам ускоренного развития ССЗ у больных РА относят сочетанное влияние ТФР и хронического воспаления, поэтому в основе профилактики ССО лежит эффективный контроль ТФР ССЗ и активности заболевания. НПВП являются одними из самых эффективных и доступных лекарственных препаратов для симптоматического лечения боли при РА. Все НПВП, как селективные, так и неселективные, могут вызывать ССО, вероятность которых определяется свойствами и дозой конкретного препарата. Результаты последних исследований свидетельствуют о том, что НПВП за счет своих противовоспалительных эффектов могут в меньшей степени увеличивать риск ССЗ у пациентов с РА по сравнению с общей популяцией. Однако РА — хроническое заболевание с периодами ремиссий и обострений. Можно предположить, что в период обострения негативное влияние воспаления на сердечно-сосудистую систему выходит на первый план, и НПВП могут быть полезны в этой ситуации. При этом остается неясным, как будут влиять НПВП на ССР у пациентов с РА в период ремиссии заболевания. Также недостаточно данных о безопасности применения НПВП у больных РА с существующими ССЗ.
Пока вопрос о кардиоваскулярной безопасности НПВП у пациентов с РА окончательно не решен, необходимо придерживаться рекомендаций российских экспертов и EULAR об использовании НПВП с осторожностью, особенно у пациентов с документированными ССЗ и при наличии ТФР ССЗ. Целесообразность назначения НПВП пациентам с РА должна оцениваться индивидуально на основании показаний к обезболивающей терапии и наличия факторов риска развития побочных эффектов, и автоматически не исключаться ввиду ожидаемого развития ССО. При обращении пациента с РА к ревматологу или врачу общей практики необходимы детальный сбор анамнеза с акцентом на документированные ССЗ, скрининг ТФР ССЗ с расчетом суммарного риска ССО по шкале SCORE в модификации EULAR (×1,5) и, в случае необходимости, проведение дополнительного обследования сердечно-сосудистой системы. Необходим мониторинг АД на фоне терапии НПВП, особенно в первый месяц терапии. НПВП могут снижать эффективность некоторых антигипертензивных препаратов (иАПФ, АРА, β-адреноблокаторов, мочегонных препаратов). При наличии АГ у пациента, получающего НПВП, применение БМКК более предпочтительно, чем монотерапия иАПФ и АРА. Комбинация антиагрегантов, антикоагулянтов и НПВП увеличивает риск кровотечений. Комбинация диуретиков, иАПФ/АРА и НПВП увеличивает риск острой почечной недостаточности. При выявлении повышенного риска ССО вопросы дальнейшего ведения пациентов, нуждающихся в регулярном приеме НПВП, целесообразно согласовать с кардиологом. Препаратом выбора в этой ситуации может стать Мовалис® — один из наиболее безопасных НПВП в отношении риска развития ССО.
Информация с rmj.ru





