Статья посвящена вопросам диагностики предиабета, механизмам его развития, выявления групп риска и возможностям патогенетической терапии
Содержание статьи
Определение и эпидемиология
Предиабет — это раннее нарушение углеводного обмена, предшествующее развитию сахарного диабета 2 типа (СД2), при котором показатели гликемии уже превышают норму, однако еще не достигли показателей СД2 [1]. К предиабету относят любое из ранних нарушений углеводного обмена, такие как нарушенная гликемия натощак (НГТ), нарушенная толерантность к глюкозе (НТГ) [2].
Во всем мире насчитывается около 352,1 млн человек с нарушением толерантности к глюкозе. К 2045 г. ожидается увеличение числа людей с НТГ в возрасте 20–79 лет до 587 млн, что составит 8,3% взрослого населения [1].
NATION — первое национальное эпидемиологическое кросс-секционное исследование распространенности СД2 на территории Российской Федерации — показало, что ранние нарушения углеводного обмена, такие как НТГ и НГТ, зафиксированы у 19,3% (около 20,7 млн) взрослого населения России в возрасте 20–79 лет [3]. Согласно различным исследованиям особое значение в углеводном обмене имеет именно НТГ. Так, например, по данным исследования DECODE, в котором были представлены результаты 10 европейских когортных исследований, которые включали более чем 22 тыс. пациентов, регистрировалась повышенная смертность среди пациентов с НТГ, выявленной при проведении глюкозотолерантного теста, тогда как корреляция между изменением уровня глюкозы плазмы натощак и смертностью отсутствовала [4].
В настоящее время активно обсуждается роль ожирения в формировании ранних нарушений углеводного обмена. Нарушения углеводного обмена встречаются более чем у половины пациентов с ожирением В современном мире ожирение стало одной из наиболее важных медицинских и социальных проблем, поскольку показывает высокую распространенность и требует значительных финансовых затрат на лечение ассоциированных с ожирением заболеваний. Распространенность избыточной массы тела и ожирения в Российской Федерации составляет 59,2 и 24,1% соответственно. По данным 7-го доклада ООН, в 2013 г. Российская Федерация занимала 19-е место среди всех стран мира по распространенности ожирения. По данным многоцентрового (охватившего 11 регионов РФ) наблюдательного исследования ЭССЕ-РФ («Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации»), в котором приняли участие 25 224 человека в возрасте 25–64 лет, показано, что распространенность ожирения в популяции составила 29,7%. Ожирение является важнейшим фактором риска сердечно-сосудистых заболеваний (ССЗ) и СД2 (по данным ВОЗ, избыточная масса тела и ожирение лежат в основе развития до 44–57% всех случаев СД2). Значительно выше вероятность развития в дальнейшем сахарного диабета у лиц с ожирением и НТГ. Ежегодная конверсия НТГ в сахарный диабет наблюдается у 5–10% пациентов и у 20–34% за 5-летний период, а при сочетании НГТ и НТГ — у 38–65% [5].
Сегодня накопленные данные свидетельствуют, что предиабет значимо повышает риск развития не только сахарного диабета, но и кардиоваскулярных заболеваний на всех этапах сердечно-сосудистого континуума от эндотелиальной дисфункции до сердечной недостаточности (СН). В исследовании М.В. Шестаковой и соавт. (2016) продемонстрирована распространенность СД2 у пациентов с различными ССЗ. Выявлено, что распространенность СД2 среди пациентов с ССЗ составляет 8–14%, а предиабета — 14,6–36,4%, что оказалось выше аналогичных показателей в популяции, полученных в исследовании NATION — 5,4% и 19,3% для СД2 и предиабета соответственно [6]. В ходе 14-летнего наблюдения за 11 057 лицами, исходно не имевшими СД2, продемонстрировано увеличение риска развития СН на 40% у пациентов c предиабетическим уровнем HbA1c (6,0–6,5%) по сравнению с лицами, имевшими нормогликемию [7].
Однако, несмотря на вышеперечисленные риски, существует низкая настороженность специалистов в отношении предиабета и СД2. Интересные данные получены в исследовании PARADIGM-FH, в котором показано, что среди 8274 пациентов с систолической СН только у 35% имелось указание на СД2 в анамнезе. Проведенное перед началом исследования обследование выявило дополнительно 13% пациентов с СД2 (HbA1c >6,5%) и 25% с предиабетом (HbA1c 6,0–6,4%). То есть у 38% пациентов с развившейся СН с фракцией выброса левого желудочка ≤40% не были вовремя выявлены клинически значимые нарушения углеводного обмена (предиабет и СД2) [8].
Таким образом, все приведенные данные свидетельствуют о том, что предиабет индуцирует развитие серьезных заболеваний и состояний, значительно ухудшающих качество жизни больного и прогноз.
Факторы риска и скрининг
Исследование NATION продемонстрировало корреляцию нарушений углеводного обмена с возрастом, индексом массы тела (ИМТ), малоподвижным образом жизни, артериальной гипертензией [3].
Таким образом, были определены основные факторы риска развития СД2: предиабет, возраст старше 45 лет, избыточная масса тела и ожирение, отягощенный семейный анамнез по СД, низкая физическая активность, гестационный СД или рождение крупного плода в анамнезе, артериальная гипертензия (≥140/90 мм рт. ст. или медикаментозная антигипертензивная терапия), холестерин ЛПВП ≤0,9 ммоль/л и/или уровень триглицеридов ≥2,82 ммоль/л, синдром поликистозных яичников, наличие ССЗ. Cкрининг с целью выявления ранних нарушений углеводного обмена, таких как НТГ и НГТ, должны проходить все пациенты в возрасте старше 45 лет, а также пациенты любого возраста с избыточной массой тела и наличием одного из факторов риска [2].
Учитывая роль ожирения в формировании ранних нарушений углеводного обмена, в настоящее время активно изучают особенности распределения жира с помощью компьютерной и магнитно-резонансной томографии. На основании полученных данных жировую ткань разделяют на висцеральную (интраабдоминальную) и подкожную. Именно повышение количества интраабдоминального жира зачастую сочетается с гиперинсулинемией и инсулинорезистентностью, что лежит в основе развития ранних нарушений углеводного обмена.
Характер распределения жировой ткани в организме оценивают с помощью отношения окружности талии к окружности бедер (ОТ/ОБ) пациента, измеренных с помощью сантиметровой ленты. При повышении этого соотношения более 1,0 у мужчин и 0,8 у женщин необходимо говорить об абдоминальном типе ожирения.
Отмечено 10-кратное повышение риска сахарного диабета у лиц с высокими значениями ОТ по сравнению с имеющими максимально низкие значения ОТ. На основании анализа целого ряда крупных проспективных эпидемиологических исследований в различных популяциях (европейских и азиатских) среди различных возрастных групп сделаны примечательные выводы. Абдоминальное ожирение, оцениваемое по ОТ и соотношению ОТ/ОБ, ассоциировано с повышенным риском смерти от любой причины на всем диапазоне значений ИМТ. В целом как ОТ, так и ОТ/ОБ являются более значимыми маркерами риска общей смертности, чем ИМТ. Особенно это свойственно для пожилых лиц, у которых зачастую отмечается обратная ассоциация между ИМТ и смертностью. По мнению авторов, ОТ может заменить как ИМТ, так и ОТ/ОБ в качестве маркера риска смерти от любой причины [9, 10].
В 2015 г. в ходе проспективного Фрамингемского исследования оценивалось содержание висцерального и подкожного жира с помощью мультидетекторной компьютерной томографии, выборка включала 3324 больных ожирением. Было продемонстрировано, что каждая 1 SD лишнего объема жировой ткани ассоциирована с увеличением общей смертности, а также смертности вследствие онкологических заболеваний. Авторами исследования сделан вывод, что выявленная взаимосвязь обусловлена системным воспалением, вызванным высоким уровнем макрофагов, провоспалительных цитокинов, фиброзом внеклеточного матрикса [11].
Отдельно стоит отметить понятие «метаболический синдром», которое было предложено для выделения категории лиц, имеющих повышенный риск развития ССЗ и СД2. Метаболический синдром (МС), описанный Reaven в 1988 г. и активно обсуждаемый в последние десятилетия, включает в себя такие параметры, как: ожирение (по абдоминальному типу, при котором ОТ у женщин превышает 80 см, а у мужчин — 94 см), артериальная гипертензия, дислипидемия с повышением триглицеридов более 1,7 ммоль/л, повышение холестерина липопротеидов низкой плотности (>3 ммоль/л), снижение липопротеидов высокой плотности (ЛПВП, <1 ммоль/л у мужчин и <1,2 ммоль/л у женщин) и нарушение углеводного обмена. Доказано, что пациенты с МС подвержены двукратному риску ССЗ и пятикратному риску развития СД2. И хотя МС не включает наиболее важные факторы риска (курение, пол, возраст), не выставляется в качестве самостоятельного диагноза, а некоторыми исследователями вообще оспаривается как полезный клинический критерий, активный поиск нарушений углеводного обмена явно целесообразен у пациентов с абдоминальным ожирением и одним или двумя дополнительными признаками МС [9].
Критерии диагностики предиабета
Российская ассоциация эндокринологов (РАЭ) определила критерии для постановки диагноза «предиабет» (табл. 1) [2].
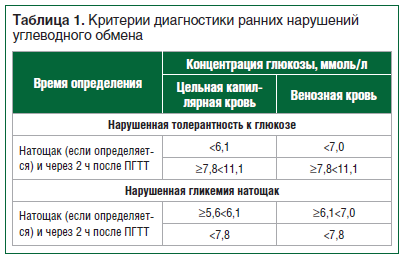
Подтверждением для выявления НТГ является проведение перорального глюкозотолерантного теста (ПГТТ). Стандартизованный ПГТТ проводится утром после 8–14-часового голодания. Взятие крови производится до теста и через 120 мин после приема в течение 5 мин 75 г глюкозы, растворенной в 250–300 мл воды (началом теста считается первый глоток). Для исследования используется плазма венозной крови [2].
В отношении гликированного гемоглобина как критерия для диагностики ранних нарушений углеводного обмена существуют различные мнения. Так, по рекомендациям Американской диабетической ассоциации критерием для постановки диагноза «предиабет» является уровень гликированного гемоглобина 5,7–6,4%, в то время как РАЭ гликированный гемоглобин как диагностический критерий ранних нарушений углеводного обмена не использует [2, 12].
Тем не менее в статье «Низкая согласованность между HbA1c и ГТТ для диагностики предиабета и диабета при избыточном весе или ожирении», опубликованной в журнале Clinical Endocrinology в 2019 г., изучался вопрос использования показателей, полученных в результате проведения ПГТТ, и уровня гликированного гемоглобина в диагностике предиабета и СД2. Тест на HbA1c показал более высокую встречаемость предиабета, чем ПГТТ [13]. Все приведенные критерии диагностики ранних нарушений углеводного обмена требуют дальнейших исследований для оптимизации и унификации выявления ранней гипергликемии. В настоящий момент РАЭ рекомендует использовать ПГТТ в качестве основного критерия для выявления НТГ и НГТ [2].
Патогенез развития ранних нарушений углеводного обмена
Соотношение двух ведущих компонентов патогенеза, таких как инсулинорезистентность и дисфункция островкового аппарата, лежит в основе запуска ранних нарушений углеводного обмена. Инсулинорезистентность (ИР) — снижение способности инсулина оказывать свои обычные биологические эффекты. ИР обусловлена многими факторами, такими как малоподвижный образ жизни, ожирение, гиперлипидемия. Именно висцеральный тип ожирения способствует развитию ИР. Для висцерального жира характерна низкая чувствительность к антилиполитическому действию инсулина и повышенная чувствительность к липолитическому действию катехоламинов. Поэтому при данном типе ожирения усилен липолиз, в результате чего образуется большое количество свободных жирных кислот (СЖК), которые препятствуют нормальному процессу связывания инсулина с гепатоцитами, устраняют его ингибирующее влияние на продукцию глюкозы в печени и ухудшают утилизацию глюкозы в мышцах. Также СЖК вызывают продукцию активных форм кислорода, которые блокируют работу субстрата инсулинового рецептора 1 типа и сигнального пути PI3K-Akt рецепторов к инсулину, приводя к понижению работоспособности транспортера глюкозы GLUT-4.
Кроме того, среди механизмов ИР выделяют пострецепторные дефекты в виде недостаточности активации ферментных систем и белковых структур, передающих сигналы инсулина или участвующих в транспорте глюкозы внутрь клетки.
Длительное время состояние ИР компенсируется гиперинсулинемией. Длительное функциональное напряжение бета-клеток способствует нарушению секреции инсулина с изменением его плазменного уровня.
Нарушение секреторной функции бета-клеток обусловлено различными причинами, среди которых наиболее значимыми являются: глюкозотоксичность — отрицательное влияние длительной гипергликемии, приводящей к снижению секреторного ответа бета-клеток на повышение уровня глюкозы в крови; липотоксичность — отрицательное влияние избыточного содержания в крови свободных жирных кислот на секреторную функцию бета-клеток; повышение в бета-клетках синтеза и агрегации амилина, играющего регуляторно-ингибирующую роль в секреции инсулина; снижение количества глюкозного транспортера GLUT-2, который является единственным транспортером глюкозы в бета-клетках [14].
Сегодня признано, что важным патогенетическим звеном развития ранних нарушений углеводного обмена и СД2 является дефект инкретиновой системы. Еще в 1932 г. Ля Барр назвал термином «инкретин» (INtestine seCRETion INsulin) экстракт слизистой оболочки тонкого кишечника, который способствовал снижению уровня глюкозы в крови, однако не вызывал экзокринную секрецию поджелудочной железы. Наиболее изученные сегодня инкретины — глюкозозависимый инсулинотропный пептид (ГИП) и глюкагоноподобный пептид-1 (ГПП-1), способные усиливать секрецию инсулина и снижать уровень глюкозы в крови. Сегодня, после длительного изучения механизмов действия инкретинов, стали активно обсуждаться и их системные эффекты. В последнее время инкретинам отводится особая роль в развитии ожирения.
Известно, что у здоровых людей инкретины отвечают за 50–70% секреции инсулина после употребления глюкозы, что доказывает их важное физиологическое значение в поддержании нормогликемии.
Гормоны инкретинового ряда, являясь звеньями одной системы, действуют по принципу взаимной регуляции: ГИП, гормон проксимального отдела тонкой кишки, стимулирует продукцию ГПП-1 — гормона дистального отдела тонкой кишки. Отмечено, что секреция ГПП-1, вызванная приемом пищи, зависит от массы тела, уровня глюкагона и СЖК натощак, а также от активности дипептидилпептидазы-4 и уровня гликированного гемоглобина. Секреция ГПП-1 при приеме глюкозы или смешанной пищи ниже у лиц с ожирением, а секреция ГИП у лиц с ожирением повышается при приеме глюкозы и снижается при приеме белковой пищи. Кроме того, инкретиновый дефект при СД2 заключается не только в снижении секреции инкретинов, но и в развитии инкретинорезистентности, прежде всего в отношении ГИП. Выявлено, что при НТГ эффект ГИП снижается более выраженно, чем эффект ГПП-1 [15].
Сердечно-сосудистые риски при ранних нарушениях углеводного обмена
СД2 является доказанным фактором риска ССЗ. Между тем еще задолго до того, как будет зафиксирован СД2 на фоне формирующейся ИР с компенсаторной гиперинсулинемией, формируются ранние нарушения углеводного обмена: происходит повышение тощаковой и постпрандиальной гликемии, развиваются макро- и микрососудистые осложнения [16].
Развитие ССЗ у лиц с ИР — процесс стойко прогрессирующий, который характеризуется ранним повреждением эндотелия, а также сосудистым воспалением. Все данные механизмы приводят к вовлечению моноцитов, которые трансформируются в пенистые клетки с образованием жировых полосок. Спустя многие годы это ведет к увеличению количества и размера атеросклеротических бляшек, что, при наличии общего провоспалительного фона, проявляется в нестабильности и разрыве бляшки с развитием окклюзирующего тромбоза. Атеромы у лиц с СД имеют большее содержание жира, являются в большей степени воспалительно измененными и характеризуются более высоким риском тромбообразования, чем у лиц без СД [17].
Более тяжелое течение атеросклероза в коронарных сосудах на фоне предиабета было продемонстрировано в исследовании В. Açar et al. (2018). Исследование включало 255 пациентов с впервые возникшим острым коронарным синдромом, которым проводилась коронароангиография с оценкой частоты трехсосудистого поражения. Показано, что значение частоты многососудистого поражения было достоверно выше в группах СД2 и предиабета по сравнению с группой контроля, при этом выраженность коронарного атеросклероза оказалась сопоставимой у пациентов с СД2 и предиабетом [18].
Лечение
Основная цель ведения и лечения пациентов с предиабетом заключается в профилактике развития СД2 и сердечно-сосудистых осложнений. Сегодня обоснованно эффективными являются как немедикаментозная, так и медикаментозная стратегия в профилактике развития СД2 у лиц с ранними нарушениями углеводного обмена. Кроме того, сегодня имеется уже большое количество данных о возможности эффективной профилактики ССЗ при предиабете. В различных рекомендациях (отечественных и зарубежных) по профилактике СД2 у лиц с предиабетом подчеркивается главная роль мероприятий по активному изменению образа жизни (ИОЖ). Целью данных мероприятий является снижение массы тела на 5–7% от исходной. Снижения массы тела необходимо достигать за счет умеренно гипокалорийного питания с преимущественным ограничением потребления жиров и простых углеводов, а также регулярной физической активности умеренной степени. Продемонстрировано, что только лица с высокой приверженностью ИОЖ достигали необходимого снижения массы тела. Однако мероприятия по ИОЖ, проведенные в клинических исследованиях, зачастую сложно применить в реальной клинической практике. Поэтому обоснованно применение медикаментозной терапии для профилактики СД2 у лиц с предиабетом и неэффективностью мероприятий по ИОЖ [19].
Согласно алгоритмам управления СД2 Американской ассоциации клинических эндокринологов и Американского колледжа эндокринологии 2019 г. основу ИОЖ должны составлять следующие компоненты:
поддержание оптимального веса с ограничением калорий (если ИМТ увеличен);
физическая активность не менее 150 мин в неделю с умеренной физической нагрузкой (например, ходьба, подъем по лестнице), силовые тренировки, увеличивающиеся по мере возможности;
около 7 ч сна в день;
ограничение употребления алкоголя и табакокурения.
Диета
Целью диеты при ранних нарушениях углеводного обмена является снижение массы тела. Снижение массы тела на 5–10% в течение 6–12 мес. (оптимальным считается снижение на 2–4 кг, но не более 5 кг в месяц), вполне осуществимое для большинства пациентов, сопровождается достоверным уменьшением риска для здоровья и нормализацией гликемических показателей. Для пациентов с ранними нарушениями углеводного обмена основой снижения массы тела является гипокалорийная диета. Для составления сбалансированной диеты необходимо рассчитать количество калорий, которое допустимо употребить за сутки с учетом индивидуальных энергозатрат. И из расчета суточной нормы калорий можно составить меню на весь день (снижения калорийности рациона следует достигать преимущественно за счет уменьшения количества жиров и частично — углеводов). На долю жиров должно приходиться не более 30% от общего числа калорий в суточном рационе, на долю насыщенных жиров — не более 7–10%. Углеводы являются основным источником энергии для организма. В суточном рационе углеводы должны составлять 50%. Белки являются главным «строительным материалом» в организме и должны составлять 15–20% суточного рациона (при отсутствии нефропатии). Следует отметить, что очень низкокалорийные диеты дают кратковременные результаты и не рекомендуются для применения. Голодание противопоказано. У лиц с предиабетом целевым является снижение массы тела на 5–7% от исходной [2, 20].
Впечатляющие данные были получены в открытом кластер-рандомизированном исследовании DIRECT, которое проводилось в 2014–2017 гг. в 49 клиниках Англии. В исследовании приняли участие 306 пациентов в возрасте 20–65 лет со средним ИМТ 27–45 кг/м2, которым в течение последних 6 лет был выставлен диагноз СД2 и которым не требовалась терапия инсулином. Интервенция включала в себя отмену антидиабетических и антигипертензивных средств, соблюдение диетических рекомендаций (825–853 ккал/сут: 59% углеводов, 13% жиров, 26% белков, 2% волокон) в течение 3–5 мес., последующее перераспределение состава пищи (50% углеводов, 35% жиров, 15% белков) в течение 2–8 нед. и дальнейшие ежемесячные визиты к специалистам с целью поддержания мотивации для удержания веса. В группе контроля проводилась стандартная терапия СД2. Через 12 мес. в основной группе среднее снижение веса составило 10 кг и 1 кг в группе контроля. Ремиссия диабета, которая верифицировалась по уровню HbA1c <6,5% в течение как минимум 2 мес. после отмены антидиабетических препаратов, была достигнута у 46% пациентов основной группы, причем среди пациентов, достигших снижения веса на 15 кг, этот показатель составил 86% [21].
В настоящее время доказано, что терапия ожирения замедляет развитие предиабета [22] и является важным фактором в лечении СД2. Так, некоторые исследования выявили, что снижение массы тела на 10% сокращает на 80% риск развития СД2 в будущем [23]. В последних стандартах медицинской помощи больным СД2, подготовленных Американской диабетической ассоциацией, пациентам с предиабетом рекомендуется снижение массы тела на 7%, поскольку подсчитано, что этот результат доказанно уменьшает риск развития диабета в дальнейшем [12]. У пациентов с СД2 и ожирением устойчивое снижение массы тела приводит к улучшению гликемического контроля и снижению доз сахароснижающих препаратов [24].
Физическая активность и медикаментозная терапия
Физическая активность увеличивает расход кислорода и метаболических субстратов как источников энергии. В состоянии покоя неэтерифицированные жирные кислоты (НЭЖК) являются главным источником энергии для скелетных мышц, в то время как при небольшой по продолжительности и интенсивности нагрузке источником энергии, кроме НЭЖК, выступает глюкоза. При умеренной физической нагрузке источником энергии являются глюкоза, которая преимущественно образуется из гликогена в печени, и НЭЖК, высвобождаемые в результате липолиза.
Известно, что печень взрослых людей содержит запас глюкозы (около 10–200 г) в виде гликогена, достаточный для поддержания гликемии в течение 24 ч после последнего приема пищи.
В результате длительной физической нагрузки запасы гликогена в печени уменьшаются, что вызывает адренергическую стимуляцию, приводящую к усиленному липолизу, результатом чего является высвобождение НЭЖК из триглицеридов жирового депо и окисление их в мышечной ткани.
Регулярные занятия физкультурой повышают чувствительность мышц к инсулину. Продолжительность данного эффекта после тренировки составляет 12 ч и более (до 48 ч). Физические упражнения повышают активность и количество переносчиков глюкозы в мембранах миоцитов. Физическая нагрузка является важной составляющей в лечении пациентов с впервые выявленным СД2. У этих пациентов физическая нагрузка повышает поглощение глюкозы тканями в 7–20 раз. Длительное улучшение контроля гликемии эффективнее обеспечивают силовые тренировки (вследствие увеличения соотношения капилляров к мышечным волокнам, а также емкости запасов гликогена).
Согласно алгоритмам, разработанным AACE (American Association of Clinical Endocrinologists), РАЭ, физическая активность умеренной интенсивности длительностью не менее 30 мин должна присутствовать в большинстве дней недели (не менее 150 мин в неделю) [2, 25].
ИОЖ и использование метформина в качестве методов профилактики СД2 были изучены сначала в исследовании DPP (Diabetes Prevention Program), а далее оценены в динамике через 15 лет в исследовании DPPOS (Diabetes Prevention Program Outcomes Study) — следующей части исследования DPP, которая была посвящена оценке возможности длительной профилактики СД2 и ССЗ. В DPP было включено 3234 пациента с предиабетом в возрасте старше 25 лет и с ИМТ >25 кг/м2, которые были разделены на 3 группы: 1-я группа получала плацебо и стандартные рекомендации по ИОЖ; 2-я группа получала метформин 1700 мг/сут; 3-я группа была мотивирована на активное ИОЖ (16 индивидуальных учебных занятий со специалистом с учетом индивидуальных особенностей и последующие ежемесячные индивидуальные или групповые занятия). Средняя продолжительность наблюдения составила 2,8 года. Было продемонстрировано снижение массы тела на 0,1, 2,1 и 5,6 кг в группах плацебо, метформина и ИОЖ соответственно. Риск развития СД2 снизился максимально на 58% в группе ИОЖ (р<0,001 против плацебо и метформина). В группе метформина снижение составило 31% (р<0,001 против плацебо). Бóльшая эффективность метформина была продемонстрирована у пациентов с ИМТ ≥30 кг/м2 (максимально ≥35 кг/м2), в возрасте до 60 лет (максимально в 25–44 года), а также с уровнем глюкозы плазмы натощак 6,1–6,9 ммоль/л. Следует отметить, что при приеме метформина не было зафиксировано состояний гипогликемии у пациентов с предиабетом [26]. В дальнейшем значительная часть участников (88%) перешла под наблюдение в исследование DPPOS. В группах плацебо и метформина не было изменений по ведению пациентов, тогда как в группе ИОЖ частота занятий была уменьшена до 6 в год. Это привело к тому, что в группе метформина достигнутое в ходе исследования DPP снижение веса сохранилось, тогда как в группе ИОЖ оно достаточно быстро нивелировалось [27].
Основой ведения пациентов с ранними нарушениями углеводного обмена, безусловно, является ИОЖ, но, к сожалению, как показывают крупномасштабные исследования, результативность данных мероприятий далеко не всегда удовлетворяет врачей и пациентов. Так, например, в исследовании Look AHEAD, несмотря на идеально разработанный дизайн и высокие затраты (200 млн долларов США), лишь 46% больных снизили массу тела на 5% [28].
Поэтому наряду с ИОЖ фармакотерапия является неотъемлемым этапом программы ведения этих пациентов.
Согласно алгоритмам диагностики и лечения СД, предложенным РАЭ, препаратом выбора для лечения ранних нарушений углеводного обмена является метформин. Связываясь с фосфолипидами клеточных мембран, метформин:
снижает продукцию глюкозы печенью;
увеличивает поглощение глюкозы периферическими тканями (преимущественно скелетными мышцами). В связи с этим эффект метформина можно охарактеризовать не как гипогликемический, а как антигипергликемический. В итоге под действием метформина происходит уменьшение ИР;
снижает концентрацию СЖК в плазме и уровень триглицеридов;
замедляет всасывание глюкозы в тонком кишечнике;
активирует фибринолиз и снижает агрегационные свойства тромбоцитов путем подавления активности ингибитора активатора тканевого плазминогена 1.
Применение метформина в дозе 500–850 мг 2 р./сут (в зависимости от переносимости) может быть рассмотрено у лиц с предиабетом, особенно у лиц моложе 60 лет с ИМТ >30 кг/м2 [2, 25].
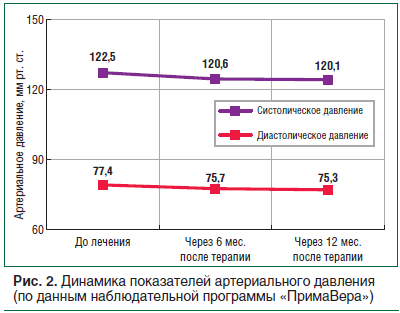
В упомянутом выше исследовании DPPOS получены данные, которые говорят о том, что среди мужчин в группе терапии метформином частота развития и выраженность атеросклероза коронарных артерий, который оценивался по индексу коронарного кальция, были достоверно ниже, чем в группе плацебо и группе ИОЖ. Причем антиатерогенный эффект метформина в этом исследовании не зависел от демографических, антропометрических или метаболических факторов, использования статинов и от того, развился ли СД2 в последующем. Такой эффект метформина может быть обусловлен не столько гипогликемическим, сколько дополнительным кардиопротективным действием [27]. Также для пациентов с предиабетом продемонстрирована эффективность метформина в снижении систолического АД (особенно у лиц с НТГ и ожирением) и уменьшении гипертрофии миокарда левого желудочка [29].
Однако, несмотря на то, что назначение метформина клинически значимо для метаболического здоровья, минимальная динамика снижения веса на его фоне (1–5 кг в год) не позволяет его использовать в качестве монотерапии пациентов с предиабетом, и рекомендовано комбинировать его с другими препаратами, зарегистрированными для снижения веса [30].
Отличительной особенностью терапии сибутраминсодержащими препаратами является положительное влияние на модификацию пищевого поведения, что способствует сохранению достигнутых результатов снижения веса. Так, показано, что через 8 мес. после отмены терапии сибутрамином 79% пациентов смогли сохранить сниженную массу тела. Сибутрамин и его метаболиты не влияют на высвобождение моноаминов, не ингибируют моноаминооксидазу, не обладают сродством к большому числу нейромедиаторных рецепторов, поэтому не способствуют развитию привыкания, лекарственной зависимости и синдрома отмены, а следовательно, сибутрамин не снижает своей терапевтической эффективности на протяжении всего курса лечения [31–33].
В нашей стране с 2011 г. выполнены 3 масштабные наблюдательные программы, посвященные проблеме ожирения, с участием почти 140 тыс. пациентов, позволившие реализовать принципы активного мониторинга эффективности и безопасности применения сибутраминсодержащих препаратов (Редуксин®, Редуксин® Мет) в реальной клинической практике и сформулировать для врачей правила обоснованного назначения данной группы лекарственных препаратов с целью снижения массы тела.
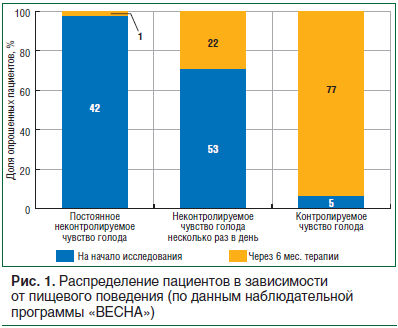
В рамках Всероссийской наблюдательной программы «ВЕСНА», которая проводилась в 2011–2012 гг. (N=34 719), было продемонстрировано, что применение комбинированного препарата сибутрамин + целлюлоза микрокристаллическая в течение 6 мес. приводит к клинически значимому снижению веса, уменьшению ОТ, что лабораторно обеспечило положительную динамику показателей липидного профиля и гликемического контроля. Шестимесячный курс приема препарата сибутрамин + целлюлоза микрокристаллическая (Редуксин®) позволил пациентам научиться контролировать объем потребляемой пищи (рис. 1), выработать правильные привычки питания, снизить калорийность суточного рациона [34].
Наблюдательная программа «ПримаВера», проведенная в 2012–2015 гг. под руководством Эндокринологического научного центра и РАЭ, ставила перед собой цель изучить эффективность и безопасность применения препарата сибутрамин + целлюлоза микрокристаллическая (Редуксин®) у большой разноплановой популяции пациентов в рамках клинической практики врачей различных специальностей. В этой программе приняли участие почти 100 тыс. пациентов, наблюдавшихся у 3095 врачей различных специальностей из 142 городов нашей страны. Среди указанной выборки 13 167 человек страдали СД2. Длительность применения препарата составила от 3 до 12 мес.
92,4% пациентов продемонстрировали снижение массы тела на 5% от исходной в течение 3 мес. лечения. Более длительная терапия в течение 12 мес. позволила добиться снижения веса более 10% у 94,2% пациентов, включая больных СД2. При тщательном анализе динамики показателей сердечно-сосудистой системы и частоты развития нежелательных явлений было показано, что длительная терапия комбинированным препаратом сибутрамин + целлюлоза микрокристаллическая характеризуется благоприятным профилем безопасности даже у пациентов с высоким риском развития побочных реакций (пациенты с СД2, МС, контролируемой артериальной гипертензией), но не имеющих противопоказаний (рис. 2). Отметим, что частота возникновения нежелательных явлений была незначительной и не превысила 3,2% [35]. Таким образом, в рамках широкомасштабного изучения применения препарата Редуксин® в рутинной клинической практике врачей различных специальностей было подтверждено, что польза от терапии превышает возможные риски [36].
В рамках терапии пациентов с различными нарушениями углеводного обмена на фоне ожирения обоснованной является комбинация сибутрамина с метформином, которая обеспечивает синергическое действие компонентов и возможность воздействия на различные аспекты нарушений углеводного обмена, способствует не только снижению массы тела (в среднем на 11,5 кг за полгода), но и улучшению показателей углеводного обмена (снижение HbA1c на 0,5%) и липидного профиля [37, 38].
Препарат Редуксин® Мет представляет собой нефиксированную комбинацию сибутрамина (капсулы, содержащие 10 мг или 15 мг) и метформина (таблетки по 850 мг) в одной упаковке и предназначен для снижения веса у пациентов с алиментарным ожирением и СД2 или предиабетом с дополнительными факторами риска развития СД2, у которых ИОЖ не привело к нормализации гликемии. Целесообразность использования препарата в комплексной терапии пациентов с СД2 изучена в рамках наблюдательной программы «АВРОРА», которая проводилась в 2016–2018 гг. и включала 5812 пациентов. Было показано, что включение препарата в терапию пациентов с СД2 и ожирением не только способствовало эффективному снижению веса, но и оказывало положительное влияние на липидный и углеводный обмен, способствуя снижению гликированного гемоглобина, достижению его целевых значений, нормализации индекса атерогенности. Данный эффект наблюдался у 50% пациентов. В целом по результатам программы «АВРОРА» был сделан вывод о том, что комбинация метформина и сибутрамина обеспечивает длительный метаболический контроль СД2, а также способствует снижению риска развития осложнений [39].
Полученные в ходе наблюдательной программы «АВРОРА» результаты, а также имеющиеся в настоящее время данные мировой литературы свидетельствуют о потенциальной клинической эффективности и безопасности применения комбинации сибутрамина с метформином для коррекции метаболических нарушений и снижения веса, особенно у пациентов с ранними нарушениями углеводного обмена, поскольку данная комбинация обладает [40]:
изученным механизмом действия компонентов;
понятным режимом дозирования, удобным способом применения;
отсутствием сведений о повышении частоты нежелательных явлений и прогнозируемыми побочными эффектами;
наличием достоверных данных об эффективности совместного применения сибутрамина и метформина у больных с факторами риска СД2 и у пациентов с МС;
комплексным многофакторным воздействием на основные звенья развития заболеваний, ассоциированных с ожирением.
В 2019 г. в России зарегистрирован препарат Редуксин® Форте, представляющий собой фиксированную комбинацию сибутрамина и метформина в одной таблетке. Подобная терапия позволит одновременно воздействовать на различные патогенетические факторы формирования и прогрессирования патологических процессов, развивающихся при ожирении, что, с одной стороны, обеспечивает интенсификацию метаболического контроля, а с другой — повышает приверженность лечению пациентов и эффективность терапии в целом, что способствует профилактике развития осложнений и неинфекционных заболеваний на фоне ожирения.
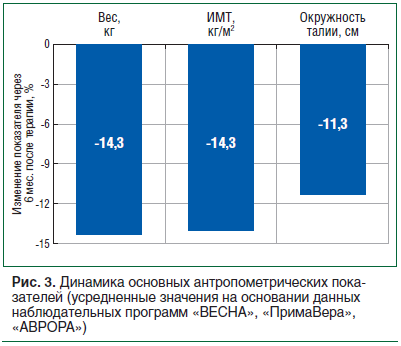
Обобщенные результаты применения сибутраминсодержащих препаратов в широкомасштабных наблюдательных исследованиях в реальной клинической практике показывают, что данная терапия позволяет достичь клинически значимого снижения веса и уменьшения ОТ у пациентов без противопоказаний вне зависимости от пола, возраста и наличия сопутствующих заболеваний. Эффективность терапии пропорциональна длительности лечения (рис. 3).
Таким образом, убедительно доказано, что применение сибутраминсодержащих препаратов у пациентов без противопоказаний к ним является эффективным и безопасным [41].
Заключение
Терапия ранних нарушений углеводного обмена сегодня стоит во главе профилактической медицины в отношении предупреждения развития СД2. Существует еще много вопросов относительно механизма патогенеза дисфункции β-клетки, парадоксального инкретинового дефекта, а также участия других систем и органов, таких как ЦНС, почки, в запуске и формировании ранних нарушений углеводного обмена. Однако сегодня совершенно ясно, что развитие предиабета имеет обратимый характер, и, понимая все компоненты и механизмы развития ранней гипергликемии, мы можем предупредить или значительно отодвинуть во времени дебют СД2. Снижение массы тела является одним из основных шагов в достижении контроля над прогрессированием ранних нарушений углеводного обмена у пациентов с ожирением. Даже небольшое уменьшение массы тела (на 5–7%) приводит к улучшению гликемических показателей, метаболических исходов и снижению сердечно-сосудистых рисков. Включение в клиническую практику препаратов, удовлетворяющих принципам превентивной и персонализированной медицины, поможет лечащему врачу повысить продолжительность и качество жизни пациентов.
Информация с rmj.ru





