Содержание статьи
Оценка антиокислительной активности различных соединений
Н. А. Аксенова*, кандидат химических наук
А. А. Акованцева**
А. Б. Соловьева*, доктор химических наук, профессор
П. С. Тимашев**, кандидат химических наук
* ФГБУН ИХФ им. Н. Н. Семенова РАН, Москва
** ФГБУН ИПЛИТ РАН, Москва
Проблема свободнорадикального окисления в последнее время привлекает внимание
ученых различных специальностей. Загрязнение окружающей среды, потребляемая пища
и различные инфекционно-воспалительные заболевания являются причинами
образования свободных радикалов в человеческом организме. Свободным радикалом
считается химическое соединение, имеющее один или более неспаренных электронов и
образованное путем потери или приобретения одного электрона. В человеческом
организме постоянно образуются свободные радикалы [1]. Например, около 5%
потребляемого тканями кислорода превращается в свободные радикалы, так
называемые активные формы кислорода (АФК). В норме клетки инактивируют АФК при
помощи антиокислительной защитной системы, однако повышение уровня АФК сверх
защитных возможностей клетки может вызвать серьезные клеточные нарушения.
Значительное усиление процессов свободнорадикального окисления, связанное с
увеличением содержания АФК, называется оксидативным стрессом [2]. При
оксидативном стрессе свободные радикалы окисляют биологические макромолекулы,
такие как ДНК, протеины, липиды, ингибируя их функциональную активность и
инициируя мутации [3]. Доказано, что оксидативный стресс является причиной
развития сердечно-сосудистых заболеваний, в том числе атеросклероза [4],
гипертонии [5], диабета [6] и ряда других, а также является одной из причин
старения.
Вещества, способные инактивировать свободные радикалы с образованием
неактивных или менее активных форм, называют антиоксидантами. Антиоксиданты
играют важную роль в регуляции протекания свободнорадикальных реакций в
организме и существенно влияют на его состояние. В исследованиях, проведенных
как in vitro, так и in vivo, было показано положительное
влияние антиоксидантов на течение различных инфекционно-воспалительных
заболеваний, доказано, что различные вещества имеют разную эффективность [7, 8].
Оценка антиокислительных свойств различных соединений является крайне актуальной
задачей, однако стандартизованного метода оценки антиокислительной активности не
существует [9]. Целью настоящей работы явилось выявление наиболее активных
антиоксидантов, позволяющих ингибировать активные формы кислорода как в водной,
так и в водно-органической средах, на модельных реакциях фотокаталитического
окисления.
Материалы и методы исследования
Препараты: dl-альфа-токоферола ацетат (DSM nutritional products, Швейцария),
аскорбиновая кислота (DSM nutritional products, Швейцария), дигидрокверцетин (Taxifolin
hydrate, Sigma-Aldrich, США), метионин (ООО «Полисинтез», Россия), таурин (ООО «Полисинтез»,
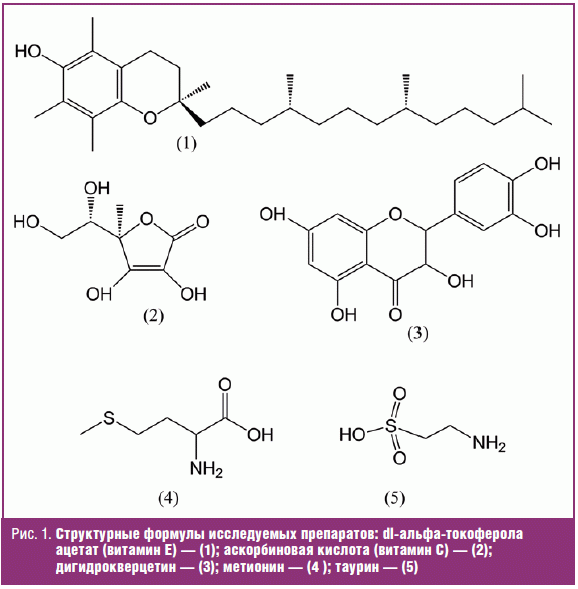
Россия). Структурные формулы исследуемых препаратов представлены на рис. 1.
Оценку антиокислительной активности соединений проводили методом, описанным
ранее [10]. В качестве фотосенсибилизатора использовали димегин (ДМГ) —
динатриевую соль 2,7,12,18-тетраметил-3,8-ди (1-метоксиэтил)-13,17-ди
(2-оксикарбонилэтил) порфирина, синтезированную в ИМБХ РАМН Г. В. Пономаревым. В
качестве субстрата использовали водный или водно-спиртовой раствор антрацена (Sigma-Aldrich,
США) или триптофана (Sigma-Aldrich, США) в отсутствие и в присутствии плюроника
в концентрации 1 × 10-5 М. Концентрация субстратов составляла 0,8–1,5
× 10-4 М, концентрация фотосенсибилизатора составила 5 × 10-6
М, исследуемые препараты вносили в концентрации от 1 × 10-5 М до 1 ×
10-3 М. Реакционную смесь обрабатывали при помощи
фототерапевтического светодиодного аппарата с длиной волны 400 нм, мощностью 210
мВт.
Результаты и обсуждение
При изучении антиокислительной активности соединений на модели фотоокисления
антрацена в этиловом спирте в присутствии плюроника были получены данные,
показывающие высокую антиокислительную активность dl-альфа-токоферола ацетата,
аскорбиновой кислоты и дигидрокверцетина. Определенные в ходе работы эффективные
константы окисления антрацена в отсутствие и в присутствии веществ показывают
снижение до двух раз константы скорости реакции окисления. Установлено, что
добавление плюроника в реакционную смесь не влияет на скорость протекания
реакции фотоокисления. Ранее было показано, что плюроник влияет на скорость
процессов фотосенсибилизированного окисления в водных растворах вследствие
встраивания ДМГ в мицеллы полимера. Можно полагать, что причина отсутствия
влияния полимера в данном случае заключается в том, что в спиртовых растворах
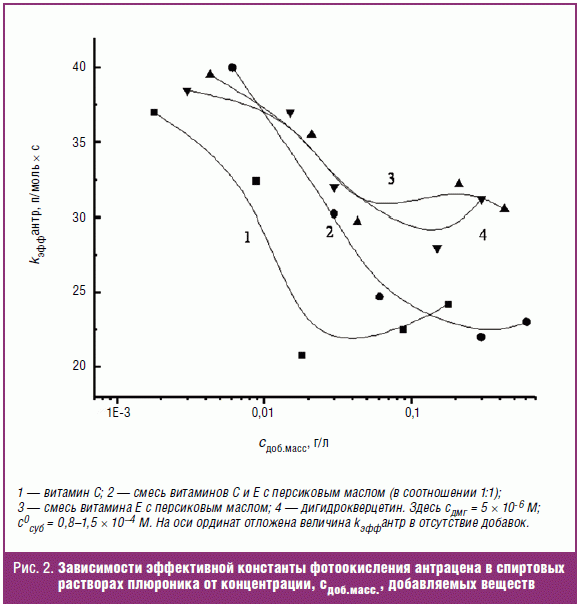
плюроник находится в виде юнимеров [11]. На рис. 2 приведены зависимости
констант скорости окисления антрацена в присутствии различных веществ в
различных концентрациях. Видно, что при концентрациях веществ выше 5 × 10-5
М наблюдается падение констант скорости окисления. При этом наибольшее падение
фиксируется при введении в реакционную среду аскорбиновой кислоты (рис. 2,
кривая 2) или ее смеси с dl-альфа-токоферола ацетатом и персиковым маслом (рис.
2, кривая 3). Сравнение полученных констант скорости фотосенсибилизированного
окисления антрацена в спирте в присутствии ДМГ (5 × 10-6 М) дает
основание считать наиболее активным антиоксидантом аскорбиновую кислоту. При
этом в случае использования смеси dl-альфа-токоферола ацетата, аскорбиновой
кислоты и персикового масла первоначально антиокислительная активность
проявляется за счет аскорбиновой кислоты, затем ингибирующее действие оказывает
смесь, содержащая dl-альфа-токоферола ацетат (витамин Е).
При изучении антиокислительной активности соединений на модели фотоокисления
триптофана в водно-спиртовом растворе в присутствии плюроника (соотношение
спирт/вода 1:1) были получены данные, показывающие высокую антиокислительную
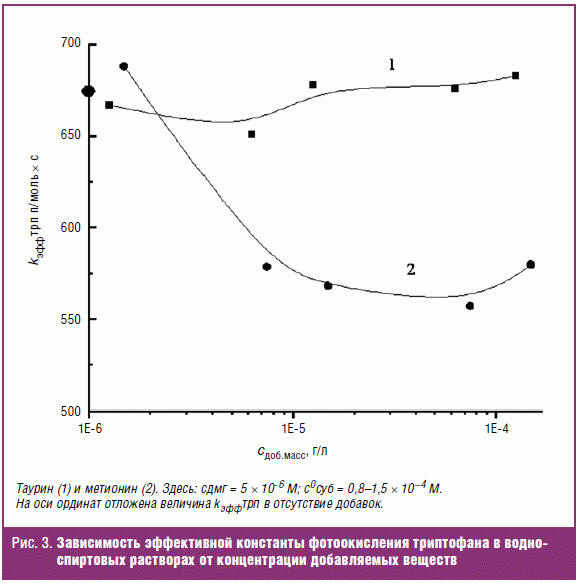
активность метионина. На рис. 3 представлена зависимость констант скорости
окисления триптофана в присутствии метионина или таурина в различных
концентрациях. При сравнении полученных данных видно, что в присутствии
метионина наблюдается снижение константы скорости фотоокисления триптофана. В то
же время таурин фактически не оказывает влияния на константу скорости процесса
фотоокисления. Выявляемую разницу в антиоксидантных свойствах метионина и
таурина можно связать с наличием в молекуле метионина реакционноспособной
тиольной группы, тогда как в состав молекулы таурина входит устойчивая к
окислению сульфогруппа. Следует отметить, что в присутствии таурина не
наблюдалось изменений ни в значениях константы kэффтрп
(рис. 3), ни в характере кинетических зависимостей. При этом наличие плюроника
также не влияло на скорость фотоокисления субстрата и вид кинетических
зависимостей для процесса фотоокисления триптофана.
Таким образом, по полученным данным можно сделать вывод о том, что
dl-альфа-токоферола ацетат (витамин Е), аскорбиновая кислота (витамин С),
дигидрокверцетин и метионин обладают антиокислительной активностью. Наиболее
выраженная антиокислительная активность обнаружена у аскорбиновой кислоты. При
анализе смеси dl-альфа-токоферола ацетата, аскорбиновой кислоты и персикового
масла первоначально антиокислительная активность проявляется за счет
аскорбиновой кислоты, затем ингибирующее действие оказывает смесь, содержащая
dl-альфа-токоферола ацетат (витамин Е) с персиковым маслом. Показано, что таурин
не обладает антиокислительной активностью на модели фотосенсибилизированного
окисления и не способен реагировать с активными формами кислорода.
Литература
-
Владимиров Ю. А. Свободные радикалы и антиоксиданты // Вестник
РАМН. 1998. № 7. С. 43–51. -
Мартинович Г. Г., Черенкевич С. Н. Окислительно-восстановительные
процессы в клетках. Минск: БГУ, 2006. 159 с. -
Aitken R. John, Krausz C. Oxidative stress, DNA damage and the Y
chromosome // Reproduction. 2001. Vol. 122. Р. 497–506. -
Morrow J. D. Quantification of isoprostanes as indices of oxidant
stress and the risk of atherosclerosis in humans // Arteriosclerosis,
thrombosis, and vascular biology. 2005. Vol. 25 (2). P. 279–286. -
Wu L. et al. Dietary approach to attenuate oxidative stress,
hypertension, and inflammation in the cardiovascular system // Proceedings of
the National Academy of Sciences of the United States of America. 2004. Vol.
101 (18). P. 7094–7099. -
Giugliano D., Ceriello A., Paolisso G. Oxidative stress and
diabetic vascular complications // Diabetes care. 1996. Vol. 19 (3). P.
257–267. -
Васильев А. Н. Оценка влияния антиоксидантов на специфическую
противовирусную активность интерферона алфьа-2 b человеческого рекомбинантного
в отношении вируса простого герпеса в культуре клеток // Антибиотики и
химиотерапия. 2010. № 7. C. 20–25. -
Васильев А. Н., Дерябин П. Г., Галегов Г. А. Противовирусная
активность антиоксидантов и их комбинаций с интерфероном альфа-2b человеческим
рекомбинантным в отношении вируса гриппа птиц А/H5N1 // Цитокины и воспаление.
2011. Т. 10. № 2. C. 32–36. -
Хасанов В. В., Рыжова Г. Л., Мальцева Е. В. Методы исследования
антиоксидантов // Химия растительного сырья. 2004. № 3. C. 63–75. -
Аксенова Н. А. и др. Особенности ингибирования реакции
фотосенсибилизированного окисления антрацена и триптофана природными
антиоксидантами // Журнал физической химии. 2013. Т. 87. № 8. С. 51. -
Кудряшова Ю. Р. Самоорганизация неионных амфифильных соединений и
их каталитический эффект в реакциях расщепления сложных эфиров и реакции
кросс-сочетания. Дисс. канд. хим. наук: 02.00.04. М-2011. 179 с.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru







