Остроконечные кондиломы: современные возможности терапии и проблема комплаенса пациентов
Содержание статьи
Введение
Проблема папилломавирусной инфекции (ПВИ), вызываемой вирусами папилломы человека (ВПЧ), представляющими собой большую гетерогенную группу вирусов, очень актуальна. Данная группа вирусов обладает онкогенными свойствами и вызывает развитие доброкачественных или злокачественных новообразований. Определенные типы папилломавирусов играют этиологическую роль в патогенезе рака шейки матки (РШМ) [1]. Около 40 генитальных типов ВПЧ обладают тропностью к слизистым оболочкам аногенитальной области. Инкубационный период ПВИ в среднем составляет 3 мес. (от 3–4 нед. до 8 мес.). ПВИ поражает от 29,1 до 44,8% населения в РФ. Многочисленные эпидемиологические, клинические и молекулярно-биологические исследования показывают ведущую роль инфицирования женщин ВПЧ в канцерогенезе шейки матки [1, 2]. Женщины с определенными вариантами генов HLA I и II класса более подвержены цервикальной интраэпителиальной неоплазии (ЦИН) и РШМ. Для элиминации вирус-инфицированных клеток из организма необходимо распознавание ВПЧ-антигенов продуктами генов основного комплекса гистосовместимости HLA I и II класса. Полиморфизм генов НLA I и II класса определяет иммунологическую чувствительность к инфицированию ВПЧ, поэтому генетическая предрасположенность может быть важна для развития ЦИН и РШМ [1–5].
В 99,7% биоптатов при РШМ (как при плоскоэпителиальных карциномах, так и при аденокарциномах) выявляли различные типы ВПЧ [3]. По данным последних эпидемиологических и вирусологических исследований, ВПЧ является причиной РШМ в 100% случаев, рака прямой кишки — в 90% случаев, рака вульвы и влагалища — в 40%, рака ротоглотки — примерно в 12%, рака ротовой полости — в 3% [3].
Возникновение остроконечных кондилом у партнера; заражение обоих партнеров одним типом вируса; крайне редкая заболеваемость у женщин, никогда не практиковавших вагинальные контакты; подтвержденная многими исследованиями прямая связь между количеством половых партнеров в течение жизни (и у мужчин, и у женщин в равной степени) и риском заражения; высокий риск заражения от нового полового партнера, страдающего данной инфекцией, — все это свидетельствует в пользу прямого пути передачи ВПЧ при половом контакте. Существуют и другие пути передачи, кроме полового, но они не имеют существенного значения [4].
В настоящее время известно, что использование презервативов не гарантирует 100% защиты, а только снижает риск передачи ВПЧ [4, 5], особенно это относится к презервативам 1-го поколения. Очевидно, что столь популярный индивидуальный метод профилактики инфекций, передающихся половым путем (ИППП), не обеспечивает выраженной защиты от вирусных инфекций (вируса простого герпеса и ВПЧ) даже при правильном и постоянном их использовании.
Среди факторов риска заражения ВПЧ на первом месте стоит ранний сексуальный дебют. Раннее начало половой жизни может быть маркером рискованного сексуального поведения и соответственно большого числа половых партнеров в течение жизни или конкурентного партнерства. Кроме того, не исключена роль биологических механизмов: инфицированию могут способствовать незрелость шейки матки, неадекватная продукция протективной цервикальной слизи и шеечная эктопия [7, 8].
В организме человека ВПЧ инфицирует базальный слой эпителия, причем наиболее сильно поражается зона трансформации многослойного плоского эпителия в цилиндрический эпителий. В инфицированной клетке ВПЧ паразитирует в доброкачественной эписомальной (вне хромосом клетки) и злокачественной интегрированной (встроенной в геном клетки) формах. По способности трансформировать эпителий слизистой шейки матки вирусы условно разделяют на низкоканцерогенные, высококанцерогенные и вирусы неустановленного канцерогенного риска [9]. К первой группе традиционно относят 6, 11, 42, 43, 44 типы, которые чаще оказывают продуктивное воздействие, результатом которого являются аногенитальные бородавки. Инфекция, вызванная ВПЧ низкого онкогенного риска, обычно протекает доброкачественно. Ко второй группе относят 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типы ВПЧ, они могут трансформировать эпителий слизистой оболочки шейки матки, вызывая ЦИН, которые могут прогрессировать в плоскоклеточную карциному и аденокарциному. Типы 30, 34, 40, 53, 54, 55, 57, 61, 62, 64, 67, 69, 70, 72, 73, 80, 82 и другие, недавно открытые, считаются вирусами невыясненного канцерогенного риска [10, 11].
Стадии ПВИ
Персистенция ВПЧ в организме (или латентное течение) — вирус существует в эписомальной форме, не вызывая патологических изменений в клетках; клинических проявлений нет; определить наличие вируса можно только с помощью молекулярно-биологических методов.
Неоплазия (дисплазия) легкой степени — ВПЧ существует в эписомальной форме: имеются изменения в структуре клетки, получившие название «койлоцитарная атипия», которая возникает в поверхностных слоях эпителия, при этом клеточное ядро принимает неправильную форму и становится гиперхромным, в цитоплазме появляются вакуоли. Поражения локализуются чаще всего в зоне трансформации шейки матки, выявляются при помощи цитологического исследования, а также при гистологическом исследовании биоптата.
Неоплазия (дисплазия) тяжелой степени — ВПЧ существует в интегрированной форме, имеются измененные атипичные клетки с увеличенным ядром, свидетельствующие о злокачественности процесса: чем больше таких клеток в образце, тем выше степень дисплазии. Поражения локализуются чаще всего в переходной зоне трансформации шейки матки и могут прогрессировать в инвазивный рак (карциному). Выявляется при цитологическом и гистологическом исследовании биоптата, полученного при кольпоскопии.
Карцинома — ВПЧ существует в интегрированной форме, при этом измененные атипичные клетки свидетельствуют о злокачественности процесса (инвазивная опухоль).
Мишенью онкогенных типов ВПЧ является зона трансформации шейки матки, где и развиваются предраковые изменения. От клеточных изменений, связанных с ПВИ (койлоцитарной атипии), до развития РШМ обычно проходит 10–40 лет, в редких случаях прогрессирование может происходить за 1–2 года. Анализ исходов ЦИН, ассоциированных с ВПЧ, показал, что при ЦИН-1 регрессия наблюдается в 57%, персистенция — в 32%, прогрессия — в 11%, а развитие инвазивного рака — только в 1% наблюдений. В то же время при ЦИН-3 малигнизация происходит более чем в 12%, а регрессия — лишь в 32% наблюдений. Прогрессирование цервикальной неоплазии зависит прежде всего от типа вируса. Наибольший удельный вес прогрессирования диспластических процессов шейки матки, ассоциированных с ВПЧ-инфекцией, наблюдается при инфицировании вирусом 16, 18, 31, 33 и 45 типов, наименьший — при инфицировании 51 и 56 типами ВПЧ [12].
Лабораторная диагностика ПВИ
Выявление нуклеиновых кислот (ДНК/РНК) ВПЧ высокого онкогенного риска методами гибридизации нуклеиновых кислот (МГНК) и/или амплификации нуклеиновых кислот (МАНК) лежит в основе молекулярно-биологического исследования. МАНК имеют большую чувствительность и позволяют обнаружить вирус в концентрациях намного меньших, чем предел обнаружения ВПЧ другими лабораторными методами, включая МГНК. Большое диагностическое значение имеют МАНК на основе полимеразной цепной реакции (ПЦР), которые позволяют не только выявлять и дифференцировать группы ВПЧ высокого и низкого канцерогенного риска, но также идентифицировать отдельные филогенетические группы и типы ВПЧ. Тест на ВПЧ обладает гораздо более высокой чувствительностью для выявления ЦИН, чем цитологическое исследование. Однако в качестве диагностического критерия неопластических процессов шейки матки этот метод непригоден. Примерно в 80% случаев инфицирование имеет кратковременный характер и заканчивается спонтанным выздоровлением и элиминацией ПВИ. Положительный результат лабораторного исследования на ДНК ВПЧ в большинстве случаев не позволяет прогнозировать развитие цервикального рака. Однако если на фоне ВПЧ-инфекции уже имеется картина дисплазии эпителия шейки матки, то этот метод можно использовать для прогнозирования неопластических процессов. Генотипирование вируса позволяет дифференцировать персистирующую инфекцию от реинфекции [12].
Одним из критериев клинически значимой инфекции, способной развиться в заболевание, является высокая вирусная нагрузка. Показатель спонтанной элиминации вируса ниже, а риск прогрессии выше в случаях ПВИ с более высокой вирусной нагрузкой. Определение вирусной нагрузки позволяет прогнозировать элиминацию ВПЧ либо прогрессирование инфекции до дисплазии. При вирусной нагрузке менее 3 логарифмов на 105 клеток риск развития дисплазии минимален, наблюдается почти 100% спонтанная регрессия. Вирусная нагрузка более 5 логарифмов на 105 клеток свидетельствует о наличии дисплазии или высоком риске ее развития, снижение вирусной нагрузки более чем на 1 логарифм за 6 мес. является динамическим маркером транзиторной инфекции [12, 13].
В настоящее время использование вирусной нагрузки как маркера риска неопластической прогрессии в клинической практике по ряду причин затруднительно. Во-первых, данный подход требует стандартного забора материала с достаточным количеством эпителиальных клеток. Во-вторых, необходимо использовать тесты, позволяющие определять истинную концентрацию вирусной ДНК и концентрацию клеток в образце. Точную количественную оценку ДНК ВПЧ можно провести только с применением метода ПЦР в реальном времени [12].
Исследования клинического материала с помощью МАНК должны проводиться с использованием коммерческих тест-систем (наборов реагентов), предназначенных для скрининга и диагностики ПВИ, апробированных в скрининговых исследованиях, прошедших процедуру государственных испытаний согласно действующему законодательству РФ и имеющих регистрационные удостоверения [12].
Клинические проявления ПВИ
Самым частым клиническим проявлением ПВИ являются остроконечные кондиломы (аногенитальные бородавки — АБ) (в 90% случаев вызываемые 6 и 11 типами ВПЧ). Пик заболеваемости наблюдается в возрасте от 18 до 28 лет и не зависит от пола.
Остроконечные кондиломы — это доброкачественные образования, вызываемые ВПЧ различных типов. Более 90% пациентов с остроконечными кондиломами инфицированы ВПЧ генотипов 6 и 11. Инфицирование высокоонкогенными типами ВПЧ 16 и 18 чаще всего вызывает субклинические поражения, связанные с интраэпителиальной неоплазией и раком вульвы, влагалища или прямой кишки [10, 12].
За последнее десятилетие заболеваемость остроконечными кондиломами резко увеличилась и на сегодняшний день составляет около 2% от числа сексуально активных людей, а при оценке с помощью ПЦР количество инфицированных ВПЧ значительно больше [14, 15].
Высокая частота ПВИ и большой риск развития ассоциированных с ней заболеваний требуют эффективных методов терапии. Медицина находится на грани глобальных перемен, достаточно консервативная система здравоохранения, ориентированная на лечение заболеваний, перестраивается и фокусируется на защите индивидуального здоровья [15].
Проблема неукоснительного выполнения назначений лечащего врача столь же стара, как и сама медицина. Ряд пациентов самовольно заменяют назначенные лекарственные препараты на иные, исходя из собственных представлений о вреде или пользе таковых для здоровья. Сотрудничество с врачом (комплаенс) — высокоиндивидуальный феномен, и принятие решения о том, выполнять предписания врача или нет, обычно требует времени. Пациент должен взвесить все доводы «за» и «против» согласно со своим стилем жизни и убеждениями о здоровье. Не только коммуникативные навыки врача, доверительные взаимоотношения с пациентом оказывают существенное влияние на комплаенс и результаты лечения, но и лекарственная форма, доступность препарата, режим приема и ряд других факторов. Персонализированная медицина подразумевает адаптацию терапевтического лечения к индивидуальным особенностям каждого пациента, чтобы выделить субпопуляции, отличающиеся по своей предрасположенности к определенному заболеванию или их ответу на конкретное лечение. При этом на основе геномных данных прогнозируют вероятность возникновения того или иного заболевания и разрабатывают профилактические индивидуальные схемы лечения [15].
Методы терапии ПВИ
Криотерапия, лазерная вапоризация, электрокоагуляция и хирургическое иссечение, используемые для лечения остроконечных кондилом, болезненны, имеют высокую стоимость, не защищают от рецидивов. Более консервативные методы терапии включают применение подофиллина, дихлоруксусной и трихлоруксусной кислоты. Эти препараты необходимо наносить не один раз в условиях клиники, кроме того, при их применении часто возникают местные воспалительные реакции: эритемы, эрозии и даже язвенные дефекты. Ни один из этих методов не обеспечивает комфортное удаление кондилом с долгосрочным эффектом и низким процентом рецидивов [16, 17].
Локальная деструкция очагов с клиническим и субклиническим проявлением ПВИ позволяет воздействовать только на участок эпителия, где произошла клиническая манифестация инфекции, при этом в окружающих тканях остается резервуар ВПЧ в латентном состоянии или в недиагностированной субклинической форме [18].
Включение интерферона-альфа в терапию ПВИ позволило надеяться на появление метода, который устранит не только клиническое проявление, но и сам вирус путем активации иммунитета или специфического антивирусного действия. Однако использование этого средства требует множественных инъекций, и хотя приводит к устранению кондилом у 36–62% без разрушения нижележащих слоев кожи, но также сопровождается высоким процентом рецидивов [19, 20]. Кроме того, это дорогостоящая терапия, которая сопровождается системными нежелательными эффектами и требует большого количества визитов в клинику.
Интерферон-альфа плохо всасывается, поэтому местное лечение неэффективно. Использование интерферонов или подофиллина не рекомендуется вследствие их низкой эффективности и токсичности [12–16].
В последние десятилетия в России появилось целое поколение иммуномодуляторов, т. е. препаратов, способных оказывать регулирующее действие на иммунную систему. Некоторые из них показали высокую эффективность в лечении самой разной патологии [17].
Например, установлено, что у больных с урогенитальными инфекциями отмечен дисбаланс цитокинового профиля, что проявляется в повышении уровня цитокинов класса Th-2 (интерлейкин 6) и снижении содержания цитокинов класса Th-1 (интерферон-γ) [22]. В компенсации этих нарушений одним из наиболее эффективных и безопасных оказался препарат инозин пранобекс.
Многоцентровое проспективное рандомизированное плацебо-контролируемое исследование показало, что у 55 пациентов обоего пола с анамнезом рефрактерных АБ в течение года четырехнедельный курс инозина пранобекса 3 г в день улучшил клинический ответ на традиционное лечение (подофиллин или трихлоруксусная кислота). Значительное улучшение по сравнению с плацебо отмечено у 82% пациентов (уменьшилось число кондилом и степень поражения), у 36% произошла полная элиминация ВПЧ [18].
В группе из 165 мужчин и женщин с остроконечными кондиломами проводили терапию инозином пранобексом, или обычное лечение (подофиллин + криотерапия), или и то и другое. Инозин пранобекс (1 г 3 р./день в течение 4 нед.) оказался более эффективным при длительных поражениях (средняя продолжительность 40 нед.), тогда как традиционное лечение было эффективно при более короткой продолжительности заболевания (12 нед.). В целом дополнение обычного лечения инозином пранобексом увеличило успешность терапии с 41 до 94% [19].
В Греции проведено рандомизированное плацебо-контролируемое исследование эффективности и безопасности инозина пранобекса (50 мг/кг ежедневно в течение 12 нед.) в лечении остроконечных кондилом, резистентных к традиционной терапии. Женщины (38) в возрасте 20–43 года получали препарат (50 мг/кг ежедневно в течение 12 нед.) или плацебо. Полное выздоровление отмечено у 24%, в то время как значительное улучшение — у 65%; терапевтическая разница у женщин, принимающих активное вещество и плацебо, была статистически значимой (χ2=6,69, P
Обзор 59 источников отечественной и зарубежной литературы, посвященных применению иммуномодулятора Изопринозин в лечении больных, инфицированных ВПЧ, а также результаты собственного опыта показали высокую распространенность ВПЧ, его роль в развитии РШМ, механизмы развития ПВИ и защиты организма-хозяина от нее. Среди медикаментозных методов воздействия особое место занимает инозин пранобекс, который относится к иммуномодуляторам с противовирусной активностью: он подавляет репликацию ДНК и РНК вирусов посредством связывания с рибосомой клетки и изменения ее стереохимического строения. ВПЧ-инфекция, особенно на ранних стадиях, успешно излечивается, вплоть до полной элиминации вируса. Инозин пранобекс обладает двойным действием и имеет наибольшую доказательную базу [20–24].
Комплексное лечение ПВИ — остроконечных кондилом у мужчин 20–30 лет с использованием иммуномодулирующего препарата Изопринозин показало эффективность в долгосрочной перспективе: рецидив заболевания спустя 8 мес. в группе больных, подвергшихся только деструктивным методам лечения, диагностировали в 32% наблюдений, в группе комбинированной терапии (деструкция + Изопринозин) — в 7%. Спектр фармакологического действия препарата (иммуностимулирующего, противовирусного), эффективность сочетания с деструктивными методами лечения позволяют считать обоснованным включение инозина пранобекса в комплексную терапию остроконечных кондилом, в т. ч. с целью профилактики рецидивов данного заболевания [24].
Комбинированная терапия, включающая деструкцию и инозин пранобекс, является международным стандартом терапии остроконечных кондилом. Согласно Европейскому курсу по заболеваниям, ассоциированным с ВПЧ, использование интерферонов, 5-фторурацила или подофиллина не рекомендуется в кабинете врача общей практики вследствие их низкой эффективности и токсичности. Применение системных иммуномодулирующих средств может быть рекомендовано при рецидивирующем течении заболевания, в случаях локализации процесса в интравагинальной, цервикальной, интраанальной и интрауретральной областях и при ВПЧ высокого онкогенного риска (16, 18 типа). Кроме того, ВПЧ нечувствителен к противовирусным препаратам, которые применяются при других вирусных инфекциях, т. к. ДНК ВПЧ кодирует небольшое количество ферментов и не имеет полимераз, киназ или протеаз, которые являются мишенями для имеющихся противовирусных средств [17, 24–28].
Применение инозина пранобекса в сочетании с радиоволновыми методами лечения заболеваний шейки матки, ассоциированных с ВПЧ, увеличивает эффективность терапии до 93,5%. Результаты клинического исследования, проведенного П.В. Будановым и соавт., продемонстрировали, что применение инозина пранобекса способствует прекращению выделения ВПЧ из очага поражения и нормализации морфологической картины экзо- и эндоцервикса, повышает эффективность деструктивных методов лечения, а также снижает частоту рецидивов. Подобные характеристики дают возможность сделать заключение, что инозин пранобекс обладает высокой эффективностью в лечении ВПЧ-инфекции у молодых женщин репродуктивного возраста [29]. Эти результаты подтверждены и работами других авторов [30].
Продолжительность лечения ВПЧ Изопринозином, применяемым в режиме монотерапии 14–28 дней по 2 таблетки 3 р./день, имеет решающее значение, т. к. соответствует естественному циклу обновления эпителия и способствует элиминации ВПЧ. При 28-дневном курсе Изопринозина обновление эпителия и элиминация вируса происходят под прикрытием медикаментозной терапии, препятствующей его распространению и дальнейшей интеграции. При 28-дневном курсе лечения элиминация вируса у 93,7% больных была отмечена в течение 6 мес. Данный подход демонстрирует необходимость активной тактики при ведении пациенток с начальными поражениями эпителия шейки матки, ассоциированными с ВПЧ [31].
Как известно, вирусные коинфекции (особенно ВПЧ) — неизбежное сопровождение ВИЧ, что и определяет медицинскую и социальную значимость этой проблемы [32]. В настоящее время Россия занимает 3-е место (после ЮАР и Нигерии) по скорости появления новых случаев ВИЧ-инфекции в единицу времени (по темпу роста).
Важно отметить, что в России среди лиц в возрасте 30–35 лет ВИЧ-инфицированы 2,5% мужчин и 1,2% женщин. В настоящее время значительно возрастает опасность инфицирования половым путем. Риск заражения от инфицированного партнера при незащищенном половом контакте является практически абсолютным. В качестве наглядного примера коинфекций приводим клиническое наблюдение.
Клиническое наблюдение
К врачу обратился 23-летний мужчина с множественными опухолевидными разрастаниями на половом члене, появившимися в течение 2–3 мес. (рис. 1 А). В анамнезе — ВИЧ-инфекция (менее 1 года) после незащищенного сексуального контакта с малознакомой женщиной. После обсуждения вариантов лечения было выбрано комбинированное лечение
Изопринозином и хирургическое иссечение опухолевидных разрастаний. По результатам гистологического исследования была диагностирована гигантская кондилома Бушке — Левенштейна (разновидность остроконечной кондиломы, отличающаяся прогрессирующим ростом и большими размерами). Перед началом терапии пациент был обследован на ИППП. Методом ПЦР выявлена хламидийная инфекция и рекомендована этиотропная терапия (доксициклина моногидрат). На повторном визите отмечена положительная динамика в разрешении процесса (рис. 1 В).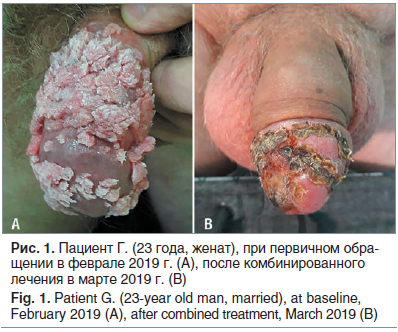
Заключение
Таким образом, использование инозина пранобекса (Изопринозин) способствует в большинстве случаев полной эрадикации ПВИ, минимизирует частоту рецидивов, а также препятствует персистенции вируса с последующей вероятностью эпителиальных трансформаций, которые имеют тяжелые онкологические последствия.
Сведения об авторах:
1Хрянин Алексей Алексеевич — д.м.н., профессор кафедры дерматовенерологии и косметологии, ORCID ID 0000-0001-9248-8303;
2Кнорринг Герман Юрьевич — к.м.н., доцент кафедры терапии, клинической фармакологии и скорой медицинской помощи, ORCID ID 0000-0003-4391-2889.
1ФГБОУ ВО НГМУ Минздрава России. 630091, Россия, г. Новосибирск, Красный проспект, д. 52.
2ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России. 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1.
Контактная информация: Хрянин Алексей Алексеевич, e-mail: khryanin@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 29.04.2019.
About the authors:
1Aleksey A. Khryanin — MD, PhD, Professor of the Department of Dermatovenerology and Cosmetology, ORCID ID 0000-0001-9248-8303;
2German Yu. Knorring — MD, PhD, associate professor of the Department of Therapy, Clinical Pharmacology, and Emergency, ORCID ID 0000-0003-4391-2889.
1Novosibirsk State Medical University. 52, Red Prospect, Novosibirsk, 630004, Russian Federation.
2A.I. Evdokimov Moscow State Medical and Dental University. 20 Build. 1, Delegatskaya str., Moscow, 127473, Russian Federation.
Contact information: Aleksey A. Khryanin, е-mail: khryanin@mail.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 29.04.2019.
Информация с rmj.ru
