Содержание статьи
Особенности клинического течения и индивидуализированный
подход к лечению пациентов с бронхиальной астмой при сочетании с ожирением
Е. Ф. Глушкова*
Т. Н. Суровенко**, доктор медицинских наук, профессор
* ФМБА ГНЦ ИИ ФМБА России, Москва
** ГОУ ВПО ТГМУ МЗ РФ, Владивосток
Метаболические нарушения и ожирение в последние десятилетия часто
сопровождают различные заболевания человека, затрагивающие несколько органов и
систем, к примеру, сахарный диабет, артериальную гипертензию, атеросклероз,
обструктивное апноэ сна и т. д. В части случаев это может быть случайным
сочетанием, но некоторые состояния могут быть прямо связаны друг с другом. К
примеру, снижение физической активности при остеоартрозе или тяжелых
заболеваниях органов дыхания может вызвать развитие метаболических нарушений
или усугубить ожирение у страдающих лиц. Довольно часто взаимовлияние ожирения
и другого заболевания является двунаправленным. К таким заболеваниям,
предположительно, и относится бронхиальная астма (БА).
Целью данного обзора является анализ взаимовлияний этих двух многофакторных
по своей природе заболеваний и возможностей терапии фенотипа бронхиальной
астмы в сочетании с ожирением.
Эпидемиология бронхиальной астмы и ожирения
БА остается на сегодняшний день одной из глобальных проблем общественного
здравоохранения, на ее лечение тратится до 10% ее ресурсов. По оценкам
Всемирной организации здравоохранения, в настоящее время около 334 млн людей в
мире страдают БА [1] и заболеваемость продолжает расти. Распространенность БА
в разных странах на сегодняшний день составляет от 3% до 15% населения. Причем
в экономически развитых государствах за последние три десятилетия число
больных с этим диагнозом возросло более чем втрое [2], при этом параллельно
растет число больных астмой в сочетании с ожирением [3].
Избыточная масса тела (МТ) и ожирение также являются широко
распространенными патологическими состояниями как в развитых, так и в
развивающихся странах. Избыточная МТ и ожирение определяются как аномальные и
излишние жировые отложения, которые могут нанести ущерб здоровью. Определение
индекса массы тела (ИМТ) — отношения веса тела в килограммах к квадрату роста
в метрах (кг/м2) — наиболее удобный для оценки ожирения и
избыточной МТ метод и поэтому широко применяется как в России, так и во все
мире.
По определению Всемирной организации здравоохранения (ВОЗ):
- ИМТ больше или равен 25 — избыточная МТ;
- ИМТ больше или равен 30 — ожирение.
По данным ВОЗ, с 1980 г. число лиц во всем мире, страдающих ожирением,
более чем удвоилось. По данным 2014 г., более 39% или 1,9 млрд взрослых людей
в возрасте 18 лет и старше (13% населения планеты) имеют избыточную МТ. Из
этого числа свыше 600 млн человек страдают от ожирения. По сравнению с
некоторыми странами, распространенность ожирения в России значительно меньше
(Мексика — 32,8%, США — 31,8%, Сирия — 31,6%, Россия — 24,9%), однако
эпидемиологические исследования показывают неуклонный рост этой патологии
также и в нашей стране [3].
Исследования последних десятилетий демонстрируют связь между ожирением или
повышенным ИМТ и БА, в частности, есть данные, что ожирение или повышение ИМТ
в раннем детском возрасте чаще, чем в общей популяции, предшествуют развитию
БА у детей и взрослых [4, 5]. Совокупные данные свидетельствуют о том, что
избыточная МТ или ожирение повышают риск развития БА, хотя вопрос, увеличивает
ли ожирение заболеваемость БА и ее тяжесть у пациентов, страдающих болезнью
ранее, остается открытым. Тем не менее, возможна и обратная связь —
недостаточный контроль БА может привести к уменьшению физической активности
больного и развитию ожирения. Некоторые исследователи показывают, что у детей
ожирение, связанное с БА, преимущественно развивается у девочек [5]. В то же
время другие исследователи показали аналогичную связь у мальчиков [6].
Возможные патогенетические взаимосвязи между БА и ожирением
Значимость влияния ожирения на течение БА может отличаться в зависимости от
пола, атопического статуса и возраста. Большинство авторов, исследующих эту
проблему, указывает на отсутствие роли атопии и эозинофильного воспаления при
сочетании БА и ожирения и выделяет этот вариант как отдельный фенотип БА [7,
8].
Одной из первых теорий, предложенных для объяснения наличия особенностей
течения БА у тучных взрослых, были избыток жировой ткани в грудной клетке и
измененная в связи с этим механика дыхания. В состоянии покоя эта
дополнительная жировая ткань оказывает давление на легкие, и при дыхании
легким приходится преодолевать дополнительное сопротивление, что и приводит к
усилению одышки и других симптомов БА. Действительно, в результате ожирения
происходит сокращение жизненной емкости легких (ЖЕЛ), уменьшаются
функциональная остаточная емкость (ФОЕЛ) и другие объемы легких [9]. Это
приводит к характерному «поверхностному» дыханию, тучные люди более склонны к
коллапсу дыхательных путей и развитию ателектазов, которые усугубляют диспноэ
и другие респираторные симптомы. Уменьшение объема легких в какой-то степени
снижает проходимость мелких бронхов и бронхиол за счет их сжатия.
Кроме того, ожирение связано с широким диапазоном сосуществующих и
сопутствующих заболеваний, которые могут повлиять на течение БА. Например,
тучные дети и взрослые имеют более высокий риск развития гастроэзофагеальной
рефлюксной болезни (ГЭРБ) [10]. ГЭРБ, по мнению многих авторов, оказывает
влияние на реактивность дыхательных путей у пациентов с БА и ее контроль, хотя
нет достаточных доказательств связи между ГЭРБ и увеличением заболеваемости БА
[11, 12].
Избыточная МТ и ожирение связаны с повышенным риском развития апноэ сна и
связанных с ним симптомов. В свою очередь, обструктивное апное сна может
привести к увеличению воспаления дыхательных путей, вызывая ухудшение и/или
стойкие симптомы БА [13, 14].
Половые гормональные различия могут частично объяснить различия в течении
БА при ожирении у мужчин и женщин. Известно, что эстрогены увеличивают
адгезию, миграцию и дегрануляцию эозинофилов, а тестостерон, напротив, снижает
[15]. Эстрогены могут стимулировать выработку интерлейкина-3 (ИЛ-3) и
интерлейкина-4 (ИЛ-4) в моноцитах. Повышенная концентрация эстрадиола может
способствовать поляризации иммунного ответа по Th2-пути, характерному для
атопической астмы, а прогестерон может усилить воспаление дыхательных путей
[16]. Клиницистами давно описан феномен менструально-связанной БА, в
результате которого некоторые симптомы БА усиливаются или проявляются
исключительно во время менструации. Ароматазы, последний фермент в каскаде,
который преобразует андрогены в эстрогены, найдены в высоких концентрациях в
жировой ткани. Их влияние способствует повышению уровня циркулирующих
эстрогенов у тучных людей, которые могут, в свою очередь, привести к
увеличению активации эозинофилов и последующему усилению воспаления
дыхательных путей и симптомов БА.
Ожирение, метаболический синдром и в определенной степени избыточная МТ
связаны с состоянием повышенного системного воспаления. Это провоспалительное
состояние теоретически может влиять и на воспаление дыхательных путей, один из
основных компонентов БА. Некоторые хемокины, продуцирующиеся адипоцитами —
адипокинами, обладают провоспалительным действием, например, ИЛ-6, эотаксин,
фактор некроза опухоли (ФНО-α), лептин, грелин и др. Другие молекулы, также
вовлеченные в патогенез воспаления при БА (трансформирующий фактор роста-β1),
не являются продуктами исключительно жировой ткани, но могут секретироваться в
значительных количествах адипоцитами [17].
Адипонектин, напротив, имеет противовоспалительные свойства. В мышиных
моделях более высокий уровень адипонектина в сыворотке снижал
гиперчувствительность и воспаление дыхательных путей [18]. Показано, что и у
городских подростков уровень адипонектина в сыворотке обратно связан с
обструкцией дыхательных путей, симптомами БА и риском обострения астмы [36].
Известно, что уровень этого адипокина снижен у тучных детей, особенно этот
эффект значим при ожирении [20].
Лептин, другой адипокин, играет не только роль в регуляции основного обмена
и чувства сытости, но и кроветворении, ангиогенезе. В мышиных моделях показано
его влияние на повышение уровня иммуноглобулина Е, реактивности и активности
воспаления дыхательных путей [21]. Оказалось, что и у человека повышенные
уровни лептина определяются при БА и ожирении, что и послужило основанием для
гипотезы влияния избытка жировой ткани на течение БА через системное
воспаление [22, 23]. Оказалось, что эпителиальные клетки дыхательных путей
экспрессируют лептин и рецепторы адипонектина. В свою очередь, лептин способен
повышать синтез и освобождение лейкотриенов из альвеолярных макрофагов, что
может в какой-то мере объяснить повышение уровня лейкотриенов при БА у тучных
людей [24]
Тем не менее, есть данные, что увеличение ИМТ ассоциируется со снижением
выдыхаемого оксида азота (FeNO) [25], отражающего активность эозинофильного
воспаления дыхательных путей. Связь между ИМТ и риском развития БА более
вероятна у неатопических, чем у атопических детей [8]. Хотя ожирение или
увеличение ИМТ ассоциируется с повышенным риском для атопии [26], ожирение
часто связано с неатопической БА. Эти данные согласуются с теорией системного
воспаления и его влияния на активность воспаления дыхательных путей. В этом
случае воспаление имеет в основном нейтрофильный характер и поэтому хуже
реагирует на лекарственные препараты, направленные на контроль БА, такие как
ингаляционные глюкокортикостероиды (иГКС), что и наблюдается у тучных больных
[27, 28].
Одним из основных метаболических эффектов ожирения является развитие
резистентности к инсулину. Инсулинорезистентность и, как следствие, увеличение
свободного инсулиноподобного фактора роста 1 (ИФР-1) глубоко затрагивают
несколько органов и систем, в том числе дыхательную. Показано, что инсулин и
ИФР-1 могут влиять на развитие бронхиальной обструкции и БА [29], повышают
пролиферацию легочных фибробластов, тем самым ускоряя ремоделирование
дыхательных путей [30].
Снижение чувствительности к инсулину может сопровождаться относительным
увеличением доли белка в рационе тучных лиц, в результате может подняться
уровень метаргинина, также как асимметричного диметиларгинина (AДМА) [30].
Повышение уровня АДМА и аналогичных молекул действует в качестве конкурентных
ингибиторов эндотелиальной синтазы оксида азота (eNOS). У здоровых людей eNOS
обеспечивает низкие уровни оксида азота (NO), который регулирует несколько
гомеостатических процессов посредством циклического гуанозинмонофосфата,
включая релаксацию дыхательных путей. Однако увеличение АДМА ингибирует eNOS,
что приводит к снижению производства NO и нарушению расслабления мускулатуры
бронхиального дерева. В дополнение к бронхиальному тонусу и реактивности, NO
также играет роль в других биологических процессах, в том числе
функционировании эндотелиальных клеток и тромбоцитов, а также иммунной
модуляции. В мышиных моделях подкожная инъекция АДМА приводит к увеличению
реактивности дыхательных путей и фиброзу дыхательных путей [31].
Таким образом, ожирение влияет на метаболизм инсулина и/или аргинина, и это
нарушение регуляции может повлиять на дыхательные пути. Инсулин и ИФР-1 могут
увеличить спазм дыхательных путей, пролиферацию фибробластов и отложение
коллагена. Инсулинорезистентность, связанная с ожирением, может привести к
снижению синтеза NO, нарушению механизмов релаксации и воспалению дыхательных
путей и, возможно, нарушению иммунной регуляции.
В последние годы активно обсуждается другой аспект патогенеза БА и участия
в нем системных механизмов — через обмен витамина D [32]. Поскольку витамин D
является липофильным, тучные люди подвергаются более высокому риску для
развития дефицита витамина D [33]. Низкий уровень витамина D у пациентов с БА
ассоциирован с повышением тяжести и снижением контроля БА, повышением частоты
тяжелых обострений, значимым снижением функции легких и увеличением
гиперреактивности дыхательных путей [34]. Как показано на группе свыше 1000
детей-астматиков, исследованных в течение четырех лет, оба фактора — низкий
уровень витамина D и избыточный вес/ожирение — связаны со снижением ответа на
иГКС, по оценке функции легких, таких как объем форсированного выдоха за 1
секунду (ОФВ1) [27]. Это говорит о независимом, но потенциально
синергетическом влиянии ожирения и недостаточности витамина D на течение БА.
Исследования влияния витамина D на течение БА продолжаются, однозначного
ответа пока нет. Результаты этих исследований будут иметь непосредственное
отношение к модификации лечения БА у тучных пациентов, которые обычно имеют
недостаточность витамина D.
Достоин внимания также вопрос генетического полиморфизма в патогенезе обоих
заболеваний и регуляции ответа на терапию. Оба патологических состояния, БА и
ожирение, являются многофакторными заболеваниями, возникающими в результате
взаимодействия генетических, экологических факторов и образа жизни. Поскольку
ожирение и БА часто сочетаются, можно предположить, что эти два заболевания
имеют некоторые общие генетические и/или эпигенетические детерминанты.
У детей исследование одиночных нуклеотидных полиморфизмов (SNPs) в гене
лептина с использованием кандидат-гена [35] и SPNs в гене протеинкиназы С-α (PRKCA)
показало, что оба были связаны с повышением ИМТ и БА [36]. Косвенным
доказательством взаимосвязи обоих состояний может служить локализация генов
для b2-адренергического рецептора (ADRB2) и глюкокортикоидов (NR3C1). Эти
рецепторы вовлечены в разные механизмы, задействованные в том числе в
патогенезе БА и ожирения, и они оба расположены на хромосоме 5 q.
Полиморфизм гена для рецептора к фракталкину (CX3CR1) также связывают с БА,
атопией и ожирением [37, 38]. Трансмембранный белок фракталкин относится к
хемокинам, участвующим в патогенезе системного воспаления.
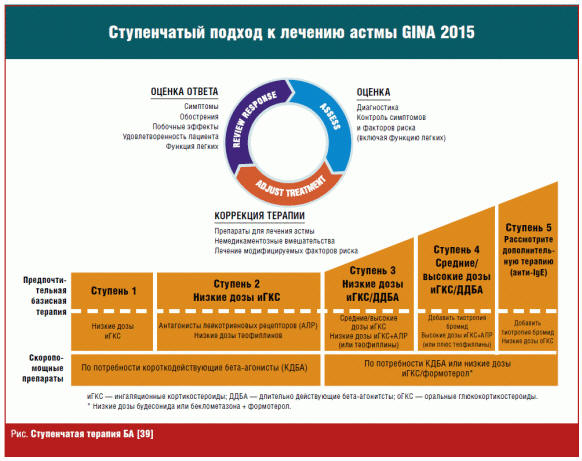
Модификация лечения у пациентов с фенотипом сочетания БА и ожирения
Международные эксперты Глобальной инициативы по бронхиальной астме (Global
Initiative for Asthma, GINA) определяют главными целями лечения БА контроль
симптомов и минимизацию рисков. Это в большой степени достигается путем
снижения активности воспаления дыхательных путей. иГКС являются одними из
наиболее эффективных противовоспалительных препаратов для лечения БА и
рекомендуются экспертами GINA как препараты первого выбора для достижения этих
целей начиная со второй ступени лечения и как дополнительная возможность
лучшего контроля — на первой ступени [39].
иГКС, по мнению экспертов, должны быть препаратами первого выбора также для
лечения пациентов с фенотипом БА при сочетании с ожирением. Однако ряд
исследований показывают снижение ответа на иГКС как тучных взрослых [28, 40,
41], так и детей с БА [27] при сохранении адекватного ответа на системные
противовоспалительные препараты, такие как системные кортикостероиды и
антилейкотриеновые препараты [28].
Это явление можно частично объяснить снижением значимости эозинофильного
воспаления дыхательных путей или влиянием системного воспаления у тучных
пациентов с БА, как обсуждалось ранее. Ингаляционные препараты, чьи эффекты
ограничены дыхательными путями, не будут эффективными в борьбе с системным
воспалением, как системные глюкокортикостероиды (сГКС). Кроме этого, системное
воспаление способствует прогрессированию ожирения у пациентов, страдающих
стероидрезистентной БА.
Глюкокортикоидный рецептор имеет две основные изоформы. β-изоформа (GRβ)
значимо тормозит активные альфа изоформы (GRα), блокируя активацию
глюкокортикоид-активных генов. β-изоформа связана с
глюкокортикоид-резистентностью, а цитокины, ассоциированные с воспалением и
ожирением, такие как ФНО-а и ИЛ-6. регулируют экспрессию рецептора
глюкокортикостероидов (ГКС) и накопление GRβ.
Возможные общие генетические полиморфизмы генов при БА и ожирении могут
также влиять на ответ на ГКС, как в случае с CX3CR1-геном фракталкин рецептора
[38]. Кроме того, рекомендуемые в общей группе пациентов с БА дозы иГКС могут
быть недостаточны при коморбидности с ожирением.
В последние годы показано, что фенотип БА в сочетании с ожирением
ассоциирован с особым типом воспаления в дыхательных путях — лейкотриеновым,
обусловленным повышением синтеза цистеиновых лейкотриенов [42]. Наблюдающийся
при БА и ожирении повышенный их синтез может быть отражением системного
воспаления и частично объясняет эффективность антилейкотриеновых препаратов в
этом случае [28]. Причем этот эффект сохраняется и при наблюдающемся при
сочетании БА и ожирении нейтрофильном воспалении дыхательных путей.
Теоретическое обоснование такой терапии было получено в последних
исследованиях влияния лейкотриенов на нейтрофилы. Была показана чрезвычайная
чувствительность нейтрофилов к подавляющим эффектам антагонистов cysLTR1.
Нейтрофилы не продуцируют лейкотриены, но экспрессируют рецепторы cysLTR1,
хотя и в меньшем количестве, чем другие типы клеток (эозинофилы, моноциты;
тучные клетки). Взаимодействие с этими рецепторами обеспечивает возможности
лейкотриенов повышать чувствительность нейтрофилов к хемоатрактантам и тем
вызывать прогрессирование нейтрофильного воспаления в дыхательных путях [43].
Другой недавно открытый механизм действия антилейкотриеновых препаратов на
активность нейтрофильного воспаления связан с вторичным CysLTR1-независимым
противовоспалительным эффектом, обусловленным, главным образом, действием на
клетки врожденной иммунной системы — нейтрофилов и моноцитов/макрофагов [44].
Поэтому дополнительное или, в некоторых случаях, назначение ингибиторов
антилейкотриеновых рецепторов в монотерапии при таком фенотипе БА может иметь
преимущества в связи с их общим иммуномодулирующим и противовоспалительным
действием и влиянием как на эозинофильный, так и нейтрофильный тип воспаления
дыхательных путей [44]. Именно поэтому монтелукаст эффективен как при БА в
сочетании с аллергическим ринитом [45, 46], так и при неастматическом
эозинофильном бронхите [47], обструктивном апноэ сна [48] и других состояниях
с системным воспалением.
Позитивное влияние антилейкотриеновых препаратов на течение атеросклероза,
который характеризуется, подобно ожирению, развитием системного воспаления и
часто ему сопутствует, показано в эксперименте [49]. Поэтому, к примеру, один
из представителей этого класса препаратов — монтелукаст предлагается как
дополнительная к иГКС терапия у пациентов с БА старшего возраста [50]. Такой
подход улучшает приверженность пожилых людей к лечению БА.
Как показано в исследовании генетического полиморфизма генов более 200
генов-кандидатов, наибольшая эффективность монтелукаста в контроле астмы
наблюдалась у носителей гена rs6475448. Дальнейшее изучение генетического
контроля ответа на фармакологические воздействия может быть платформой для
разработки персонифицированного лечения [51].
Препараты монтелукаста доступны в России как оригинальный препарат Сингуляр
(MSD), так и дженерики, причем для воспроизведенного препарата монтелукаста
Монтелар (Сандоз) показана биэквивалентность оригинальному препарату [52].
Как считают эксперты GINA, при таком фенотипе астмы снижение веса тела
должно быть обязательно включено в план лечения, причем позитивный эффект на
контроль БА и улучшение качества жизни могут быть получены даже при его
небольшом снижении на 5–10% [53]. Добиться позитивного эффекта потери веса и
улучшения контроля БА при неэффективности консервативной терапии позволяет
бариатрическая хирургия, к примеру, широко применяемая в Европе методика
установки внутрижелудочного баллона или другие хирургические методы [54, 55].
Кроме иГКС и антагонистов лейкотриеновых рецепторов для контроля симптомов
БА в сочетании с ожирением могут использоваться и другие лекарственные
средства: ингаляционные β2-агонисты длительного действия (БАДД) в комбинации с
иГКС с третьей ступени терапии, теофиллины замедленного высвобождения,
системные ГКС (пятая ступень терапии) и др. С 2015 г. экспертами рекомендовано
применение для контроля симптомов астмы антихолинергического препарата (АХП)
24-часового действия — тиотропия бромида, если не достигнут достаточный
уровень контроля при применении комбинированной терапии БАДД + иГКС.
Несколько исследований показали, что среди больных астмой лучше всего
отвечают на АХП пожилые больные, больные с ночной астмой, больные с
фиксированной бронхиальной обструкцией и больные с неатопической бронхиальной
астмой [56–58]. Таким образом, больные с тяжелой неэозинофильной астмой,
которую сегодня многие эксперты выделяют как отдельную форму заболевания,
патогенетически связанную с активацией нейтрофилов [59, 60], могут быть
рассмотрены как кандидаты на терапию тиотропием. Именно такой тип воспаления
преобладает при сочетании БА и ожирения.
Для разработки индивидуализированных схем терапии БА у пациентов с
ожирением нужны исследования всех возможных механизмов взаимовлияния этих двух
состояний и обсуждение клинической эффективности различных терапевтических
тактик. Именно поэтому в последние годы анализируются многие аспекты этой
проблемы [61–63]. Но уже сейчас ясно, что новые терапевтические подходы
необходимы для «тучной астмы».
Такие подходы могут включать новые и безопасные методы лечения как
дыхательных путей, так и системного воспаления и, одновременно, агрессивного
лечения ожирения. Поэтому так важно в лечении пациентов с БА и коморбидными
состояниями взаимодействие специалистов разных специальностей.
Литература
- World Health Organization. Global surveillance, prevention and control
of chronicrespiratory Diseases: A comprehensive approach, 2007. -
Mannino D. M. Surveillance for asthma // United States,
1988–1999. MMWR Morb. Mortal. Wkly Rep. 2002. V. 51. P. 1–13. -
Ford E. S. The epidemiology of obesity and asthma // Journal of
Allergy and Clinical Immunology. 2005. V. 115. Р. 897–909. -
Flaherman V., Rutherford G. W. A meta-analysis of the affect of
hight weight on asthma // Arch Dis Child. 2006, 91 (4): P. 334–339. -
Guh D. P., Zhang W., Bansback N. et al. The incidence of
co-morbidities related to obesity and overweight: a systematic review and
meta-analysis // BMC Public Health. 2009; 9: 88. -
Mannino D. M., Mott J., Ferdinands J. M. et al. Boys with high
body masses have an increased risk of Developing asthma: findings from the
National Longitudinal Survey of Youth (NLSY) // Int J Obesity. 2006; 30 (1).
P. 6–13. -
Telenga E. D., Tideman S. W., Kerstiens H. A. et al. Obesity in
asthma: more neutrophilic inflammation as a possible explanation for a
reduced treatment response // Allergy. 2012. 67 (8), P. 1060–1068. -
Visness C. M., London S. J., Daniels J. L. et al. Association
of childhood obesity with atopic and nonatopic asthma: results from the
National Health and Nutrition Examination Survey 1999–2006 // J Asthma.
2010. 47 (7). P. 822–829. -
Collins L. C., Hoberty P. D., Walker J. F., Fletcher E. C., Peiris
A. N. The effect of body fat Distribution on pulmonary function tests
// Chest. 1995; 107 (5). P. 1298–1302. -
Jacobson B. C., Somers S. C., Fuchs C. S. et al. Body-mass
index and symptoms of gastroesophageal reflux in women // N Engl J Med.
2006; 354 (22). P. 2340–2348. -
Hancox R. J., Poulton R., Taylor D. R. et al. Associations
between respiratory symptoms, lung function and gastro-oesophageal reflux
symptoms in a population-based birth cohort // Respir Res. 2006; 7. P. 142. -
Shirai T., Mikamo M., Shishido Y. et a1. Impaired cough-related
quality of life in patients with controlled asthma with gastroesophageal
reflux Disease // Ann Allergy Asthma Immunol. 2012; 108 (5). P. 379–380. -
Teodorescu M., Polomis D. A., Hall S. V. et al. Association of
obstructive sleep apnea risk with asthma control in adults // Chest. 2010;
138 (3). P. 543–550. -
Verhulst S. L., Aerts L., Jacobs et al. Sleep-disordered
breathing, obesity, and airway inflammation in children and adolescents //
Chest. 2008; 134 (6). P. 1169–1175. -
Hamano N., Terada N., Maesako K. et al. Effect of sex hormones
on eosinophilic inflammation in nasal mucosa // Allergy Asthma Proc. 1998;
19 (5). P. 263–269. -
Tam A., Morrish D., Wadsworth S. et al. The role of female
hormones on lung function in chronic lung Diseases // BMC Womens Health.
2011. P. 11: 24. -
Alessi M. C., Bastelica D., Morange P. et al. Plasminogen
activator inhibitor 1, transforming growth factor-beta l, and BMI are
closely associated in human adipose tissue During morbid obesity // Diabetes.
2000; 49 (8). P. 1374–1380. -
Shore S. A., Terry R. D., Flynt L., Xu A. Hug. C-Adiponectin
attenuates allergen-induced alrway inflammation and hyperresponsivеness in
mice // J Allergy Clin Immunol. 2006; 118 (2). P. 389–395. -
Kattan M., Kumar R., Bloomberg G. R. et al. Asthma control,
adiposity, and adipokines among inner-city adolescents // J Allergy Clin
Immunol. 2010; 125 (3). P. 584–592. -
Ochiai H., Shirasawa T., Nishimura R. et al.
High-molecular-weight adiponectin and anthropometric variables among
elementary school-children: a population-based cross-sectional study in
Japan // BMC Pediatr. 2012; 12 (1). P. 139. -
Johnston R. A., Zhu M., Rivera-Sanchez Y. M. et al. Allergic
airway responses in obese mice // Am J Respir Crit Care Med. 2007; 176 (7).
P. 650–658. -
Sutherland T. J., Sears M. R., McLachlan C. R. et al. Leptin,
adiponectin, and asthma: findings from a population-based cohort study //
Ann Allergy Asthma Immunol. 2009; 103 (2). P. 101–107. -
Sutherland T. J., Cowan J. O., Young S. et al. The association
between obesity and asthma: interactions between systemic and airway
inflammation // Am J Respir Crit Care Med. 2008; 178 (5). P. 469–475. -
Mancuso P. et al. Leptin augments alveolar macrophage
leukotriene synthesis by increasing phospholipase activity and enhancing
group IVC iPLA2 (cPLA2 gamma) protein expression // Am. J. Physiol. Lung
Cell Mol. Physiol. 2004. Vol. 287. P. 497–502. -
Komakula S., Khatri S., Mermis J. et al. Body mass index is
associated with reduced exhaled nitric oxide and higher exhaled
8-isoprostanes in asthmatics // Respir Res. 2007; 8. P. 32. -
Hancox R. J., Milne B. J., Poulton R. et al. Sex Differences in
the relation between body mass index and asthma and atopy in a birtch cohort
// Am J Respir Crit Care Med. 2005; 171 (5). P. 440–445. -
Porno E., Lescher R., Strunk R. et al. Decreased response to
inhaled steroids in overweight and obese asthmatic children // J Allergy
Clin Immunol. 2011; 127 (3). P. 74 l-749. -
Peters-Golden M., Swern A., Bird S. S. et al. Influence of body
mass index on the response to asthma controller agents // Eur Respir J.
2006; 27 (3). P. 495–503. -
Dekkers B. G., Schaafsma D., Tran T. et al. Insulin-induced
laminin expression promotes a hypercontractile airway smooth muscle
phenotype // Am J Respir Cell Mol Biol. 2009; 41 (4). P. 494–504. -
Agrawal A., Mabalirajan U., Ahmad T., Ghosh B. Emerging
interface between metabolic syndrome and asthma // Am J Respir Cell Mol Biol.
2011; 44 (3). P. 270–275. -
Wells S. M., Buford M. C., Migliaccio C. T., Holian A. Elevated
asymmetric Dimethylarginine alters lung function and induces collagen
Deposition in mice // Am J Respir Cell Mol Biol. 2009; 40 (2). P. 179–188. -
Paul G., Brehm J. M., Alcorn J. F. et al. Vitamin D and asthma
// Am J Respir Crit Care Med. 2012; 185 (2). P. 124–132. -
Alemzadeh R., Kichler J., Babar G., Calhoun M. Hypovitaminosis
D in obese children and adolescents: relationship with adiposity, insulin
sensitivity, ethnicity, and season // Metabolizm. 2008; 57 (2). P. 183–191. -
Brehm J. M., Acosta-Perez E., Klei L. et al. Vitamin D
insufficiency and severe asthma exacerbations in Puerto Rican children // Am
J Respir Crit Care Med. 2012; 186 (2). P. 140–146. -
Szczepankiewicz A., Breborowicz A., Sobkowiak P., Popiel A. Are
genes associated with energy metabolism important in asthma and BMI? // J
Asthma. 2009; 46 (1). P. 53. -
Murphy A., Tantisira K. G., Soto-Quiros M. E. et al. PRKCA: a
positional candidate gene for body mass index and asthma // Am J Human Genet.
2009; 85 (1). P. 87–96. -
Sirois-Gagnon D., Chamberland A., Perron S. et al. Association
of common pоlymorphisms in the fractalkine receptor (CXBCRl) with Obesity //
Obesity. 2011; 19 (1). P. 222–227. -
Tremblay K., Lemire M., Provost et al. Association study
between the CX3 CR1 gene and asthma // Genes Immun. 2006; 7 (8). P. 632–639. - Global Initiative for Asthma (GINA) Executive Committee, Global Strategy
for Asthma Management and Prevention. GINA 2015. www. ginasthma. com. -
Sutherland E. R., Camargo C. A. Jr., Busse W. et al.
Comparative effect of body mass index on response to asthma controller
therapy // Allergy Asthma Proc. 2010; 31 (1) P. 20–25. -
Sutherland E. R., Goleva E., Strand M. et al. Body mass and
glucocorticoid response in asthma // Am J Respir Crit Care Med 2008; 178. P.
682–687. -
Giouleka P., Papatheodorou G., Lyberopoulos P. et al. Body mass
index is associated with leukotriene inflammation in asthmatics // Eur J
Clin Invest. 2011; 41. P. 30–38. -
Teron A. J., Gravett C. M., Steel H. C. et al. Leukotrienes C4
and D4 sensitize human neutrophils for hyperreactivity to chemoattractants
// In ammation Research. 2009, vol. 58, № 5. P. 263–268. -
Theron A. J., Steel H. C., Tintinger G. R. et al. Cysteinyl
Leukotriene Receptor-1 Antagonists as Modulators of Innate Immune Cell
Function // Journal of Immunology Research. 2014, Article ID 608930, 16
pages. -
Grainger J., Drake-Lee A. Montelukast in allergic rhinitis: a
systematic review and meta-analysis // Clinical Otolaryngology. 2006. Vol.
31, № 5, P. 360–367. -
Liu M., Yokomizo T. The role of leukotrienes in allergic
Diseases // Allergology International. 2015, v. 64. P. 17–26. -
Bao W., Liu P., Qiu Z. et al. Efficacy of Add-on Montelukast in
Nonasthmatic Eosinophilic Bronchitis: The Additive Effect on Airway
Infflammation, Cough and Life Quality // Chin Med J. 2015; 128. P. 39-45. -
Goldbart A. D., Greenberg-Dotan S., Tal A. Montelukast for
children with obstructive sleep apnea: a Double-blind, placebo-controlled
study // Pediatrics. 2012 Sep; 130 (3). P. 575–580. -
Gennaro A., Haeggstrom J. Z. The leukotrienes:
immune-modulating lipid mediators of Disease // Advances in Immunology.
2012. vol. 116. P. 51–92, -
Scichilone N., Battaglia S., Benfante A., Bellia V. Safety and
efficiency of montelukast as adjunctive therapy for treatment of asthma in
elderly patients // Clinical Interventions in Aging. 2013, vol. 8. P.
1329–1337. -
Dahlin A., Litonjua A., Lima J. J. et al. Genome-Wide
Association Study Identifies Novel Pharmacogenomic Loci For Therapeutic
Response to Montelukast in Asthma // PLoS ONE. 2015, 10 (6). -
Fey C., Thyroff-Friesinger U., Jones S. Bioequivalence of two
formulations of montelukast sodium 4 mg oral granules in healthy adults //
Clinical and Translational Allergy. 2014. 4. P. 29. -
Scott H. A., Gibson P. G., Garg M. L. et al. Dietary
restriction and exercise improve airway inflammation and clinical outcomes
in overweight and obese asthma: a randomized trial // Clin Exp Allergy.
2013; 43. P. 36–49. -
Dixon A. E., Pratley R. E., Forgione P. M. et al. Effects of
obesity and bariatric surgery on airway hyperresponsiveness, asthma control,
and inflammation // J Allergy Clin Immunol. 2011; 128:508–15 P. 1–2. -
Boulet L. P., Turcotte H., Martin J., Poirier P. Effect of
bariatric surgery on airway response and lung function in obese subjects
with asthma // Respir Med. 2012; 106. P. 651–660. -
Gross N. J. Anticholinergic agents in asthma and COPD // Eur J
Pharmacol. 2006; 533. P. 36–39. -
Княжеская Н. П. Место пролонгированных холинолитиков при
бронхиальнои астме // Справочник клинического врача. 2010; № 11, с. 32–36. -
Kerstjens H. et al. Tiotropium in Asthma Poorly Controlled with
Standard Combination Therapy // The New England journal of medicine. 2012;
367. P. 1198–207. -
Haldar P., Pavord I. D. Noneosinophilic asthma: a Distinct
clinical and pathologic phenotype // J Allergy Clin Immunol. 2007; 119. P.
1043–1052. -
Iwamoto H., Yokoyama A., Shiota N. et al. Tiotropium bromide is
effective for severe asthma with noneosinophilic phenotype // Eur Respir J.
2008; 31. P. 1379–1380. -
Минеев В. Н., Лалаева Т. М., Васильева Т. С., Трофимов В. И.
Фенотип бронхиальной астмы с ожирением // Пульмонология. 2012, 2, с.
102–107. -
Астафьева Н. Г., Гамова И. В., Удовиченко Е. Н., Перфилова И. А.
Ожирение и бронхиальная астма // Лечащий Врач. 2014, № 4, 5. -
Новикова В. П., Эглит А. Э. Бронхиальная астма и ожирение у
детеи? // Вопросы детской диетологии, 2014, т. 12, № 3, с. 46–51.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru