Введение
Внутриматочная патология в настоящее время является одной из ведущих причин женского бесплодия, ее частота варьирует, по данным разных авторов, от 35 до 41% [1]. В большинстве случаев требуется оперативное лечение, сопровождающееся вскрытием полости матки и повреждением базального слоя эндометрия, что может привести к образованию внутриматочных синехий.
Известно, что основным патогенетическим звеном спайкообразования является травма базального слоя эндометрия [2–4]. Ишемия подлежащих тканей, наличие крови, инфекционных агентов и инородных тел в полости матки — все это приводит к нарушению физиологического фибринолиза и формированию фибриновых сращений между маточными стенками. Этот процесс протекает преимущественно в течение первых 3–5 дней после операции, что и создает условия для формирования синехий [5, 6].
Как в отечественной, так и в зарубежной литературе имеются сообщения о высокой эффективности противоспаечных барьеров в профилактике синдрома Ашермана. Согласно клиническим рекомендациям Американской ассоциации лапароскопических хирургов и гинекологов (American Association of Laparoscopic Surgeons and Gynecologists), а также Королевского колледжа акушерства и гинекологии Великобритании (Royal College of Obstetrics and Gynecology) антиадгезивные гели следует применять после проведения любых внутриматочных вмешательств [7].
Наиболее эффективными противоспаечными барьерами признаны гели на основе натуральной гиалуроновой кислоты [6, 8]. Широкое применение в последние годы приобрели противоспаечные гели на основе солей гиалуроновой кислоты и карбоксиметилцеллюлозы, механизм действия которых реализуется путем формирования механического барьера на поврежденных участках эндометрия только на период критической фазы раневого заживления. Карбоксиметилцеллюлоза, входящая в состав геля, обладает стабилизирующими, эмульгирующими и смягчающими свойствами, не оказывает токсического и канцерогенного эффектов и пролонгирует действие гиалуроновой кислоты на поверхности ткани. Соприкосновение геля с раневой поверхностью ингибирует адгезию фибробластов и тромбоцитов, подавляет активность макрофагов, тем самым инициируя регенеративные процессы [2, 6]. Гель на основе гиалуроновой кислоты не растекается, хорошо фиксируется на раневой поверхности и является абсорбируемым макромолекулярным комплексом. За счет биодеградируемых свойств, короткого времени полураспада, хорошей гистосовместимости и всасываемости гель полностью элиминируется после применения.
По данным опубликованного в 2020 г. клинического рандомизированного контролируемого исследования, включившего 625 пациенток, подтверждена эффективность противоспаечных гелей на основе гиалуроновой кислоты. Введение геля в полость матки после выкидыша значительно снижало частоту возникновения умеренных и тяжелых внутриматочных сращений (р=0,0008) и значительно увеличивало частоту наступления беременности после выкидыша (р<0,0001) [9]. В отечественной гинекологической практике наиболее эффективным противоспаечным барьером признан биодеградируемый гель на основе высокоочищенной натриевой соли гиалуроновой кислоты и карбоксиметилцеллюлозы — Антиадгезин® [10].
Цель исследования: определить эффективность противоспаечного геля на основе гиалуроновой кислоты в комплексной терапии маточного фактора бесплодия.
Материал и методы
Проведено ретроспективное исследование. За период с 2018 по 2021 г. были проанализированы данные 95 пациенток с наиболее часто встречающимися в клинической практике внутриматочными патологиями: гиперпластическими процессами эндометрия (полипы и гиперплазия) у 48, внутриматочными синехиями (2-я степень — с вовлечением от ¼ до ¾ объема полости матки) — у 21, единичной субмукозной миомой (1–2-й тип по классификации Международной федерации гинекологии и акушерства — The International Federation of Gynecology and Obstetrics, FIGO; d≤2,0 см) — у 13, внутриматочной перегородкой (не более двух, без смыкания полости матки) — у 13.
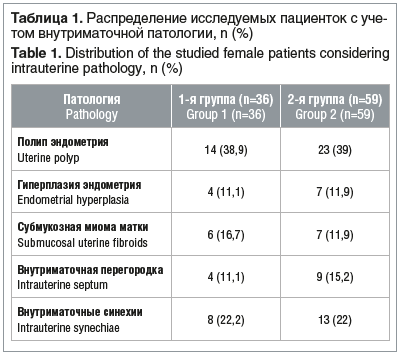
Распределение пациенток с учетом нозологии представлено в таблице 1.
Критерии включения: репродуктивный возраст, отсутствие мужского, трубно-перитонеального и иммунного бесплодия, готовность к реализации репродуктивной функции в течение 24 мес. после операции.
Пациентки были разделены на 2 группы: в 1-й группе интраоперационно в полость матки вводили 3 г (1 шприц Антиадгезин) противоспаечного геля на основе гиалуроновой кислоты (n=36), во 2-й группе (n=59) противоспаечный гель не вводили.
Всем пациенткам было проведено хирургическое лечение согласно общепринятым рекомендациям: гистероскопия, раздельное лечебно-диагностическое выскабливание полости матки и цервикального канала. Пациенткам с внутриматочными синехиями и перегородками при помощи петли гистерорезектоскопа проводилось рассечение внутриматочных сращений и внутриматочных перегородок, диагноз верифицирован при гистологическом исследовании. С учетом нозологии проведено соответствующее консервативное лечение.
Через 3 мес. после оперативного лечения проводилось трансвагинальное ультразвуковое исследование (УЗИ) в раннюю пролиферативную (5–7-й день) и среднюю лютеиновую (19–23-й день) фазы менструального цикла с оценкой эхоструктуры и толщины эндометрия (М-ЭХО). УЗИ проводилось на аппарате Voluson E6 с использованием внутриполостного датчика IC5-9-D (4–9 МГц).
Оценивали частоту наступления беременности через 12 и 24 мес. после проведения комплексного лечения.
Статистическая обработка полученных данных выполнялась с использованием программного обеспечения IBM® SPSS® Statistics 23.0.0.0. Количественные показатели сравниваемых групп представлены как средние отклонения (М±SD). Статистически значимым для всех видов анализа считали р≤0,05.
Результаты и обсуждение
Все пациентки находились в возрастном диапазоне от 23 до 39 лет. Средний возраст в 1-й группе составил 32,1±3,8 года, во 2-й группе — 31,1±4,1 года (p>0,05).
При детализации репродуктивного анамнеза мы не выявили никаких различий между исследуемыми группами. В анамнезе пациенток обеих групп указывалось на наличие первичного и вторичного бесплодия. В 1-й группе первичное бесплодие выявлено у 14 (38,9%) пациенток: с полипом эндометрия — у 2 (5,5%), с гиперплазией эндометрия — у 2 (5,5%), с субмукозной миомой матки — у 6 (16,7%), с внутриматочной перегородкой — у 4 (11,1%); во 2-й группе первичное бесплодие выявлено у 28 (47,4%) пациенток: с полипом эндометрия — у 10 (16,9%), с гиперплазией эндометрия — у 2 (3,3%), с субмукозной мио-мой матки — у 7 (11,9%), с внутриматочной перегородкой — у 9 (15,2%). Вторичное бесплодие выявлено у 22 (61,1%) обследованных 1-й группы: полип эндометрия — у 12 (33,3%), гиперплазия эндометрия — у 2 (5,5%), внутриматочная перегородка — у 8 (22,2%); и у 31 (52,5%) пациентки 2-й группы: полип эндометрия — у 13 (22,0%), гиперплазия эндометрия — у 5 (8,4%), внутриматочные синехии — у 13 (22,0%).
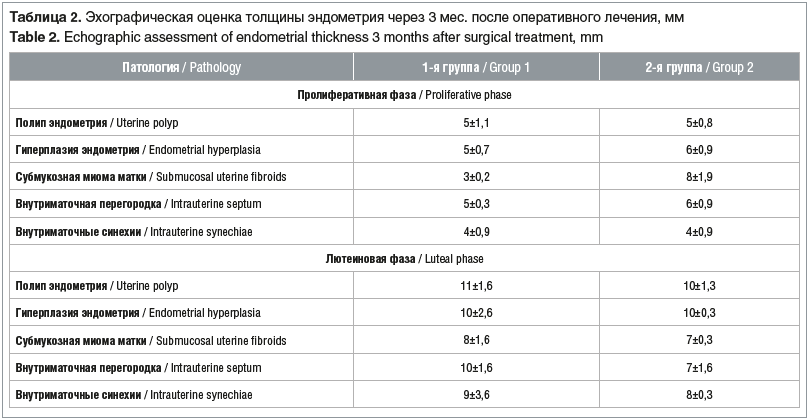
Эхографическая оценка эндометрия в 1-й группе в фазу ранней пролиферации показала нормальные значения у большинства наблюдаемых — 30 (83,3%): эндометрий характеризовался низкой эхогенностью, между двумя гипоэхогенными слоями функциональной слизистой визуализировалась тонкая гиперэхогенная полоска, представляющая границу соприкосновения слизистой передней и задней стенок матки.
Среднее значение М-ЭХО составило 5±1,1 мм. Изменения в виде неровности линии смыкания переднего и зад-него функциональных слоев эндометрия определены на 6 (16,7%) эхограммах — у пациенток после перенесенной гистерорезектоскопии субмукозных миоматозных узлов, М-ЭХО составило 3±0,2 мм.
В среднюю лютеиновую фазу в 1-й группе УЗ-картина эндометрия в большинстве (30 (83,3%)) наблюдений оценивалась как физиологическая: визуализировался эндометрий средней эхогенности с нечеткой гиперэхогенной линией в центре; М-ЭХО варьировало от 9 до 13 мм, составляя в среднем 10±3,6 мм. В 6 (16,7%) наблюдениях выявлено снижение толщины эндометрия, М-ЭХО составило 7±1,6 мм, однако эхогенность эндометрия оставалась однородной на всем протяжении.
Следует отметить, что в 1-й группе мы не выявили эхографических признаков внутриматочных сращений даже среди тех, у кого в анамнезе отмечались внутриматочные синехии и перегородки, что указывало на высокий противорецидивный эффект противоспаечного барьера.
Стандартное трансвагинальное УЗИ во 2-й группе на 5–7-й день менструального цикла не выявило патологических изменений на 16 (27,1%) эхограммах. Однородность и толщина эндометрия находились в пределах референтных значений, М-ЭХО составило 5±0,8 мм. На 15 (25,4%) эхограммах визуализировались единичные гиперэхогенные включения в проекции базального слоя, толщина эндометрия оставалась нормальной (М-ЭХО 6±0,9 мм). Утолщение эндометрия в сочетании с неровным контуром, множественные гиперэхогенные включения в проекции базального слоя эндометрия, дающие эффект «эхогенного ободка», определены у 28 (47,5%) наблюдаемых 2-й группы (М-ЭХО 8±1,9 мм). При детализации данных отмечено, что это были пациентки, прооперированные по поводу субмукозной миомы матки (2-й тип по FIGO) и внутриматочных сращений. Подобная ультразвуковая визуализация расценена нами как проявления хронического эндометрита, а увеличение средних значений М-ЭХО стало отражением поствоспалительной реакции эндометрия.
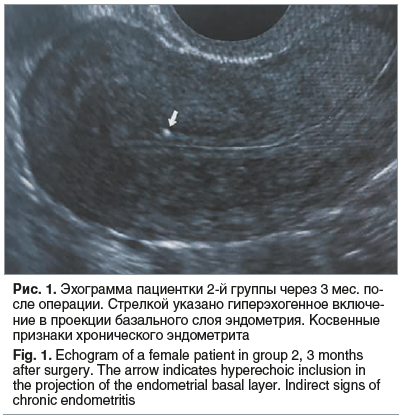
Интерпретация полученных результатов на 19–23-й день менструального цикла показала значимые изменения функционального слоя эндометрия у 29 (49,1%) пациенток 2-й группы. В 15 (25,4%) наблюдениях эхоструктура эндометрия характеризовалась наличием мелких гиперэхогенных включений в проекции базального слоя как передней, так и задней стенок, которые сохранялись вне зависимости от фазы менструального цикла и были отражением вовлеченности в хронический воспалительный процесс неотторгающегося камбиального слоя слизистой оболочки полости матки (М-ЭХО 9±1,6 мм) (рис. 1).
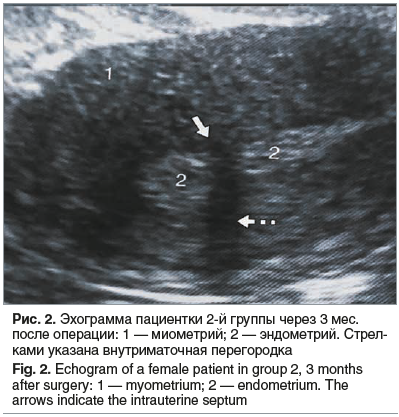
На 14 (23,7%) эхограммах определены гипер- и изоэхогенные вертикальные тяжи, «прерывающие» линию эндометрия, дающие акустическую тень, что свидетельствует о наличии внутриматочных сращений (М-ЭХО 8±0,3 мм). Ультразвуковые признаки внутриматочных синехий были выявлены у 5 (8,4%) обследованных, перенесших гистерорезектоскопическую миомэктомию субмукозных узлов, 9 (15,2%) пациенток ранее уже были прооперированы по поводу внутриматочных синехий, что свидетельствовало о высокой вероятности рецидива внутриматочных синехий без применения противоспаечного барьера (рис. 2).
Результаты эхографической оценки толщины эндометрия через 3 мес. после оперативного лечения приведены в таблице 2.
При оценке фертильной функции в течение 12 мес. после оперативного лечения на фоне регулярной половой жизни установили, что спонтанная беременность у обследованных пациенток статистически значимо чаще (p<0,05) наступала в 1-й группе — у 44,4% (n=16) пациенток, тогда как во 2-й группе — у 27,1% (n=16). Через 2 года после проведенного внутриматочного вмешательства спонтанная беременность наступила еще у 5 (13,9%) пациенток 1-й группы и у 9 (15,2%) пациенток 2-й группы (p>0,05). У женщин старшего репродуктивного возраста в связи с отсутствием спонтанной беременности в течение 6 мес. после оперативного лечения было проведено экстракорпоральное оплодотворение (ЭКО), в результате которого беременность наступила в 7 (19,4%) случаях в 1-й группе и в 6 (10,1%) случаях во 2-й группе (p<0,05). Таким образом, использование противоспаечного барьера способствовало увеличению частоты наступления самостоятельной и индуцированной беременности у пациенток 1-й группы, что, по-видимому, отражает более эффективное восстановление функционального состояния эндометрия.
Общее число пациенток, реализовавших репродуктивные планы (самостоятельно или при помощи вспомогательных репродуктивных технологий), составило 28 (77,8%) в 1-й группе и 31 (52,5%) во 2-й группе (p<0,05). Отсутствие беременности за период наблюдения отмечено у 8 (22,2%) пациенток 1-й группы и 28 (47,5%) — 2-й группы (p<0,05).
Эпидемиологические показатели внутриматочной патологии в последние годы не имеют тенденции к снижению, что демонстрирует необходимость проведения профилактических мероприятий послеоперационных осложнений, особенно среди пациенток репродуктивного возраста. Известным фактом является различная степень риска развития внутриматочных синехий и хронического эндометрита после хирургического лечения в полости матки с учетом внутриматочной нозологии. Наиболее выраженные изменения были ассоциированы с патологиями, требовавшими гистерорезектоскопических операций (субмукозные миоматозные узлы, полипы эндометрия и эндоцервикса, наличие внутриматочных сращений после предшествующих внутриматочных вмешательств, внутриматочные перегородки). Однако современным клиницистам необходимо минимизировать послеоперационные риски после любых внутриполостных операций на матке. Результаты настоящего исследования доказывают высокую эффективность противоспаечного геля и положительную тенденцию улучшения репродуктивного здоровья пациенток при его применении, что оправдывает включение его в комплексную терапию внутриматочной патологии. Полученные нами данные соответствуют результатам отечественных и зарубежных исследований и отражают высокую эффективность применения противоспаечных барьеров с целью профилактики внутриматочных синехий и хронического эндометрита [11–20].
Заключение
Проведенное нами исследование подтверждает наличие высокого риска возникновения внутриматочных синехий после выполнения внутриматочных вмешательств с последующим нарушением репродуктивной функции. Использование противоспаечного геля на основе гиалуроновой кислоты во время внутриматочных оперативных вмешательств можно рассматривать как профилактику внутриматочных послеоперационных спаек. Согласно проведенному исследованию введение в полость матки противоспаечного геля на основе гиалуроновой кислоты значимо улучшает репродуктивный прогноз у пациенток с маточным фактором бесплодия.
Сведения об авторах:
Насырова Наиля Ильдаровна — к.м.н., заведующая гинекологическим отделением № 1 ЦКБ ГА; Россия, г. Москва, Иваньковское ш., д. 7; доцент кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-0657-7655.
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-5389-7817.
Озолиня Людмила Анатольевна — д.м.н., профессор, профессор кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-2353-123Х.
Аргун Мадина Зурабовна — к.м.н., врач акушер-гинеколог гинекологического отделения № 1 ЦКБ ГА; 125367; Россия, г. Москва, Иваньковское ш., д. 7; ORCID iD 0000-0003-4841-2496.
Мирская Каролина Владимировна — врач акушер-гинеколог гинекологического отделения № 1 ЦКБ ГА; 125367; г. Москва, Иваньковское ш., д. 7; ORCID iD 0009-0001-0874-507X.
Контактная информация: Насырова Наиля Ильдаровна, e-mail: ni_nasyrova@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.10.2023.
Поступила после рецензирования 30.10.2023.
Принята в печать 20.11.2023.
About the authors:
Nailya I. Nasyrova — C. Sc. (Med.), Head of the Department of Gynecology No. 1, Central Clinical Hospital of Civil Aviation; 7, Ivankovskoe Highway, Moscow, 125367, Russian Federation; Associate Professor of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-0657-7655.
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation, ORCID iD 0000-0001-5389-7817.
Lyudmila A. Ozolinya — Dr. Sc. (Med.), Professor of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation, ORCID iD 0000-0002-2353-123Х.
Madina Z. Argun — C. Sc. (Med.), obstetrician-gynecologist of the Department of Gynecology No. 1, Central Clinical Hospital of Civil Aviation; 7, Ivankovskoe Highway, Moscow, 125367, Russian Federation; ORCID iD 0000-0003-4841-2496.
Karolina V. Mirskaya — obstetrician-gynecologist of the Department of Gynecology No. 1, Central Clinical Hospital of Civil Aviation; 7, Ivankovskoe Highway, Moscow, 125367, Russian Federation; ORCID iD 0009-0001-0874-507X.
Contact information: Nailya I. Nasyrova, e-mail: ni_nasyrova@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 09.10.2023.
Revised 30.10.2023.
Accepted 20.11.2023.
Информация с rmj.ru





