Оптимизация лечебно-диагностического алгоритма у больных с постхолецистэктомическим синдромом
Ж.В. Басарболиева, В.А. Ступин, Н.В. Кобесов, В.И. Васин, Д.А. Дорошенко
Резюме. Цель – оптимизировать лечебно-диагностический алгоритм у больных с постхолецистэктомическим синдромом (ПХЭС). В исследование включено 125 больных, которые были разделены на 3 группы. 1 группа – больные с органической патологией, которым проводилась эндоскопическая коррекция выявленных патологических изменений. 2 группа – больные с функциональными нарушениями, которым проводилась консервативная терапия, направленная на ликвидацию спазма или недостаточности сфинктерного аппарата большого сосочка двенадцатиперстной кишки. 3 группа – больные с обострением заболеваний органов гепатобилиарной зоны. Лечение проводилось в зависимости от выявленной патологии верхнего отдела желудочно-кишечного тракта. Больным проводились УЗИ органов брюшной полости с нагрузочными пробами, эндоскопическая манометрия сфинктера Одди. Качество жизни пациентов оценивали по шкале SF-36. Выявлено, что комплексная диагностика больных с ПХЭС позволяет выявить органическую и функциональную патологию и проводить дифференцированное консервативное и эндоскопическое лечение данной категории больных
Ключевые слова: холедох, дисфункция сфинктера Одди, эндоскопическая манометрия сфинктера Одди, бускопан, постхолецистэктомический синдром.
«Золотым стандартом» в хирургическом лечении ЖКБ на сегодняшний день является холецистэктомия. Ежегодно в мире выполняют более 1 млн холецистэктомий, в США – около 700 тыс., в России – 100 тыс. [2]. Однако хирургическое лечение не всегда избавляет больного от страданий.Частота неудовлетворительных отдаленных результатов после холецистэктомий составляет 2–40 % [5]. Подобные симптомы связаны с возникновением постхолецистэктомического синдрома (ПХЭС) [6–8, 11].
Согласно Римскому консенсусу по функциональным расстройствам органов пищеварения 1999 г., термином «ПХЭС» принято обозначать дисфункцию сфинктера Одди. Согласно ему, дисфункция сфинктера Одди – нарушение сократительной функции сфинктера Одди, препятствующее нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку. Нарушение функции сфинктера Одди может носить органический (стенозы, стриктуры и т. д.) и/или функциональный характер. Отсутствие критериев диагностики органической и функциональной патологии у больных, перенесших холецистэктомию, создает трудности при выборе дифференцированного лечения данных больных.
Трансабдоминальное ультразвуковое исследование информативно при дисфункции сфинктера Одди при выполнении нагрузочных пищевых проб (Малярчук В. И., 2004).
Эндоскопическая сфинктероманометрия является наиболее информативным исследованием функции сфинктерного аппарата большого сосочка двенадцатиперстной кишки на сегодняшний день (Sgouros S. N., 2006). Однако не разработан алгоритм обследования и лечения данных больных. Диагностика и дифференцированный подход к лечению больных с дисфункцией сфинктера Одди продолжают оставаться одной из актуальных проблем современной хирургии. В связи с этим представляется актуальными цель данного исследования.
Цель: оптимизировать лечебно-диагностический алгоритм у больных с ПХЭС.
Материалы и методы
Проведено рандомизированное сравнительное проспективное исследование 125 больных, находящихся на стационарном лечении в ГКБ № 15 им. О. М. Филатова в период с 2005 по 2013 г. включительно с диагнозом постхолецистэктомический синдром. Обследование проводилось при добровольном информированном согласии пациента.
Критерий включения в исследование: диагноз: постхолецистэктомический синдром.
Критерии исключения из исследования:
- сердечная недостаточность III–IV степени по классификации NYHA,
- дыхательная недостаточность III,
- острые вирусные гепатиты,
- психические заболевания,
- аутоиммунные заболевания,
- туберкулезная инфекция,
- ВИЧ-инфекция,
- беременность,
- лактация.
Возраст больных варьировался от 17 до 94 лет. Средний возраст больных составил 62,02±12,2 лет. 40,8 % пациентов составили лица трудоспособного возраста. Лица старше 50 лет составили 79,2 % всех пациентов, старше 60 лет – 59,2 %. Большое количество больных трудоспособного возраста говорит о значимости социальной проблемы диагностики и лечения больных с ПХЭС.
Соотношение мужского и женского пола составило 1:8,6. Распределение больных в пользу женского пола объясняется более частой встречаемостью желчнокаменной болезни у женщин.
Средняя продолжительность анамнеза ЖКБ до оперативного лечения составила 3,5± 2,4 лет. Больные с ПХЭС с анамнезом ЖКБ (камненосительство) до 1 года составили 20 %, а со сроком камненосительства более 1 года – 80 %. Вышеуказанные данные позволяют сделать вывод о необходимости своевременной диагностики и выполнения лечебных мероприятий у больных с камненосительством.
Характер проводимых оперативных вмешательств был следующим: 70 (56 %) больным произведена лапароскопическая холецистэктомия (ЛХЭ), у 2 (1,6 %) больных после ЛХЭ произведена ЭПСТ, 48 (38,4 %) больным выполнена открытая холецистэктомия. У 4 (3,2 %) больных холецистэктомия дополнена ЭПСТ. У 1 (0,8 %) больного произведена холецистэктомия, холедохотомия, дренирование холедоха по Керу.
Появление клинических признаков ПХЭС после оперативного лечения желчнокаменной болезни в среднем составило 9,3 ± 7 лет. При этом следует отметить значительную вариабельность временных показателей от 1 месяца до более 11 лет.
Раннее появление ПХЭС может свидетельствовать о наличии патологии у больных и в дооперационном периоде, что говорит о необходимости более тщательного обследования больных до операции.
Табл. 1 указывает на раннее возникновение ПХЭС у больных, оперированных в плановом порядке после выполненной ЛХЭ, в то время как у больных с проведенной открытой холецистэктомией ПХЭС возникал чаще через длительное время.
Таблица 1. Распределение больных в зависимости от оперативного лечения и сроков возникновения ПХЭС
| Возраст | ХЭ | ЛХЭ |
| До 1 года | 3 (2,4 %) | 25 (20 %) * |
| 1–5 лет | 8 (6,4 %) | 16 (12,8 %) |
| 6–10 лет | 6 (4,8 %) | 17 (13,6 %) * |
| Более 11 лет | 34 (27,2 %) | 14 (11,2 %) |
| Всего | 51 (40,8 %) | 74 (59,2 %) |
Примечание: * – разница достоверна между столбцами (р < 0,05).
Среди сопутствующей патологии преобладали больные с артериальной гипертензией 72 (57,6 %), ИБС 56 (44,8 %).
Преобладание пациентов старших возрастных групп отразилось на высоком проценте больных с сопутствующими сердечно-сосудистыми заболеваниями.
В сочетании с ПХЭС у больных в анамнезе часто встречались заболевания органов желудочно-кишечного тракта (ЖКТ).
Главенствующее месте среди заболеваний органов ЖКТ у больных с ПХЭС составляли хронический гастрит и дуодено-гастральный рефлюкс. Это может быть связано с уменьшением бактерицидности кишечного содержимого после удаления желчного пузыря. Под влиянием патогенной микрофлоры желчные кислоты подвергаются преждевременной деконъюгации, что сопровождается повреждением слизистой оболочки двенадцатиперстной кишки с развитием рефлюкс-гастрита. Частое сочетание заболеваний органов ЖКТ с ПХЭС объясняется анатомофизиологической связью органов гепатобилиарной системы [6–9].
Таким образом, учитывая частую встречаемость у больных с ПХЭС заболеваний верхнего отдела ЖКТ, необходимо более полно обследовать больных в дооперационном периоде.
Для верификации диагноза всем больным проводилось принятое в ГКБ № 15 им. О. М. Филатова клиническое обследование больных, включающее сбор жалоб, изучение анамнеза, объективное обследование, лабораторные и инструментальные методы исследования. В комплекс обследования входили биохимический анализ крови, трансабдоминальное УЗИ органов брюшной полости, дуоденоскопия с эндоскопической манометрией сфинктера Одди. Биохимическое исследование крови включало определение уровня билирубина, аспартатаминотрансферазы (АсАТ), аланинаминотрансферазы (АлАТ), щелочной фосфатазы (ЩФ), амилазы. Биохимическое исследование проводилось всем больным при поступлении и в динамике. Для выполнения анализов использован биохимический анализатор OLYMPUS с реактивами фирм OLYMPUS и RANDEX. Исследование проводили натощак. УЗИ органов брюшной полости проводилось также всем больным при поступлении (исследование проводилось на УЗ-сканерах фирмы Philips Еnvizor полипозиционно, с использованием конвексного датчика с частотой 3,5 МГц в В-режиме в утренние часы натощак). Оценивали состояние холедоха, внутрипеченочных протоков, эхо-структуру и размеры поджелудочной железы.
Дуоденоскопию проводили натощак с использованием местной анестезии глоточного кольца раствором лидокаина. Во время дуоденоскопии больным проводилась эндоскопическая манометрия сфинктера Одди на аппарате Гастроскан Д «Исток-Система».
Эндоскопическая сфинктероманометрия является «золотым стандартом» исследования функции сфинктерного аппарата большого сосочка двенадцатиперстной кишки (Орлов С. Ю., 1995, 1996; Ивашкин В. Т., 2003; Niiyama H., 2003; Arguedas M. R., 2004; Sgouros S. N., 2006).
Во время исследования пациента укладывали на левый бок. Через инструментальный канал дуоденоскопа в большой сосочек двенадцатиперстной кишки вводили манометрический катетер, далее катетер проводили в холедох. После регистрации давления катетер медленно извлекали на 2 мм и производили регистрацию давления сфинктера. Затем измеряли давления в двенадцатиперстной кишке. По данным манометрии сфинктера Одди, у больных определялся характер функциональных расстройств.
В ходе исследования проводилось изучение патологии билиарного тракта у добровольцев (людей без патологии гепатобилиарной системы) с помощью манометрии сфинктера Одди на аппарате Гастроскан Д («Исток-Система») с целью определения нормальных значений. Манометрия сфинктера Одди проведена 31 добровольцу. Средний возраст составил 44 ± 13 лет. Мужчин было 35 %, женщин – 65 %. Получены средние значения показателей:
Базальное давление сфинктера Одди (превышение давления над давлением в двенадцатиперстной кишке) – 14,45 ± 5,67, амплитуда фазовых волн – 125,7 ± 21,86, частота фазовых волн – 4,5 ± 1,9 в минуту. Данные показатели сходны с показателями других исследований (Панцырев Ю. М., Шаповальянц С. Г., Чернякевич С. А., Паньков А. Г., Бабкова И. В., Орлов С. Ю., Зубова Н. В., 2011).
Статистический анализ данных проводили с использованием статистического пакета программ Microsoft Excel и Biostat. Для каждого вариационного ряда определяли среднюю арифметическую (М), среднюю ошибку средней арифметической (m). Достоверность различных средних арифметических величин определяли по абсолютному показателю точности (Р) по таблице процентных точек распределения Стьюдента в зависимости от коэффициента достоверности (t) и числа степеней свободы (n). На основании t по таблице Стьюдента определялась вероятность различия (p). Различия считали достоверными при уровне доверительной связи свыше 95 % (ошибка р < 0,05).
Результаты и обсуждения
В результате проведенного клинико-инструментального обследования все пациенты с постхолецистэктомическим синдромом были разделены на 3 группы.
В 1 группу вошли больные с органической патологией (n = 19). Средний возраст больных – 69,3 ± 10,68 лет. Мужчин – 2 (10,5 %), женщин – 17 (89,5 %). Среди органической патологии встречались резидуальный и рецидивный холедохолитиаз – 84,2 % (n = 16); рубцовый стеноз дистального отдела холедоха – 15,8 % (n = 3).
Пациентам c органическими причинами нарушения желчеоттока проводилась эндоскопическая коррекция выявленных патологических изменений (эндоскопическая папиллосфинктеротомия).
2 группу составили больные с функциональными нарушениями (n = 83). Средний возраст больных – 59,96 ± 15,98 лет. Мужчин – 13 (15,7 %), женщин – 72 (84,3 %).
Больным данной группы проводилась консервативная терапия. Помимо стандартной консервативной терапии, принятой в ГКБ № 15 им. О. М. Филатова, с целью ликвидации спазма сфинктерного аппарата большого сосочка двенадцатиперстной кишки больные принимали Бускопан в дозе 10 мг 3 раза в сутки. Больные с гипомоторной дискинезией принимали прокинетики (церукал, мотилиум).
3 группу составили больные с обострением заболеваний органов гепатобилиарной зоны (n = 23). Средний возраст больных – 64,13 ± 13,02 лет. Мужчин – 2 (8,7 %), женщин – 21 (91,3 %). Лечение проводилось в зависимости от выявленной патологии верхнего отдела желудочно-кишечного тракта.
Группы были сопоставимы по полу, возрасту и сопутствующей патологии.
Качество жизни пациентов оценивали по шкале SF-36.
Анализируя показатели диаграммы, можно сделать вывод, что повышение уровня ферментов цитолиза и холестаза достоверно чаще наблюдалось у больных с органической патологией. У пациентов с функциональными нарушениями желчеоттока (2 группа) чаще регистрировалось транзиторное повышение печеночных и панкреатических ферментов у больных, в то время как у пациентов с органической патологией (1 группа) регистрировалось стабильное повышение активности ферментов (р < 0,05). У 73,7 % больных 1 группы наблюдалось изменения биохимических показателей, во 2 группе – у 39,7 %, в 3 – у 52 % больных.
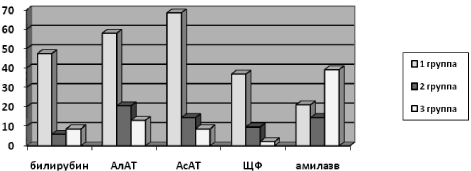
Рис. 1. Биохимические показатели в разных группах
При биохимическом анализе крови чаще всего у больных с органической патологией (1 группа) встречается повышение уровня АсАТ (68,4 %), повышение АлАТ наблюдается в 57,9 % случаев, а ЩФ – в 36,8 %. Чаще всего у больных с функциональной патологией (2 группа) встречается также повышение уровня АлАТ. Повышение АсАТ наблюдается в 14,4 % случаев, а ЩФ – в 9,6 %. У больных 3 группы наиболее часто наблюдалось повышение уровня амилазы (39,1 % случаев), что может быть связано с включением в данную группу больных с острым рецидивирующим панкреатитом.
Таким образом, учитывая проведенное нами исследование, можно прийти к заключению, что какие-либо определенные биохимические показатели нельзя считать достоверным диагностическим критерием при определении характера патологии большого сосочка двенадцатиперстной кишки.
При проведении трансабдоминального ультразвукового исследования органов брюшной полости у больных с органической патологией (1 группа) выявлены – холедохолитиаз в 62,5 % случаев (n = 10), а стеноз дистального отдела холедоха по данным УЗИ органов брюшной полости диагностирован не был.
У 15 % больных возникали трудности с визуализацией из-за выраженного пневматоза и ожирения. Конкременты в холедохе не были визуализированы в 37,5 % случаев. Гипердиагностика органической патологии, по данным УЗИ органов брюшной полости, выявлена у 2 (10,5 %) больных. Органическая патология подтверждена с помощью ЭРПХГ.
На основании полученных результатов проанализированы показатели чувствительности и специфичности ТУС в диагностике органической патологии билиарной системы. Показатель чувствительности (Se) ТУС соответствует 52,6 %, специфичности (Sp) 81,8 %. Относительно низкие показатели чувствительности и специфичности диктуют необходимость в поиске дополнительных методов диагностики органической патологии.
Кроме того, больным с функциональной патологией проводились УЗИ органов брюшной полости на аппарате Philips Invisor (США) с нагрузочными пробами. Нагрузочная проба включала пищевую стимуляцию (с жирным завтраком): оценивали диаметр холедоха. Проба проводилась натощак. Проба считалась положительной в случае увеличения размера холедоха в течение часа на 2 мм и более. Холедох измеряли до приема жирного завтрака и каждые 15 минут в течение 1 часа после приема 150 г сливок и 2 яичных желтков.
Тест с пищевой нагрузкой при ультразвуковом исследовании был проведен 30 больным с функциональными нарушениями большого сосочка двенадцатиперстной кишки. По данным эндоскопической манометрии, у 5 (16,7 %) больных наблюдалась гипомоторная дискинезия, у 20 (66,6 %) пациентов – гипермоторная дискинезия, а у 5 (16,7 %) больных диагностирован папиллоспазмом. У 7 больных провести пробу не удалось из-за выраженной тошноты. 2 больных не смогли съесть жирный завтрак. Таким образом, тест проведен полностью 21 (70 %) больному. Тест с нагрузочной пробой оказался положительным у 12 больных (40 %).
Таким образом, тест оказался информативным в 40 % случаев. Обращает на себя внимание отсутствие положительного результата у больных с гипомоторной дискинезией, в то время как у больных с гипермоторной дискинезией тест оказался положительным в 55 % случаев.
Таким образом, ультразвуковой тест с нагрузочными пробами может применяться как дополнительный метод диагностики функциональных нарушений, однако из-за побочных эффектов (тошнота, рвота), низкой информативности (40 %), все же уступает эндоскопической манометрии сфинктера Одди. Тест может применяться у больных, которым по разным причинам невозможно провести эндоскопическую манометрию сфинктера Одди.
Показаниями для проведения ЭРХПГ явилась верификация ультразвуковых или эндоскопических признаков: 1) холедохолитиаз; 2) стеноз дистального отдела холедоха. Таким образом, ЭРПХГ была выполнена больным 1 группы. С помощью ЭРПХГ в 3 случаях был диагностирован стеноз дистального отдела холедоха. Всем больным произведена ЭПСТ.
В 1 случае ЭПСТ дополнена литэкстракцией, у 1 пациента после ЭПСТ больному произведена лапаротомия, холедохотомия, дренирование холедоха по Керу.
Больным с органической патологией, подтвержденной данными трансабдоминального УЗИ органов брюшной полости и дуоденоскопией, эндоскопическая манометрия сфинктера Одди не выполнялась. Больным производилась ЭРПХГ и ЭПСТ.
Больным с обострением заболеваний органов верхнего отдела ЖКТ, подтвержденной данными трансабдоминального УЗИ органов брюшной полости, ЭГДС и дуоденоскопией эндоскопическая манометрия сфинктера Одди не выполнялась. Больным производилась консервативная терапия соответственно заболеванию.
Больным с отсутствием органической патологии и отсутствием обострения заболеваний верхнего отдела ЖКТ при наличии болевого синдрома проводилась эндоскопическая манометрия сфинктера Одди.
Больным с повышенными биохимическими показателями и/или холедохоэктазией, высокой амплитудой и базальным давлением сфинктера Одди, по данным эндоскопической маноментрии, с целью дифференциальной диагностики папиллостеноза и папиллоспазма выполнялась фармакологическая проба с нитроглицерином (0,0005 г, 2–3 мл 1 %).
Эндоскопическая манометрия сфинктера Одди произведена 60 больным.
1 группа – 1 больной (со стеноз дистального отдела холедоха). Манометрическая кривая была представлена частыми, высокой амплитуды сокращениями, с повышенным базальным давлением сфинктера Одди. Проба с нитроглицерином отрицательная. Манометрическая картина расценена как папиллостеноз. Диагноз подтвержден результатами ЭРПХГ. Больному произведена ЭПСТ. Осложнений не было.
2 группа – 52 больных (из них 8 с повышенными биохимическими показателями, 5 с расширенным холедохом, 4 с повышенными биохимическими показателями и холедохоэктазией. Всем больным проведена проба с нитроглицерином. Оставшиеся 35 больных только предъявляли жалобы на болевой синдром. Данным больным проба с нитроглицерином не проводилась. Таким образом, фармакологическая проба проводилась 17 больным. У 5 больных диагностирован папиллоспазм. Папиллоспазм характеризовался частыми высокой амплитуды сокращениями сфинктера Одди. Проба с нитроглицерином была положительной.
У 37 больных манометрическая картина была представлена увеличенной амплитудой сокращения сфинктера Одди, аритмией сокращения, увеличением среднего базального давления сфинктера Одди, увеличением частоты сокращений в минуту, что соответствовало гипермоторной дискинезии.
У 10 больных манометрическая картина была расценена как гипомоторная дискинезия, которая характеризовалась уменьшенной амплитудой сокращений и аритмией.
В 3 группе эндоскопическая манометрия сфинктера Одди произведена 4 больных (у 2 больных отмечалась холедохоэктазия, у других 2 пациентов – повышение биохимических показателей). У данных больных, по данным эндоскопической манометрии сфинктера Одди, патологии не выявлено. Впоследствии эти больные были отнесены к 3 группе.
Таким образом, у большинства пациентов (n = 42) определялись функциональные расстройства сфинктерного аппарата большого сосочка двенадцатиперстной кишки по гиперкинетическому типу, а у 10 больных наблюдалась дисфункцией сфинктера
Одди по гипокинетическому типу. Больные с гипомоторной дискинезией (n = 10) получали прокинетики (церукал, мотилиум). Учитывая малое количество больных, исследование качества лечения у данной категории больных не проводилось.
42 пациента имели гипермоторную дискинезию. Больные были разделены на 2 группы.
1 группа (основная) n = 22 – больные, получавшие в течение 2-х недель Бускопан в дозе 10 мг 3 раза в сутки. Средний возраст – 57,3 ± 11,7 мужчин – 3 (13,6 %), женщин – 19 (86,4 %). ХЭ – 6 (27 %), ЛХЭ – 16 (73 %).
2 группа (контрольная) n = 20 – больные, получавшие стандартную терапию.
Средний возраст – 60,2 ± 12,4, мужчин – 3 (15 %), женщин – 17 (85 %). ХЭ – 5 (25 %), ЛХЭ – 15 (75 %).
Группы были сопоставимы по полу, возрасту, сопутствующей патологии, р > 0,05.
До начала лечения больных, оценивая качество жизни, выявлено достоверное снижение показателей в обеих группах. Больные отмечали снижение физического, социального функционирования, эмоционального состояния, психического и общего здоровья.
После проведенного лечения в основной группе отмечается значительная положительная динамика по всем показателям – результаты представлены на рис. 3.
Таблица 2. Результаты эндоскопической манометрии сфинктера Одди
| Гипермоторная дискинезия n=37 |
Папиллоспазм n=5 |
Гипомоторная дискинезия n=10 |
Норма n=30 |
р | |
| Среднее давление в холедохе |
14,5 ± 7,2 | 13,4 ± 6,1 | 11,5 ± 4,9 | 11,3±5,2 | Р1-2=0,7 Р1-3=0,2 Р1-4=0,045 Р2-3=0,5 Р2-4=0,4 Р3-4=0,9 |
| Среднее базальное давление сфинктера Одди |
52,7 ± 14,6 | 49,6 ± 12,1 | 11,1 ± 5,7 | 14,45±6,67 | Р1-2=0,6 Р1-3=0,000 Р1-4=0,000 Р2-3=0,000 Р2-4=0,000 Р3-4=0,16 |
| Амплитуда сокращений сфинктера Одди |
262,4 ± 31,6 | 321,5 ± 121,7 | 45,7 ± 28,9 | 125,7±21,86 | Р1-2=0,015 Р1-3=0,000 Р1-4=0,000 Р2-3=0,000 Р2-4=0,000 Р3–4=0,000 |
| Среднее давление в ДПК кишке |
4,1 ± 2,5 | 3,7 ± 1,9 | 3,8 ± 2,6 | 3,5±2,7 | Р1-2=0,73 Р1-3=0,74 Р1-4=0,35 Р2-3=0,9 Р2-4=0,87 Р3-4=0,76 |
| Частота фазовых волн |
8 ± 2,5 | 10,6 ± 2,1 | 3 ± 1,1 | 4,5±1,9 | Р1-2=0,03 Р1-3= 0,000 Р1-4=0,000 Р2-3=0,000 Р2-4=0,000 Р3–4=0,024 |
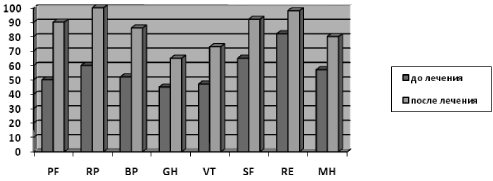
Рис. 2. Показатели качества жизни по опроснику SF-36 (в баллах) у пациентов с функциональной патологией
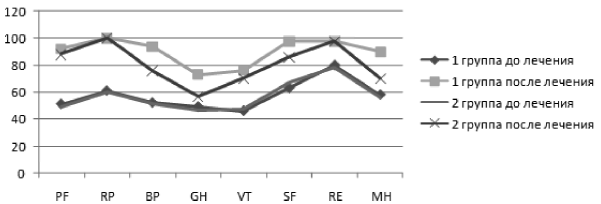
Рис. 3. Показатели качества жизни по опроснику SF-36 (в баллах) у пациентов с гипермоторной дискинезией до лечения и после
Из рис. 3 видно, что у больных, принимавших Бускопан, статистически значимо изменились степень болевого синдрома (BP), показатель общего здоровья (GH) и психическое здоровье (МН), p > 0,05.
Таким образом, применение спазмолитической терапии Бускопаном сопровождается большей степенью социальной и психологической реабилитации. Проводя анализ полученных результатов, можно сделать вывод о положительном эффекте гистиоцина бутилбромида – положительный эффект в основной группе наблюдался в отношении боли и диспептических расстройств достоверно чаще, чем в контрольной группе. Таким образом, можно сделать вывод, что своевременная, комплексная и тщательная диагностика и дифференцированное лечение причины ПХЭС позволяет улучшить качество жизни больных, уменьшить болевой и диспептический синдромы.
Вывод
Точная и своевременная комплексная диагностика больных с постхолецистэктомическим синдромом позволяет выявить органическую и функциональную патологию и проводить дифференцированное консервативное и эндоскопическое лечение данной категории больных.
Литература
- Абдуламитов Х. К. Отдаленные результаты видеолапароскопической холецистэктомии при остром холецистите / X. К. Абдуламитов, А. С. Ермолов, А. А. Гуляев и др. // Эндоскопическая хирургия. – 2009. – № 3. – С. 3–7.
- Бурков С. Г., Гребенев А. Л. Болезни печени и билиарной системы. – М.: Медицина, 1995. – С. 417–441.
- Зубова Н. В. Функциональные расстройства сфинктера Одди после холецистэктомии // РГГК. – 2011. – № 3. – Т. XXI. – С. 28–34.
- Иванченкова Р. А. Принципы лечения больных желчнокаменной болезнью после холецистэктомии // Гастроэнтерология Санкт-Петербурга. – 2006. – № 1–2. – М61, № 215.
- Ильченко А. А., Быстровская Е. В. Холедохолитиаз: этиология, патогенез, диагностика (обзор литературы) // Экспериментальная и клиническая гастроэнтерология. – 2003 – № 2. – С. 40–46.
- Ильченко А. А. Желчнокаменная болезнь. – М.: Анахарсис, 2004. – 200 с.
- Ильченко А. А. Заболевания желчного пузыря и желчных путей: руководство для врачей. – М.: Анахарсис, 2006. 448 с.
- Ильченко А. А. Постхолецистэктомический синдром: клинические аспекты проблемы // Consillium medicum. – 2006. – № 2.
- Ильченко А. А. Тактика ведения больных с постхолецистэктомическим синдромом // Consilsum medicum. – 2010. – № 2. – С.8–11.
- Козлова И. В., Граушкина Е. В., Волков С. В. Клинико-функциональные и структурные нарушения гастродуоденальной зоны после холецистэктомии // Врач. – 2010. – № 9. – С.72–76.
- Лазебник Л. Б., Копанева М. И., Ежова Т. Б. Потребность в медицинской помощи после оперативных вмешательств на желудке и желчном пузыре (обзор литературы и собственные наблюдения) // Тер. арх. – 2004. – № 2. – С. 83–87.
- Панцырев Ю. М., Шаповальянц С. Г., Чернякевич С. А., Паньков А. Г., Бабкова И. В., Орлов С. Ю., Ильченко А. А., Быстровская Е. В. Терапия постхолецистэктомического синдрома // Фарматека. – 2009. – № 2. – С. 44–47.
- Савельев В. С., Петухов В. А. Диагностические и терапевтические возможности гиосцина бутилбромида (Бускопан) при желчнокаменной болезни и бескаменном холестерозе желчного пузыря // РМЖ. – 2009. – № 17. – С. 1–10.
- Суздальцев И. В., Золотухин Т. Ф., Архипов О. И. и др. Постхолецистэктомический синдром: причины, факторы риска, современные методы диагностики и лечения. – М.: АНМИ, 2003. – 118 с.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru






