Ключевые слова: дети, вегетативная дистония, L-карнитин, коэнзим Q10, альтернативное взаимодействие.
Для цитирования: Неудахин Е.В. Обоснование энерготропной терапии вегетативных расстройств у детей // РМЖ. 2018. №2(ll). С. 107-112
E. V. Neudakhin
Scientific and practical center for specialized medical care for children named after V. F. Voino-Yasenetskiy
The article presents information on the terminology of vegetative disorders. It shows the expediency of using the term «syndrome of vegetative dystonia», which is a complex of symptoms caused by violation of autonomic regulation of all organs and systems of the organism, metabolic processes as a result of primary or secondary morphofunctional changes in the suprasegmentary and / or segmental structures of the autonomic nervous system, combined with psychoemotional disorders. The pathogenesis of vegetative disorders is considered from the viewpoint of alternative interaction of the processes forming adaptive-compensatory reactions in the body. It is demonstrated that the pathogenesis of the syndrome of vegetative dystonia is caused by the imbalance between the sympathetic and parasympathetic regulation of the organs and systems of the organism, connected with the disintegration of the higher vegetative centers. The mechanisms of action of energotropic drugs (L-carnitine and coenzyme Q10) are described in detail, information on the effectiveness of their use for various manifestations of vegetative disorders is presented. Data from the literature indicate a pronounced energotropic and vegetotropic action of these drugs. The discussed drugs are systemic drugs, which corresponds to the systemic nature of autonomic regulation. The positive effect of their action is associated, first of all, with their participation in the energy supply of all organs and systems of the body.
Key words: children, vegetative dystonia, L-carnitine, coenzyme Q10, alternative interaction.
For citation: Neudakhin E. V. Substantiation of energotropic therapy of vegetative disorders in children // RMJ. 2018. № 2(II)P. 107–112.
В статье представлено обоснование энерготропной терапии вегетативных расстройств у детей. Рассмотрен патогенез вегетативных расстройств с позиции альтернативного взаимодействия процессов. Подробно представлены сведения о механизмах действия энерготропных препаратов (L-карнитина и коэнзима Q10).
Содержание статьи
Терминология вегетативных расстройств
Вегетативная дистония является частой патологией детского возраста. Ее распространенность колеблется от 15 до 80%, встречаясь в 2,5 раза чаще у девочек, чем у мальчиков [1–3]. По данным С. Б. Шваркова [4], вегетативные расстройства отмечаются практически у всех детей, особенно часто — у подростков. У детей по сравнению со взрослыми при нарушении вегетативной регуляции возникают более заметные вегетативные изменения. В то же время у них труднее заподозрить опасную для жизни органическую патологию.
Вегетативные нарушения характеризуются сочетанием с психоэмоциональными расстройствами, вовлечением в патологический процесс всех органов и систем организма. На фоне полисистемных нарушений (общих соматотропных расстройств) могут доминировать проявления повреждений отдельных органов и систем. При этом в некоторых случаях у детей развиваются хронические психосоматические заболевания. Отмеченные аспекты являются поводом для инициации поиска наиболее патогенетически оправданной терапии.
Несмотря на почти 200-летнюю историю изучения вегетативных нарушений у человека, в литературе до настоящего времени нет четких представлений об этой проблеме, не определено место вегетативных расстройств в ряду патологических состояний (пограничное состояние, синдром, болезнь?). В уточнении нуждаются вопросы терминологии, патогенеза, классификации, диагностики и лечения. Для обозначения вегетативных нарушений предложено большое количество различных терминов: «невроз сердца», «вегетативный невроз», «нейроциркуляторная астения» (согласно Международной классификации болезней (МКБ) — F.45), «соматоформная дисфункция вегетативной нервной системы» (F.45.3), «нейроциркуляторная дистония», «расстройства вегетативной (автономной) нервной системы» (J.90), «вегетативная дистония», «вегетативная дисфункция».
Педиатрами нашей страны наиболее широко используются термины «нейроциркуляторная дистония» и «вегетативно-сосудистая дистония», однако они не отражают сущность обсуждаемого состояния. При указанном состоянии нарушается деятельность не только сердечно-сосудистой системы, но и всех органов и систем организма, а также обмен веществ. Поэтому наиболее точно отражающим вегетативные расстройства следует считать термин «вегетативная дисфункция». Однако в связи с тем, что для характеристики некоторых сторон вегетативных нарушений используются термины «исходный вегетативный тонус», «симпатикотония», «ваготония», с целью сохранения преемственности в терминологии следует отдавать предпочтение термину «вегетативная дистония», несмотря на то, что термин «тонус» в большей степени отражает состояние напряжения мышц или стенки сосудов, а не состояние вегетативной регуляции.
Хотя вегетативная дистония и нашла свое отражение в МКБ-Х, ее все-таки нельзя считать болезнью. Болезнь — это патологическое состояние, возникшее в результате действия определенного этиологического (болезнетворного) фактора и развития специфических и неспецифических реакций организма, качественно отличающихся от физиологических. Лечебные мероприятия при болезни должны быть этиологически и патогенетически значимыми. Синдром (греч. syndrome — степень, скопление) — устойчивая совокупность ряда симптомов с единым патогенезом. Он может наблюдаться при разных заболеваниях, ему присущи устойчивость и определенная закономерность возникновения. Лечебные мероприятия при синдроме должны быть патогенетически значимыми [5].
По мнению А. М. Вейна [6], с которым мы полностью согласны, вегетативная дистония — это клинический синдром, в связи с чем при постановке соответствующего диагноза следует использовать понятие «синдром вегетативной дистонии» (СВД). Под СВД следует понимать симптомокомплекс, обусловленный нарушением вегетативной регуляции всех органов и систем организма, обменных процессов в результате первично или вторично возникших морфофункциональных изменений в надсегментарном и/или сегментарном отделах вегетативной нервной системы (ВНС), сочетающийся с психоэмоциональными расстройствами. СВД, по мнению А. М. Вейна [7], включает в себя 3 клинических синдрома: психовегетативный; прогрессирующей периферической вегетативной недостаточности; ангиотрофопатический.
У детей в основном встречается психовегетативный синдром, который характеризуется сочетанием психоэмоциональных и вегетативных расстройств. В связи с этим большой интерес у педиатров вызывает церебральный уровень поражения ВНС. Организация адаптивных реакций организма в первую очередь зависит от активности надсегментарного отдела. Таким образом, только психовегетативный синдром по своей природе является функциональным, т. к. он связан с нарушением вегетативной регуляции. Другие два синдрома ассоциированы с органической патологией периферической (сегментарной) ВНС. Их нужно рассматривать в контексте тех заболеваний, осложнениями которых они являются. Эти синдромы в большей степени находятся в сфере интересов неврологов. Педиатров больше интересуют психосоматические (соматоформные) проявления, интегративные по своей сути, при которых наряду с функциональными нарушениями со стороны различных органов и систем организма ярко представлены психоэмоциональные расстройства [8].
Патогенетические аспекты вегетативных нарушений
В составе ВНС различают сегментарные и надсегментарные отделы. Первый из них обеспечивает гомеостаз покоя, второй — адаптивный гомеостаз. К сегментарному отделу относятся симпатическая и парасимпатическая ВНС. Симпатическая нервная система обеспечивает адаптацию организма к условиям внешней среды. Она усиливает эрготропные реакции за счет увеличения продукции стресс-реализующих гормонов и активации катаболических процессов. Парасимпатическая нервная система способствует сохранению постоянства внутренней среды организма (гомеостаза), выполняя в основном трофотропную функцию. При этом усиливаются анаболические процессы, синтез белка, и повышается активность генетического аппарата клеток. На первый взгляд, симпатический и парасимпатический отделы ВНС являются антагонистами. На самом деле, при усилении активности одного из отделов происходит компенсаторное увеличение активности другого, благодаря чему возникает новый уровень динамического равновесия в обеспечении вегетативной регуляции [6]. Такое взаимодействие отделов ВНС И. Хаулике [9] обозначил термином «взаимостимулирующий антагонизм». Чем выше исходная активность одного отдела ВНС, тем меньше его резервные возможности и тем быстрее наступает его истощение. Защита гомеостаза в живых организмах осуществляется благодаря закону единства и борьбы противоположностей. Противоположности непрерывно взаимодействуют. Адаптационные реакции в организме реализуются благодаря альтернативному взаимодействию противоположностей, в первую очередь катаболических и анаболических процессов, направленных на образование энергии. Взаимодействие альтернативных процессов осуществляется по принципу «обратных связей», по принципу «качелей» [10]. Взаимодействие противоположностей, взаимопроникающих и взаимостимулирующих друг друга, является внутренним источником циклического, ритмического развития живого организма. По нашему мнению [11], закон единства и борьбы противоположностей целесообразно назвать законом альтернативного взаимодействия.
В основе патогенеза СВД лежит нарушение равновесия между симпатической и парасимпатической регуляцией органов и систем организма, связанное с дезинтеграцией высших вегетативных центров, прежде всего лимбико-ретикулярного комплекса. По мнению А. М. Вейна и соавт. [6], структурно-функциональные изменения в области надсегментарных образований приводят к формированию генератора патологически усиленного возбуждения (ГПУВ) [12], в результате чего индуцируется нейродистрофический процесс с развитием трофических изменений в тканях организма. ГПУВ способствует хронизации психовегетативных расстройств, сохранению преобладания активности одного из отделов (симпатического или парасимпатического) ВНС. Если ГПУВ локализуется преимущественно в задних отделах гипоталамуса, то у детей фиксируется симпатикотония, если в передних, то ваготония. Под влиянием ГПУВ образуется функциональная патологическая система со своими определенными внутрисистемными взаимоотношениями между психоэмоциональными, вегетативными и гормонально-метаболическими механизмами.
В дебюте развития СВД отмечается адекватное усиление активности симпатического и парасимпатического отделов ВНС (компенсаторное повышение активности одного из них в ответ на повышение активности другого), что, по нашему мнению [14], характеризует фазу напряженной адаптации (рис. 1). При длительном существовании раздражителя (состояние хронического стресса) подключаются гормональные механизмы. При этом повышается приспособительная значимость последних, и относительно уменьшается приспособительная роль нервных механизмов. В связи с этим следующий этап вегетативных расстройств характеризуется тем, что при повышении активности одного из отделов ВНС компенсаторное изменение другого отдела является однонаправленным, но недостаточным. Подобный характер вегетативных сдвигов отражает фазу относительной компенсации. В дальнейшем, при сохранении повышенной активности одного из отделов ВНС вместо однонаправленных изменений другого отдела возникает его противоположная направленность (например, вместо компенсаторного повышения активности другого отдела она снижается), что на вегетативном уровне отражает фазу декомпенсации.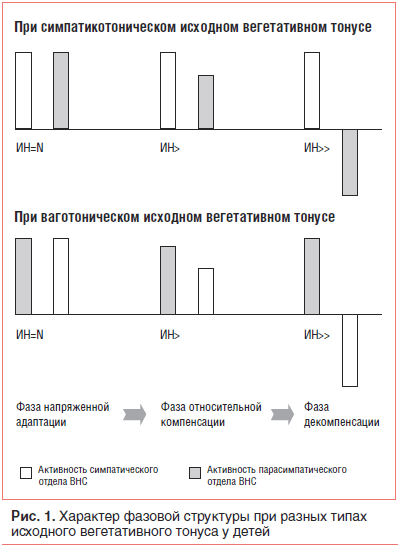
При смене одной фазы СВД на другую важную роль играют изменения вегетативной реактивности [13]. В начальном периоде каждой фазы отмечается нормальная вегетативная реактивность, которая затем сменяется гиперсимпатикотонической, а последняя — асимпатикотонической. Асимпатикотоническая реактивность, сменяющая гиперсимпатикотоническую с ее чрезвычайными энергетическими расходами, способствует сохранению энергии и функционированию всей системы уже на другом, более экономном уровне, т. е. асимпатикотония является пусковым механизмом смены фаз. По моему мнению [14], асимпатикотония является еще и пусковым механизмом подключения новых (для каждой фазы) гормонально-метаболических реакций. Следовательно, нарастающая гиперсимпатикотоническая реактивность на каком-то этапе трансформируется в новое качественное состояние — асимпатикотонию, отражающую истощение (недостаточность) вегетативной регуляции. В этих условиях с целью обеспечения или поддержания долговременной адаптации подключаются соответствующие эндокринные механизмы, которые в свою очередь «подпитывают» ВНС для того, чтобы она уже на новом качественном уровне могла обеспечить срочную адаптацию.
Смена симпатикотонии ваготонией, а ваготонии — симпатикотонией происходит в фазу декомпенсации. При этом важнейшую роль играют гормонально-метаболические механизмы. Указанная смена исходного вегетативного тонуса имеет адаптационно-компенсаторное значение. При выраженной симпатикотонии ваготония — результат не «синдрома истощения норадреналина», не «патологической десимпатизации» по Н. А. Белоконь [1], а необходимая реакция организма, направленная на ограничение катаболических процессов, ограничение энерготрат. При выраженной ваготонии нарастание симпатикотонии связано с необходимостью усиления обменных процессов, усиления образования энергии. При дисбалансе ВНС (значительном преобладании симпатического или парасимпатического отдела) заметно повышаются энергетические потребности органов и тканей организма, что приводит к развитию гипоксии и энергетическому дефициту. При этом в тканях возникает внутриклеточный ацидоз, усиливается перекисное окисление липидов [11].
По данным О. Е. Талицкой [15], нашим данным [16], у многих детей с вегетативными расстройствами определяется увеличение содержания в крови стресс-реализующих гормонов (адренокортикотропного гормона, кортизола, катехоламинов). Это связано с повышением активности гипоталамо-гипофизарной системы, мобилизующей симпато-адреналовую систему. При высокой активности симпато-адреналовой системы снижается чувствительность периферических тканей к инсулину, в результате чего стимулируется его образование. Под влиянием стресс-реализующих гормонов угнетается использование глюкозы, усиливается липолиз, в организме накапливаются свободные жирные кислоты, холестерин и триглицериды. Свободные жирные кислоты, в свою очередь, повышают резистентность тканей к инсулину, нарушают использование тканями глюкозы. Стимуляция образования инсулина сопровождается повышением активности симпатической нервной системы. При высоком уровне инсулина и катехоламинов усиливается деятельность ренин-ангиотензин-альдостероновой системы (РААС). Подобные гормональные сдвиги повышают риск развития артериальной гипертензии, ожирения, способствуют раннему развитию атеросклероза [16].
Особого внимания заслуживает исследование зависимости психовегетативного состояния от содержания половых гормонов. Нами [17] установлено, что у мальчиков с тяжелым гипогонадизмом при низкой концентрации тестостерона в крови отмечается выраженная симпатикотония. При назначении препаратов тестостерона, по мере повышения его уровня, все больше усиливается ваготоническая направленность вегетативного гомеостаза. Одновременно с этим закономерно изменяется и психоэмоциональный статус.
Важную роль в патогенезе СВД играют метаболические нарушения. При СВД у детей как с симпатикотонией, так и с ваготонией определяются атерогенные изменения липидного обмена (гиперхолестеринемия, гипертриглицеридемия, увеличение содержания липопротеинов низкой плотности, уменьшение концентрации липопротеинов высокой плотности), повышенная активность процессов перекисного окисления липидов [13]. При высокой активности вагоинсулярного аппарата, как правило, отмечается гипогликемия.
При оценке вегетативного гомеостаза с выделением фаз адаптации у детей с метаболическим синдромом (МС) в 70% случаев нами [16] определялась фаза декомпенсации, ассоциированная с некомпенсированной гиперсимпатикотонией. У этих детей отмечались повышенные показатели кортизола, С-пептида, инсулина, высокий уровень инсулинорезистентности, что свидетельствует об «эндокринной подпитке» вегетативных сдвигов, поддержании симпатикотонического состояния вегетативного гомеостаза, обеспечении стабильного функционирования ВНС.
По данным исследования активности митохондриальных ферментов: сукцинатдегидрогеназы (СДГ), α-глицерофосфатдегидрогеназы (α-ГФДГ), лактатдегидрогеназы (ЛДГ) у 80% детей определялась активация СДГ, которая коррелирует с уровнем среднего систолического АД (r=0,6; р>0,05).
Это объясняется тем, что активность СДГ (основного энергетического фермента) весьма чувствительно отражает уровень адренергической регуляции в организме [18]. Следовательно, метаболические процессы в митохондриях имеют сигнальную связь с выраженными признаками ожирения. При этом достоверно снижена активность α-ГФДГ, достоверно повышена активность ЛДГ. Эти данные свидетельствуют о том, что симпатикотония, характерная для детей c МС, способствует дестабилизации клеточных мембран (снижение активности (α-ГФДГ), усилению анаэробного гликолиза, развитию метаболического ацидоза (повышение активности ЛДГ) и компенсаторному усилению окислительно-восстановительных процессов.
Таким образом, при СВД постоянство основных физиологических функций организма поддерживается в условиях уменьшения диапазона его резервных возможностей, в связи с чем увеличивается вероятность срыва адаптации. Сохранение относительного гомеостаза достигается за счет своевременного переключения адаптационно-компенсаторных механизмов, генетически запрограммированных, физиологических по своей сути. Другими словами, в недрах нарастающей активности симпато-адреналовой системы происходят такие нейрогуморальные и гормонально-метаболические изменения, которые обеспечивают повышение активности вагоинсулярного аппарата. При развитии долговременной адаптации ослабляется нервное влияние, увеличивается чувствительность тканей к действию гормонов, т. е. изменяется механизм нейрогуморальной регуляции, что способствует развитию психосоматических заболеваний.
Эффекты энерготропных препаратов
Полисистемный характер нарушений клеточного энергообмена при СВД у детей является основанием для применения у них комплекса энерготропных препаратов, оказывающих одновременное воздействие на различные механизмы энергетического обмена [19]. Их метаболическая активность в основном связана с влиянием на процессы аэробного и анаэробного окисления, происходящие в митохондриях [20]. К энерготропным средствам, по мнению многих авторов, относятся препараты L-карнитина, коэнзима Q10, янтарной кислоты, некоторые витамины.
Среди метаболических (энерготропных) лекарственных средств особого внимания заслуживают препараты L-карнитина. L-карнитин связан с большим количеством биохимических процессов в клетке, являясь регулятором энергетических и пластических процессов. Основная его функция — биоэнергетическая. Он обеспечивает транспорт длинноцепочечных жирных кислот из цитоплазмы в митохондрии, где происходит их β-окисление в цикле Кребса с образованием ацетил-КоА. Последний необходим для процессов глюконеогенеза и окислительного фосфорилирования, образования кетоновых тел (энергетический субстрат для миокарда) и АТФ, синтеза холина и его эфиров, из которых образуется ацетилхолин. Он является основным нейромедиатором как соматической, так и вегетативной нервной системы, причем как симпатического, так и парасимпатического ее отделов.
Кроме нейромедиаторного ацетилхолина, который образуется в синапсах, важную роль в обеспечении метаболических процессов, в регуляции иммунной, сердечно-сосудистой и других систем организма играет немедиаторный ацетилхолин, который образуется в клетках разных тканей. Доказано, что внутриклеточный ацетилхолин, образующийся под влиянием L-карнитина, активно синтезируется определенными субпопуляциями Т- и В-лимфоцитов [21]. После этого он взаимодействует с ацетилхолиновыми рецепторами на макрофагах селезенки, ингибирует активность воспалительного медиатора (фактора некроза опухоли-α), ответственного за развитие системного воспаления, благодаря чему повышается общая устойчивость ткани. Однако при значительном образовании ацетилхолина возрастает его повреждающее действие (например, развитие язв 12-перстной кишки). Синтез ацетилхолина индуцируется секрецией адреналина. Именно при их взаимодействии осуществляется адекватная регуляция вегетативной нервной и иммунной систем [22].
L-карнитин принимает участие в регуляции не только жирового, но и белкового, и углеводного видов обмена. Он повышает чувствительность тканей к инсулину, благодаря чему поддерживается положительный белковый баланс, замедляется распад белковых и углеводных молекул [23]. В связи с этим, а также благодаря его участию в метаболизме фосфолипидов он обеспечивает трофотропное (анаболическое) и мембрано-стабилизирующее действие [24]. L-карнитин оказывает антигипоксическое, антиоксидантное, дезинтоксикационное, вазодилатирующее и антиагрегантное действие [25, 26]. Под влиянием L-карнитина усиливаются секреция и ферментативная активность желудочного и кишечного сока, повышается аппетит, улучшается усвоение пищи, увеличиваются запасы гликогена [27, 28]. Отмечаются кардиопротекторный, нейропротекторный, иммуномодулирующий и противовоспалительный эффекты L-карнитина [29–31]. Ведущей причиной перечисленных защитных эффектов L-карнитина является его влияние на клеточную редокс-сигнализацию, ассоциированную с ядерными рецепторами (факторами транскрипции генов). Последние контролируют защитные процессы, в первую очередь антиоксидантные, в результате чего уменьшается повреждающее воздействие окислительного стресса [32].
Важнейшую роль в метаболизме клеток играет коэнзим Q10 (убихинон). Это митохондриальный кофермент, принимающий участие в окислительном фосфорилировании и образовании АТФ. Он обеспечивает взаимосвязь между транспортом электронов в дыхательной цепи и процессом окисления жирных кислот в митохондриях. Коэнзим Q10 является одним из наиболее активных антиоксидантов в организме. Он характеризуется способностью к саморегенерации после окисления, а также способностью восстанавливать окисленный токоферол и другие антиоксиданты. Благодаря антиоксидантной активности это вещество защищает клеточные мембраны от воздействия свободных радикалов. Кофермент Q10 участвует в образовании тромбоцитов и эритроцитов, повышает фагоцитарную активность макрофагов, защищает эндотелий сосудов от повреждения.
В литературе имеется достаточно много сообщений об использовании энерготропных препаратов при вегетативных расстройствах у детей и подростков. Так, при обследовании 50 часто болеющих детей дошкольного и младшего школьного возраста от 3 до 9 лет Т. Н. Накостенко и соавт. [33] в 38,5% случаев установили асимпатикотоническую вегетативную реактивность, в 28,2% — нормотоническую, в 33,3% — гиперсимпатикотоническую. У всех детей с вегетативными расстройствами отмечалось снижение активности митохондриальных ферментов: СДГ, α-ГФДГ, ЛДГ.
В качестве средств метаболической коррекции авторы использовали гопантеновую кислоту и Элькар (20% раствор). Курс лечения составил 1 мес. На фоне указанной комбинированной терапии отмечалась положительная динамика клинических проявлений, показателей активности митохондриальных ферментов, а также параметров вегетативного гомеостаза. Особый интерес вызывают данные о том, что более выраженная положительная динамика активности митохондриальных ферментов отмечалась у детей с нормотоническим вариантом вегетативной реактивности по сравнению с асимпатикотоническим. Следовательно, при асимпатикотоническом варианте резервные возможности организма более низкие.
Значительное уменьшение клинических проявлений вегетативной дистонии при использовании энерготропных препаратов наблюдали Н. А. Коровина и соавт. [34]. В своей
работе авторы применяли L-карнитин и убидекаренон в виде моно- или комбинированной терапии. У наблюдавшихся 49 детей в возрасте от 8 до 13 лет и 23 подростков в возрасте от 14 до 16 лет отмечались нормализация сна, повышение устойчивости к интеллектуальным нагрузкам, отсутствие жалоб на повышенную утомляемость, головную боль, кардиалгии, сердцебиение. Кроме того, под влиянием указанных препаратов наблюдалась тенденция к уменьшению массы миокарда и индекса массы миокарда, улучшались его систолическая и диастолическая функции. В исследовании С. О. Ключникова с соавт. [35] на фоне 4-недельного приема L-карнитина (500 мг/сут) в виде монотерапии и/или в сочетании с убидекареноном (15 мг/сут) у детей и подростков с вегетативной дистонией также отмечалось повышение адаптации к психоэмоциональным нагрузкам, определялись нормализация вегетативного статуса, уменьшение ситуационной тревожности. С целью оценки эффективности двух энерготропных препаратов: L-карнитина и коэнзима Q10 В. В. Скворцовым и соавт. [36] обследовано 100 детей и подростков с кардиальным типом СВД, у которых наблюдались нарушения процессов реполяризации (100%), миграция водителя ритма (66%), синоатриальные блокады (16%), наджелудочковые экстрасистолы (18%). Дети получали указанные препараты в виде монотерапии или в комбинации. Установлено, что наиболее эффективна комбинация этих препаратов. Она позволяет предупреждать развитие миокардиодистрофии, наиболее часто возникающей на фоне СВД.
Исследование одного из препаратов L-карнитина проводилось на базе Харьковского медицинского университета. Т. В. Фролова и О. В. Охапкина [37] изучали эффективность L-карнитина при СВД. Под наблюдением находилось 150 подростков 14–17 лет. После 3-кратных курсов терапии (1 раз в 6 мес.) у большинства детей основной группы в течение 1 года отмечалась стабильная сбалансированная работа обоих отделов ВНС, в то время как у детей группы сравнения уже через 5–6 мес. определялись признаки ее десинхроноза и дисбаланса. В связи с этим авторы делают вывод о вегетотропном действии L-карнитина.
В работе С. Л. Морозова [38] показано, что у детей с гиперактивным мочевым пузырем, ассоциированным с вегетативной дистонией, в 80% случаев отмечается нарушение клеточной биоэнергетики, в 94,6% — снижение уровня общего карнитина на фоне выраженной ваготонии. Применение энерготропных (Элькара) и вегетотропных препаратов ведет к уменьшению выраженности клинических проявлений и улучшению функции мочевого пузыря.
Заключение
На основании теоретических представлений о механизме действия энерготропных препаратов (в первую очередь L-карнитина и коэнзима Q10) в организме человека, а также многочисленных данных об эффективности их клинического применения при СВД у детей разного возраста можно сделать вывод об их вегетотропном действии. Обсуждаемые лекарственные средства являются препаратами системного действия, что соответствует системному характеру вегетативной регуляции. Положительный эффект их действия связан в первую очередь с их участием в энергетическом обеспечении всех органов и систем организма. Известно, что L-карнитин обладает как энерготропной, так и трофотропной активностью. Его уникальность заключается в обеспечении: альтернативного взаимодействия процессов образования и сохранения энергии (процессов катаболизма и анаболизма); альтернативного взаимодействия симпатического и парасимпатического отделов ВНС; в поддержании равновесия альтернативных процессов на разных иерархических уровнях. Описано его действие на эпигенетическом уровне. Благодаря влиянию на транскрипцию генов L-карнитин может влиять и на альтернативное взаимодействие про- и антиоксидантных, про- и антивоспалительных, а также других процессов.
Из препаратов L-карнитина в нашей стране наиболее широко используется Элькар (левокарнитин) — препарат компании «ПИК-Фарма» (Россия).
Литература
1. Белоконь Н. А., Кубергер М. Б. Вегетососудистая дистония. Болезни сердца и сосудов у детей: Руководство для врачей. В 2-х тт. Т. 1. М.: Медицина, 1987. С. 303–338 [Belokon’ N.A., Kuberger M. B. Vegetososudistaja distonija. Bolezni serdca i sosudov u detej: Rukovodstvo dlja vrachej. V 2 tt. T. 1. M.: Medicina, 1987. S. 303–338 (in Russian)].
2. Ширеторова Д. Ч. Синдром вегетативной дистонии у детей. М., 1998. 27 с. [Shiretorova D. Ch. Sindrom vegetativnoj distonii u detej. M., 1998. 27 s. (in Russian)].
3. Вегетативная дисфункция у детей и подростков (классификация, клиника, диагностика, лечение). Учебно-методическое пособие / под ред. Л. В. Козловой. Смоленск, 2003. 80 с. [Vegetativnaja disfunkcija u detej i podrostkov (klassifikacija, klinika, diagnostika, lechenie). Uchebno-metodicheskoe posobie / pod red. L. V. Kozlovoj. Smolensk, 2003. 80 s. (in Russian)].
4. Шварков С. Б. Особенности вегетативной дистонии у детей. Заболевания вегетативной нервной системы / под ред. А. М. Вейна. М.: Медицина, 1991. С. 508–549 [Shvarkov S. B. Osobennosti vegetativnoj distonii u detej. Zabolevanija vegetativnoj nervnoj sistemy / pod. red. A. M. Vejna. M.: Medicina, 1991. S. 508–549 (in Russian)].
5. Неудахин Е. В., Агейкин В. А. Спорные теоретические и практические вопросы рахита у детей на современном этапе // Педиатрия. 2003. № 4. С. 95–98 [Neudahin E.V., Agejkin V. A. Spornye teoreticheskie i prakticheskie voprosy rahita u detej na sovremennom jetape // Pediatrija. 2003. № 4. S. 95–98 (in Russian)].
6. Вейн А. М. Синдром вегетативной дистонии. Вегетативные расстройства: клиника, диагностика, лечение / под ред. А. М. Вейна. М.: Медицинское информационное агентство, 1998. С. 109–121 [Vejn A. M. Sindrom vegetativnoj distonii. Vegetativnye rasstrojstva: klinika, diagnostika, lechenie / pod. red. A. M. Vejna. M.: Medicinskoe informacionnoe agentstvo, 1998. S. 109–121 (in Russian)].
7. Вейн А. М. Психосоматические отношения. Заболевания вегетативной нервной системы / под ред. А. М. Вейна. М.: Медицина, 1991. С. 374–385 [Vejn A. M. Psihosomaticheskie otnoshenija. Zabolevanija vegetativnoj nervnoj sistemy / pod red. A. M. Vejna. M.: Medicina, 1991. S. 374–385 (in Russian)].
8. Заваденко Н. Н., Нестеровский Ю. Е. Клинические проявления и лечение синдрома вегетативной дисфункции у детей и подростков // Педиатрия. 2012. № 91 (2). С. 93–101 [Zavadenko N.N., Nesterovskij Ju.E. Klinicheskie projavlenija i lechenie sindroma vegetativnoj disfunkcii u detej i podrostkov // Pediatrija. 2012. № 91 (2). S. 93–101 (in Russian)].
9. Хауликэ И. Вегетативная нервная система. Бухарест: Медицинское издание, 1978. 350 с. [Haulikje I. Vegetativnaja nervnaja sistema. Buharest: Medicinskoe izdanie, 1978. 350 s. (in Russian)].
10. Алякринский Б. С., Степанова С. И. По закону ритма. М., 1985. 176 с. [Aljakrinskij B.S., Stepanova S. I. Po zakonu ritma. M.,1985. 176 s. (in Russian)].
11. Неудахин Е. В., Морено И. Г. Углубление представлений о некоторых механизмах формирования хронического стресса // Вопросы практической педиатрии. 2016. № 11 (54). С. 28–37 [Neudahin E.V., Moreno I. G. Uglublenie predstavlenij o nekotoryh me-hanizmah formirovanija hronicheskogo stressa // Voprosy prakticheskoj pe-diatrii. 2016. № 11 (54). S. 28–37 (in Russian)].
12. Крыжановский Г. Н. Введение в общую патофизиологию. М.: РГМУ, 2000. 71 с.[Kryzhanovskij G. N. Vvedenie v obshhuju patofiziologiju. M.: RGMU, 2000. 71 s. (in Russian)].
13. Антонова Л. К. Динамика вегетативного статуса у детей подросткового возраста: Автореф. дис. … докт. мед. наук. М., 2004. 47 с. [Antonova L. K. Dinamika vegetativnogo statusa u detej podrostkovogo vozrasta: Avtoref. dis. … dokt. med. nauk. M., 2004. 47 s. (in Russian)].
14. Неудахин Е. В. К вопросу о вегетативных расстройствах у детей // Педиатрия. 2003. № 2. С. 98–100 [Neudahin E.V. K voprosu o vegetativnyh rasstrojstvah u detej // Pediatrija. 2003. № 2. S. 98–100 (in Russian)].
15. Талицкая О. Е. Цефалгический синдром при вегетативной дисфункции у детей: Автореф. дис. … канд. мед. наук. М., 2002. 27 с. [Talickaja O. E. Cefalgicheskij sindrom pri vegetativnoj disfunkcii u detej. Avtoref. dis. … kand. med. nauk. M., 2002. 27 s. (in Russian)].
16. Морено И. Г., Неудахин Е. В., Иванова С. В., Гурьева Е. Н. Роль вегетативных и гормонально-метаболических расстройств в развитии первичной артериальной гипертензии у детей и подростков с ожирением // Педиатрия. 2016. № 95 (3). С. 31–38 [Moreno I.G., Neudahin E. V., Ivanova S. V., Gur’eva E. N. Rol’ vegetativnyh i gormonal’no-metabolicheskih rasstrojstv v razvitii pervichnoj arterial’noj gipertenzii u detej i podrostkov s ozhireniem // Pediatrija. 2016. № 95 (3). S. 31–38 (in Russian)].
17. Неудахин Е. В., Громова С. В., Карманов М. Е. Особенности вегетативного гомеостаза у подростков с первичным гипогонадизмом. Детская вегетология / под ред. Р. Р. Шиляева, Е. В. Неудахина. М.: Медпрактика-М, 2008. С. 313–324 [Neudahin E.V., Gromova S. V., Karmanov M. E. Osobennosti vegetativnogo gomeostaza u podrostkov s pervichnym gipogonadizmom. Detskaja vegetologija / pod red. R. R. Shiljaeva, E. V. Neudahina. M.: Medpraktika-M, 2008. S. 313–324 (in Russian)].
18. Кондрашова М. Н., Хундерякова Н. В., Захарченко М. В. Индивидуальная характеристика человека по паттерну (узору) цитобиохимических показателей взаимодействия янтарной кислоты с митохондриями: материалы симпозиума «Регуляторы энергетического обмена / под ред. В. А. Хазанова. Томск, 2007. С. 8–16 [Kondrashova M.N., Hunderjakova N. V., Zaharchenko M. V. Individual’naja harakteristika cheloveka po patternu (uzoru) citobiohimicheskih pokazate-lej vzaimodejstvija jantarnoj kisloty s mitohondrijami: Materialy simpoziuma «Reguljatory jenergeticheskogo obmena / pod red. V. A. Hazanova. Tomsk, 2007. S. 8–16 (in Russian)].
19. Сухоруков В. С., Ключников С. О. Энерготропная терапия в современной педиатрии // Вестник педиатрической фармакологии и нутрициологии. 2006. № 6. С. 34–38 [Suhorukov V.S., Kljuchnikov S. O. Jenergotropnaja terapija v sovremennoj pediatrii // Vestnik pediatricheskoj farmakologii i nutriciologii. 2006. № 6. S. 34–38 (in Russian)].
20. Сухоруков В. С. Очерки митохондриальной патологии. М.: Медпрактика-М, 2011. 288 с. [Suhorukov V. S. Ocherki mitohondrial’noj patologii. M.: Medpraktika-M, 2011. 288 s. (in Russian)].
21. Морозов С. Л., Гусева Н. Б., Длин В. В. Перспективы энерготропной терапии нейрогенной дисфункции мочевого пузыря // Российский вестник перинатологии и педиатрии. 2013. № 5. С. 35–37 [Morozov S.L., Guseva N. B., Dlin V. V. Perspektivy jenergotropnoj terapii nejrogennoj disfunkcii mochevogo puzyrja // Rossijskij vestnik perinatologii i pediatrii. 2013. № 5. S. 35–37 (in Russian)].
22. Vida G., Pefia G., Kanashiro A. et al. Beta-Adrenoreceptors of regulatory lymphocytes are essential for vagal neuromodulation of the innate immune system // FASEB J. 2011. Vol. 25. P. 4476–4485.
23. Savica V., Calvani M., Benatti P. et al. Carnitine system in uremik patients. Molecular and clinical aspects // Semin Nephrol. 2004. Vol. 24 (5). P. 464–468.
24. Seim H., Eichler K., Kleber H. L-carnitine and its precursor, gammabyterobetaine. Nutraceuticals in Health and Disease Prevention. New York: Marcel Dekker inc. 2001. P. 217–256.
25. Coelho C. F., Mota I. F., Braganca E., Burini R. C. Aplicacoes clinicas da supplementation de L-carnitina // Rev Nutr. 2005. Vol. 18. P. 651–659.
26. Gruber I., Schaffer S., Halliwell B. The mitochondrial free radical theory of ageing. Where do we stand? // Frontiers in Bioscience. 2008. Vol. 13. P. 6554–6579.
27. Быков И. Л. Молекулярные механизмы и патогенетическая роль нарушений обмена L-карнитина: Автореф. дис. … докт. мед. наук. Новосибирск, 2006. 31 с. [Bykov I. L. Molekuljarnye mehanizmy i patogeneticheskaja rol’ narushenij obmena L-karnitina: Avtoref. dis. … dokt. med. nauk. Novosibirsk, 2006. 31 s. (in Russian)].
28. Брин И. Л., Неудахин Е. В., Дунайкин М. Л. Карнитин в педиатрии: исследования и клиническая практика. М.: Медпрактика-М, 2015. 112 с. [Brin I.L., Neudahin E. V., Dunajkin M. L. Karnitin v pediatrii: issle-dovanija i klinicheskaja praktika. M.: Medpraktika-M, 2015. 112 s. (in Russian)].
29. Леонтьева И. В. Нарушение клеточной энергетики при патологии миокарда, применение L-карнитина. М.: Медпрактика-М, 2009. 52 с. [Leont’eva I. V. Narushenie kletochnoj jenergetiki pri patologii miokarda, primenenie L-karnitina. M.: Medpraktika-M, 2009. 52 s. (in Russian)].
30. Scott I. The role of mitochondria in the mammalian antiviral system // Mitochondrion. 2010. Vol. 10. P. 316–320.
31. Scafidi S., Fiskum G., Lindauer S. L. et al. Metabolism of acetyl-L-carnitine for energy and neurotransmitter synthesis in the immature rat brain // J Neurochem. 2010. Vol. 114 (3). P. 820–831.
32. Асташкин Е. И., Глезер М. Г. Влияние L-карнитина на оксидативный стресс // Медицинский совет. 2016. № 10. С. 94–100 [Astashkin E.I., Glezer M. G. Vlijanie L-karnitina na oksidativnyj stress // Medicinskij sovet. 2016. № 10. S. 94–100 (in Russian)].
33. Накостенко Т. Н., Ключников С. О., Сухоруков В. С. Коррекция нарушений вегетативного гомеостаза и внутриклеточного энергообмена у часто болеющих детей // Вестник педиатрической фармакологии и нутрициологии. 2007. № 4 (1). С. 25–29 [Nakostenko T.N., Kljuchnikov S. O., Suhorukov V. S. Korrekcija narushenij vegetativnogo gomeostaza i vnutrikletochnogo jenergoobmena u chasto bolejushhih detej // Vestnik pediatricheskoj farmakologii i nutriciologii. 2007. № 4 (1). S. 25–29 (in Russian)].
34. Коровина Н. А., Творогова Т. М., Захарова И. Н., Тарасова А. А., Хрунова К. М. Эффективность энерготропной терапии при вегетативной дистонии с кардиальными изменениями у детей и подростков // Российский вестник перинатологии и педиатрии. 2008. № 6. С. 21–29 [Korovina N.A., Tvorogova T. M., Zaharova I. N., Tarasova A. A., Hrunova K. M. Jeffektivnost’ jenergotropnoj terapii pri vegetativnoj distonii s kardial’nymi izmenenijami u detej i podrostkov // Rossijskij vestnik perinatologii i pediatrii. 2008. № 6. S. 21–29 (in Russian)].
35. Ключников С. О., Ильяшенко Д. А., Ключников М. С. Обоснование применения L-карнитина и коэнзима Q10 у подростков // Вопросы современной педиатрии. 2008. № 7 (4). С. 102–104 [Kljuchnikov S.O., Il’jashenko D.A., Kljuchnikov M. S. Obosnovanie prime-nenija L-karnitina i kojenzima Q10 u podrostkov // Voprosy sovremennoj pediatrii. 2008. № 7 (4). S. 102–104 (in Russian)].
36. Скворцов В. В., Тумаренко А. В., Орлов О. В. Нейроциркуляторная дистония: актуальные вопросы диагностики и лечения // Лечащий врач. 2008. № 5. С. 12–17 [Skvorcov V.V., Tumarenko A. V., Orlov O. V. Nejrocirkuljatornaja distonija: aktual’nye voprosy diagnostiki i lechenija // Lechashhij vrach. 2008. № 5. S. 12–17 (in Russian)].
37. Фролова Т. В., Охапкина О. В. Клинические преимущества препарата Кардонат в лечении детей с вегетососудистой дистонией // Лiku Уkраiни. 2011. № 148 (2). С. 98–102 [Frolova T.V., Ohapkina O. V. Klinicheskie preimushhestva preparata Kardonat v lechenii detej s vegetososudistoj distoniej // Liku Ukraini. 2011. № 148 (2). S. 98–102 (in Russian)].
38. Морозов С. А. Состояние вегетативной регуляции и клеточной биоэнергетики у детей с гиперактивным мочевым пузырем для обоснования вегетотропной и энерготропной терапии: Автореф. дис. … канд. мед. наук. М., 2015. 24 с. [Morozov S. A. Sostojanie vegetativnoj reguljacii i kletochnoj biojener-getiki u detej s giperaktivnym mochevym puzyrjom dlja obosnovanija vegetotropnoj i jenergotropnoj terapii: Avtoref. Dis. … kand. med. nauk. M., 2015. 24 s. (in Russian)].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru


