Содержание статьи
Молекулярные механизмы воздействия метаболических пребиотиков на выживание позитивной микрофлоры
О. А. Громова*, 1, доктор медицинских наук, профессор
И. Ю. Торшин**, кандидат химических наук
А. Ю. Волков***, кандидат химических наук
А. В. Лисица****
Е. В. Гарасько*, доктор медицинских наук, профессор
* ГБОУ ВПО ИвГМА МЗ РФ, Иваново
** ГБОУ ВПО МФТИ, Москва
*** ГБОУ ВПО РНИМУ им. Н.И. Пирогова МЗ РФ, Москва
**** ВЦ им. А. А. Дородницына РАН, Москва
Дисбиоз кишечника — нарушение баланса между положительной и патогенной микрофлорой в сторону патогенной. Как правило, в терапии дисбиоза используются пробиотики (препараты активной микрофлоры) и пребиотики (олигосахариды, способствующие росту положительной микрофлоры). Весьма перспективным направлением терапии дисбиоза является использование водных субстратов продуктов обмена веществ положительной микрофлоры (например, препарат Хилак форте), которые, подобно пребиотикам, стимулируют рост нативной микрофлоры индивидуального пациента.
Данный препарат содержит водные субстраты продуктов метаболизма типичных представителей физиологической микробиоты (E. coli DSM, S. faecalis DSM, L. acidophilus DSM, L. helveticus DSM). Кроме того, препарат содержит значительные количества фосфорной, лимонной и молочной кислот, которые способствуют нормализации рН и росту позитивной микрофлоры желудочно-кишечного тракта (ЖКТ). Препарат способствует быстрому восстановлению нормофлоры кишечника, нарушенной во время применения антибиотиков, и показан при диспепсии, запорах или диарее, гастроэнтерите, аллергических кожных заболеваниях и острых кишечных инфекциях.
Проводимые российскими и зарубежными исследователями клинические работы показали высокую эффективность и безопасность использования препарата в клинической практике. Хилак форте используется в профилактике дисбактериоза после антибиотикотерапии [1], для поддержания микробиоценоза [2], эффективен как адаптоген [3] и успешно используется у пациентов с синдромом раздраженного кишечника [4–6]. Исследования фекалий на содержание короткоцепочечных летучих жирных кислот методом газожидкостной хроматографии у 30 пациентов с хроническими заболеваниями ЖКТ показали, что при применении Хилак форте отмечена нормализация уровней и соотношений короткоцепочечных летучих жирных кислот [7, 8].
Несмотря на подтвержденную клиническую эффективность препарата, сложный состав водных субстратов не позволяет однозначно указать на соответствующие молекулярные механизмы воздействия метаболических пребиотиков на выживание позитивной микрофлоры. В ходе бактериологических исследований были установлены различные вещества, которые могут влиять на выживание положительной микрофлоры: наличие пирофосфата, глутаминовая и янтарная кислоты [9] и др. В состав водных субстратов продуктов жизнедеятельности позитивной микрофлоры могут достоверно входить такие сигнальные молекулы, как ацил-гомосерин-лактоны, аутоиндуктор-2 (посредством которых контролируется образование бактериальных пленок положительной микрофлоры), метаболиты, необходимые для синтеза и переработки витаминов (витамин В6, витамин В2, витамин K, каротиноиды), пребиотические сахара (мелибиоза) и короткоцепочечные жирные кислоты. Эти молекулы могут являться действующим началом пребиотической активности препаратов [10, 11].
Важным компонентом любого природного водного субстрата являются макро- и микроэлементы (МЭ) [12]. В настоящей работе представлены результаты макро- и микроэлементного анализа состава препарата Хилак форте различных серий.
Материалы и методы исследования
Образцы препарата
Было исследовано 7 образцов препарата Хилак форте, каждый из которых принадлежал отдельной серии выпуска (табл. 1). После определения МЭ были рассчитаны среднеквадратичные отклонения содержания каждого из элементов.

Определение микроэлементного состава образцов
Растворы образцов анализировались на масс-спектрометре с ионизацией в индуктивно-связанной плазме VGPlasmaQuadPQ2 Turbo (Англия), рабочая мощность СВЧ-генератора 1,3 кВт, расход плазмообразующего газа (аргон) 14 л/мин, расход транспортирующего газа 0,89 мл/мин. Проводилось три экспозиции каждого образца, время интегрирования сигнала 60 с. Результаты анализа «холостой пробы» автоматически вычитались в анализе.
Результаты исследования
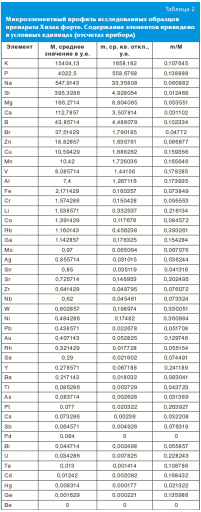
В результате исследования установлено содержание и вариации содержания 59 химических элементов в препарате Хилак форте (табл. 2).
Анализ показал высокое содержание калия и фосфора в исследованных образцах, что соответствует данным производителя о добавлении в препарат кислого фосфата калия и фосфорной кислоты. Уровни остальных элементов были на несколько порядков ниже.
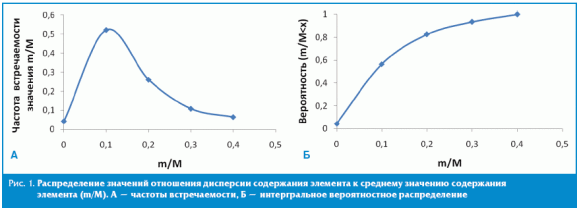
Представляется интересным анализ соотношения m/M между значениями средних значений содержания МЭ в исследованном препарате (M) и среднеквадратичным отклонением этих значений (m). Типичным значением отношения m/M было 0,1 (рис. 1А), то есть отклонение содержания МЭ в среднем составило 10% от содержания МЭ. При этом для 95% элементов (все, за исключением рубидия, никеля и вольфрама) соотношение m/M не превышало 0,3. Столь узкие рамки отклонений среднего содержания для элементов указывают на высокую степень стандартизации препарата.
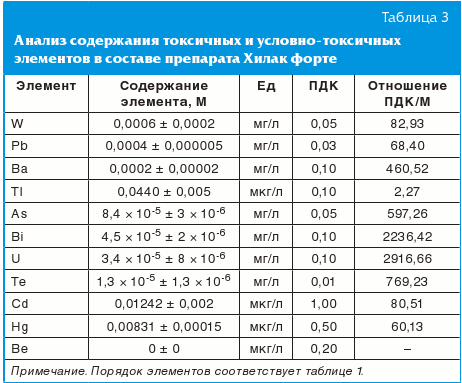
Полученные данные позволили провести анализ содержания токсичных и условно-токсичных элементов в составе препарата Хилак форте (табл. 3). Сравнение с установленными в РФ уровнями предельно допустимых концентраций (ПДК) по каждому элементу показало, что содержание и условно-токсичных элементов в препарате было ниже ПДК в 2–2240 раз, то есть Хилак форте характеризуется высокой степенью чистоты.
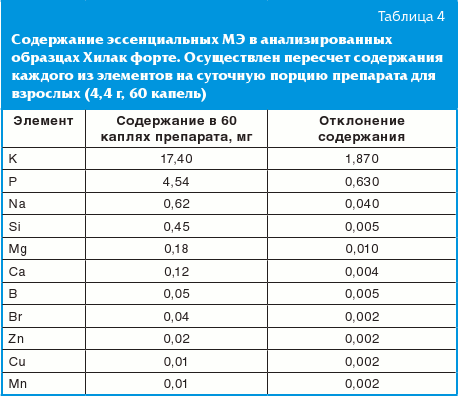
Были рассчитаны количества жизненно важных МЭ, входящих в состав препарата (табл. 4). За исключением макроэлементов калия и фосфора, содержание микроэлементов в суточной дозе препарата для взрослых (60 капель или 4400 мг) составляло менее 1 мг. Пирофосфат вызывает рост E. coli (на 25–35%) [13].
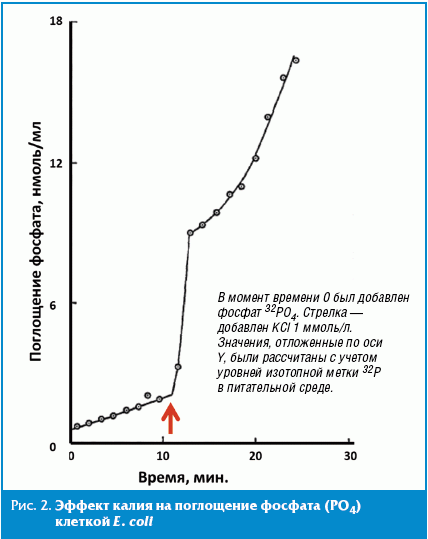
Калий является важным элементом, необходимым для поддержания функционирования микробиоты. Типичное содержание элементарного калия в искусственных питательных средах для E. coli составляет 20–100 ммоль/л; эффекты калия на выживание микробиоты наблюдаются уже при концентрациях 1 ммоль/л. При дефиците калия, в частности, распад стабильных белков клетки ускорялся в 2–3 раза, тогда как гидролиз короткоживущих белков не изменился [14]. Предположительно, калий необходим для всасывания клеткой фосфата. При выращивании кишечной палочки К-12 на калийсодержащих средах, рост колонии продолжается до тех пор, пока не израсходован весь внеклеточный калий. После этого темпы роста, потребление глюкозы и кислорода начинают постепенно уменьшаться, внутриклеточное содержание калия и фосфора падает [15]. Недостаток калия приводит также к падению внутриклеточных уровней аденозинтрифосфата (АТФ) на 40–75% — эффект, схожий с недостатком глюкозы в питательной среде [14, 15] (рис. 2 и 3). Уже в течение нескольких секунд после добавления K в среду наблюдается быстрое поглощение PO4 — средняя скорость поглощения выросла от 1,3 ± 0,2 до 6,5 ± 0,5.
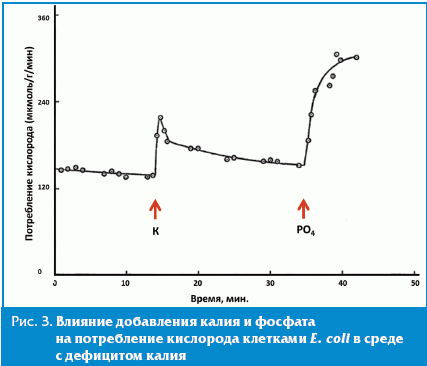
Добавление калия к питательной среде с дефицитом калия приводит также к увеличению потребления кислорода. Последующее добавление фосфата PO4 привело к возобновлению роста и устойчивого роста потребления кислорода (рис. 3). Таким образом, клетки сначала компенсируют недостаток калия и затем, после добавления фосфата, наблюдается устойчивый рост потребления кислорода.
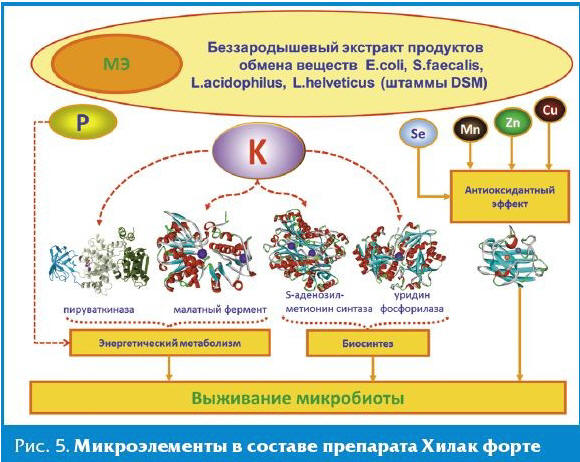
Ускорение поглощения калия и фосфата может быть обусловлено существованием ряда калий-зависимых ферментов в протеоме E. coli и других представителей микробиоты: пируваткиназы, малатдегидрогеназы и др. Пируваткиназа-1 (ген pykF в E. coli) и пируваткиназа-2 (ген pykA в E. coli) — один из ферментов гликолиза, осуществляющий взаимопревращения пируват и фосфоенолпирувата с образованием АТФ. Делеции генов пируваткиназ приводили к уменьшению потребления глюкозы, снижению уровней экспрессии генов гликолиза (glk, pgi, pfkA и tpiA), повышению экспрессии генов ppc (фосфоенолпируват карбоксилаза), pckA (фосфоенолпируват карбоксикиназа), maeB (НАДФ-малатдегидрогеназа, «малатный фермент» (НАДФ — никотинамидадениндинуклеотидфосфат)) и mdh (малатдегидрогеназа) [16] и другим нарушениям активности центральной метаболической сети E. coli [17]. Так как пируваткиназы являются калий-зависимыми ферментами (рис. 4), то дефицит калия будет приводить к сходным метаболическим эффектам. Восполнение дефицита калия, соответственно, будет стимулировать усвоение сахаров и интенсифицировать энергетический метаболизм клеток микробиоты.
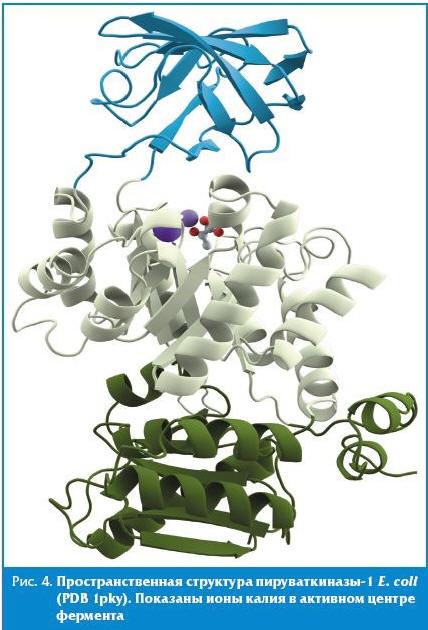
Калий необходим и для активности НАДФ-специфической малатдегидрогеназы (так называемого «малатного фермента», ген maeB), осуществляющего взаимопревращения S-малата (яблочной кислоты) и оксалоацетата в пируват при участии кофермента НАДФ [18, 19]. Калий связывается непосредственно с активным центром фермента с результирующим изменением конформации фермента, приводящей к повышению активности фермента [20].
S-аденозилметионинсинтаза (ген metK) катализирует образование S-аденозилметионина (SАМ) из метионина и АТФ. Ген metK имеет важное значение для выживания и роста E. coli: когда экспрессия гена низка, снижается метилирование ДНК, что существенно осложняет деление клеток [21]. Активность калий-зависимого фермента S-аденозилметионинсинтазы будет падать в условиях дефицита калия, что также будет затруднять клеточное деление.
Уридинфосфорилаза является ключевым ферментом регенерации пиримидина. Фермент активируется, в частности, в ответ на повреждение ДНК и катализирует обратимый гидролиз уридина в урацил и рибоза-1-фосфат [22]. Полученные молекулы затем используются в качестве источников углерода и энергии либо для использования полученных пиримидиновых оснований для синтеза новых нуклеотидов [23]. Уридинфосфорилаза — калий-зависимый фермент, и дефицит калия будет приводить к падению его активности, тормозя синтез дезоксирибонуклеиновой кислоты (ДНК) и энергетический метаболизм клеток микробиоты.
В препарате Хилак форте также содержится так называемый «антиоксидантный комплекс» МЭ (цинк, медь, марганец), необходимых для активации Cu, Zn-супероксиддисмутазы и Mn-супероксиддисмутазы — важнейших антиоксидантных ферментов, защищающих клетки от перекисных анионов. Магний в составе Хилак форте является одним из наиболее важных элементов энергетического метаболизма. Следует также отметить, что обнаруженные в Хилак форте жизненно важные элементы K, Mg, Ca, B, Br, Cu, Mn и, в особенности, Zn, необходимы для функционирования пейеровых бляшек, играющих значительную роль в поддержании иммунитета [24]. В составе препарата Хилак форте обнаружены следовые количества ультрамикроэлементов (Se, I, Cr, Mo, Co, Li, Rb и других).
Заключение
Результаты настоящего исследования указывают на высокую степень очистки и технологической стандартизации препарата Хилак форте. Практически полное отсутствие в составе препарата токсических и условно-токсических микроэлементов является существенно важным для обеспечения международных стандартов качества для лекарственных препаратов — GMP (Good Manufacturing Practice, надлежащая производственная практика) и GLP (Good Laboratory Practice, надлежащая лабораторная практика). Присутствие в составе препарата значительных количеств калия и фосфора специфически воздействует на определенные ферменты энергетического метаболизма и биосинтеза (рис. 5). Группа эссенциальных биоэлементов K, Mg, Ca, B, Br, Cu, Zn, Mn в составе Хилак форте участвуют в поддержании иммунитета и физиологического функционирования микробиоты. Таким образом, молекулярные компоненты препарата Хилак форте способствуют синтезу и переработке витаминов и короткоцепочечных жирных кислот, селена, а калий и другие микроэлементы в составе препарата принципиально важны для выживания клеток микробиоты посредством воздействия на энергетический метаболизм, способствуя рациональной терапии дисбактериоза кишечника [25].
Литература
- Florkiewicz H., Szurska G. Role of the hylak forte preparation in the prevention of dysbacteriosis following intraoral antibiotic therapy // Pol Tyg Lek. 1963; 18: 1066–1068.
- Копанев Ю. А. Применение Хилак форте для коррекции микроэкологических нарушений и функциональных расстройств у детей и взрослых // Трудный пациент. 2007. Т. 5. № 10. С. 46–52.
- Плоскирева А. А., Усенко Д. В., Горелов А. В. Адаптогенные свойства метаболитного пребиотика хилак форте // Инфекционные болезни. 2010. Т. 8. № 1. С. 48–54.
- Агафонова Н. А., Яковенко Э. П., Иванов А. Н., Яковенко А. В., Прянишникова А. С. Особенности терапии больных с постинфекционным синдромом раздраженного кишечника // Фарматека. 2011. № 15. С. 50–55.
- Бурков С. Г., Макух Е. А. Синдром раздраженного кишечника в поликлинической практике. Фарматека. 2009. № 8. С. 60–64.
- Ардатская М. Д. Пре- и пробиотики в коррекции микроэкологических нарушений кишечника // Фарматека. 2011. № 12. С. 62–68.
- Грачева Н. М., Малышев Н. А., Леонтьева Н. И., Кондракова О. А., Партин О. С., Соловьева А. И., Затевалов А. М., Кошкина Н. К. Восстановление метаболитного статуса кишечной микрофлоры у больных хроническими заболеваниями желудочно-кишечного тракта // Инфекционные болезни. 2006. Т. 4. № 2. С. 37–41.
- Чернусь Н. П. Особенности микробиоценоза толстой кишки у пациентов с функциональными запорами и его коррекция пробиотиком Хилак форте // Клиницист. 2006. № 3. С. 47–53.
- Vakhitov T. Ia., Protasov E. A., Visnol’d N. V., Tolparov Iu. T., Petrov L. N. Isolation and identification of growth stimulators of Escherichia coli M-17 // Zh Mikrobiol Epidemiol Immunobiol. 2003; (2): 7–12.
- Лиманова О. А., Гарасько Е. В., Торшин И. Ю., Громова О. А. Избирательная модуляция позитивной микрофлоры кишечника — новая концепция воздействия метаболического пребиотика Хилак форте // Фарматека. 2012, № 20, 53–37.
- Громова О. А., Торшин И. Ю., Гришина Т. Р., Гарасько Е. В. Механизмы молекулярного воздействия метаболического пребиотика Хилак форте на кишечную биофлору и обмен витаминов // Russian Union Medical Professions, Журнал Гастро. 2013, № 1, 11–16.
- Торшин И. Ю., Громова О. А. 25 мгновений молекулярной фармакологии. А-Гриф, 2012, 678 с.
- Biville F., Laurent-Winter C., Danchin A. In vivo positive effects of exogenous pyrophosphate on Escherichia coli cell growth and stationary phase survival // Res Microbiol. 1996; 147 (8): 597–608.
- St. John A. C., Goldberg A. L. Effects of starvation for potassium and other inorganic ions on protein degradation and ribonucleic acid synthesis in Escherichia coli // J Bacteriol. 1980; 143 (3): 1223–1233.
- Weiden P. L., Epstein W., Schultz S. G. Cation transport in Escherichia coli. VII. Potassium requirement for phosphate uptake // J Gen Physiol. 1967; 50 (6): 1641–1661.
- Siddiquee K. A., Arauzo-Bravo M. J., Shimizu K. Effect of a pyruvate kinase (pykF-gene) knockout mutation on the control of gene expression and metabolic fluxes in Escherichia coli // FEMS Microbiol Lett. 2004; 235 (1): 25–33.
- Meza E., Becker J., Bolivar F., Gosset G., Wittmann C. Consequences of phosphoenolpyruvate: sugar phosphotranferase system and pyruvate kinase isozymes inactivation in central carbon metabolism flux distribution in Escherichia coli // Microb Cell Fact. 2012; 11: 127 doi.
- Wang B., Wang P., Zheng E., Chen X., Zhao H., Song P., Su R., Li X., Zhu G. Biochemical properties and physiological roles of NADP-dependent malic enzyme in Escherichia coli // J Microbiol. 2011; 49 (5): 797–802 doi.
- Stols L., Donnelly M. I. Production of succinic acid through overexpression of NAD (+)-dependent malic enzyme in an Escherichia coli mutant // Appl Environ Microbiol. 1997; 63 (7): 2695–2701.
- Brown D. A., Cook R. A. Regulatory effects of potassium and inorganic anions on the NADP-specific malic enzyme of Escherichia coli // Can J Biochem Cell Biol. 1985; 63 (2): 128–136.
- Wei Y., Newman E. B. Studies on the role of the metK gene product of Escherichia coli K-12 // Mol Microbiol. 2002; 43 (6): 1651–1656.
- Khil P. P., Camerini-Otero R. D. Over 1000 genes are involved in the DNA damage response of Escherichia coli // Mol Microbiol. 2002; 44 (1): 89–105.
- Caradoc-Davies T. T., Cutfield S. M., Lamont I. L., Cutfield J. F. Crystal structures of Escherichia coli uridine phosphorylase in two native and three complexed forms reveal basis of substrate specificity, induced conformational changes and influence of potassium // J Mol Biol. 2004; 337 (2): 337–354.
- Ребров В. Г., Громова О. А. Витамины, макро- и микроэлементы. М.: Геотар, 2008, 700 с.
- Таболин В. А., Бельмер С. В., Гасилина Т. В., Мухина Ю. Г., Корнева Т. И. Рациональная терапия дисбактериоза кишечника у детей. Методические рекомендации. М., 1998.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru


