Модифицированная Пилобакт АМ-основанная терапия
Введение
Распространенность Helicobacter pylori по-прежнему остается достаточно высокой, несмотря на активно проводимую эрадикационную терапию. По данным Н.В. Захаровой и соавт., инфицированность H. pylori в Санкт-Петербурге составляет 50% от всего населения [1]. С другой стороны, эрадикация H. pylori приводит к гистологической ремиссии хронического гастрита, прерывает цепь событий в каскаде Корреа за счет снижения активности воспалительного процесса и уменьшения выраженности атрофии и метаплазии слизистой оболочки желудка, установленных гистологически в соответствии с классификацией OLGA (Operative Link for Gastritis Assessment) или OLGA-IM (OLGA-intestinal metaplasia). По данным M. Kodama et al., выраженность атрофии и интестинальной метаплазии существенно снижается через 10 лет после эрадикации [2]. Метаанализ
16 исследований Y.J. Kong et al. выявил существенное снижение выраженности атрофии слизистой оболочки желудка в антральном отделе и теле желудка, а также интестинальной метаплазии в антральном отделе [3]. Следовательно, эрадикация H. pylori оказывает не только прямое действие на снижение и устранение воспалительного процесса в слизистой желудка, заживление язвенного дефекта и предупреждение развития рецидивов и повторных кровотечений (как при язвенной болезни, так и при использовании нестероидных противовоспалительных препаратов на фоне наличия H. pylori), развитие гистологической ремиссии на ранних стадиях мальтомы желудка, но и приводит к хорошим отдаленным результатам — уменьшению выраженности атрофии и интестинальной метаплазии и в конечном счете к снижению заболеваемости раком дистального отдела желудка. Отсюда становится понятным, насколько важна адекватная эрадикация H. pylori в клинической практике. По данным Кохрейновского обзора, эрадикация Н. рylori снижает уровень заболеваемости раком желудка на 34% [4]. Данные метаанализа Y.C. Lee et al. доказывают высокую эффективность эрадикации Н. рylori в предупреждении развития рака желудка [5]. В России также отмечены факты снижения заболеваемости раком дистального отдела желудка [6, 7], связанные с эрадикацией H. pylori. Огромное значение эрадикации H. pylori отражено в многочисленных положениях и рекомендациях, принятых в последние годы медицинскими сообществами [8–20]. Необходимость эрадикации H. pylori у всех инфицированных этим возбудителем пациентов согласуется с Киотским консенсусом по хеликобактерному гастриту, Маастрихтским V и Хьюстонским консенсусами [8, 10, 20]. Реалии XXI в. таковы, что отмечено существенное снижение эффективности ранее применявшихся антихеликобактерных режимов, в т. ч. в России. Предикторами низкой эффективности антихеликобактерной терапии являются разные факторы, основными из которых признаны: резистентность возбудителя, недостаточный кислотосупрессивный эффект, низкая комплаентность.
Содержание статьи
Предикторы низкой эффективности антихеликобактерной терапии:
резистентность возбудителя к антибактериальным препаратам;
полиморфизмы CYP2C19 (*1/*1; *1/*1 +*17; 1/1 +*17/*17), гена гликопротеина P MDR1 (C3435T), T/T генотип, гена интерлейкина 1β (C-511T) — С/С генотип;
низкая комплаентность пациентов;
высокая степень обсемененности слизистой оболочки желудка H. pylori;
наличие H. pylori в ротовой полости;
Cag A негативные штаммы и vacA s2 генотип;
dup A ген H. pylori;
гиперацидность;
курение;
употребление алкоголя;
низкая антиоксидантная активность;
ошибки в назначении антихеликобактерной терапии;
возраст старше 50 лет;
частое употребление продуктов, снижающих рН в желудке.
Преимущественными вариантами эрадикации H. pylori являются 14-дневная тройная терапия, 14-дневная сопутствующая терапия, 14-дневная висмут-содержащая квадротерапия, 14-дневная фуразолидон-содержащая терапия. Но все эти варианты не являются оптимальными в соответствии с критериями Киотского соглашения и исследований D. Graham, т. к. процент эрадикации H. pylori при использовании их <90–95% [8, 21]. Существуют различные
методы, позволяющие повысить эффективность применяемых в клинической практике антихеликобактерных режимов.
Методы повышения эффективности антихеликобактерной терапии:
Направленная терапия с учетом бактериальной резистентности и генотипического полиморфизма CYP2C19, индивидуализированная антихеликобактерная терапия с учетом особенностей микро- и макроорганизмов.
Увеличение продолжительности, кратности приема или дозы компонентов антихеликобактерного режима.
Применение двойных доз ингибиторов протонной помпы (ИПП). Использование новых, более сильных кислотосупрессивных препаратов (К-конкурентные блокаторы протонной помпы — вонопразан), контроль кислотопродукции в процессе проведения антихеликобактерного режима и поддержание ее на определенном уровне.
Применение 3 антибактериальных препаратов одновременно и использование новых антибактериальных препаратов, применение природных антибиотиков (пилорицидин А, В и С), природных антимикробных пептидов (кателицидины и дефензины), производных бензимидазола, полициклических компонентов.
Комбинирование антихеликобактерной терапии и санации ротовой полости (устранение гингивита, периодонтита и др.).
Влияние на биопленку Н. pylori (ацетилцистеин, комплекс протеиназ, ингибиторы quorum sensing, наночастицы серебра, наноэмульсии, лактоферрин и др.), адъювантное применение пробиотиков, пребиотиков или метабиотиков.
Включение в схему лечения ребамипида, пиридодиазепинов, сульфаниламидов.
Фитотерапия (экстракт корневища имбиря, красный и чили перец (капсаицин), брокколи (сульфорафан), экстракт красного женьшеня, зеленый чай, зверобой, гвоздика), виноград, клюквенный сок, куркумин, концентрированный раствор меда, красное вино (ресвератрол), витаминные добавки (витамины С и Е).
Использование специальных систем доставки лекарств в желудок (gastro retentive drug delivery sestems — GRDDS), микро- и наночастиц различных лекарственных препаратов.
Можно предполагать, что увеличение продолжительности Пилобакт АМ-основанного антихеликобактерного режима с 7 до 14 дней, увеличение дозы омепразола с 40 мг/сут до 80 мг/сут и включение в состав коллоидного субцитрата висмута при адъювантном применении пребиотического комплекса приведет к существенному повышению показателей эрадикации H. pylori без увеличения числа нежелательных явлений. Все вышеизложенное послужило основанием для изучения эффективности применения модифицированной Пилобакт АМ-основанной терапии (МПАМОТ) для эрадикации H. pylori.
Введение в антихеликобактерный режим пребиотического комплекса также может повышать эффективность лечения [22–30]. Пребиотический комплекс селективно стимулирует рост и/или активность ограниченного количества бактерий микробиоты, пребиотики обладают резистентностью к пищеварительному процессу в верхнем отделе ЖКТ, ферментируются кишечной микробиотой, оказывают доказанное синергическое действие на микрофлору кишечника [22]. Пребиотики хорошо переносятся, действуют на протяжении всей толстой кишки, оказывают противоинфекционное действие (за счет синтеза пропионата), обладают высокой эффективностью [23–27]. Действие пребиотика не зависит от жизнеспособности культуры, при этом поддерживается собственная микрофлора, а не заселяется чужеродная. Пробиотики же создают положительный эффект при дисбиозе, но не всегда и не такой, как предполагалось [28]. У каждого второго при использовании пробиотика проявляются антагонистические свойства по отношению к микроорганизмам хозяина; биосовместимость — 15% [29].
Цель исследования: определить эффективность
МПАМОТ у пациентов, инфицированных Н. рylori .
Для достижения намеченной цели поставлены следующие задачи:
Оценить показатели эрадикации Н. рylori у всех пациентов, вошедших в исследование.
Оценить показатели эрадикации Н. рylori у всех пациентов, прошедших курс лечения.
Оценить частоту нежелательных явлений среди всех вошедших в исследование пациентов (intention to treat — ITT) и всех пациентов, прошедших курс лечения (per protocolum — PP).
Сравнить МПАМОТ со стандартной 7-дневной Пилобакт АМ-основанной терапией (СПАМОТ) и направленной антихеликобактерной терапией.
Оценить частоту нежелательных явлений (диарея, тошнота, абдоминальный дискомфорт, изменения вкуса) при МПАМОТ и СПАМОТ.
Материал и методы
Проведено двухцентровое контролируемое многофакторное исследование по специально разработанному протоколу в соответствии со стандартами GCP (Good Clinical Practice). Все пациенты подписывали информированное согласие. В 1-й исследуемой группе (n=201) мужчин 90, женщин — 111. Возраст варьировал от 18 до 87 лет (средний возраст 47,9±6,9 года). Средний рост — 168,3±9,5 см. Масса тела — 73,2±11,7 кг. Среди пациентов 177 — с Н. рylori—
индуцированным хроническим гастродуоденитом, 19 — с язвенной болезнью, с локализацией язвы в луковице двенадцатиперстной кишки, 5 — с язвенной болезнью желудка. Пациенты 1-й группы получали 14-дневную МПАМОТ — препарат Пилобакт АМ (в соответствии с инструкцией к данному комплексному препарату), в состав которого входят омепразол 20 мг, амоксициллин 1000 мг и кларитромицин 500 мг, 2 р./сут и дополнительно омепразол 20 мг 2 р./сут за 30–45 мин до завтрака и ужина, коллоидный субцитрат висмута (КСВ) 240 мг 2 р./сут через 40–60 мин после завтрака и ужина 14 дней и комплекс пребиотиков 5,0 × 2 р./сут 28 дней. Во 2-й группе (n=15) пациенты получали СПАМОТ — омепразол 20 мг 2 р./сут, амоксициллин 1000 мг и кларитромицин 500 мг 2 р./сут — 7 дней. Сравниваемые группы не имели статистически значимых различий по возрастным, половым и другим критериям, в т. ч. по нозологическим формам, частоте и выраженности симптомов до лечения, которые могли бы повлиять на результаты исследования. Обоснованием для 14-дневного курса послужили данные Кохрейновского метаанализа по оценке эффективности антихеликобактерного режима в зависимости от его продолжительности [31]. Обоснованием введения в антихеликобактерный режим КСВ являются данные о существенном повышении показателей эрадикации Н. рylori [32, 33]. В антихеликобактерный режим ввели пребиотический комплекс с фруктоолигосахаридами, гуммиарабиком, лактитолом.
Диагностику Н. рylori проводили с помощью быстрого уреазного теста (Biochit), гистологически, а установление эрадикации Н. рylori через 1 мес. после окончания приема всех препаратов — путем определения антигена Н. рylori в стуле и уреазного дыхательного теста с меченым углеродом, что соответствовало положениям 20, 21 и 27 Хьюстонского консенсуса по диагностике H. pylori в США. Факт эрадикации устанавливали только при отрицательных результатах обоих валидированных тестов.
Результаты исследования и их обсуждение
Антибиотик-ассоциированная диарея (ААД) была выявлена у 12 из 201 среди всех вошедших в исследование (ITT) — 5,97% и у 12 из 199 пациентов 1-й группы, прошедших лечение по протоколу (PP), — 6,03%. Во 2-й группе у пациентов, которым проводилась СПАМОТ, — 14,3% ITT и 13,3% PP. Таким образом, ААД встречалась в 2 раза чаще при проведении СПАМОТ, чем при МПАМОТ, несмотря на более короткий курс антихеликобактерного режима. Данные различия связаны с включением в модифицированный режим комплекса пребиотиков, что согласуется с ранее полученными данными по их применению в составе антихеликобактерных режимов.
Другие нежелательные явления (тошнота, абдоминальный дискомфорт, изменения вкуса) были отмечены в 1-й группе у 32 из 201 пациента — 15,9% ITT и у 32 из 199 пациентов — 16,1% PP, во 2-й группе — у 4 из 15 пациентов — 26,7% ITT, у 4 из 14 — 28,6% PP. Суммарно все нежелательные явления встречались в 1-й группе у 21,9% ITT и у 22,1% PP против, соответственно, во 2-й группе у 41% ITT и у 41,9% PP. Несмотря на большую продолжительность МПАМОТ (14 дней), увеличение дозы омепразола до 80 мг/сут и введение в режим КСВ, суммарно количество нежелательных явлений не только не увеличилось, но за счет введения комплекса пребиотиков уменьшилось в 2 раза.
Удовлетворенность и приверженность проводимому лечению были выше в 1-й группе. Так, если из исследования в 1-й группе (201 пациент) выбыли только 2 пациента (1%), то во 2-й группе — 1 из 15 пациентов, вступивших в исследование (6,7%). В 1-й группе пациентов, которым проводилась МПАМОТ, из 201 пациента, вошедшего в исследование по протоколу, закончили лечение 199 пациентов. Среди закончивших лечение эрадикация Н. pylori была установлена у 191 пациента — 96% PP, у 95% ITT. Во 2-й группе пациентов, которым проводилась СПАМОТ, эрадикация была установлена у 8 из 14 прошедших лечение — 57% PP и у 53% пациентов ITT (рис. 1).
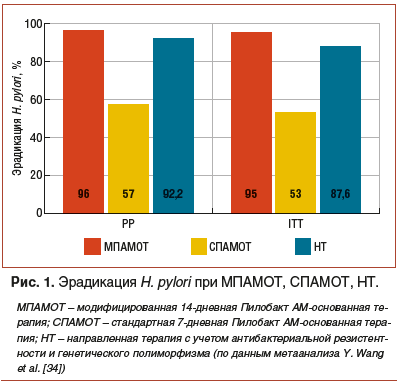
С учетом этих данных набор во 2-ю группу был прекращен из-за неудовлетворительных результатов эрадикации Н. pylori (неэтичность дальнейшего использования такого режима), несоответствующих современным критериям эффективности антихеликобактерных режимов (не менее 90–95%). Различия между сравниваемыми группами считали статистически значимыми при р<0,01. В соответствии с положением 9 второго раздела консенсуса Ирландской рабочей группы по диагностике и лечению Helicobacter pylori у взрослых в Ирландии 7-дневная стандартная тройная терапия больше не может быть рекомендована [35].
Cравнение полученных в исследовании данных применения МПАМОТ с данными эрадикации Н. pylori при использовании направленной терапии, проводимой с учетом индивидуальной или популяционной резистентности H. pylori к антибактериальным препаратам либо с учетом генотипа метаболизма ИПП (индивидуальный или популяционный), свидетельствует о том, что МПАМОТ не уступает направленной терапии (95% PP и 94% ITT). Высокие показатели эрадикации Н. рylori при проведении МПАМОТ обусловлены рядом обстоятельств. Прежде всего это связано с оптимальной продолжительностью данного антихеликобактерного режима — 14 дней и согласуется с данными Кохрейновского обзора, рекомендациями Маастрихтского IV консенсуса (положение 10, раздел 2), Маастрихтского V консенсуса (положения 5 и 8, раздел 3). Большое значение при проведении антихеликобактерного лечения имеет создание оптимальных условий для действия применяемых антибактериальных препаратов, что достигается использованием высоких доз ИПП 2 р./сут и согласуется с положением 10 Маастрихтского V консенсуса и Маастрихтского IV консенсуса (положение 9). Увеличение дозы омепразола до 80 мг/сут повышает показатели эрадикации Н. pylori у пациентов с кларитромицин-резистентными штаммами почти на 20% — при использовании омепразола 40 мг/сут в составе хеликобактерного режима эрадикация Н. pylori составила 66,6% против 86% при использовании 80 мг/сут [36]. Более высокие показатели эрадикации H. pylori при использовании двойных доз, в т. ч. омепразола (95% при применении в составе антихеликобактерного режима с амоксициллином, кларитромицином и КСВ), подтверждаются данными Панъевропейского регистра лечения H. pylori [37] и сравнимо с полученными в нашем исследовании данными. Удвоение дозы омепразола до 80 мг незначительно удорожает антихеликобактерную терапию, но будет доступнее по цене, в отличие от использования других ИПП, что согласуется с данными, представленными D. Graham et al. [38].
В Санкт-Петербурге в соответствии с ранее проведенным нами изучением структуры генотипического полиморфизма CYP2C19 каждый третий пациент является «ультрабыстрым» метаболизатором (имеет 1 или 2 дополнительных *17 аллеля). *17 аллель гена CYP2C19 ассоциирован с повышенной активностью данного изофермента. Данный характер метаболизма ИПП предрасполагает к недостаточному эффекту при лечении пациентов с кислотозависимыми заболеваниями, что ведет к развитию рефрактерной ГЭРБ или снижению показателей эрадикации хеликобактерной инфекции. Из 1227 обследованных пациентов у 37,8% (n=502) был выявлен ультрабыстрый метаболизм, у 34,6% (n=459) — быстрый метаболизм, у 18,5% (n=245) — промежуточный метаболизм, у 7,4% (n=98) — неидентифицируемый метаболизм и у 1,7% (n=23) — медленный метаболизм. Суммарно экстенсивные метаболизаторы составили 72,4% (рис. 2).
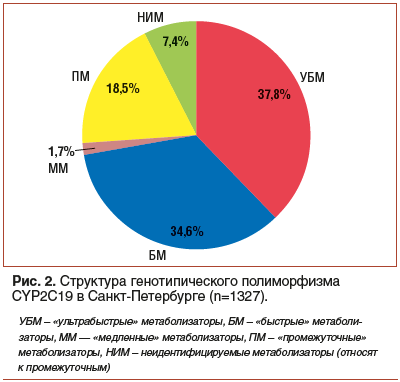
Таким образом, на практике почти 2/3 пациентов будут нуждаться в коррекции дозы ИПП или их соответствующем выборе для предупреждения низкой эффективности применения ИПП, что может быть достигнуто, например, увеличением дозы омепразола в 2 раза. Метаболический уровень омепразола у носителей 2 аллелей в 4 раза выше у «ультрабыстрых» метаболизаторов, и в 2 раза выше у «быстрых» метаболизаторов, что обусловливает более низкие показатели AUC (площадь под фармакокинетической кривой) у экстенсивных метаболизаторов [39]. Соответственно кислотосупрессивный эффект у них будет существенно ниже, чем у «медленных» метаболизаторов. Чувствительность Н. pylori к кларитромицину наиболее высокая при нейтральном рН. Снижение рН до 5,75 приводит к потере эффективности кларитромицина в 8–32 раза [40]. Увеличение дозы омепразола в 2 раза при проведении МПАМОТ позволяет создать оптимальные условия для эрадикации H. pylori.
Метаанализ направленной терапии, проведенный H. Chen et al., выявил преимущество данного варианта лечения перед эмпирической терапией 1-й линии [41]. В метаанализ были включены 13 исследований, из которых 10 учитывали чувствительность H. pylori к различным антибактериальным препаратам, 3 — генотипический полиморфизм CYP2C19. В двух исследованиях эмпирическая терапия была более эффективной, чем направленная. Сопутствующая терапия проявляла более высокую эффективность для метронидазол-резистентных и кларитромицин-резистентных штаммов [34], что, естественно, должно учитываться при проведении эрадикации H. pylori в России, и в частности Санкт-Петербурге. Проведенное исследование доказало высокую эффективность и безопасность МПАМОТ, которая является, по сути, сопутствующей терапией. Высокая эффективность эрадикации H. pylori в нашем исследовании связана с тем, что удвоение дозы омепразола позволяет предупредить вероятность влияния экстенсивного метаболизма ИПП на результаты лечения, что может быть предупреждено выбором ИПП или удвоением дозы (омепразол 80 мг/сут), а также созданием оптимальных условий для действия антибактериальных средств с усилением антихеликобактерного действия за счет введения в режим также КСВ. Полученные результаты эрадикации H. pylori при проведении МПАМОТ не уступают результатам направленной терапии, но при этом не требуется определение чувствительности H. pylori к антибактериальным препаратам и определение типа метаболизма ИПП, что позволяет назначить этиопатогенетическое лечение существенно раньше.
Учитывая высокую эффективность МПАМОТ, данный вариант антихеликобактерной терапии можно рекомендовать в качестве 1-й линии лечения, что позволит преодолеть возможную резистентность H. pylori к различным антибактериальным препаратам, влияние генотипического полиморфизма CYP2C19 и даст возможность проводить антихеликобактерную терапию эмпирически.
Выводы
МПАМОТ у пациентов, инфицированных H. pylori, может быть рекомендована для проведения 1-й линии терапии.
МПАМОТ является высокоэффективным и безопасным вариантом лечения заболеваний, ассоциированных с H. pylori.
МПАМОТ исключает необходимость проведения дополнительных исследований, направленных на определение чувствительности H. pylori и типа метаболизма ИПП.
МПАМОТ не уступает направленной терапии, проводимой с учетом антибактериальной чувствительности и/или генотипического полиморфизма СYP2С19.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Информация с rmj.ru





