Содержание статьи
Введение
В марте 2020 г. Всемирная организация здравоохранения объявила пандемию новой коронавирусной инфекции (COVID-19), вызываемой вирусом SARS-CoV-2. Первичной мишенью вируса стала дыхательная система, однако по мере увеличения числа клинических наблюдений стало очевидным вовлечение в патологический процесс сердечно-сосудистой системы.
Миокардит — воспалительное заболевание сердца, при котором вирусы рассматриваются как наиболее вероятный этиологический фактор [1]. При этом патогенетические механизмы воздействия вирусов на сердце до конца не ясны. Известно как о прямом повреждающем действии вирусов на клетки миокарда, так и об иммуноопосредованном [2]. В настоящее время кардиотропность SARS-CoV-2 обсуждается. Прямое повреждающее действие SARS-CoV-2 связывают с его проникновением в кардиомиоциты через рецепторы ангиотензинпревращающего фермента-2 (АПФ-2), что, вероятно, приводит к развитию миокардита. Иммуноопосредованное действие можно объяснить формированием патологического системного воспалительного ответа, называемого еще «цитокиновым штормом», при котором отмечается гиперпродукция цитокинов (интерлейкинов (ИЛ) -6, ИЛ-7, ИЛ-22, ИЛ-17 и др.), что приводит к повреждению ткани миокарда и полиорганной недостаточности [3, 4]. Дополнительную роль в повреждении миокарда могут играть поражение микроциркуляторного русла, связанное с прямым повреждающим действием вируса на клетки эндотелия и развитием эндотелиальной дисфункции, а также метаболический дисбаланс между потребностью миокарда в кислороде и его доставкой [5]. Последнее нарушение обусловлено развитием гипоксемии на фоне повреждения легочной ткани и описанного некоторыми авторами прямого повреждающего воздействия вируса на эритроциты, при котором SARS-CoV-2 способен связываться с бета-цепью гидроксигемоглобина, в результате чего порфирин диссоциирует от железа, что приводит к гемической гипоксии [6]. Существенная роль отводится дисбалансу в ренин-ангиотензин-альдостероновой системе (РААС), который развивается из-за снижения экспрессии рецепторов АПФ-2 при высокой вирусной нагрузке SARS-CoV-2. При этом падает уровень защитного ангиотензина (АТ) на фоне роста количества АТ II, который вызывает активацию симпато-адреналовой системы, повышение артериального давления, увеличение потребности миокарда в кислороде, вазоконстрикцию, развитие фиброза, активацию воспалительных цитокинов и нарушения в системе гемостаза [4, 7]. Описанные патогенетические механизмы могут способствовать развитию миокардиального повреждения в рамках COVID-19, а также приводить к прогрессированию имеющихся у пациента сердечно-сосудистых заболеваний. Отдельного обсуждения заслуживает кардиотоксичность используемых при лечении COVID-19 лекарственных средств как этиологический фактор развития миокардиального поражения. По мнению некоторых авторов [8, 9], применение определенных препаратов может инициировать развитие лекарственного миокардита.
Частота миокардитов, ассоциированных с COVID-19, точно не установлена. Диагностика миокардита представляет определенные сложности, особенно в условиях ведения пациентов с COVID-19. «Золотым стандартом» диагностики остается эндомиокардиальная биопсия (ЭМБ), проведение которой у пациентов с COVID-19 далеко не всегда представляется возможным [10]. Наиболее доступными методами инструментального обследования пациентов с предполагаемым поражением сердца в условиях ковидных клиник остаются электрокардиография (ЭКГ) и эхокардиография (ЭхоКГ), а также лабораторные методы (тропонины, мозговой натрийуретический пептид, С-реактивный белок и др.) [11, 12]. Однако результаты этих исследований не всегда напрямую свидетельствуют именно о воспалительном характере поражения миокарда. В этой связи в литературе часто используют термин «миокардиальное повреждение», а не «миокардит», подразумевая, что за этим понятием скрывается довольно большой круг патологий, включающий и воспалительное поражение миокарда [3, 4, 9, 13].
Проанализировав доступные литературные источники, содержащие результаты ЭМБ и аутопсий пациентов с новой коронавирусной инфекцией, R. Kawakami et al. [5] пришли к выводу о том, что миокардит в рамках COVID-19 является достаточно редким клиническим проявлением; частота подтвержденного миокардита в образцах ткани миокарда суммарно составила 4,5%. Согласно другому источнику [14] около 7% смертей пациентов с COVID-19 обусловлено миокардитом. Магнитно-резонансная томография (МРТ) сердца — информативный неинвазивный визуализирующий метод диагностики миокардита — к сожалению, тоже не является общедоступной. В этой связи накопление информации о клинических проявлениях миокардита приобретает первостепенное значение для клиницистов.
Клинические проявления миокардитов, ассоциированных с COVID-19
Клинические проявления миокардита весьма разнообразны ввиду различия форм, характера течения заболевания, гендерных особенностей и наличия коморбидных состояний пациента [2, 15, 16]. Спектр клинических проявлений может варьировать от легких симптомов, таких как дискомфорт в груди, одышка и утомляемость, до более серьезных симптомов, связанных с право- и левожелудочковой недостаточностью, кардиогенным шоком, аритмией и внезапной сердечной смертью при фульминантном миокардите [15]. По данным крупного метаанализа [17] 10 исследований с участием 1995 пациентов с COVID-19, общими симптомами у них были лихорадка (88,5%), кашель (68,6%), миалгия или усталость (35,8%), кашель с мокротой (28,2%) и одышка (21,9%), а также головная боль или головокружение (12,1%), диарея (4,8%), тошнота и рвота (3,9%). Как было отмечено, фактическая частота миокардитов, ассоциированных с COVID-19, не установлена. Для сравнительной оценки клинических проявлений, возникающих у пациентов с миокардитом, ассоциированным с новой коронавирусной инфекцией, приводим данные нескольких наиболее значимых метаанализов [18–21], в которые были включены клинические наблюдения пациентов с установленным диагнозом «миокардит» (см. таблицу).
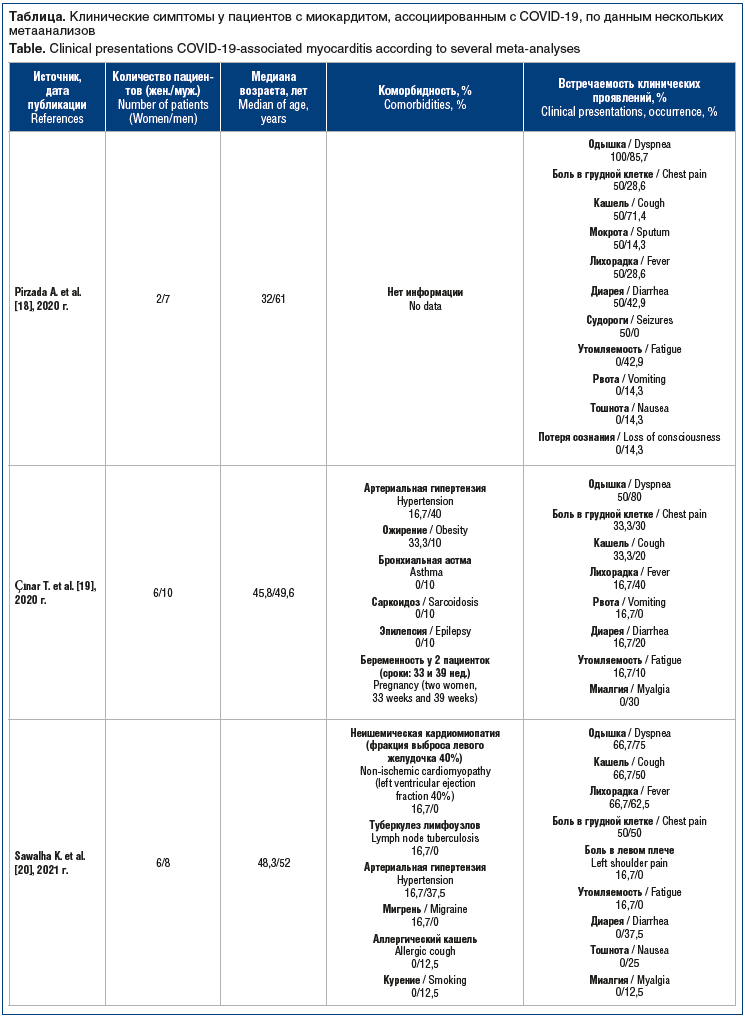
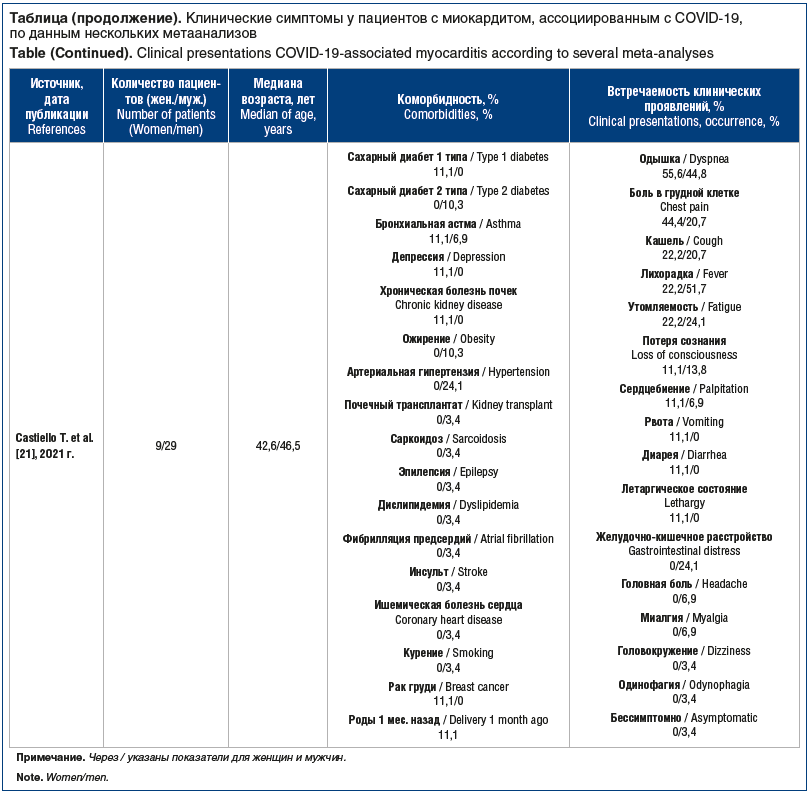
Суммируя данные представленных метаанализов [18–21], можно сделать вывод, что у пациентов с миокардитом, ассоциированным с COVID-19, выявляются в основном неспецифичные жалобы: одышка, лихорадка, кашель. Эти клинические проявления ожидаемы и у пациентов без поражения сердца. Боли в грудной клетке, «перебои» в работе сердца не были ведущими симптомами. В своем обзоре К. Sawalha et al. [20] также отметили, что среди пациентов с миокардитом, ассоциированным с COVID-19, часто регистрировались нарушения гемодинамики в виде шоков (64%), из которых 71% — кардиогенный, 29% — смешанный (кардиогенный и септический шок). Практически все метаанализы демонстрируют преобладание мужчин среди пациентов с миокардитом, ассоциированным с новой коронавирусной инфекцией. Возраст пациентов в выборках был различен, но большинство было старше 50 лет. Там, где имелась возможность установить коморбидность пациентов с COVID-19, у мужчин преобладали артериальная гипертензия, сахарный диабет, ожирение. Среди женщин фертильного возраста у нескольких пациенток поражение миокарда развилось на поздних сроках беременности и в послеродовом периоде, возможно, эти периоды могут быть опасны в плане развития воспалительного миокардиального повреждения [22]. По данным большинства исследователей [20, 23], летальность у пациентов с сочетанной патологией была выше, чем у пациентов без сопутствующих заболеваний.
Опубликованные недавно результаты проспективного эпидемиологического когортного исследования CORONA Germany [24] продемонстрировали почти пятикратное увеличение риска смерти у госпитализированных пациентов с COVID-19 при манифестации клинических проявлений острых сердечно-сосудистых событий. Однако не стоит забывать, что существует категория пациентов, у которых симптомы со стороны сердечно-сосудистой системы отсутствуют, при этом есть лабораторное подтверждение миокардиального повреждения в виде повышения уровня сердечных тропонинов. Некоторые авторы [25, 26] связывают случаи внезапной сердечной смерти у пациентов с нетяжелым течением COVID-19, находящихся дома на амбулаторном лечении или карантине, с вероятным развитием желудочковой тахикардии и острого миокардита. Исследователи подчеркивают необходимость проведения МРТ-диагностики сердца пациентам с новой коронавирусной инфекцией даже после курса лечения и госпитализации ввиду того, что такие структурные изменения, как фиброз предсердий и желудочков, могут стать субстратом для жизнеугрожающих нарушений сердечного ритма. Имеются публикации [18, 26, 27], согласно которым мио-
кардит может быть случайной находкой на аутопсии у пациентов с новой коронавирусной инфекцией, не имевших клинических проявлений патологии сердечно-сосудистой системы.
Медикаментозные подходы к лечению миокардитов, ассоциированных с инфекцией COVID-19
Известно, что проникновение SARS-CoV-2 в организм пациента происходит опосредованно через рецепторы АПФ-2 [4, 7, 28]. Все больше публикаций [28, 29] подтверждают наличие внутриклеточного расположения вируса и возможности его прямого повреждающего действия на клетки миокарда. При этом нет понимания роли и механизмов влияния препаратов, блокирующих РААС. В настоящее время, если пациент получал препараты данной группы до заболевания новой коронавирусной инфекцией, то их прием рекомендовано продолжать [28]. Вероятно, у пациентов с миокардитом в рамках COVID-19, так же как и с миокардитом иной этиологии, препараты данной группы могут сыграть положительную роль в предотвращении развития или прогрессирования симптомов недостаточности кровообращения, однако следует ли их назначать пациентам с COVID-19, не получавшим их до этого, пока не ясно [30].
Рассматривая в качестве предиктора тяжелого течения COVID-19 «цитокиновый шторм», практикующие врачи назначают значительному числу пациентов различные формы глюкокортикостероидов (ГКС) [18–20]. Согласно российским и европейским рекомендациям по диагностике и лечению миокардитов [2, 15] назначение ГКС требует разумного и взвешенного подхода: исключение острого периода инфекционного процесса, отсутствие положительного эффекта от проводимой терапии препаратами первого ряда (блокаторами РААС, β-адреноблокаторами, диуретиками, антиаритмическими препаратами и пр.). Наибольшая эффективность ГКС описана у пациентов с миокардитами на фоне ревматических заболеваний [4]. Данные о влиянии ГКС на исходы пациентов с новой коронавирусной инфекцией противоречивы. Проведенный китайскими учеными метаанализ [31] 15 исследований с участием 5270 пациентов продемонстрировал, что наиболее часто ГКС назначаются при тяжелом течении инфекции SARS-CoV-2. Назначение препаратов этой группы ухудшает выживаемость, способствует увеличению продолжительности госпитализации, присоединению бактериальной коинфекции и гипокалиемии у пациентов с пневмонией. В то же время, по данным крупного клинического исследования RECOVERY (Randomized Evaluation of COVid-19 thERapY) [32], дексаметазон показал свое преимущество в снижении летальности у пациентов, находящихся на искусственной вентиляции легких (ИВЛ) и оксигенотерапии, и в настоящее время включен в рекомендации по ведению пациентов с тяжелым течением COVID-19. Некоторые авторы [33] приводят собственный положительный клинический опыт использования ГКС при наблюдении фульминантных форм миокардита, ассоциированного с новой коронавирусной инфекцией. Другие исследователи [34] описывают наблюдения с благоприятным исходом острого течения миокардита без назначения ГКС. Таким образом, окончательная роль этих препаратов в лечении воспалительного процесса в сердечной мышце при COVID-19 остается неясной.
В качестве перспективного альтернативного лечения пациентов с тяжелым течением COVID-19 и клинической картиной «цитокинового шторма» врачами некоторых клиник [8, 9, 35] практикуется назначение тоцилизумаба — рекомбинантного гуманизированного моноклонального антитела против ИЛ-6. Данный препарат предположительно положительно влияет на исходы у пациентов с тяжелым течением инфекции и снижает риски инвазивной ИВЛ у пациентов с пневмонией, ассоциированной с COVID-19, однако число наблюдений невелико [35]. Также отсутствуют данные о влиянии препарата на течение миокардитов, ассоциированных с COVID-19.
В литературе [36, 37] все еще встречаются свидетельства применения при новой коронавирусной инфекции кардиотоксичных препаратов, обладающих слабыми иммуномодулирующими свойствами, таких как гидроксихлорохин, колхицин, а также антибиотиков (азитромицин, фторхинолоны). Известно, что их использование как самостоятельно, так и в составе комбинаций способствует увеличению продолжительности интервала QT, в результате чего может развиться полиморфная желудочковая тахикардия и фибрилляция желудочков [8, 9]. Сходный побочный эффект отмечен у противовирусного препарата лопинавир (ритонавир) [8]. Нежелательными являются также лекарственные взаимодействия фавипиравира с антикоагулянтами, статинами, антиаритмическими препаратами [8, 9]. Описан прямой кардиотоксический эффект интерферонов α и β [9]. Очевидно, что назначение этих препаратов в условиях предположительного или установленного диагноза миокардита является нежелательным. Некоторые авторы [9] подчеркивают, что назначение данных препаратов само по себе может способствовать развитию миокардиального повреждения и ухудшить прогноз у пациента.
С учетом развития эндотелиальной дисфункции и гиперкоагуляции в условиях системного воспаления у пациентов с COVID-19, помимо препаратов, блокирующих РААС, в клинической практике применяются статины, антикоагулянты, дезагреганты [37, 38].
Нестероидные противовоспалительные препараты (НПВП) не показаны при воспалительном миокардиальном повреждении, их применение возможно при наличии сопутствующего перикардита [15]. Есть данные, свидетельствующие, что они способны повышать экспрессию АПФ-2-рецепторов на мембранах клеток, что теоретически может увеличивать проникающую способность SARS-CoV-2 внутрь клеток [39]. В противовес этому, есть публикация [40] о снижении синтеза РНК SARS-CoV-1 in vitro вне зависимости от активности циклооксигеназы на фоне приема индометацина. Учитывая противоречивые данные о применении НПВП, исследования эффективности и безопасности этих препаратов при новой коронавирусной инфекции следует продолжать. Один из препаратов данной группы (парацетамол) Европейское агентство лекарственных средств [41] считает наиболее предпочтительным выбором для купирования лихорадки и боли при инфекциях дыхательной системы.
Заключение
В настоящее время идет накопление информации о внелегочных полиорганных проявлениях новой коронавирусной инфекции. Очевидно, что пациенты, имеющие исходно сочетанную патологию, находятся в зоне риска в отношении благоприятного прогноза течения заболевания [42–44]. Миокардиальное повреждение, развивающееся на фоне COVID-19, находится в зоне особого внимания исследователей, так как обусловливает увеличение летальности [45]. Предположительно имеется несколько патогенетических механизмов, ответственных за развитие миокардита, ассоциированного с COVID-19. Наиболее вероятен иммуноопосредованный механизм, возникающий вследствие «цитокинового шторма». Однако продолжается обсуждение и прямого цитопатического воздействия вируса на кардиомиоциты. Также свой вклад вносят эндотелиальная дисфункция, нарушение работы РААС, негативное медикаментозное воздействие препаратов, используемых для лечения инфекции SARS-CoV-2.
Установление диагноза «миокардит» с учетом особенностей клинической картины и неспецифичности симптоматики представляет значительные трудности. Термин «миокардиальное повреждение», базирующийся, по данным литературы, на определении повышения уровня сердечного тропонина, является, по сути, более емким понятием, чем «миокардит», так как может включать также состояния, обусловленные ишемией миокарда, и кардиомиопатию Такоцубо [46]. Для подтверждения диагноза «миокардит» необходимы дополнительные диагностические манипуляции: ЭКГ, ЭхоКГ, МРТ и в конечном итоге эндомиокардиальная биопсия, проведение которых не всегда возможно в условиях ковидного стационара [47].
Медикаментозная терапия пациентов с воспалительным поражением миокарда, ассоциированным с новой коронавирусной инфекцией, не разработана. По данным нескольких метаанализов, пациенты получают лечение согласно протоколам ведения COVID-19, при этом неизвестно о влиянии большинства препаратов на течение миокардита. Многие препараты, использующиеся для лечения пациентов с новой коронавирусной инфекцией, имеют потенциально негативное влияние на миокард и могут сами по себе спровоцировать миокардиальное повреждение.
Ответы на многие вопросы могут быть получены в рамках проведения эпидемиологического исследования пациентов с миокардитами, ассоциированными с новой коронавирусной инфекцией.
Сведения об авторах:
Сергеева Виктория Алексеевна — к.м.н., доцент кафедры терапии с курсами кардиологии, функциональной диагностики и гериатрии ФГБОУ ВО СГМУ им. В.И. Разумовского Минздрава России; 410012, Россия, г. Саратов, ул. Большая Казачья, д. 112; ORCID iD 0000-0003-3517-8231.
Липатова Татьяна Евгеньевна — д.м.н., заведующая кафедрой терапии с курсами кардиологии, функциональной диагностики и гериатрии ФГБОУ ВО СГМУ им. В.И. Разу-
мовского Минздрава России; 410012, Россия, г. Саратов, ул. Большая Казачья, д. 112; ORCID iD 0000-0002-7401-9930.
Контактная информация: Сергеева Виктория Алексеевна, e-mail: viktoriasergeeva@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финанасовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 17.11.2021.
Поступила после рецензирования 10.12.2021.
Принята в печать 11.01.2022.
About the authors:
Victoria A. Sergeeva — C. Sc. (Med.), associate professor of the Department of Therapy with the Courses of Cardiology, Functional Diagnostics, and Geriatrics, V.I. Razumovskiy Saratov State Medical University; 112, Bolshaya Kazach’ya str., Saratov, 410012, Russian Federation; ORCID iD 0000-0003-3517-8231.
Tatjana. E. Lipatova — D. Sc. (Med.), Head of Department of Therapy with the Courses of Cardiology, Functional Diagnostics, and Geriatrics, V.I. Razumovskiy Saratov State Medical University; 112, Bolshaya Kazach’ya str., Saratov, 410012, Russian Federation; ORCID iD 0000-0002-7401-9930.
Contact information: Victoria A. Sergeeva, e-mail: viktoriasergeeva@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 17.11.2021.
Revised 10.12.2021.
Accepted 11.01.2022.
.
Информация с rmj.ru






