В статье представлены результаты оригинального исследования, посвященного изучению микрофлоры родовых путей при послеродовом эндометрите и определению ассоциативного риска развития инфекционно-воспалительной патологии пуэрперия.
Послеродовые гнойно-воспалительные заболевания, в частности эндометрит, представляют собой важную медицинскую и социальную проблему [1]. Социальная значимость этой проблемы заключается в том, что до сих пор во всем мире среди причин материнской смертности фигурирует сепсис, развившийся во время родов и в послеродовом периоде [2, 3]. В России показатели смертности от осложнений беременности, родов и послеродового периода неуклонно снижаются: с 11,5 на 100 тыс. родов живыми новорожденными в 2012 г. до 10,0 на 100 тыс. родов живыми новорожденными в 2016 г. В то же время число родильниц, умерших от сепсиса во время родов и в послеродовом периоде на 100 тыс. родившихся живыми, растет: в 2012 г. оно равнялось 0,2, в 2013 г. — 0,6, в 2014 и 2015 гг. — по 0,4, а в 2016 г. повысилось до 0,7 [4].
В Европе и США частота послеродового эндометрита после вагинальных родов составляет около 1–3%, в России — от 2% до 5%, после планового оперативного родоразрешения в странах Европы и в США — от 5% до 15%, в нашей стране — от 10% до 15% [1]. У пациенток из группы высокого инфекционного риска частота выявления инфекций в родовых путях может достигать 60% вне зависимости от вида родоразрешения [5].
Считается, что основными факторами риска развития эндометрита являются кесарево сечение, молодой возраст, низкий социально-экономический статус, длительный безводный период и преждевременный разрыв плодных оболочек. Предрасполагающими к восходящей инфекции являются колонизация нижних половых путей и существовавшие ранее инфекции, такие как гонорея, инфекции, вызванные стрептококками группы B (
) и бактериальный вагиноз.
. (включая группы A и B),
ассоциированы не только с гинекологическими воспалительными состояниями, но и с акушерскими осложнениями [6–9].
У женщин, выписанных из родильного дома, послеродовый эндометрит наиболее часто развивается через 7 дней после родов [10]. Несмотря на многочисленные исследования, до сих пор остается спорным вопрос, какие микроорганизмы, колонизирующие родовые пути, являются абсолютно патогенными в отношении развития инфекционно-воспалительной патологии пуэрперия, а какие являются облигатной флорой и не требуют антибиотикотерапии.
— изучение спектра флоры родовых путей, определение частоты обсемененности влагалища определенными микроорганизмами у женщин с послеродовым эндометритом, а также определение статистически значимых показателей ассоциативного риска развития эндометрита.
В изучаемую группу включили 27 родильниц с клинико-лабораторными и ультразвуковыми признаками воспалительного процесса в полости послеродовой матки. Средний возраст пациенток составил 24 года (от 20 до 44). Все пациентки были выписаны из учреждения родовспоможения на 4–6-е сут после родов, но обратились за медицинской помощью с жалобами на боли в области малого таза и повышение температуры от 37,4 до 39 °C на 7–9-е сут после родов. Группу контроля составили 30 женщин после естественных срочных родов с физиологическим течением пуэрперия. Обе группы были сопоставимы по возрасту пациенток.
Критерии включения: наличие полных данных клинических, лабораторных и ультразвуковых исследований, позволяющих подтвердить или исключить диагноз послеродового эндометрита.
Критериями исключения являлись: кесарево сечение, симптомы экстрагенитальных заболеваний, сопровождавшихся гипертермией.
Гинекологическое бимануальное исследование и осмотр родовых путей с помощью гинекологического зеркала с целью оценки состояния матки и шейки матки: ее размеры, подвижность, болезненность, а также характера маточных выделений.
Комплексное исследование микрофлоры родовых путей и полости матки методом полимеразной цепной реакции и бактериологическое исследование микрофлоры родовых путей (бакпосев с определением антибиотико- и фагочувствительности) с целью выявления дисбиоза влагалища, наличия патогенной и условно-патогенной микрофлоры.
УЗИ (трансабдоминальные и трансвагинальные) на аппаратах APLIO 400 (Toshiba Medical Systems Corporation, Япония), Fukuda UF-850 XT (Fukuda denshi, Япония), Mindray DC 3 (Mindray, Китай) и LOGIQ P5 (General Electric Ultrasound, США), проводившиеся с целью оценки биометрических показателей матки, ультразвуковых характеристик полости матки (расширение, содержимое, пристеночные образования) и цервикального канала, содержимого просвета канала шейки матки.
Боли внизу живота, болезненность матки при пальпации, бледность кожных покровов, повышение температуры тела родильницы до 37,1–39 °C, сопряженные с лихорадкой тахикардия, озноб, головная боль, недомогание и/или анорексия. Увеличение и болезненность матки при пальпации, мягкая консистенция, нередко атония матки, что способствует развитию маточного кровотечения. При осмотре с помощью гинекологического зеркала — гиперемированная, утолщенная, иногда обложенная налетом фибрина шейка матки; экссудация из маточного зева. Выделения из влагалища обильные, реже скудные, зловонные, с кровью или без нее, при гнойном эндометрите — гнойные лохии с ихорозным запахом.
В общем анализе крови с лейкоцитарной формулой —
лейкоцитоз или лейкопения, повышение уровня нейтрофилов, преимущественно палочкоядерных. По данным микробиологического исследования отделяемого из полости матки — наличие патогенной и условно-патогенной флоры. Анализ полученных результатов подразумевал оценку общего количества бактерий, которое в норме равнялось 10
единиц в одном образце. Нормофлора влагалища — лактобактерии, 80–100% от общего числа бактерий в одном образце; умеренный дисбиоз — количество лактобактерий —
от 20 до 60%; выраженный дисбиоз — количество лактобактерий — 20% и меньше. Условно-патогенная флора — в норме меньше 1%, от 1% до 10% — умеренный дисбиоз, более 10% — выраженный. В норме во влагалище должны отсутствовать хламидии, микоплазмы, уреаплазмы, стафилококки, стрептококки и грибы рода
.
Были использованы следующие ультразвуковые критерии физиологического пуэрперия: матка занимает срединное положение и представляет собой образование овоидной формы; миометрий средней эхогенности и однородной структуры; дно матки отклоняется в физиологическое положение
после 7 сут; биометрические показатели матки на 7-е сут после родов: длина —
105,2±2,0 мм, переднезадний размер — 77,0±1,2 мм, ширина матки — 96,5±1,6 мм; полость матки после 7 сут закрыта, приобретает форму, характерную для небеременных женщин [11].
(в норме — на 46,2%) [12]; расширение полости матки в средней трети свыше 15 мм на 5-е сут после родов; скопление в полости матки разнородных гиперэхогенных структур без четких контуров в сочетании и без эхосвободных участков, а также пристеночных сигналов с высокой акустической плотностью (некротизированные фрагменты децидуальной оболочки и сгустки крови); наличие в полости матки мигрирующих мелких эхопозитивных структур с акустическим феноменом, характерным для пузырьков газа; повышенная эхогенность стенок полости матки, преимущественно в субэндометриальном слое, что соответствует отеку прилегающих к базальной мембране слоев эндометрия [11].
Совместно с врачами смежных специальностей проводили дифференциальную диагностику послеродового эндометрита с такими патологическими состояниями, сопровождающимися лихорадкой, как пельвиоперитонит, острый аппендицит, холецистит, прободная язва желудка, цистит, пиелонефрит, мастит, ателектаз легких, пневмония, ОРВИ, а также с осложнениями применения эпидуральной анестезии.
Статистическая обработка полученных данных проводилась с использованием статистической программы MedCalc. С целью определения наиболее значимых этиологических факторов развития послеродового эндометрита мы оценили частоту обнаружения определенной патогенной флоры. Для определения эффективности диагностического теста по выявлению определенного вида микроорганизма во влагалищном содержимом мы определяли статистические показатели — чувствительность и специфичность. Для определения влияния фактора на развитие патологического процесса использовали критерии — относительный риск (ОР) и отношение шансов, а также оценивали значения границ 95% доверительного интервала. Также определяли прогностическую ценность теста (predictive value) — вероятность наличия (отсутствия) заболевания при известном результате исследования. Для этого вычисляли вероятность наличия заболевания при положительном (патологическом) результате теста — прогностическую ценность положительного результата (ПЦПР, positive predictive value) и вероятность отсутствия заболевания при отрицательном (нормальном) результате теста — прогностическую ценность отрицательного результата (ПЦОР, negative predictive value).
Содержание статьи
Результаты исследования
При физиологическом послеродовом периоде у всех пациенток выявлялась нормальная микрофлора —
лактобациллы, в то время как при послеродовом эндометрите только у 12 (44,4%) пациенток обнаружили лактофлору (табл. 1).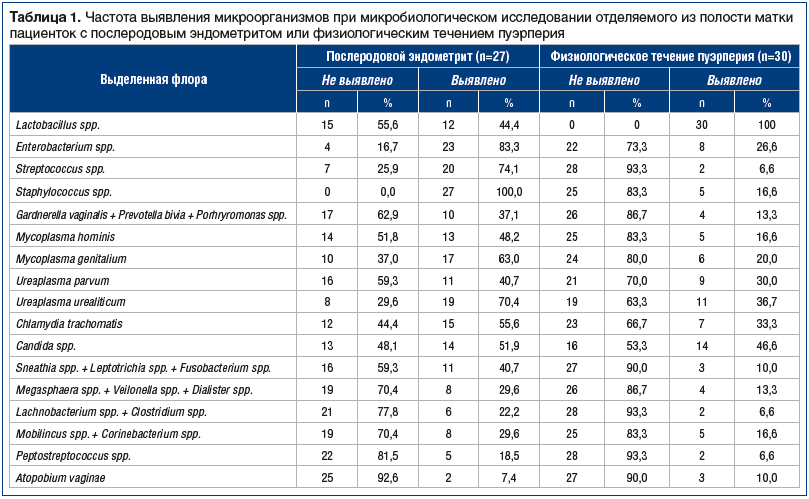
При микробиологическом исследовании влагалищного содержимого стафилококки обнаружили у всех родильниц с послеродовым эндометритом и у 5 (16,6%) родильниц с физиологическим течением пуэрперия. При исследовании микрофлоры влагалища и полости матки у родильниц с эндометритом стрептококки выявляли в 11,2 раза чаще, чем у родильниц с нормальным течением послеродового периода (74,1% против 6,6% соответственно), Mycoplasma hominis — в 2,9 раза, Mycoplasma genitalium — в 3,15 раза, Ureaplasma urealiticum — в 1,9 раза, Chlamydia trachomatis — в 1,7 раза.
Энтеробактерии выявляли при воспалительном процессе в послеродовой матке в 83,3% случаев (23 пациентки), при физиологическом течении послеродового периода — в 26,6% (8 пациенток). Микробные ассоциации Gardnerella vaginalis + Prevotella bivia + Porhryromonas spp. у пациенток с эндометритом обнаруживали в 2,8 раза чаще, чем у женщин с физиологическим течением пуэрперия. При послеродовом эндометрите микробную ассоциацию Sneathia spp. + Leptotrichia spp. + Fusobacterium spp. выявляли в 4 раза чаще, чем при нормальном течении послеродового периода; Megasphaera spp. + Veilonella spp. + Dialister spp. — в 2,2 раза; Lachnobacterium spp. + Clostridium spp. — в 3,4 раза; Mobilincus spp. + Corinebacterium spp. — в 1,8 раза; Peptostreptococcus spp. — в 2,8 раза. Atopobium vaginae не встречалась при физиологическом течении послеродового периода.
При обработке статистических данных мы обнаружили, что наибольшую чувствительность в отношении диагностики послеродового эндометрита имеет выявление в родовых путях патогенной стафилококковой флоры (100%), чуть меньшую чувствительность — выявление энтерококков (85,2%) (табл. 2). Также достаточно высокую чувствительность в отношении выявления послеродового эндометрита имело выделение стрептококков (74,1%) и Ureaplasma urealiticum (70,4%). Средними значениями чувствительности оказались для таких микроорганизмов, как Mycoplasma genitalium (62,96%), Chlamydia trachomatis (55,56%), Candida spp. (51,85%), Mycoplasma hominis (48,15%), Ureaplasma parvum (40,74%), для микробной ассоциации Sneathia spp. + Leptotrichia spp. + Fusobacterium spp. (40,74%). Низкая чувствительность метода для прогнозирования риска послеродового эндометрита оказалась для следующих микробных ассоциаций: Megasphaera spp. + Veilonella spp. + Dialister spp. (29,63%), Mobilincus spp. + Corinebacterium spp. (29,63%), Lachnobacterium spp. + Clostridium spp. (22,22%), Peptostreptococcus spp. (18,52%), самой низкой чувствительностью характеризовалось выделение Atopobium vaginae (7,41%).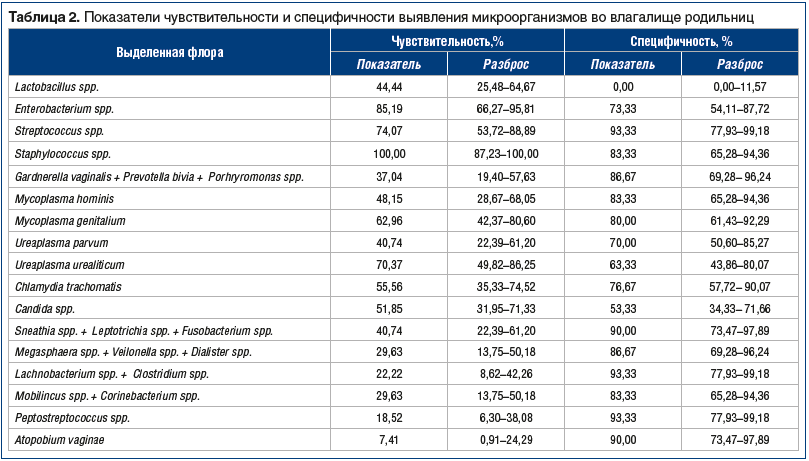
Для всех видов выявленной флоры мы получили высокие показатели специфичности (см. табл. 2). Наиболее высокие (от 90 до 100%) — для Streptococcus spp. (93,33%), Lachnobacterium spp. + Clostridium spp. (93,33%), Peptostreptococcus spp. (93,33%), Atopobium vaginae (90,00%), Sneathia spp. + Leptotrichia spp. + Fusobacterium spp. (90,00%). Показатели специфичности от 80 до 89,9% были установлены для микробных ассоциаций Gardnerella vaginalis + Prevotella bivia + Porhryromonas spp. (86,67%), Megasphaera spp. + Veilonella spp. + Dialister spp. (86,67%), Mobilincus spp. + Corinebacterium spp., Staphylococcus spp. и Mycoplasma hominis — по 83,33%, Mycoplasma genitalium — 80,00%. Специфичность в диапазоне 70–79,9% была характерна для Chlamydia trachomatis (76,67%), Enterobacterium spp. (73,33%), Ureaplasma parvum (70,00%). Невысокая специфичность выявления во влагалищном содержимом оказалась для Ureaplasma urealiticum (63,33%), еще более низкая — для Candida spp. (53,33%) (см. табл. 2).
Анализ статистических показателей ОР показал, что существует прямая связь послеродового эндометрита и всех вышеперечисленных микроорганизмов, кроме Ureaplasma parvum, Candida spp., Megasphaera spp. + Veilonella spp. + Dialister spp., Mobilincus spp. + Corinebacterium spp., Peptostreptococcus spp. и Atopobium vaginae (табл. 3). Наиболее сильная коррелятивная связь отмечалась при наличии во влагалище Staphylococcus spp. (ОР=43,3 при p=0,0072). ОР для Enterobacterium spp. составил 4,8 при p=0,0009 и для Streptococcus spp. 4,5 при p<0,0001. Низкие значения ОР оказались для микробной ассоциации Gardnerella vaginalis + Prevotella bivia + Porhryromonas spp. (1,8; p=0,0195), Mycoplasma hominis (2,0; p=0,0070), Mycoplasma genitalium (2,5; p=0,0017), Ureaplasma urealiticum (2,1; p=0,0204), Chlamydia trachomatis (1,9; p=0,0126), Sneathia spp. + Leptotrichia spp. + Fusobacterium spp. (2,1; p=0,0020), Lachnobacterium spp. + Clostridium spp. (1,8; p=0,0330).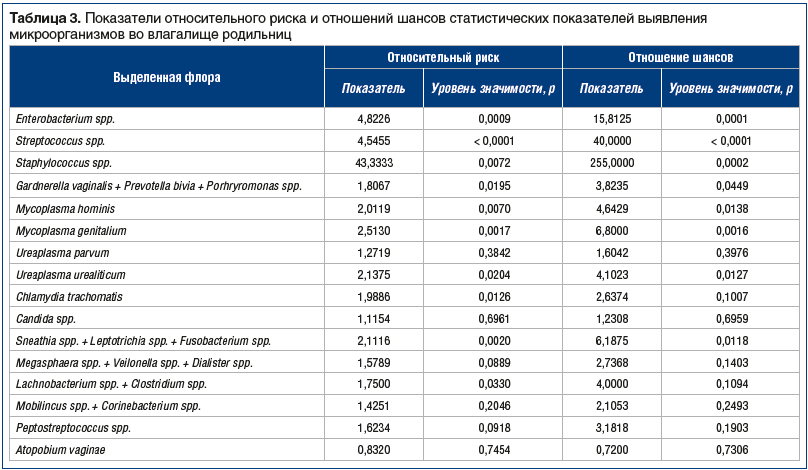
Анализ доверительного интервала показал отсутствие статистической значимости влияния фактора на частоту исхода, независимо от величины показателя ОР (p>0,05) для Ureaplasma parvum, Chlamydia trachomatis, Candida spp., Megasphaera spp. + Veilonella spp. + Dialister spp., Lachnobacterium spp. + Clostridium spp., Mobilincus spp. + Corinebacterium spp., Peptostreptococcus spp., Atopobium vaginae (см. табл. 3). В то же время показатели отношений шансов дают основание считать, что присутствие в родовых путях всех представленных в таблице 3 микроорганизмов имеет прямую ассоциативную связь с развитием послеродового эндометрита, кроме Atopobium vaginae.
Наиболее высокие показатели предсказательной ценности оказались для Staphylococcus spp. (ПЦПР=84,38%; ПЦОР=100,00%), Streptococcus spp. (ПЦПР=90,91%; ПЦОР=80,00%), Enterobacterium spp. (ПЦПР=74,19%; ПЦОР=84,62%). Таким образом, можно сделать вывод о высоком риске развития послеродового эндометрита при наличии в родовых путях именно этих микроорганизмов. Остальные микроорганизмы могут присутствовать в родовых путях при воспалении, однако не являются абсолютно значимыми этиологическими факторами риска развития послеродового эндометрита, т. к. были выявлены и у пациенток с неосложненным течением послеродового периода (табл. 4).
Содержание Staphylococcus spp. и Streptococcus spp. при эндометрите достигало 109–1010 геном-эквивалент (ГЭ) /образец или 80–100% к общей бактериальной массе. Enterobacterium spp. наиболее часто присутствовали в количестве 103–105 ГЭ/образец, в единичном случае — 106 ГЭ/образец. Микробную ассоциацию Gardnerella vaginalis + Prevotella bivia + Porhryromonas spp. и Candida spp. в основном выявляли в концентрациях 105–106 ГЭ/образец, в единичных случаях — до 107 ГЭ/образец. Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealiticum и Chlamydia trachomatis обнаруживали в количествах до 103–105 ГЭ/образец, в то время как содержание Ureaplasma parvum и остальных облигатно-анаэробных микроорганизмов редко превышало 102–104 ГЭ/образец.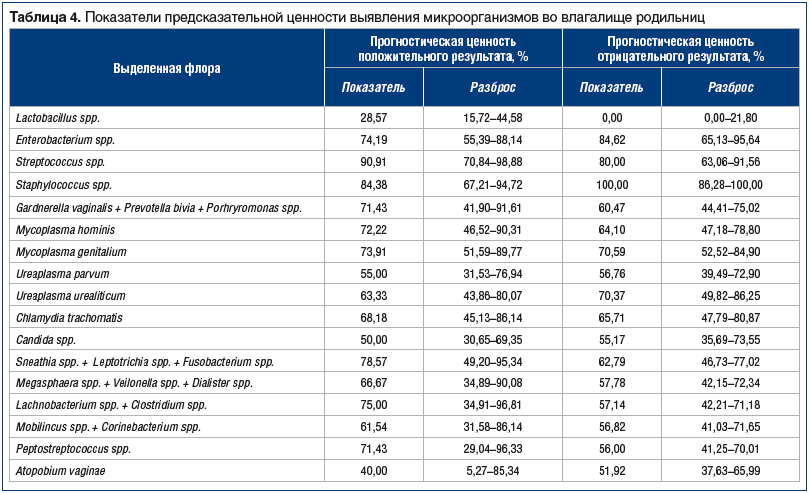
Обсуждение
Послеродовой эндометрит, как правило, вызван полимикробной инфекцией. В состав колонизирующей микрофлоры входит от двух до трех аэробных и анаэробных микроорганизмов, преимущественно из микробиоты половых путей. Бактериологический посев на микрофлору из влагалища и полости матки не является рутинным методом диагностики из-за трудностей в получении незагрязненного образца через шейку матки, хотя Filker и Monif (1979) использовали трехпросветный катетер для получения изолированного материала из полости матки для бактериологического посева на микрофлору у женщин с манифестным послеродовым эндометритом до применения антибиотикотерапии [13]. Кроме того, результаты бактериологического посева на микрофлору могут быть получены слишком поздно для практического использования, что также ограничивает применение данного метода у родильниц с послеродовой лихорадкой. В то же время часто возникает необходимость исключить гонорейную и хламидийную этиологию послеродового инфекционно-воспалительного осложнения. Для оценки динамики инфекционно-воспалительного процесса рекомендуют использовать показатели бактериальной контаминации тканей или экссудата (при благоприятном течении она не превышает 105 КОЕ/мл) [1]. В связи с этим в своем исследовании мы использовали комбинацию клинико-лабораторных методов исследования, что позволило не только получить более точную информацию о составе микрофлоры родовых путей, но и подобрать этиологически верную терапию.
Результаты нашего исследования были схожи с результатами, полученными другими авторами. В 70% случаев был выделен более чем один микроорганизм; около 60% штаммов включали факультативные грамположительные и грамотрицательные бактерии, примерно в 40% посевов были выделены анаэробы, и, кроме того, в 30% случаев были выделены микоплазмы [13]. Rosene et al. (1986) отбирали образцы отделяемого из полости матки с помощью трехпросветного защищенного катетера у пациенток с послеродовым эндометритом. По крайней мере один факультативный или один анаэробный вид бактерий был выделен из отобранных образцов у 82% пациенток с эндометритом, генитальные микоплазмы — у 76% женщин, бактерии и генитальные микоплазмы — у 61% женщин, только бактерии — у 20%, а Chlamydia trachomatis выделили у 2% пациенток. Наиболее распространенными микроорганизмами, выделенными из образцов отделяемого из полости матки у пациенток с эндометритом, являлись Gardnerella vaginalis, Peptococcus spp., Bacteroides spp., Staphylococcus epidermidis, Streptococcus группы B и Ureaplasma urealyticum [14].
В России этиологическим фактором 80–90% случаев послеродовых инфекционно-воспалительных состояний матки считаются ассоциации аэробных и анаэробных условно-патогенных микроорганизмов, входящих в состав нормальной микрофлоры половых путей у женщин: Escherichia coli (17–37%), Enterococcus faecalis (37–52%), Bacteroides fragilis (40–96%). Бактерии родов Proteus, Klebsiella, Enterobacter, Fusobacterium, Peptococcus, Peptostreptococcus, Streptococcus, Staphylococcus (S. aureus 3–7%) и др. являются причиной послеродовых осложнений в небольшом проценте случаев. Chlamydia trachomatis вызывает поздние формы заболевания, манифестирующие через 4–6 нед. после родов [1].
По данным Duff (1986), Filker и Monif (1979), в большинстве случаев эндометрит возникает вследствие воздействия организмов, относящихся к нормальной вагинальной флоре: грамположительные кокки (стрептококки группы B, Staphylococcus epidermidis, Enterococcus); анаэробы (преимущественно пептострептококки, Bacteroides sр., и Prevotella); грамотрицательные бактерии (преимущественно Gardnerella vaginalis, Escherichia coli, Klebsiella pneumonia и Proteus mirabilis) [5, 13].
Мы получили аналогичные результаты. Колонизация родовых путей стрептококками группы B, массивное обсеменение влагалища Streptococcus agalactiae или кишечной палочкой, носительство Staphylococcus aureus или обсеменение им экстрагенитальных органов являются грозными факторами риска развития послеродового эндометрита. Мы выявили наиболее точную ассоциацию развития послеродового эндометрита с патогенной стафилококковой флорой (100%), энтерококками (85,2%) стрептококками (74,1%) и Ureaplasma urealiticum (70,4%).
Gibbs et al. (1981), Gibney et al. (1983) и Jorup-Rönström et al. (1996) сообщили о высоком риске развития токсического инфекционного шока при послеродовых эндометритах, ассоциированных со стрептококковой и стафилококковой внутриматочной инфекцией, назвав такие патологические состояния синдромом стрептококкового или стафилококкового токсического шока [15–17]. На наш взгляд, несмотря на то, что большинство членов семейства Enterobacteriaceae являются нормальной частью кишечной флоры, эти микроорганизмы также могут при колонизации родовых путей приводить к тяжелым осложнениям, поскольку продуцируют эндотоксины, которые высвобождаются в кровоток и вызывают системный воспалительный ответ, а в наиболее тяжелых случаях — эндотоксический шок, который может привести к смертельному исходу [18].
Filker и Monif (1979), а затем Harrison (1983) показали, что чаще всего при бактериологическом посеве содержимого полости матки в послеродовом периоде выделяют Ureaplasma urealyticum, Gardnerella, Peptostreptococcus, Gardnerella vaginalis, Bacteroides bоvius и стрептококки группы B [13, 19]. По нашим данным, микробные ассоциации Gardnerella vaginalis + Prevotella bivia + Porhryromonas spp. и Candida spp. у пациенток с послеродовым эндометритом в основном выявлялись в концентрациях 105–106 ГЭ/образец, в единичных случаях — до 107 ГЭ/образец.
Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealiticum и Chlamydia trachomatis были обнаружены в количествах до 103–105 ГЭ/образец, в то время как содержание Ureaplasma parvum и остальных облигатно-анаэробных микроорганизмов редко превышало 102–104 ГЭ/образец. Patai et al. (2005) указывают на значительную роль генитальных микоплазм в этиологии тяжелых послеродовых панэндомиометритов, особенно после оперативного родоразрешения [20]. Однако мы не получили доказательств достоверной статистической значимости влияния фактора на частоту исхода, независимо от величины показателя ОР (p>0,05) для Ureaplasma parvum, Chlamydia trachomatis, Candida spp., Megasphaera spp. + Veilonella spp. + Dialister spp., Lachnobacterium spp. + Clostridium spp., Mobilincus spp. + Corinebacterium spp., Peptostreptococcus spp., Atopobium vaginae.
Необходимо отметить, что ни в одном случае не была диагностирована гонорея. По данным литературы, инфекции, передаваемые половым путем, такие как гонорея и хламидиоз, не являются частыми причинами раннего послеродового эндометрита. Filker и Monif (1979), Harrison (1983), Ismail (1987) сообщали, что хламидиоз коррелирует с поздним началом послеродового эндометрита [13, 19, 21]. По данным современных исследований, Chlamydia trachomatis более распространена у пациенток с поздним появлением симптомов послеродового эндометрита (2 нед. или более после родов) [20].
Soper в 1993 г. доказал, что бактериальный вагиноз является важным патогенетическим фактором развития осложнений кесарева сечения [22]. Fernandez et al. (1993) установили, что наличие бактериального вагиноза значительно увеличило риск развития эндометрита после кесарева сечения у женщин старшего репродуктивного возраста с преждевременным излитием околоплодных вод и длительным безводным промежутком [23]. Склонность к инфекции верхних половых путей у женщин с бактериальным вагинозом может быть связана с более высокими концентрациями вагинальных анаэробных бактерий. Заражение эндометрия или децидуальной оболочки обычно возникает в результате восходящей инфекции из нижних половых путей [15]. Доказано, что во время родов цервиковагинальная флора попадает в полость матки, тем самым инфицируя ее содержимое [24, 25]. В то же время существует мнение, что колонизация родовых путей не всегда приводит к восходящему инфицированию полости матки. Развитие инфекции, как полагают Casey и Cox (1997), связано со сложным взаимодействием между защитными механизмами организма родильницы, объемом бактериального инокулята и степенью вирулентности бактерий [26].
Факторами риска развития осложнений в послеродовом периоде являются как преждевременные роды, так и переношенная беременность. Доказана ассоциативная связь между типом родоразрешения и продолжительностью безводного промежутка, микробным обсеменением родовых путей, временем начала антибиотикотерапии и антибиотикопрофилактики и продолжительностью введения антибиотиков [23, 27, 28]. Частота послеродового эндометрита после вагинальных родов составляет менее 3%, но повышается в 10 раз после кесарева сечения из-за наличия инородных тел (например, шовного материала), некроза миометрия по линии шва и формирования гематом. Немаловажную роль играют также травмы родовых путей и фрагменты последа, задержавшиеся в полости матки [29, 30].
Bobitt и Ledger (1978), D’Angelo и Sokol (1980) доказали, что затяжные роды, преждевременное излитие околоплодных вод и длительный безводный период являются факторами риска послеродовых инфекционных осложнений [31, 32]. Ely et al. (1995), а затем Wilkinson и Enkin (2000) установили, что многократные исследования шейки матки, внутриматочное исследование плода или полости матки, мануальное удаление плаценты повышают риск развития послеродового эндометрита [33, 34]. Кроме того, с послеродовым воспалением коррелируют наличие хориоамнионита и обильная мекониальная насыщенность околоплодных вод [31, 35, 36].
ВИЧ-инфекция, а также заболевания, сопровождающиеся снижением иммунорезистентности организма, такие как гестационный сахарный диабет или тяжелая анемия, создают условия для развития инфекционно-воспалительного процесса в полости матки [33, 37].
В нашей стране предпосылками для развития послеродового эндомиометрита считаются: наличие раневой поверхности в матке после отделения последа; скопление в полости матки крови — питательной среды для бактерий; дисбиотические и воспалительные заболевания нижних отделов родовых путей; снижение иммунитета родильницы, усугубленное кровопотерей в родах; снижение сократительной способности матки при отказе от исключительно грудного вскармливания [1].
Наше исследование показало, что существует прямая корреляционная связь между развитием послеродового эндометрита не только с абсолютными патогенами, но и с ассоциациями облигатно-анаэробной, факультативно-анаэробной и дрожжевой флоры. Различие заключалось лишь в концентрации микроорганизмов в образцах влагалищного содержимого и аспиратов полости матки.
Множество исследований посвящено целесообразности профилактической санации родовых путей и пре- и интранатальной антибиотикотерапии. Например, в Мексике остается спорным вопрос интранатальной антибиотикопрофилактики при обсемененности родовых путей Streptococci Group B (Streptococcus agalactiae) [38].
В прошлом роль микоплазм в патогенезе эндометрита была неясной. Существовало мнение, что антибактериальная терапия обычно не требуется для клинического излечения в случаях, когда из полости матки выделяли только микоплазмы, и в частности Ureaplasma urealyticum, без других микроорганизмов [14, 19, 39]. Однако Rosene et al. в 1986 г. а затем Watts et al. в 1989 г. изучили влияние антибактериальной терапии на ранние проявления послеродового эндометрита, ассоциированного c полимикробным обсеменением полости матки факультативной и анаэробной флорой, в т. ч. генитальными микоплазмами и Chlamydia trachomatis, и пришли к выводу, что антибактериальная терапия обычно не требуется для клинического излечения у женщин, которые имеют только Ureaplasma urealyticum, без других микроорганизмов [14, 39].
Hoyme et al. (1986) доказали, что у 25% женщин, получивших антибиотикопрофилактику цефалоспорином, в полости матки продолжают персистировать энтерококки [40]. Ahmadzia et al. (2015) в многоцентровом ретроспективном когортном исследовании показали, что предоперационная профилактика послеродовых инфекционно-воспалительных осложнений цефазолином не снижала частоту инфекционных осложнений после кесарева сечения [41]. Результаты этих исследований объясняют персистенцию энтеробактерий во влагалищном содержимом и высокую ассоциативную связь с послеродовым эндометритом, которую мы подтвердили.
В мире продолжается поиск эффективных мер профилактики послеродовых осложнений с использованием комбинированных схем антибиотикотерапии [14, 42, 43]. Согласно результатам Кокрановского систематического обзора, выполненного Mackeen et al. (2015), качество доказательств большей эффективности комбинированной терапии клиндамицином и аминогликозидом по сравнению с эффективностью применения цефалоспоринов или пенициллинов было низким или очень низким. В то же время было доказано, что комбинации антибактериальных препаратов, подобранные с учетом чувствительности микроорганизма, являются эффективным средством не только лечения инфекционно-воспалительной патологии пуэрперия, но и профилактики тяжелых осложнений послеродового периода [44]. Зарубежные исследователи считают, что рутинное введение антибиотиков может снизить риск эндометрита после неосложненных естественных родов [45]. Также было показано, что лечение антибактериальными агентами инфекции, вызванной Chlamydia trachomatis во время беременности, обеспечивает микробиологическое излечение и эффективно предотвращает развитие осложнений беременности (преждевременные роды, преждевременный разрыв плодных оболочек, низкие массо-ростовые показатели новорожденных) [46].
Заключение
Послеродовой эндометрит может манифестировать на 6–9-е сут. В группу риска попадают женщины с ранней выпиской из роддома. С инфекционно-воспалительным процессом в полости матки ассоциировано наличие в отделяемом из влагалища и полости матки следующих микроорганизмов: Enterobacterium spp., Streptococcus spp., Staphylococcus spp., Gardnerella vaginalis, Prevotella bivia, Porhryromonas spp., Eubacterium spp., Sneathia spp., Leptotrichia spp., Fusobacterium spp., Megasphaera spp., Veilonella spp., Dialister spp., Lachnobacterium spp., Clostridium spp., Mobilincus spp., Corinebacterium spp., Peptostreptococcus spp., Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealiticum, Ureaplasma parvum, Chlamydia trachomatis и Candida spp. Наиболее высок риск развития послеродового эндометрита при обсемененности родовых путей стафилококковой флорой (100%), энтерококками (85,2%) стрептококками (74,1%) и Ureaplasma urealiticum (70,4%) в концентрациях до 107–1010 ГЭ/образец. Считаем целесообразным продолжать исследования по выявлению эффективных схем профилактики послеродового эндометрита с использованием микробиологических методов для определения наиболее этиологически верной терапии.
Информация с rmj.ru






