Методы повышения эффективности эрадикационной терапии
Содержание статьи
- 1 Введение
- 2 Антибиотикорезистентность H. pylori
- 3 Кларитромицин
- 4 Метронидазол
- 5 Амоксициллин
- 6 Тетрациклин
- 7 Левофлоксацин
- 8 Рифабутин
- 9 Фуразолидон
- 10 Методы повышения эффективности эрадикационной терапии
- 11 Использование высоких доз ИПП
- 12 Определение чувствительности
- 13 Терапия первой линии
- 14 Кларитромицин-содержащая тройная терапия более 7 дней
- 15 Квадротерапия без препарата висмута
- 16 Висмут-содержащая квадротерапия
- 17 Терапия второй линии и «терапия спасения»
- 18 Заключение
Введение
Основой профилактики злокачественных новообразований желудка является проведение эрадикационной терапии у пациентов, имеющих в анамнезе хронический гастрит, язвенную болезнь желудка и двенадцатиперстной кишки, а также другие заболевания, связанные с Helicobacter pylori (H. pylori) [1].
Следует признать, что появление штаммов H. pylori, резистентных к антибактериальным препаратам, становится достаточно распространенной тенденцией в медицинской практике, поэтому возникает необходимость разработки алгоритма повышения эффективности использования противомикробных средств и снижения риска развития фатальных осложнений.
Представленный вопрос на текущий момент является очень актуальным, что подтверждается результатами исследований. H. pylori считается одним из самых распространенных возбудителей хронических инфекций у человека. Частота встречаемости данной инфекции у населения развитых стран Европы и Северной Америки — 30–35%, Восточной Европы и Латинской Америки — 40–70%, развивающихся стран Азии и Африки — 85% [2].
В клинической практике при подозрении на инфицирование H. pylori у больных с наличием факторов риска и отягощенным анамнезом и планировании антихеликобактерной терапии следует учитывать профилактический эффект эрадикации относительно формирования некардиального рака желудка и ее диагностическое значение [3]. Известными на данный момент факторами, понижающими эффективность эрадикационной терапии, являются: избыточная масса тела, сахарный диабет, курение, повторные курсы антибиотикотерапии за последний год [4].
Антибиотикорезистентность H. pylori
Существует множество антибактериальных препаратов, к которым чувствителен H. pylori. Это β-лактамные антибиотики, макролиды, тетрациклины, фторхинолоны, рифамицины, амфениколы, аминогликозиды, нитрофураны и другие лекарственные средства [5]. Но применение многих антибиотиков лимитировано из-за наличия выраженных побочных эффектов (панцитопения у хлорамфеникола, особенность метаболизма и нефротоксичность у аминогликозидов) [6].
Процентное соотношение резистентных штаммов H. pylori к противомикробным средствам изменяется в разных географических регионах. Это привело к невозможности использования общей стандартизированной схемы эрадикации [7, 8]. Существенный вклад в вариабельность существующей картины устойчивости к антибактериальным препаратам вносит перемещение людей (миграция) как в границах одного административно-территориального образования, так и за пределы страны. Особую роль в возникновении невосприимчивости H. pylori играет частое неоправданное использование противомикробных средств для лечения прочих инфекционных заболеваний. В частности, применение кларитромицина для лечения заболеваний органов дыхания и метронидазола при протозоозах повысило первичную невосприимчивость возбудителя к данным антибиотикам среди людей во многих странах мира [9, 10].
Показатель резистентности к кларитромицину и метронидазолу среди популяции вносит весомый вклад в возможность использования той или иной схемы эрадикационной терапии. Вместе с тем невосприимчивость к кларитромицину, по мнению многих исследователей, играет более важную практическую роль, чем невосприимчивость к метронидазолу [11].
Кларитромицин
В течение многих десятилетий кларитромицин входит в состав основных схем эрадикационной терапии. В основе механизма действия данного препарата лежит ингибирование синтеза белка на бактериальной рибосоме, что впоследствии влечет за собой ее связывание и замедление активности [12].
Резистентность H. pylori к кларитромицину обусловлена точечными хромосомными мутациями в регионе, кодирующем пептидил-трансферазу в V домене 23 субъединицы рибосомальной РНК [13].
Показатель устойчивости к кларитромицину варьирует от 5,46% до 30,8% в зависимости от региона. В Европе самая низкая устойчивость к кларитромицину была зарегистрирована в Норвегии (5,9%), а самая высокая — в Испании (32,01%) и Португалии (42,35%). Европейские исследования показали, что устойчивость H. pylori снизилась с 36,65% в 2009 г. до 24,38% в 2014 г. В Азии высокая частота устойчивости к кларитромицину была зарегистрирована в Индии (58,8%) и Китае (46,54%), тогда как самый низкий показатель был обнаружен в Малайзии (2,4%). В Азии наблюдается рост резистентности к кларитромицину — с 15,28% в 2009 г. до 32,46% в 2014 г., это, вероятно, связано с более частым применением макролидов [14].
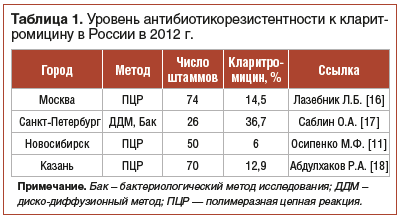
Уровень резистентности H. pylori к кларитромицину в Российской Федерации приближается к 20%. Но при этом в некоторых регионах, в частности в Ленинградской области, показатель выявленных резистентных штаммов H. pylori уже на данный момент превосходит средний показатель по РФ (табл. 1) [15, 16].
Метронидазол
Метронидазол действует на микроорганизм путем восстановления электронов и последующего структурного повреждения ДНК нитроанионными радикалами (NO2) [12].
Механизмы формирования резистентности связаны с множеством факторов. К ним относятся снижение всасывания и повышение элиминации лекарственного вещества, увеличение активности ферментов, ответственных за репарацию ДНК бактериальной клетки, увеличение кислороднейтрализующей способности (мутации в генах rdxA и frxA) и снижение антибиотической активации, являющееся результатом изменений функции ферментных систем [13, 19].
Общая устойчивость к метронидазолу наблюдается в 47,22% случаев по всему миру. В порядке убывания: в Африке — 75,02%, в Южной Америке — 52,85%, в Азии — 46,57%, в Европе — 31,19%, в Северной Америке — 30,5%. В развитых странах около 30% штаммов H. pylori устойчивы к метронидазолу, тогда как в развивающихся странах частота резистентности очень высока. Эта связь между устойчивостью к метронидазолу и уровнем социально-
экономического состояния, возможно, обусловлена использованием препаратов группы нитроимидазолов в лечении гинекологических, стоматологических и паразитарных инфекционных заболеваний [14]. Сопоставление результатов показало, что устойчивость к метронидазолу в странах Азии, Европы и Северной Америки значительно не изменилась, а в странах Африки растет (с 51,3% в 2010 г. до 85% в 2013 г.). Кроме того, устойчивость к метронидазолу в 2014 г. оставалась примерно на том же уровне, что и в начале 2009 г. в Европе. Так, в соответствии с последними рекомендациями, использование метронидазола в комплексе с амоксициллином одобрено в качестве первой линии терапии в странах Азии, Европы и Северной Америки, но не у пациентов в странах Африканского континента [8].
В Российской Федерации показатель резистентности с конца XX в. существенно не менялся, составив на 2005 г. порядка 55% [20].
Амоксициллин
Амоксициллин является самым распространенным антибактериальным препаратом, который чаще всего используется в качестве основного компонента всех эрадикационных схем («Маастрихт-V») [21]. Этот аминопенициллин из группы β-лактамных антибиотиков имеет широкий спектр действия.
Амоксициллин действует на Н. pylori путем подавления образования пенициллинсвязывающих протеинов в клеточной стенке микроорганизма. Снижение синтеза пептидогликана приводит к замедлению роста и в итоге к гибели бактериальной клетки [12].
Резистентность к аминопенициллинам формируется в результате мутации в гене pbp1A и изменения проницаемости мембран и ионных насосов [7, 12, 13].
Первые штаммы, резистентные к амоксициллину, были получены M.P. Dore в 1997 г., но устойчивость оказалась не длительной и исчезла после их заморозки и последующей рекультивации [22].
Частота устойчивости к амоксициллину значительно отличается в Азиатском регионе: в пределах от 0% в Малайзии, Тайване и Вьетнаме до 72,5% в Индии. Уровень устойчивости к амоксициллину в Африке составляет 40,87%. Распространенность устойчивости к амоксициллину в странах Европы и Северной Америки низкая: от 0% в некоторых регионах, таких как Финляндия, Германия, Норвегия и Польша, 1,4% в Испании до 2% в США. Это связано с государственной политикой, ограничивающей использование антибиотиков при инфекционных заболеваниях в странах Европы и Северной Америки. Резистентность H. pylori к амоксициллину особенно возрастает в Азии и Южной Америке, где данный препарат можно получить без рецепта. По последним данным, в ЮАР, Индии, Нигерии и Колумбии зарегистрирована резистентность H. pylori к амоксициллину на уровне 97,5, 72,5, 66 и 20,5% соответственно [14].
В Российской Федерации амоксициллин-резистентные штаммы H. pylori не выявлены [23, 24].
Тетрациклин
Тетрациклин относится к антибактериальным препаратам бактериостатического и широкого спектра действия, который активен в отношении H. pylori. Механизм действия основан на обратимом ингибировании синтеза белка на 30 субъединице бактериальной рибосомы (формирование блока слияния комплекса аминоацил-тРНК с иРНК-рибосом) [25].
Резистентность формируется в результате трех непрерывных мутаций нуклеотидов в гене 16 субъединицы рибосомальной РНК [26].
Среди 4 наиболее используемых противомикробных средств резистентность к тетрациклину была самой низкой. Процентное соотношение резистентных штаммов H. pylori к тетрациклину в мире составляет около 11,7%. Общий уровень устойчивости к тетрациклину не изменяется в Южной Америке и Северной Америке (резистентность отсутствовала), в то время как в Африке она была относительно высокой (50%). В Азии резистентность отсутствовала в Таиланде и была на очень низком уровне в Китае (0,6%) и Южной Корее (0,01%). Повышенные значения резистентности были обнаружены в Индии (53,8%) и Иране (11,7%). Распространенность устойчивости к тетрациклину остается очень низкой (менее 7,4%) в большинстве регионов мира, за исключением Африки. Сравнение данных показало, что устойчивость к тетрациклину в мире снижалась с 26,85% в 2009 г. до 6,11% в 2014 г. [27]. В России штаммы H. pylori, резистентные к тетрациклину, не выявлены [23].
Левофлоксацин
Левофлоксацин представляет собой фторхинолон III поколения. Механизм действия данного препарата основан на ингибировании жизненно необходимых микроорганизму ферментов, а именно ДНК-гиразы, топоизомеразы II и IV типа. Процессы ферментативного подавления приводят к деструкции ДНК и замедлению репликативной функции бактериальной клетки [12].
Резистентность к данной группе препаратов формируется в результате точечных мутаций в гене gyrA (позициях 87, 88, 91), что в итоге приводит к структурным изменениям отдельных субъединиц бактериальной ДНК-гиразы [8, 12].
Наличие выраженной резистентности к фторхинолонам имеет в настоящий момент большое практическое значение, которое впоследствии может привести к понижению эффективности эрадикационных схем с участием лекарственных средств данной группы на 40–50% [28].
Устойчивость возбудителя к левофлоксацину во всем
мире низкая (<19%). Уровень распространенности выше в Азии (25,28%) и Южной Америке (21,23%) по сравнению с Африкой и Европой (менее 15%). Частота резистентности к левофлоксацину сильно варьирует в Азиатском регионе: около 57% в Японии, 24,55% в Южной Корее, 5,3% в Иране и 2,6% в Малайзии. Кроме того, уровень устойчивости к левофлоксацину изменчив и в странах Европы: от 7% до 33,9%. Показатель резистентности к левофлоксацину, по-видимому, повсеместно растет — с 4,25% в 2009 г. до 17,55% в 2014 г. [14].
Из-за резкого увеличения устойчивости к кларитромицину левофлоксацин использовали в качестве альтернативы кларитромицину в некоторых схемах лечения. Но частое использование хинолонов при инфекциях мочевыделительной системы увеличило частоту возникновения устойчивости к ним H. pylori в мире [8]. Поэтому использование левофлоксацина в качестве терапии первой линии обычно не рекомендуется. Его необходимо использовать в качестве препарата второй линии или после отказа от кларитромицина и/или режима на основе метронидазола [14].
Рифабутин
Рифабутин структурно связан с группой рифамицинов и обладает потенциальной эффективностью в отношении H. pylori [29]. Механизм действия данного препарата основан на ингибировании b-субъединицы ДНК-зависимой РНК-полимеразы H. pylori, кодируемой геном rpoB. Хромосомные мутации в гене rpoB приводят к формированию резистентности [8]. Рифабутин обычно используют для лечения микобактериальных инфекций, поэтому вторичная резистентность H. pylori к рифабутину в настоящее время не наблюдается у здоровых людей. В настоящее время исследования устойчивости к рифабутину H. pylori недостаточно обширны. В Южной и Северной Америке, Африке исследования не проводились в течение последних 6 лет. Уровень устойчивости к рифабутину выше в Азии (12,45%), чем в Европе (1%). Частота устойчивости к рифабутину в азиатских странах колеблется от 28,6% в Иране до примерно 7% в Китае и Малайзии [14].
Фуразолидон
Фуразолидон представляет собой дешевый синтетический нитрофуран с широким спектром антибактериального действия, обычно используемый для лечения бактериальных и протозойных инфекций. Данный препарат используют в качестве возможной альтернативы в регионах с высокой резистентностью к метронидазолу (Китай и Южная Америка) [30]. Однако некоторые исследователи обнаружили, что схемы лечения с фуразолидоном показывают низкую эффективность и значительно повышают риск развития осложнений [31].
Исследования резистентности H. pylori к фуразолидону широко не проводились, но имеются некоторые данные о повышении устойчивости в Азии (13,8%). При этом резистентность в различных странах Азии значительно различается: от 61,4% в Иране до 16,8% в Китае и 13,8% в Индии [14].
Методы повышения эффективности эрадикационной терапии
Для оптимизации лечения инфекции H. pylori следует принять во внимание три основных момента:
использование высоких доз ингибиторов протонной помпы (ИПП);
необходимость определения чувствительности
H. pylori к антибактериальному препарату, если он применялся пациентом ранее для лечения другой патологии;
исключение повторения ранее использовавшегося антимикробного режима.
Использование высоких доз ИПП
Согласно международным рекомендациям необходимо использовать ИПП в стандартной дозе 2 р./сут для повышения эффективности противомикробной терапии [32].
Систематический обзор и метаанализ РКИ продемонстрировали значительно более высокие показатели эрадикации H. pylori, когда стандартную дозу ИПП (омепразол 20 мг, эзомепразол 40 мг, пантопразол 40 мг, лансопразол 30 мг, рабепразол 20 мг) назначали 2 р./сут. Это объясняется более значительным снижением бактериальной нагрузки H. pylori при высоких значениях внутрижелудочного рН [33].
Кроме того, высокие дозы ИПП увеличат вероятность эрадикации у пациентов с полиморфизмом CYP2C19. По последним данным, более половины жителей Европы и Северной Америки являются «быстрыми» метаболизаторами ИПП [34].
Определение чувствительности
Если пациент с инфекцией H. pylori использовал ранее макролиды или хинолоны для лечения инфекции мочевыводящих или дыхательных путей, существует высокая вероятность того, что H. pylori стал устойчивым к данным антибиотикам [35]. Поэтому необходимо проводить определение чувствительности H. pylori к антибактериальному препарату, использование которого планируется. В связи с наличием потенциально резистентных штаммов H. pylori у вышеназванных пациентов следует избегать тройной терапии, содержащей кларитромицин и левофлоксацин [32, 36].
Изменение антимикробного режима
Общее правило эмпирического лечения любых инфекционных заболеваний состоит в том, чтобы не допустить повторного применения определенного антибиотика. Метаанализ 8 исследований показал более низкий уровень эрадикации H. pylori (46%) после повторной тройной терапии с кларитромицином [37]. Поэтому необходимо избегать повторения одного и того же антимикробного режима в лечении инфекции H. pylori.
Терапия первой линии
Кларитромицин-содержащая тройная терапия
более 7 дней
Систематический обзор и метаанализ 45 РКИ, включающих в общей сложности 7722 пациента, показали, что 14 дней являются оптимальной продолжительностью тройной терапии, содержащей кларитромицин (ИПП, кларитромицин, амоксициллин или метронидазол/тинидазол) [38]. Частота эрадикации повысилась по сравнению с 7-дневной терапией (81,9% и 72,9% соответственно). С другой стороны, увеличение продолжительности с 7 до 10 дней принесло лишь небольшую пользу в плане темпов эрадикации (75,7% против 79,9%).
Квадротерапия без препарата висмута
Квадротерапия без препарата висмута включает в себя ИПП и 3 антибиотика — кларитромицин, амоксициллин и метронидазол/тинидазол. Существует 2 варианта данной терапии: последовательная терапия, когда 3 антибиотика дают последовательно — амоксициллин в течение 5 дней, а затем его заменяют кларитромицином и метронидазолом в течение дополнительных 5 дней; или 3 антибиотика назначают одновременно.
В последнем большом РКИ оценивали эффективность 10-дневной последовательной терапии по сравнению с 14-дневной кларитромицин-содержащей тройной терапией [39]. При этом были получены следующие результаты: оба режима достаточно хорошо действовали на кларитромицин-чувствительные штаммы, показав уровень деконтаминации выше 90%, тогда как эффективность обеих схем значительно снизилась (≤70%), когда штаммы H. pylori были резистентны к кларитромицину.
Недавний систематический обзор и метаанализ, включавший 8 РКИ и 3831 пациента, не показал преимущества эффективности последовательной терапии по сравнению с 14-дневной кларитромицин-содержащей тройной терапией в качестве первой линии эрадикации H. pylori (уровень эрадикации 81,4% для последовательной терапии и 80,3% для 14-дневной тройной терапии) [40].
С другой стороны, эффективность комбинированной терапии одновременно 3 антибиотиками, по-видимому, не зависит от резистентности к кларитромицину, обеспечивая высокий уровень эрадикации H. pylori (80%) у пациентов со штаммами, устойчивыми к данному антибиотику [32].
Такая терапия также эффективна при наличии резистентности H. pylori к метронидазолу. В прямом сравнительном исследовании (head-to-head) одновременная квадротерапия 3 антибиотиками продемонстрировала значительный уровень эрадикации (97%) у пациентов со штаммами, резистентными к метронидазолу, тогда как последовательная терапия показала более низкий показатель эрадикации (79%) у таких пациентов [40].
Однако при наличии штаммов H. pylori с двойной резистентностью к кларитромицину и метронидазолу одновременная квадротерапия показала более низкую эффективность. Уровень эрадикации, определенный в РКИ региона с высокой двойной резистентностью, составил 75% [40].
Висмут-содержащая квадротерапия
Данная схема включает в себя ИПП, тетрациклин, метронидазол и соль висмута [32]. В прошлом этот режим использовали лишь как терапию второй линии, однако висмут, добавленный в качестве 4-го компонента, сделал квадротерапию по-настоящему сильным оружием против резистентных штаммов H. pylori [7].
Как ожидалось, этот режим оказался очень эффективным у внушаемых пациентов. В многоцентровом РКИ оценивали эффективность квадротерапии с висмутом и 14-дневной кларитромицин-содержащей тройной терапии в качестве первой линии эрадикационной схемы [38]. По результатам исследования, квадротерапия с висмутом продемонстрировала высокий уровень эрадикации по сравнению с кларитромицин-содержащей тройной терапией (90,4% против 83,7%), а также несколько лучшие результаты, чем одновременная квадротерапия с 3 антибиотиками (85,9%).
Висмут-содержащая квадротерапия эффективна в отношении штаммов, резистентных к кларитромицину (уровень эрадикации 89%) и штаммов с двойной устойчивостью (к кларитромицину и метронидазолу) — уровень эрадикации 94%. Данное исследование также подтвердило, что устойчивость к кларитромицину влияет на эффективность 14-дневной тройной терапии (уровень устойчивости 48%). При двойной устойчивости возбудителей к кларитромицину и метронидазолу эффективность одновременной квадротерапии с 3 антибиотиками значительно снижается (уровень эрадикации 59%).
Терапия второй линии и «терапия спасения»
При безуспешности эмпирической терапии первой линии необходимо использовать тройную терапию с левофлоксацином или квадротерапию с висмутом (рис. 1) [32]. Два недавних метаанализа показали, что данные схемы имеют практически сходные показатели эрадикации в качестве терапии второй линии. В первом метаанализе 25 РКИ оценивали исходы после применения левофлоксацин-содержащей тройной терапии. Уровень эрадикации составил 74,5%. Анализ 38 РКИ показал эффективность квадротерапии с висмутом в качестве терапии второй линии. В данном случае показатель эрадикации составил 78% [42].
![Рис. 1. Выбор предпочтительной схемы лечения [41] Рис. 1. Выбор предпочтительной схемы лечения [41]](https://medblog.su/wp-content/uploads/2019/10/1570958113_446_metody-povysheniya-effektivnosti-eradikatsionnoj-terapii-bikbavova-g-r-ahmedov-v-a-muhamedzhanov-b-m.png)
При неэффективности второй линии эрадикационной терапии необходимо рассмотреть возможность определения генотипа и молекулярных механизмов резистентности штаммов H. pylori. Однако данная методика не нашла на сегодняшний момент широкого применения [32].
В качестве третьей или четвертой линии оправдано применение схем лечения, не использовавшихся в терапии первой и второй линии: квадротерапия с висмутом и левофлоксацином, а также тройная терапия с рифабутином (ИПП + рифабутин + амоксициллин) [35, 42].
Заключение
Гастрит, ассоциированный c H. рylori, в современной медицинской практике является очень распространенной инфекционной болезнью, а эрадикационную терапию необходимо проводить всем зараженным пациентам.
Основными правилами, выполнение которых будет способствовать повышению эффективности эрадикационной терапии, являются: использование больших доз ИПП; определение чувтствительности H. рylori к антибактериальному препарату, если пациент ранее использовал его для лечения других заболеваний; исключение повторного применения ранее использовавшейся схемы эрадикационной терапии.
В регионах с высокой устойчивостью к антибактериальным препаратам или после неудачного применения тройной схемы с кларитромицином/левофлоксацином, а также у пациентов, имеющих в анамнезе данные о применении макролидов и хинолонов, наиболее оптимальной схемой лечения является квадротерапия с висмутом.
Тройная схема с кларитромицином рекомендована пациентам, проживающим в регионах с низкой резистентностью к данному препарату (<15%), при этом продолжительность лечения должна быть увеличена до 14 дней. Применение схемы с последовательным приемом антибактериальных препаратов в настоящее время настоятельно не рекомендуется.
Информация с rmj.ru