Содержание статьи
Введение
Лимфома Ходжкина (ЛХ), или лимфогранулематоз, — это В-клеточное злокачественное лимфопролиферативное заболевание, частота которого в России составляет 2,2 случая на 100 000 населения в год, а смертность достигает 0,61 случая на 100 000 в год. Характерной особенностью ЛХ является локализованность патологического процесса на ранних стадиях с постепенным вовлечением лимфоузлов пограничных областей.
Чаще болеют женщины, а пик заболеваемости приходится на возрастной период 16–35 лет [1].
Согласно классификации опухолей гемопоэтической и лимфоидной тканей, применяемой Всемирной организацией здравоохранения, ЛХ разделяют на классическую и нодулярную с лимфоидным преобладанием. Классическая ЛХ включает гистологические варианты с нодулярным склерозом (I и II типа), смешанно-клеточный вариант, классический вариант с большим количеством лимфоцитов и редко встречающийся тип с лимфоидным истощением [2].
Классическая ЛХ составляет 10% всех лимфом, является наиболее распространенным типом и диагностируется во время беременности с частотой 1:1000–1:60001.
Стадирование болезни основано на степени вовлеченности в патологический процесс лимфатических узлов (Энн-Арборская классификация). При I стадии поражаются лимфатические узлы одной области или органа, при II стадии — двух или нескольких областей по одну сторону диафрагмы, при III стадии в патологический процесс вовлекаются лимфатические узлы по обе стороны диафрагмы и селезенка, а при IV стадии развивается диссеминированное поражение одного или нескольких внелимфатических органов. Буквенная аббревиатура (А и В) характеризует наличие или отсутствие В-симптомов (лихорадка выше 38 °С не менее трех дней подряд без признаков воспаления, ночной профузный пот, похудание на 10% от исходной массы тела за последние 6 мес.)1.
Клинические признаки заболевания многообразны и включают бессимптомное увеличение периферических лимфоузлов (лимфаденопатия), интоксикацию (В-симптомы), интермиттирующую лихорадку, кожный зуд, боль в груди, кашель, одышку и симптомы сдавления верхней полой вены. Некоторые признаки, такие как утомляемость, потливость, одышка, анемия и тромбоцитопения, могут развиваться и при обычной беременности, что иногда затрудняет диагностику лимфом1 [3]. Присутствие В-симптомов и зуда у беременных отмечается редко [3]. Наиболее ранним первым признаком ЛХ у беременных является развитие локализованной или генерализованной лимфаденопатии1.
Диагноз ЛХ ставится на основании гистологического исследования материала, полученного при биопсии или эксцизии лимфатического узла [4]. Доминирующим гистологическим типом опухоли при беременности является вариант с нодулярным типом склероза1[3]. Ограничений для проведения биопсии во время беременности нет.
После гистологической верификации необходимо определить стадию заболевания, от которой будет зависеть выбор лечебной тактики. Стандартный объем обследования при беременности включает1 [5]:
лабораторные тесты: общий анализ крови и мочи, скорость оседания эритроцитов, биохимический анализ крови, коагулограмму и серологическое исследование на ВИЧ, гепатиты В и С;
МРТ (без контрастирования) органов грудной клетки, брюшной полости и малого таза;
УЗИ органов брюшной полости и периферических лимфатических узлов (при невозможности проведения МРТ);
КТ органов грудной полости при недоступности МРТ; рентгенографию органов грудной полости (в двух проекциях, с экранированием живота, со II триместра) при недоступности КТ и МРТ.
Лимфома Ходжкина и беременность
При любых формах и стадиях ЛХ возможны три варианта ведения пациенток: прерывание беременности, выжидательная тактика или противоопухолевая терапия. Общепринятыми являются следующие положения1 [2, 4, 5]:
-
При наступлении беременности на фоне ремиссии ЛХ нет показаний к медицинскому аборту.
-
При рецидивирующем течении ЛХ или неблагоприятном прогнозе в I триместре показано прерывание беременности.
-
При выявлении ЛХ в I триместре у женщин с IА и IIА стадиями без массивного поражения средостения и вовлечении менее четырех областей лимфатических коллекторов возможно отложить начало лечения до II или III триместра.
-
Со II триместра возможно проведение полихимио-терапии (ПХТ) без использования алкилирующих препаратов. Обязательным является назначение низкомолекулярных гепаринов на протяжении всего периода гестации и в течение 6 нед. после родов.
-
Сроки родоразрешения определяются индивидуально, в интересах плода они должны быть не ранее 33–34 нед., а оптимально — после 37 нед. В связи с возможной миелосупрессией у матери и у плода ПХТ должна быть отменена за 3 нед. до родов.
-
Предпочтительными являются естественные роды, кесарево сечение проводится только по акушерским показаниям.
-
Беременным с симптомами интоксикации, синдромом сдавления верхней полой вены или угрозой прогрессирования ЛХ рекомендовано начать монохимио-терапию (винбластин 6 мг/м2 каждые 2–4 нед.) или, при резистентности, ПХТ по схеме ABVD (доксорубицин, блеомицин, винбластин и дакарбазин).
На основании данных ретроспективных исследований показано, что беременность не оказывает существенного влияния на течение ЛХ. Анализ международной онкологической базы данных продемонстрировал отсутствие различий в показателях общей и безрецидивной выживаемости у 77 беременных, проходивших лечение в период с 1969 по 2018 г. [6].
Влияние ПХТ на рост и развитие плода
Все химиотерапевтические препараты оказывают тератогенное действие, наиболее значимое в периоды имплантации (1–2-я недели) и эмбриогенеза (3–8-я недели). Риск развития пороков или смерти плода зависит от срока гестации, используемого агента и его дозы. Риск формирования пороков при моно- и комбинированной химио-терапии, проводимой в I триместре, составляет 15 и 25% соответственно [7]. Во II и III триместрах химиотерапия не связана с образованием пороков у плода (1,3% по сравнению с 3,1% в общей популяции) [7].
Плацента играет ключевую роль в переносе лекарственных средств [8]. Плацентарные клетки обладают фенотипом множественной лекарственной устойчивости, который может снижать или предотвращать передачу плоду доксорубицина, винбластина и винкристина.
Применение ПХТ во II и III триместрах может приводить к задержке роста плода, преждевременным родам, мертворождению, гипотрофии новорожденных, умственной отсталости и снижению способности к обучению [9, 10]. Изучен катамнез 43 детей в возрасте от 3 до 19 лет, подвергшихся внутриутробно химиотерапии ABVD, и установлено, что при комплексном обследовании ни у кого не было выявлено отклонений в психическом и физическом развитии [11].
Проведение ПХТ во время беременности требует соблюдения тщательного баланса между эффективной дозой и потенциальным вредом для плода [12]. Большинству пациенток с ЛХ, диагностированной во время беременности, возможно проведение специфического лечения, однако есть данные об отсутствии ухудшения прогноза заболевания и при терапии, отложенной на послеродовый период [3].
Выбор лечения зависит от триместра, локализации процесса и стадии заболевания. Начало терапии следует отложить до начала II триместра, если течение болезни бессимптомное, стабильное и с супрадиафрагмальной локализацией. Однако при симптомном течении, массивном вовлечении лимфатических узлов, поддиафрагмальной локализации или прогрессирующем течении ЛХ в I триместре целесообразно рассмотреть возможность прерывания беременности1.
Со II триместра назначается стартовое лечение — комбинированная химиотерапия ABVD или монотерапия винбластином [13]. При бессимптомном течении с наддиафрагмальной локализацией вовлеченных лимофоузлов лечение может быть отложено до III триместра или на послеродовый период. При симптомном заболевании или прогрессирующей ЛХ комбинированная химиотерапия по схеме ABVD назначается незамедлительно [14]. Беременным назначают такие же дозы ПХТ, что и небеременным, хотя на фоне гестационного процесса увеличивается объем крови, повышается почечный и печеночный клиренс, снижается перистальтика кишечника и уровень альбумина, появляется «третье пространство» амниотической полости, а также присутствует p-гликопротеин в тканях плода и в эндометрии, что обусловливает множественную лекарственную устойчивость [14, 15].
На фоне химиотерапии наиболее частыми побочными эффектами являются тошнота и рвота. Для ее купирования могут быть использованы прометазин, селективные антагонисты серотонина (5-HT), антагонисты нейрокинина 1 (NK1) и дроперидол в сочетании с димедролом или дексаметазоном [14].
Лучевая терапия на фоне беременности имеет ограничения к применению и проводится с экранированием живота только во II–III триместрах супрадиафрагмально и в дозе до 0,1 Гр [3]. Сообщается о безопасности лучевого облучения области шеи и средостения дозой от 35 до 40 Гр (расчетная доза для плода 0,011–0,055 Гр для фотонов и 0,10–0,14 Гр для кобальта-60) [16]. При соблюдении всех предостережений прогноз для плода после лучевой терапии не ухудшается [16, 17].
Собственный опыт родоразрешения пациенток с ЛХ
Родильный дом при ГКБ № 40 ДЗ г. Москвы функционирует с 2017 г. и специализируется на оказании медицинской помощи беременным с онкопатологией. За 3 года были родоразрешены 20 пациенток с ЛХ. Возраст женщин был от 19 до 37 лет, в среднем 26,92 года, все они проживали в Москве и состояли на учете по беременности в женской консультации с I триместра.
Гинекологический анамнез был отягощен у 5 (25%) эктопией шейки матки, у 4 (20%) в анамнезе были инфекции, передающиеся половым путем, у 1 (5%) — миома матки и у 1 (5%) — внематочная беременность с тубэктомией. Соматический анамнез был отягощен у 4 (20%) хроническим аутоиммунным гипотиреозом, у 4 (20%) варикозным расширением вен, у 2 (10%) хроническим гастритом и у 1 (5%) пациентки выявлены хронический пиелонефрит, мочекаменная болезнь, ожирение 1-й степени.
Первобеременными были 10 (50%) пациенток, у 9 (45%) ранее были роды. Настоящая беременность наступила спонтанно у 19 (95%), в одном случае — путем вспомогательных репродуктивных технологий.
Из 20 пациенток ЛХ IIА стадии была у 5 (25%) пациенток, IIВ стадии — у 7 (35%), IIIА стадии — у 2 (10%), IIIВ стадии — у 3 (15%) и IVВ стадии — у 3 (15%). Ремиссия ЛХ на момент наступления беременности была у 16 (80%) пациенток. Ранее они прошли курсы ПХТ (100%) и лучевой терапии (53,3%) со стойкой ремиссией. У 4 (20%) женщин заболевание впервые манифестировало на фоне беременности. В таблице представлена информация о пациентках.
Одним из показателей качества жизни женщин, перенесших ЛХ, является сохранение и реализация репродуктивной функции. По данным ряда авторов, после окончания ПХТ полное восстановление функции яичников происходит у 70% пациенток [17]. Частота рецидивов ЛХ наибольшая в первые 3 года после окончания лечения и достигает 14% [18]. После родов количество рецидивов лимфогранулематоза у женщин, находящихся в полной ремиссии более трех лет, не превышает 9%, а при неуверенной полной или частичной ремиссии до трех лет может достигать 44% [19]. По данным ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, беременность и роды у женщин, перенесших лимфогранулематоз и рожавших в полной ремиссии, не отягощают прогноз заболевания [20]. Сроки возникновения рецидивов в этой группе женщин соответствуют всем показателям в общей популяции больных.
В связи с этим планирование беременности оптимально после истечения трех лет и при достижении полной ремиссии. Под полной ремиссией понимается полное исчезновение всех проявлений заболевания, в том числе выявляемых при помощи лабораторных и лучевых методов диагностики, а также клинических симптомов, если они имели место до начала лечения.
Среди пациенток, родоразрешенных в родильном доме при ГКБ № 40, полная ремиссия с длительностью 2, 3, 4, 5, 7, 8 и 15 лет была у 14 человек (по 2 (12,5%) случая для каждого отрезка времени), еще у двух женщин длительность ремиссии составила 9 и 13 лет.
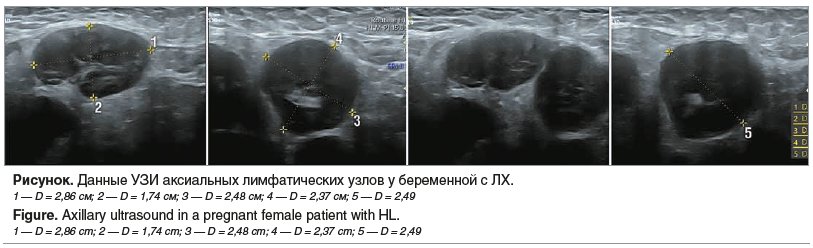
У четырех женщин ЛХ была впервые диагностирована во время беременности. Основным клиническим признаком была лимфаденопатия, пример степени увеличения аксиальных лимфатических узлов представлен на рисунке. У одной пациентки лечение было отложено на послеродовый период, у трех — проводилась ПХТ.
Течение беременности у пациенток с ЛХ в анамнезе осложнялось умеренной (3/16 (18,75%)) и тяжелой (1/16 (6,25%)) преэклампсией, анемией (3/16 (18,75%)) и угрозой преждевременных родов (25% (4/16)). Своевременные вагинальные роды были у 12/16 (75%) пациенток, кесарево сечение у 4/16 (25%). Масса новорожденных составила от 1690 до 4080 г (в среднем 3250±75 г). Репродуктивные потери во время анализируемой беременности составили 1/20 (5%) и были представлены случаем внутриутробной гибели одного плода при монохориальной диамниотической двойне. Пациентка была родоразрешена в 37 нед.
Из четырех женщин с манифестацией ЛХ на фоне текущей беременности у трех развилась анемия и у двух — угроза преждевременных родов. Во всех случаях беременность завершилась вагинальными срочными родами, с массой новорожденных от 2960 до 3500 г (3055±90 г). Средняя кровопотеря в родах не отличалась по величине таковой у здоровых женщин и составила 420,0±75,5 мл. Осложнений в послеоперационном и послеродовом периоде не было ни у одной родильницы.

Обсуждение
Клиническая картина классической ЛХ во время беременности аналогична таковой у небеременных и может включать лимфаденопатию, симптомы интоксикации, признаки сдавления органов средостения и зуд кожи. Диагностика основывается на гистологическом исследовании биопсии лимфатического узла, при этом предпочтительно проводить эксцизионную биопсию, так как тонкоигольная аспирационная биопсия недостаточна для установления диагноза и определения подтипа опухоли. Стадирование проводится на основании результатов МРТ грудной и брюшной полости в соответствии с критериями Лугано.
Лечение ЛХ следует отложить до II–III триместра или перенести на послеродовый период. Большинству женщин с диагнозом ЛХ, выявленной в I триместре, рекомендуется прерывание беременности (уровень 1C).
Специфическая терапия начинается со II триместра и чаще всего включает применение схемы ABVD, лучевая терапия назначается только в исключительных случаях (уровень 2C).
При бессимптомном течении у клинически стабильных пациенток с наддиафрагмальной локализацией заболевания химиотерапию можно отложить до послеродового периода (уровень 2C). В нашем исследовании из четырех пациенток с впервые диагностированной при беременности ЛХ химиотерапия была отложена в одном случае, трем пациенткам проводилось лечение по схеме BEACOPP-14 (этопозид, доксорубицин, циклофосфамид, винкристин, блеомицин, прокарбазин или декарбазин, преднизолон). Применение химиопрепаратов во II и III триместрах ассоциировано с задержкой роста плода, преждевременными родами, мертворождением, низким весом при рождении и нарушением когнитивных функций. В нашем исследовании во всех случаях пациентки были родоразрешены в срок, задержки роста плода и гипотрофии новорожденных выявлено не было.
Родоразрешение пациенток с ЛХ проводится в сроки, максимально приближенные к доношенности. Кесарево сечение проводится только по акушерским показаниям.
Заключение
Наш собственный опыт ведения беременности у женщин с ЛХ и родоразрешения в целом согласуется с мировым опытом. При наступлении беременности на фоне стойкой ремиссии значимых отличий в частоте развития акушерских осложнений, сроках и методах родоразрешения от среднепопуляционных показателей нет. При впервые выявленном заболевании врачебная тактика зависит от стадии болезни и срока гестации. В нашем исследовании у части беременных стартовая химиотерапия была отложена на послеродовый период в связи с благоприятным прогнозом. У части пациенток со II триместра проводилась химиотерапия.
1Клинические рекомендации. Лимфома Ходжкина. 2020. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/schema/139_1 (дата обращения: 10.09.2023).
Сведения об авторах:
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Данелян Соня Жоровна — к.м.н., заместитель главного врача по акушерству и гинекологии ГБУЗ «ММКЦ «Коммунарка» ДЗМ»; 108814, Россия, г. Москва, пос. Сосенское, п. Коммунарка, ул. Сосенский стан, д. 8; ORCID iD 0000-0002-8594-6406.
Боровкова Екатерина Игоревна — д.м.н., доцент, профессор кафедры акушерства и гинекологии РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-7140-262X.
Нагайцева Елена Анатольевна — к.м.н., заведующая отделением ультразвуковой диагностики родильного дома ГБУЗ «ММКЦ «Коммунарка» ДЗМ»; 108814, Россия, г. Москва, пос. Сосенское, п. Коммунарка, ул. Сосенский стан, д. 8.
Сарахова Джамиля Хажбаровна — к.м.н., заведующая отделением патологии беременных родильного дома ГБУЗ «ММКЦ «Коммунарка» ДЗМ»; 108814, Россия, г. Москва, пос. Сосенское, п. Коммунарка, ул. Сосенский стан, д. 8.
Боровков Иван Максимович — врач-онколог, аспирант кафедры постдипломного образования врачей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115478, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0002-2017-8047.
Гусева Марина Сергеевна — врач акушер-гинеколог ГБУЗ «ГКБ им. В.В. Вересаева ДЗМ»; 127644, Россия, г. Москва, ул. Лобненская, д. 10; ORCID iD 0000-0003-4653-2208.
Контактная информация: Боровкова Екатерина Игоревна, e-mail: Katyanikitina@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.09.2023.
Поступила после рецензирования 07.10.2023.
Принята в печать 28.10.2023.
About the authors:
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation, ORCID iD 0000-0002-7830-2290.
Sonya Zh. Danelyan — C. Sc. (Med.), Deputy Chief Medical Officer of Obstetrics and Gynecology, Moscow Multidisciplinary Clinical Center «Kommunarka»; 8, Sosneskii stan, Kommunarka settlement, Sosenskoe settlement, Moscow, 108814, Russian Federation; ORCID iD 0000-0002-8594-6406.
Ekaterina I. Borovkova — Dr. Sc. (Med.), Associate Professor, Professor of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation, ORCID iD 0000-0001-7140-262X.
Elena A. Nagaytseva — C. Sc. (Med.), Head of the Department of Diagnostic Ultrasound of the Maternity Hospital, Moscow Multidisciplinary Clinical Center «Kommunarka»; 8, Sosneskii stan, Kommunarka settlement, Sosenskoe settlement, Moscow, 108814, Russian Federation.
Jamilya Kh. Sarakhova — C. Sc. (Med.), Head of the Department of Pregnancy Pathology of the Maternity Hospital, Moscow Multidisciplinary Clinical Center «Kommunarka»; 8, Sosneskii stan, Kommunarka settlement, Sosenskoe settlement, Moscow, 108814, Russian Federation.
Ivan M. Borovkov — oncologist, postgraduate student of the Department of Postgraduate Medical Education, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoye highway, Moscow, 115478, Russian Federation; ORCID iD 0000-0002-2017-8047.
Marina S. Guseva — obstetrician-gynecologist, V.V. Veresaev City Clinical Hospital; 10, Lobnenskaya str., Moscow, 127644, Russian Federation; ORCID iD 0000-0003-4653-2208.
Contact information: Ekaterina I. Borovkova, e-mail: Katyanikitina@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 15.09.2023.
Revised 07.10.2023.
Accepted 28.10.2023.
Информация с rmj.ru