Введение
Ожирение — хроническое заболевание, характеризующееся избыточным накоплением жировой ткани в организме, представляющее угрозу здоровью и являющееся основным фактором риска ряда других хронических заболеваний, включая сахарный диабет 2 типа (СД2) и сердечно-сосудистые заболевания [1].
Избыточная масса тела и ожирение усугубляют проблемы общественного здравоохранения как в экономически развитых, так и в развивающихся странах. Согласно данным ВОЗ за 2016 г. почти у 39% людей старше 18 лет есть избыточная масса тела, а ожирением страдают 13% населения [2]. В Российской Федерации в 2016 г. доля лиц с избыточной массой тела составила 62,0%, с ожирением — 26,2% [3].
Безусловно, в лечении ожирения следует придерживаться всестороннего комплексного подхода. В настоящее время к самым эффективным методам лечения ожирения относят бариатрические операции. В то же время рецидивы ожирения после таких вмешательств встречаются не так редко, как этого хотелось бы пациентам и врачам.
Определение предикторных факторов различных исходов бариатрических операций позволит обеспечить более прецизионный отбор пациентов для вмешательств. Анализ возраста, начального индекса массы тела (ИМТ) и коморбидного фона не всегда позволяет точно предсказать результат лечения [4]. Выявление генетических факторов, связанных с устойчивой потерей веса после бариатрического вмешательства, может помочь определить стратегии управления весом до и после операции, а также определить показания к выбору того или иного вида лечения и разработать новые виды вмешательств [5].
Цель исследования: оценить отдаленные результаты лапароскопической продольной резекции желудка (ЛПРЖ) и определить перечень генов, ассоциированных с рецидивом ожирения в отдаленном послеоперационном периоде.
Материал и методы
В исследование включены пациенты с ожирением (n=81). Средний возраст пациентов составил 44,80±1,26, женщин было 72,84% (n=59), мужчин — 27,16% (n=22).
Пациенты были госпитализированы в хирургическое отделение СПб ГБУЗ «Городская больница № 40» для выполнения бариатрической операции. Исследование в рамках научно-исследовательского проекта «Биобанкирование и биомедицинские исследования образцов тканей и жидкостей человека» было одобрено экспертным советом по этике СПб ГБУЗ «Городская больница № 40» на заседании, протокол № 119 от 09.02.2017. От всех участников исследования получено письменное информированное добровольное согласие на размещение их биоматериала в биобанке с последующим использованием в научных целях.
Критерии включения в исследование: мужчины и женщины в возрасте от 20 до 70 лет, ИМТ>35, отсутствие бариатрической операции в анамнезе, отсутствие противопоказаний к хирургическому лечению, отсутствие психиатрических и онкологических заболеваний, наличие подписанного добровольного информированного согласия.
Обследование пациентов включало лабораторные исследования (клинический и биохимический анализы крови, общий анализ мочи, анализ на выявление ВИЧ, вирусных гепатитов, сифилиса), антропометрию, компьютерную томографию органов брюшной полости и малого таза, обзорную рентгенографию органов грудной клетки, ультразвуковое исследование органов брюшной полости, гастроскопию, эхокардиографию, спирометрию, консультацию терапевта, эндокринолога и психолога. Кроме того, до операции получены образцы крови всех пациентов для дальнейшего генетического исследования.
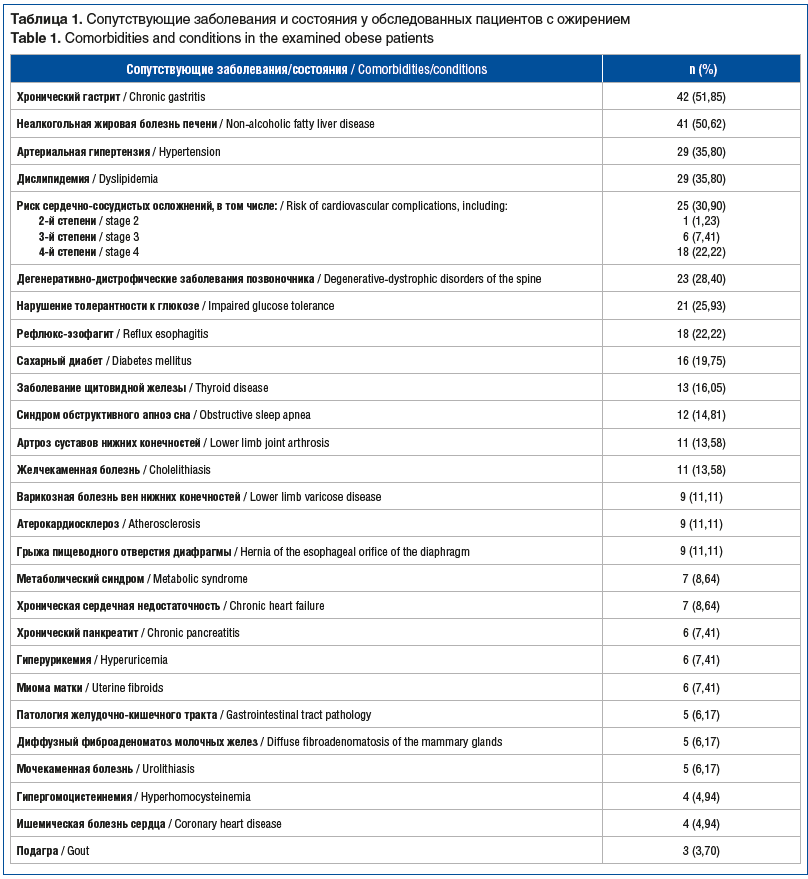
Необходимо отметить, что у пациентов часто встречались разнообразные сопутствующие заболевания (табл. 1).
Всем пациентам была выполнена ЛПРЖ.
Пациенты наблюдались амбулаторно в течение 5 лет, по истечении этого времени испытуемые были распределены в 2 группы (по наличию рецидива ожирения): 64 (79,0%) пациента в группу стойкой потери веса, 17 (21,0%) — в группу рецидива ожирения. За рецидив ожирения было принято увеличение массы тела, превышающее 25% от минимально зарегистрированного в послеоперационном периоде [6].
Для определения возможных генетических факторов риска развития рецидива ожирения после ЛПРЖ всем пациентам выполнено секвенирование полного экзома.
На автоматической станции QIACube (QIAGEN, Германия) с использованием реагентов QIAamp DNA Blood Mini (QIAGEN, Германия) выделили ДНК из образцов крови. Подготовку библиотек генов проводили с гибридизацией зондами для полноэкзомного секвенирования KAPA HyperExome (Roche, Швейцария). Для конверсии использовалиреагенты High-Throughput Sequencing Primer Kit (App-C) и MGIEasy Universal Library Conversion Kit (App-A) (MGI, Китай). Секвенировали полученные библиотеки на секвенаторе MGISEQ-2000 методом парно—концевого прочтениядлиной 150 пар оснований на ячейке DNBSEQ-G400 High-throughput Sequencing Set (PE150, 540 Гб) (MGI, Китай). Требования к качеству исследования: среднее покрытие >100×, равномерность прочтения — не менее 97% прочтений 10×.
Результаты секвенирования обрабатывали на платформе ru.genomenal.com. Контроль качества образцов проведен с помощью Falco. Выравнивание на референтный геном версии hg38 выполнено программой BWA2. Дедупликация, рекалибровка качества оснований и подсчет покрытия сделаны следующими инструментами GATK: MarkDuplicates, BaseRecalibrator и CollectHSMetrics соответственно. Детекция и фильтрация генетических вариантов также выполнены инструментами GATK: HaplotypeCaller, VariantFiltration. Аннотация проведена программой VEP.
Для статистической обработки результатов использовали программы Excel 365 (Microsoft, США) и SPSS Statistics Version 26 (IBM, США). Количественные данные были обобщены и представлены в виде среднего арифметического взвешенного со среднеквадратичной ошибкой для нормально распределенных величин, в виде квартильных оценок — для ненормально распределенных величин, а также в виде относительных показателей (%). Нормальность распределения выборок проверялась тестом Шапиро — Уилка. Для статистического анализа применяли следующие методы: U-критерий Манна — Уитни, односторонний точный критерий Фишера, критерий χ2 Пирсона, критерий χ2 с поправкой Йейтса, T-test. Статистически значимым считали значение p<0,05. При оценке однонуклеотидных полиморфизмов (Single Nucleotide Polymorphism, SNP) статистически значимым считали значение р<0,01.
Результаты и обсуждение
Для оценки эффективности ЛПРЖ через 1 год после хирургического вмешательства использовали расчет показателя %EBMIL по формуле:
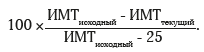
Эффективной операцию признавали при значении %EBMIL >50% [7]. Во всех случаях, включенных в данное исследование, ЛПРЖ была признана эффективной.
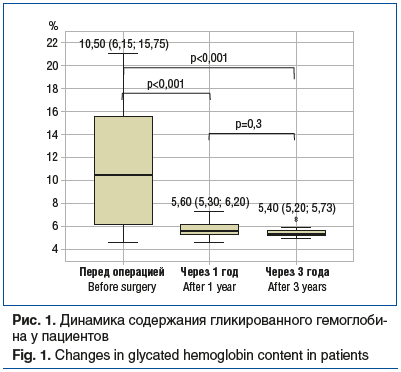
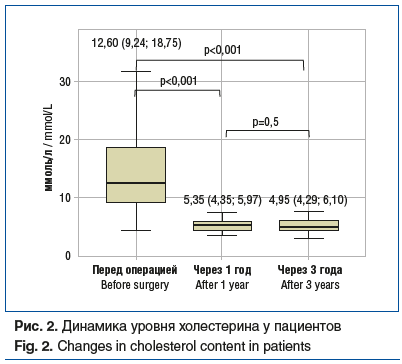
При анализе изменений данных лабораторных исследований, полученных перед операцией и через 1 и 3 года после нее, отмечены статистически значимые различия (критерий Манна — Уитни) уровней следующих показателей:
-
гликированный гемоглобин (рис. 1);
-
холестерин (рис. 2);
-
липопротеины высокой плотности (ЛПВП) (рис. 3);
-
липопротеины низкой плотности (ЛПНП) (рис. 4);
-
трийодтиронин (Т3) (рис. 5);
-
тиреотропный гормон (ТТГ) (рис. 6).
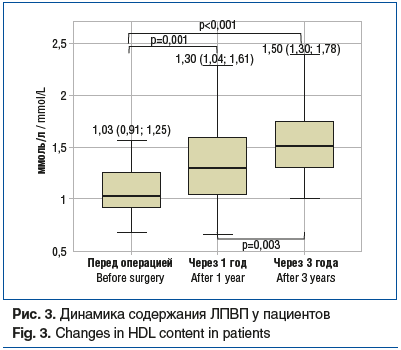
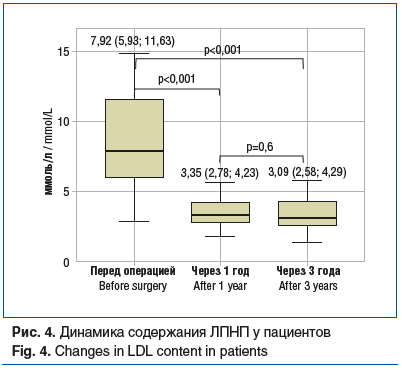
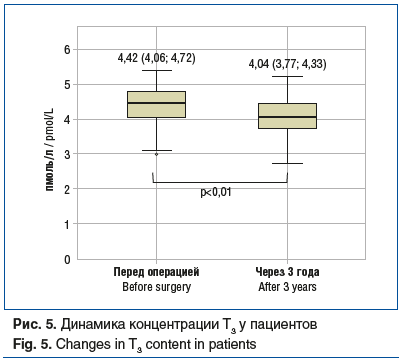
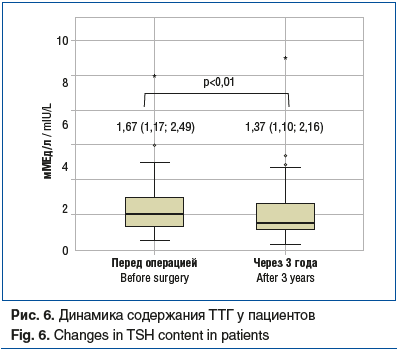
Спустя 5 лет после ЛПРЖ были достигнуты ремиссия ряда заболеваний и регресс состояний, связанных с ожирением (табл. 2).
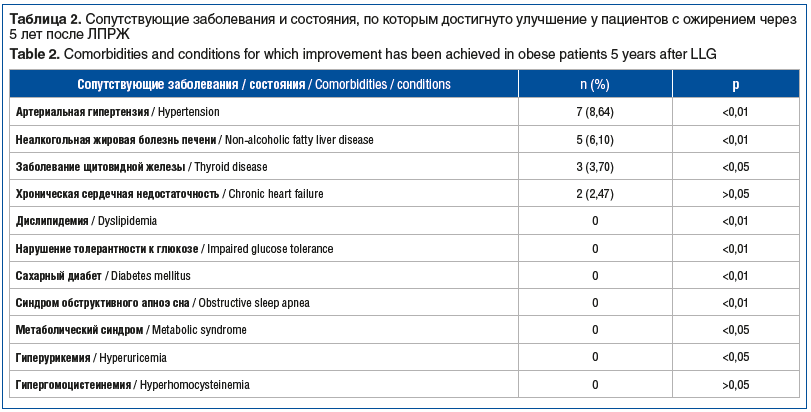
Также была отмечена нормализация антропометрических показателей [8].
Полученные данные закономерны и соотносятся с результатами, опубликованными ранее зарубежными и отечественными авторами. Однако рецидив ожирения наблюдался у каждого 5-го из обследованных нами пациентов, что также соответствует общемировым трендам [9].
Отдельно следует отметить влияние бариатрической хирургии на щитовидную железу. Масса тела и уровень гормонов щитовидной железы тесно связаны между собой. Дефицит тиреоидных гормонов приводит к увеличению массы тела из-за снижения скорости базального метаболизма и термогенеза. Также была показана отрицательная корреляция между концентрацией гормонов щитовидной железы и ИМТ. Предполагается, что при ожирении развивается резистентность к гормонам щитовидной железы посредством механизма, подобного инсулинорезистентности, что приводит к повышению уровня ТТГ [10].
Как сообщалось ранее [11], полученные результаты пред-операционного обследования не позволили построить математическую модель, которая смогла бы предсказать вероятность стойкого снижения массы тела после ЛПРЖ. Вероятно, изменения данных показателей связаны с ожирением, что не позволяет использовать их для построения такой модели. Именно поэтому, по мнению авторов, для поиска предикторных факторов следует использовать постоянные или малоизменяемые при ожирении показатели. Генетический профиль пациента соответствует этим критериям.
На основании результатов t-теста было выявлено 22 гена, мутации в которых предположительно связаны с рецидивом ожирения после ЛПРЖ (p<0,01): CARD8, FMC1, MUC16, MUC21, HTR3D, MAMDC4, IFNK, HLA-DQB1, LUC7L2, KIR3DL1, LILRB4, RBBP6, ANKRD30A, ABCC12, LRRIQ3, PDE6B, OR5H15, CCDC187, PMIS2, SAMD11, PTCHD3, AKR7L.
Многие из выявленных нами генов и их продуктов прямо или косвенно связаны с развитием ожирения, нарушениями энергетического обмена, функций желудочно-кишечного тракта и гормональной регуляции организма, что в том числе может объяснять их потенциальную роль в развитии рецидива ожирения у пациентов, перенесших ЛПРЖ.
Ген CARD8 кодирует белок, содержащий домен рекрутирования каспаз 8 (caspase recruitment domain family member 8), который участвует в регуляции инфламмосомы NLRP3 [12]. NLRP3, в свою очередь, ассоциирована с развитием ожирения, СД2 и резистентности к глюкозе [12]. В связи с этим можно предположить, что мутации в CARD8 могут влиять на развитие ожирения после ЛПРЖ.
Гены MUC16 и MUC21 кодируют белки, принадлежащие к семейству муцинов. Муцины представляют собой высокомолекулярные O-гликозилированные белки, которые играют важную роль в формировании защитного слизистого барьера и обнаруживаются на апикальных поверхностях клеток эпителия. Муцин 16 также известен как СА-125 — онкомаркер, использующийся в диагностике многих злокачественных образований, включая рак яичника. Продемонстрировано, что наличие метаболического синдрома, повышенного уровня триглицеридов или низкого уровня ЛПВП отрицательно коррелирует с концентрацией СА-125 [13]. Из этого можно заключить, что наличие вариантов MUC16 и/или концентрация СА-125 могут быть предикторами развития повторного ожирения после бариатрической операции.
Ген FMC1 кодирует белок, участвующий в сборке протон-транспортирующего комплекса АТФ-синтазы, негативной регуляции катаболизма липидов и регуляции пролиферации β-клеток поджелудочной железы, продуцирующих инсулин, поэтому его повреждение может быть одним из звеньев механизма развития рецидива ожирения после хирургического лечения [14].
Ген HTR3D кодирует субъединицу D рецептора 3-го типа 5-гидрокситриптамина (серотонина) [14]. Серотонин играет роль в регуляции потребления пищи. Существует 2 схемы регуляции пищевого поведения, опосредованные серотонином: гомеостатическая, которая сопоставляет потребление энергии с расходом энергии, и гедоническая, которая участвует в вознаграждении и мотивационных аспектах потребления энергии. В гомеостатической схеме серотонинергическая передача сигналов способствует интеграции метаболических сигналов, которые передают энергетический статус организма и снижают чувство голода, когда удовлетворены гомеостатические потребности. В гедонической схеме серотонинергическая передача сигналов может снижать связанное с вознаграждением мотивационное потребление пищи. Серотонин периферического действия способствует поглощению и накоплению энергии. Известно, что нарушение серотонинергической сигнализации достоверно связано с развитием ожирения [15].
Ген KIR3DL1 кодирует один из киллер-иммуноглобулиноподобных рецепторов (KIR), который представляет собой поверхностный рецептор натуральных киллеров и связывается с соответствующими лигандами главного комплекса гистосовместимости I типа (MHC I) [16]. Было показано, что варианты rs78852323 и rs527885640 ассоциированы с более низкими уровнями адипсина [17]. Адипсин — цитокин, который секретируется адипоцитами и участвует в активации альтернативного пути комплемента иммунной системы [18]. Он катализирует высвобождение фактора комплемента С3а, который, как было показано, стимулирует выработку инсулина в β-клетках поджелудочной железы. Концентрация адипсина в сыворотке снижена у пациентов с СД2 и недостаточностью β-клеток. Кроме того, адипсин способствует поглощению глюкозы и увеличивает синтез триглицеридов в адипоцитах [19]. Показано, что у мышей с гипоталамической моделью ожирения наблюдался дефицит адипсина, в то время как у людей его уровнь в крови положительно коррелировал с избыточной массой тела [20].
Ген IFNK кодирует участвующий в иммунном ответе интерферон κ, представляющий собой интерферон I типа (IFN-I) [21]. Ген SOCS3 (suppressor of cytokine signalling 3) служит ключевым регулятором IFN-I, а также участвует в сигнальных путях лептина, грелина и провоспалительных цитокинов, уровень которых повышается при ожирении [22]. Таким образом, активация SOCS3 и измененные уровни системного лептина могут быть ответственны за снижение ответа на IFN-I, а также за другие иммунные дисфункции у людей с ожирением. Показано (in vitro), что у людей с ожирением снижается продукция IFN-I, связанная со сверхэкспрессией SOCS3 и повышением концентрации лептина [23]. Нарушения в этом сигнальном каскаде могут быть одной из причин повторного развития ожирения после хирургического лечения.
Ген LILRB4 кодирует лейкоцитарный иммуноглобулиноподобный рецептор, который экспрессируется на иммунных клетках, где он связывается с молекулами MHC I на антигенпрезентирующих клетках и подавляет иммунный ответ [14]. Показано, что ингибирование FTO — гена, ассоциированного с ожирением, — подавляет экспрессию LILRB4 [24]. C.L. Saunders et al. [25] при исследовании множества популяций выявили ассоциацию одиночных нуклео-тидных полиморфизмов (single nucleotide polymorphisms, SNP) FTO с повышенным ИМТ.
Ген RBBP6 кодирует регулирующий белок-супрессор ретинобластомы (рRB), который участвует в регуляции пролиферации клеток. Его экспрессия положительно коррелирует с развитием отдаленных метастазов при многих злокачественных новообразованиях, включая опухоли толстой кишки, яичников, молочной железы [26]. Помимо этого, RBBP6 является негативным регулятором транскрипционного фактора p53 — важного звена во многих сигнальных каскадах в клетке. В частности, описана его роль в развитии резистентности к инсулину и СД2 при ожирении [27, 28]. Также следует отметить, что p53 подавляет гликолиз. С регуляцией гликолиза также связан ген LUC7L2. Вероятнее всего, RBBP6 и LUC7L2 могут быть связаны с развитием ожирения и сопутствующими ему состояниями (СД2, толерантность к глюкозе) посредством влияния на метаболизм глюкозы в клетке [28, 29].
Ген HLA-DQB1 кодирует один из белков MHC, варианты которого ассоциированы с развитием ожирения [30].
В настоящий момент в литературе не описаны ассоциации с конкретными фенотипами и клиническое значение генов, перечисленных ниже. Наше исследование показало, что следующие гены могут быть связаны с отдаленными исходами ЛПРЖ:
-
OR5H15 кодирует один из обонятельных рецепторов [31];
-
CCDC187 кодирует белок, предположительно участвующий в регуляции организации микротрубочек в центросоме [14];
-
PMIS2 кодирует трансмембранный белок [14];
-
SAMD11 кодирует белок, участвующий в негативной регуляции транскрипции ДНК [14];
-
PTCHD3 и AKR7L — псевдогены [14];
-
LRRIQ3 ассоциирован с развитием шизофрении [32];
-
PDE6B ассоциирован с развитием расстройства сумеречного зрения [33], участвует в дифференцировке примитивных клеток кишечной трубки [34];
-
ABCC12 ассоциирован с развитием идиопатического хронического холестаза [35];
-
ANKRD30 кодирует белок NY-BR-1, повышенная экспрессия которого коррелирует с прогрессированием рака молочной железы [36];
-
MAMDC4 кодирует один из белков мембраны, предположительно участвующий в межклеточном транспорте, адгезии клеток, эмбриогенезе желудочно-кишечного тракта и ассоциирован с развитием болезни Бехтерева [37].
Для понимания роли этих генов в развитии рецидива ожирения после хирургического вмешательства необходимы дополнительные исследования.
Заключение
Проблема определения предоперационных предикторов стойкой потери веса после бариатрической операции остается нерешенной. Изучение результатов предоперационного обследования не позволяет достаточно точно прогнозировать тот или иной исход хирургического лечения ожирения. Вероятно, построить прогностическую модель на основании результатов лабораторных и инструментальных исследований, антропометрии, данных объективного осмотра и анализа коморбидного фона не удается в связи с тем, что избыточная масса тела влияет на вышеперечисленные показатели [11]. Именно поэтому для поиска предикторных факторов следует использовать постоянные или малоизменяемые при ожирении показатели, в том числе генетический профиль пациента.
Представленное исследование продемонстрировало вариации генетических профилей пациентов с различными отдаленными результатами продольной резекции желудка. Дальнейшее, более детальное изучение полученных данных, в частности анализ частоты аллелей в двух группах пациентов, соотношение с клиническими данными, создание шкалы генетического риска, потенциально позволит создать модель, предсказывающую рецидив ожирения после бариатрической операции.
СВЕДЕНИЯ ОБ АВТОРАХ:
Ветошкин Вячеслав Андреевич — врач-хирург отделения хирургии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; м.н.с. научно-исследовательской лаборатории интервенционной пульмонологии ФГБУ «СПб НИИФ» Минздрава России; 191036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 2-4; ORCID iD 0000-0001-5346-9257.
Гладышев Дмитрий Владимирович — д.м.н., заместитель главного врача по хирургии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; доцент кафедры госпитальной хирургии Военно-медицинской академии; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6; доцент кафедры последипломного образования медицинского института СПбГУ; 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7-9; ORCID iD 0000-0001-5318-2619.
Сушенцева Наталья Николаевна — биолог научно-исследовательского отдела СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD0000-0002-5100-5229.
Апалько Светлана Вячеславовна — к.б.н., заведующая научно-исследовательской лабораторией транс-
ляционной биомедицины научно-исследовательского отдела инновационных и конверсионных программ СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; с.н.с. медицинского института СПбГУ; 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7-9; ORCID iD 0000-0002-3853-4185.
Шиманский Валентин Сергеевич — биолог научно-исследовательского отдела СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; м.н.с. медицинского института СПбГУ; 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7-9; ORCID iD 0000-0001-5662-8663.
Моисеев Михаил Евгеньевич — врач-хирург отделения хирургии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0000-0002-6180-6695.
Гладышев Андрей Дмитриевич — клинический ординатор второй кафедры усовершенствования хирургов Военно-медицинской академии; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6;ORCID iD 0009-0006-6562-5871.
Коваленко Сергей Алексеевич — врач-хирург отделения хирургии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0000-0002-5850-0599.
Аскерханов Рашид Гамидович — к.м.н., руководитель центра бариатрической хирургии ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, ш. Энтузиастов, д. 86, стр. 6; ORCID iD 0000-0002-6266-5855.
Щербак Сергей Григорьевич — д.м.н., профессор, главный врач СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; заведующий кафедрой последипломного образования медицинского института СПбГУ; 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7-9; ORCID iD 0000-0001-5036-1259.
Котив Богдан Николаевич — д.м.н., профессор, заместитель начальника по учебной и научной работе Военно-медицинской академии; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6;ORCID iD 0000-0001-5609-0517.
Контактная информация: Ветошкин Вячеслав Андреевич, e-mail: vetoshkinslava@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.05.2023.
Поступила после рецензирования 01.06.2023.
Принята в печать 27.06.2023.
About the authors:
Vyacheslav A. Vetoshkin — surgeon of the Department of Surgery, St. Petersburg City Hospital No. 40; 9, Borisov str., Sestroretsk, St. Petersburg, 197706, Russian Federation; Junior Researcher at the Research Laboratory of Interventional Pulmonology, St. Petersburg Research Institute of Phthisiopulmonology; 2-4, Ligovsky Avenue, St. Petersburg, 191036, Russian Federation; ORCID iD 0000-0001-5346-9257.
Dmitry V. Gladyshev — Dr. Sc. (Med.), Deputy Chief Medical Officer for Surgery, St. Petersburg City Hospital No. 40; 9, Borisov str., Sestroretsk, St. Petersburg, 197706, Russian Federation; Associate Professor of the Department of Hospital
Surgery, Military Medical Academy; 6, Academika Lebedeva
str., St. Petersburg, 194044, Russian Federation; Associate Professor of the Department of Postgraduate Education of the Medical Institute, St. Petersburg State University; 7-9, Universitetskaya emb., St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0001-5318-2619.
Natalia N. Sushentseva — biologist of the Research Department, St. Petersburg City Hospital No. 40; 9, Borisov str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0002-5100-5229.
Svetlana V. Apalko — C. Sc. (Bio.), Head of the Research Laboratory of Translational Biomedicine, Research Department of Innovative and Conversion Programs, St. Petersburg City Hospital No. 40; 9, Borisov str., Sestroretsk, St. Petersburg, 197706, Russian Federation; Senior Researcher of the Medical Institute, St. Petersburg State University; 7-9, Universitetskaya emb., St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0002-3853-4185.
Valentin S. Shimansky — biologist of the Research Department, of St. Petersburg City Hospital No. 40; 9, Borisov str., Sestroretsk, St. Petersburg, 197706, Russian Federation; Junior Researcherof the Medical Institute, St. Petersburg State University; 7-9, Universitetskaya emb., St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0001-5662-8663.
Mikhail E. Moiseev — surgeon of the Department of Surgery, St. Petersburg City Hospital No. 40; 9, Borisov str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0002-6180-6695.
Andrey D. Gladyshev — clinical resident of the Second Department of Advanced Surgery, Military Medical
Academy; 6, Academika Lebedeva str., St. Petersburg, 194044, Russian Federation; ORCID iD 0009-0006-6562-5871.
Sergey A. Kovalenko — surgeon of the Department of Surgery, St. Petersburg City Hospital No. 40; 9, Borisov str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0002-5850-0599.
Rashid H. Askerkhanov — C. Sc. (Med.), Head of the Center for Bariatric Surgery, A.S. Loginov Moscow Clinical Research Center; 86, build. 6, Entusiastov highroad, Moscow, 111123, Russian Federation; ORCID iD 0000-0002-6266-5855.
Sergey G. Shcherbak — Dr. Sc. (Med.), Professor, Chief Medical Officer of St. Petersburg City Hospital No. 40; 9, Borisov str., Sestroretsk, St. Petersburg, 197706, Russian Federation; Head of the Department of Postgraduate Education of the Medical Institute, St. Petersburg State University; 7-9, Universitetskaya emb., St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0001-5036-1259.
Bogdan N. Kotiv — Dr. Sc. (Med.), Professor, Deputy Head for Educational and Research Work, Military Medical Academy; 6, Academika Lebedeva str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-5609-0517.
Contact information: Vyacheslav A. Vetoshkin, e-mail: vetoshkinslava@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.05.2023.
Revised 01.06.2023.
Accepted 27.06.2023.
Информация с rmj.ru


