Контроль состояния нижних отделов респираторного тракта у пациентов с аллергическим ринитом
Содержание статьи
Введение
Бронхиальная астма (БА) и аллергический ринит (АР) являются коморбидными заболеваниями, что связано с гистологическим, физиологическим и иммунопатологическим сходством верхних и нижних дыхательных путей, системными механизмами развития хронического аллергического воспаления [1–5]. Данные BAMSE-когорты (Швеция, 2012) показали, что частота сочетанного течения этих заболеваний увеличивается с возрастом. Так, у детей в 1 год астма сочеталась с ринитом и/или атопическим дерматитом в 38% случаев, к 12 годам — в 67% случаев [6]. В исследовании E.P. de Groot et al. (2012) пациенты с БА и АР имели более тяжелое течение заболевания, а адекватное лечение АР способствовало контролю астмы [7]. Пациенты, страдающие АР, имеют в 3 раза больше шансов заболеть астмой, чем здоровые лица, и, как правило, ринит предшествует формированию БА у 32–49% больных [2, 8]. Многие больные с АР имеют гиперреактивность бронхов, что свидетельствует о том, что ринит является фактором риска развития БА [9, 10]. Одна из наиболее важных концепций относительно взаимосвязи «нос — легкие» — их функциональное взаимодействие, которое определяет протективную роль носа по отношению к легким. Доиммунные механизмы защиты носа связаны с различными функциональными особенностями, включающими согревание, увлажнение, фильтрацию и кондиционирование воздуха, поступающего в нижние дыхательные пути. Кроме того, слизистая оболочка носовой полости обладает сложным комплексом механизмов, препятствующих воздействию неблагоприятных факторов окружающей среды (барьерная функция): двигательная активность мерцательного эпителия, продукция слизи бокаловидными клетками, скопления лимфоидных фолликулов [11–13]. Нарушение носового дыхания запускает большое число негативных последствий: уменьшение глубины дыхательных движений, снижение легочной вентиляции и изменение внутригрудного давления [14, 15]. К сожалению, в клинической практике пациенты часто недооценивают серьезность АР и длительное время не обращаются за медицинской помощью, особенно в тех случаях, когда наблюдается сезонный характер болезни. Клинические проявления АР характеризуются ринореей, отеком слизистой, слезотечением и, у части пациентов, затруднением дыхания, возникающими при контакте с причинно-значимыми аллергенами. Своевременные диагностика и терапия АР могут предупредить реализацию БА у пациента.
Цель исследования: определить функциональное состояние бронхиального дерева у пациентов с АР и БА посредством изучения показателей пиковой скорости выдоха (ПСВ).
Материал и методы
В исследование были включены 54 пациента, обратившихся к врачу аллергологу-иммунологу по поводу обострения БА (n=33) или АР (n=21). Критериями включения были: возраст пациента от 5 до 18 лет, верифицированный диагноз БА или АР легкого персистирующего течения в периоде обострения [16, 17], информированное согласие пациентов или их законных представителей. Всем пациентам проведено общеклиническое обследование, осмотр оториноларингологом. Динамическое измерение ПСВ пикфлоуметром проводилось при первичном осмотре, затем после ингаляции бронхолитического препарата (ипратропия бромид / фенотерол) в возрастной дозировке [16]. Анализ полученных показателей проводили с использованием таблиц для оценки возрастных норм пикфлоуметрии [16] (табл. 1, 2).
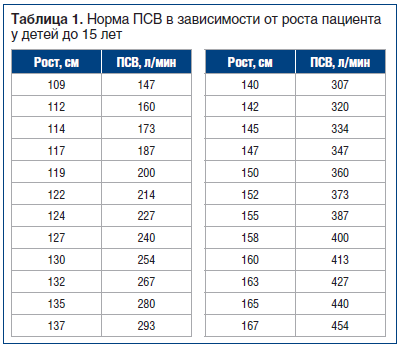
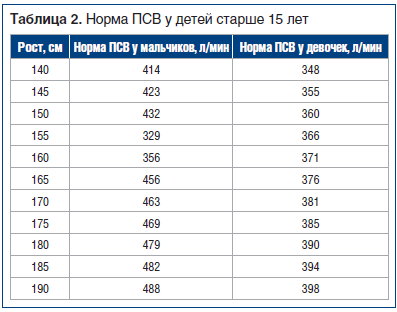
Перед измерением ПСВ каждому пациенту с БА было предложено показать технику выполнения пикфлоуметрии, при этом у 87% (47 пациентов) возникли затруднения, что свидетельствует о невыполнении рекомендаций врача, отмеченных в амбулаторной карте ранее. На подготовительном этапе перед проведением исследования нами подготовлена памятка для пациентов (см. гейтфолдер). С пациентами проведена беседа, каждому вручена памятка, рекомендовано приобретение прибора для домашнего пользования и ведение дневника самоконтроля, при этом рекомендовано проводить процедуру трехкратно утром (сразу после пробуждения) и трехкратно вечером (перед сном), фиксируя лучший показатель.
Для обработки и анализа полученных данных применяли методы математической статистики с использованием пакета прикладных программ Microsoft Office Excel.
Результаты исследования
Количество мальчиков, включенных в исследование, было несколько больше, чем количество девочек, — 31 (57%) и 23 (43%) соответственно.
Средний возраст пациентов составил 10,4 года с БА и 10,2 года с АР.
Опрос пациентов о применении диагностического метода пикфлоуметрии показал, что только 11 (33%) пациентам с БА ранее врачи проводили оценку ПСВ, только 4 (12%) пациента смогли рассказать о технике выполнения процедуры, только 2 (6%) пациента проводят мониторинг ПСВ с заполнением дневника самоконтроля ежедневно. Пациентам с АР измерение ПСВ ранее не проводили. В таблице 3 представлены показатели ПСВ пациентов с БА до и после ингаляции ипратропия бромида / фенотерола.
При анализе ПСВ пациентов с БА до и после проведения бронхолитической терапии (табл. 3) было установлено, что более чем у половины (17; 52%) пациентов наблюдалось возрастание ПСВ на 15% и выше от нормы, что подтверждало диагноз. У остальных детей с БА мы не наблюдали роста ПСВ после бронхолитической терапии, что, с одной стороны, могло быть связано с техническими погрешностями со стороны пациентов, а с другой — с необходимостью их дальнейшего обследования.
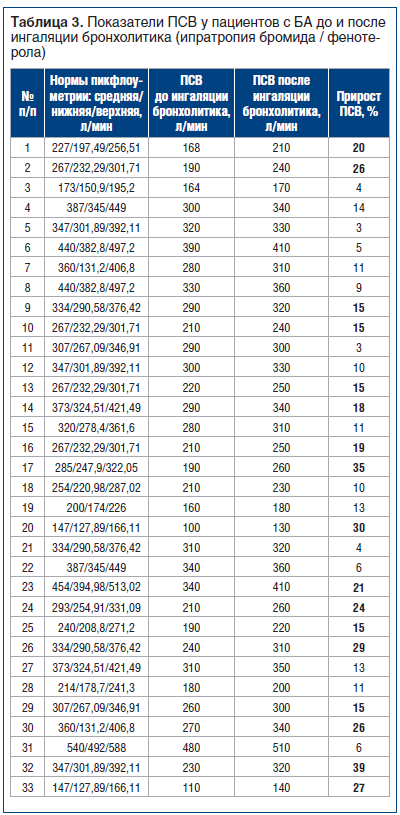
При обработке статистических данных было выявлено, что среднее значение ПСВ у пациентов с БА до проведения бронхолитической терапии составило 253,394±80,378 л/мин (средняя ошибка средней арифметической m=±13,992), на фоне проведенной терапии среднее значение ПСВ составило 289,394±81,584 л/мин (m=±14,202), изменения данного показателя достигли статистической значимости (р=0,001).
В таблице 4 приведены данные ПСВ у пациентов с АР до и после ингаляции бронхолитика.
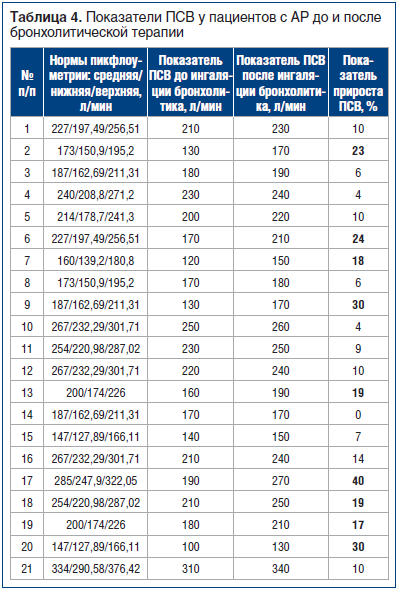
Анализ полученных данных показал, что у детей с АР в остром периоде наблюдается снижение ПСВ в 43% (9) случаев при отсутствии жалоб со стороны нижних дыхательных путей, что свидетельствует о наличии нарушений в нижних дыхательных путях и требует дальнейшего обследования пациентов. У этих же пациентов мы наблюдали прирост ПСВ после ингаляции бронхолитика, что позволило говорить о коморбидности АР и БА у наблюдаемых пациентов. Среднее значение ПСВ у пациентов с АР до проведения бронхолитической терапии составило 186,190±49,038 л/мин (m=±10,701), на фоне проведенной терапии отмечалось достоверное увеличение показателя до 212,381±81,584 л/мин (m=±14,202) (р=0,0012).
Проведенное исследование показало, что при назначении лечения пациентам с АР в соответствии со ступенчатой терапией [17] следует рассмотреть терапию коморбидного состояния — БА [16]. При отсутствии жалоб со стороны нижних дыхательных путей у детей с АР в остром периоде может иметь место снижение ПСВ, определяемое при проведении пикфлоуметрии, что свидетельствует о наличии нарушений в нижних дыхательных путях и требует дальнейшего их обследования. Прирост ПСВ после ингаляции бронхолитика позволяет предположить наличие астматического компонента.
Ступенчатая терапия при АР предусматривает назначение системных антигистаминных препаратов [17], которые могут применяться в виде монотерапии при заболевании легкой и средней степени тяжести. Перспективным является использование препаратов последнего поколения, не обладающих эффектом седации, например эбастина (Эспа-Бастин®). В алгоритм лечения пациентов с АР, у которых были выявлены изменения ПСВ, целесообразно включение ингаляционных кортикостероидов с противовоспалительным действием.
Заключение
Результаты проведенной работы свидетельствуют о том, что врачи в клинической практике и пациенты самостоятельно на дому редко применяют пикфлоуметрию — простую, доступную методику исследования ПСВ, информативную для диагностики состояния пациента. Кроме того, пациенты в большинстве случаев (до 88%) не владеют техникой пикфлоуметрии, поэтому необходимо проводить их обучение. В алгоритм диагностики пациентов с АР в остром периоде болезни целесообразно ввести проведение пикфлоуметрии, учитывая единство верхних и нижних дыхательных путей и высокую частоту коморбидности БА и АР. При выборе терапевтической тактики у пациентов с АР и БА следует ориентироваться на ступенчатую терапию заболеваний, начиная с современных системных антигистаминных препаратов (например, эбастина) и ингаляционных кортикостероидов.
Информация с rmj.ru





