Комбинированная сахароснижающая терапия. Применение новой фиксированной комбинации гликлазида и метформина у больных сахарным диабетом 2-го типа
Н. В. Ворохобина, доктор медицинских наук, профессор
А. В. Кузнецова, кандидат медицинских наук, доцент
Е. В. Арефьева, кандидат медицинских наук, доцент
Н. Л. Егорова
ГБОУ ВПО СЗГМУ им. И. И. Мечникова Минздравсоцразвития России, Санкт-Петербург
Сахарный диабет (СД) занимает ведущее место среди хронических заболеваний у лиц различного возраста. В 2000 году распространенность СД 1-го и 2-го типа составила 2,8% (170 млн человек), а к 2030 году, по прогнозам экспертов ВОЗ, возрастет до 4,4% (366 млн человек) [11]. Самостоятельными патогенетическими факторами, индуцирующими развитие СД 2-го типа, наряду с гипергликемией, являются инсулинорезистентность, гиперинсулинемия и гиперлипидемия [2, 5, 9]. Глюкозотоксичность и липотоксичность вызывают как структурные повреждения, так и функциональные нарушения на уровне бета-клеток поджелудочной железы, что приводит к существенному снижению продукции инсулина.
Традиционная пероральная терапия СД 2-го типа включает в себя препараты, устраняющие основные дефекты, лежащие в основе этого заболевания. Согласно последним рекомендациям, одной из наиболее рациональных комбинаций сахароснижающих препаратов по-прежнему остается сочетание метформина и сульфонилмочевины, которые обладают взаимодополняющим механизмом действия. Эта комбинация может быть использована при неэффективности монотерапии СД 2-го типа при исходном уровне гликированного гемоглобина (HbA1c) 6,5–7,5% или в качестве стартовой терапии при исходном уровне HbA1c 7,6–9,0% [1]. Сахароснижающий эффект метформина связан с улучшением усвоения глюкозы тканями за счет повышения чувствительности к инсулину, со снижением продукции глюкозы печенью и уменьшением всасывания глюкозы в кишечнике. Препарат не вызывает гипогликемии и прибавки массы тела, снижает гиперинсулинемию и инсулинорезистентность, обладает рядом дополнительных положительных эффектов (кардиопротективным, гиполипидемическим) [8]. Механизм действия препаратов сульфонилмочевины (ПСМ) основан на их способности стимулировать образование и секрецию эндогенного инсулина бета-клетками поджелудочной железы, особенно в присутствии глюкозы [3, 4, 7]. В то же время ПСМ не оказывают клинически значимого эффекта в отношении повышенной продукции глюкозы печенью и инсулинорезистентности. Среди ПСМ второй генерации наиболее выраженным сахароснижающим действием обладает глибенкламид вследствие высокой аффинности к рецепторам бета-клеток, что может явиться причиной гипогликемий, повышенного риска сердечно-сосудистых событий, увеличения веса. Следует заметить, что сопоставимое снижение гликемии на фоне приема глибенкламида достигается с наименьшей стимуляцией секреции эндогенного инсулина при применении гликлазида и глимеперида.
Внедрение в клиническую практику комбинированных препаратов, содержащих в одной таблетке фиксированные дозы метформина и глибенкламида (Глибомет, Глюкованс), позволило сократить количество принимаемых таблеток, снизить дозу каждого компонента, уменьшить выраженность побочных эффектов (по сравнению с монотерапией), увеличить комплаентность пациентов.
Новый препарат для лечения СД 2-го типа Глимекомб содержит в одной таблетке оригинальную фиксированную комбинацию гликлазида 40 мг и метформина 500 мг. Преимущество Глимекомба по сравнению с существующими на рынке комбинациями глибенкламида и метформина заключается в высокой избирательности действия гликлазида, который восстанавливает ранний пик секреции инсулина, сокращает промежуток времени от момента приема пищи до начала секреции инсулина, снижает постпрандиальную гипергликемию без гиперинсулинемии натощак, не приводит к увеличению массы тела [6].
Целью нашего исследования была оценка эффективности и безопасности фиксированной комбинации гликлазида и метформина в составе препарата Глимекомб у больных СД 2-го типа.
Материалы и методы. В исследование были включены 30 пациентов с СД 2-го типа (13 мужчин и 17 женщин), средний возраст которых составил 57,9 ± 7,3 года. Исходно пациенты принимали метформин от 1500 до 2550 мг в сутки в качестве монотерапии или в сочетании с препаратами сульфонилмочевины. Общая продолжительность наблюдения составила 90 дней. Всем пациентам отменялась предшествовавшая пероральная сахароснижающая терапия и назначался препарат Глимекомб с последовательным титрованием доз (в среднем с 2 до 3–5 таблеток в сутки в зависимости от достижения целевых показателей гликемии).
В зависимости от исходного уровня HbA1c пациенты были распределены на две группы. Группы были сопоставимы по возрасту, длительности СД 2-го типа, индексу массы тела (табл. 1).
В начале исследования и через 3 месяца наблюдения оценивали уровни глюкозы плазмы натощак (ГПН), постпрандиальной гликемии (ППГ), HbA1c, индекс массы тела (ИМТ), окружность талии (ОТ). Выраженность гиперинсулинемии оценивалась по уровню иммуннореактивного инсулина (ИРИ) в плазме венозной крови натощак, определенному радиоиммунологическим методом. Для расчета инсулинорезистентности (ИР) использовалась математическая модель гомеостаза (Homeostasis Model Assessment — НОМА) c определением индекса HOMA–IR (методика Matthews с соавт.), который рассчитывался по формуле: инсулин натощак (мкЕд/мл) × глюкоза натощак (ммоль/л)/22,5. Состояние липидного обмена оценивали по показателям — общий холестерин (ОХ), триглицериды (ТГ), холестерин липопротеинов высокой плотности (ХС ЛПВП), холестерин липопротеинов низкой плотности (ХС ЛПНП), которые определялись с помощью стандартных лабораторных методик. Проводилась оценка параметров биохимического анализа крови: билирубина, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ), креатинина, лактатдегидрогеназы (ЛДГ). В соответствии с протоколом исследования пациенты самостоятельно проводили самоконтроль уровня ГПН и ППГ с использованием глюкометра Accu-Chek Performa. Оценка безопасности и переносимости препарата проводилась по частоте и степени выраженности нежелательных явлений. Для обработки данных использовали непараметрические критерии Манна–Уитни и Вилкоксона.
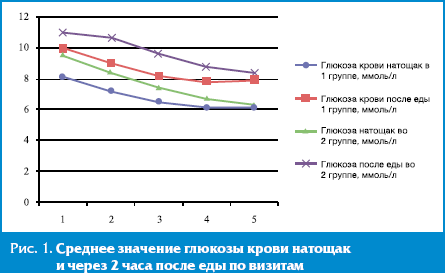
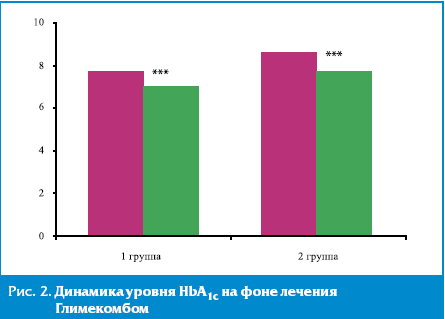
Результаты и их обсуждение. Через 3 месяца лечения Глимекомбом у всех пациентов отмечалось клинически значимое и статистически достоверное улучшение показателей углеводного обмена. Наблюдалось снижение уровня ГПН у пациентов 1-й группы — с 8,09 ± 0,72 до 6,11 ± 0,39 ммоль/л (р < 0,005), у пациентов 2-й группы — с 9,58 ± 0,81 до 6,3 ± 0,45 ммоль/л (р < 0,005). Уровень ППГ достоверно снизился у пациентов 1-й группы с 9,85 ± 0,76 до 7,9 ± 0,34 ммоль/л (p < 0,005), у пациентов 2-й группы — с 10,98 ± 0,98 до 8,28 ± 0,37 ммоль/л (p < 0,005). У пациентов обеих групп выявлено статистически значимое (р < 0,005) снижение уровня HbA1c: в 1-й группе — с 7,66 ± 0,19% до 6,98 ± 0,22%, во 2-й группе — с 8,49 ± 0,29% до 7,68 ± 0,33% (рис. 1, 2).
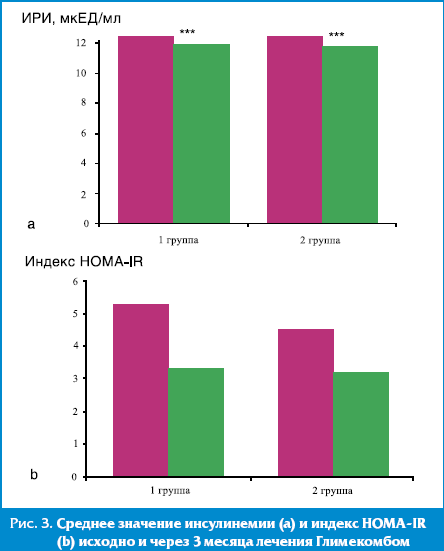
Через 3 месяца терапии Глимекомбом у всех пациентов достигнуто снижение параметров, характеризующих ИР: уровень ИРИ натощак снизился с 12,36 ± 5,66 до 11,73 ± 4,82 мкЕД/мл (р < 0,005) у пациентов 1-й группы и с 12,34 ± 5,54 до 11,67 ± 4,95 мкЕД/мл (р < 0,005) у пациентов 2-й группы. Отмечалось достоверное уменьшение индекса HOMA–IR с 5,26 ± 0,54 до 4,44 ± 0,38 (р < 0,05) в 1-й группе и с 3,28 ± 0,54 до 3,16 ± 0,38 (р < 0,05) во 2-й группе, что подтверждает высокую эффективность метформина, входящего в состав Глимекомба, в отношении коррекции чувствительности периферических тканей к инсулину (рис. 3).
Через 3 месяца терапии Глимекомбом у больных обеих групп отмечалась благоприятная динамика ряда показателей липидного обмена: достоверное снижение уровня ОХ (p < 0,005), атерогенных фракций липидов — ТГ (p < 0,005) и липопротеинов очень низкой плотности (ЛПОНП) (p < 0,005). Повышение уровня ЛПВП не достигло уровня статистической значимости, что может быть связано с недостаточной длительностью наблюдения. Полученные в нашем исследовании данные показали снижение степени висцерального ожирения. У пациентов обеих групп наблюдалось статистически значимое уменьшение ИМТ (p < 0,005) и ОТ (p < 0,005), что имеет крайне важное значение в снижении риска сердечно-сосудистой патологии у пациентов с СД 2-го типа (табл. 2, 3).
За период наблюдения большинство мониторируемых биохимических показателей крови существенно не изменилось (табл. 4). На фоне приема препарата Глимекомб в течение всего времени исследования было зафиксировано 2 случая легкой гипогликемии, связанных с нарушением диеты и режима физических нагрузок. Других нежелательных эффектов зафиксировано не было. В целом можно говорить о хорошей переносимости и безопасности терапии Глимекомбом у пациентов с СД 2-го типа.
Выводы
- Преимуществом применения у пациентов с СД 2-го типа фиксированной комбинации метформина и гликлазида в составе препарата Глимекомб является комплексное воздействие на различные звенья патогенеза заболевания за счет различных механизмов действия у данных препаратов. Через 3 месяца приема препарата Глимекомб отмечено снижение уровня ГПН, ППГ, HbA1c, ИРИ, HOMA–IR, улучшение показателей липидного профиля, при этом прибавки массы тела не наблюдалось.
- Среднесуточная доза препарата Глимекомб, при которой выявлено улучшение метаболических показателей, составляла 3–5 таблеток, распределенных на 2 приема.
- Всеми пациентами отмечена хорошая переносимость препарата, отсутствие тяжелых гипогликемий, аллергических реакций.
Литература
- Дедов И. И. Проект «Консенсус совета экспертов Российской ассоциации эндокринологов (РЭА) по инициации и интенсификации сахароснижающей терапии сахарного диабета 2-го типа» // Сахарный диабет. 2011. № 1. С. 95.
- Bolli G. B., Capani F., Kerr D., Tomas R., Torlone E., Selam J. L., Sola-Gazagnes A., Vitacolonna E. Comparison of a multiple daily injection regimen with once-daily insulin glargine basal infusion: a randomized open, parallel study // Diabetologia. 2004. Vol. 837. Suppl. 1. P. A3011.
- DeFronzo R. A. Pharmacologic therapy for type 2 diabetes mellitus // Ann Intern. Med. 1999; 131: 281–303.
- Gregori F., Ambrosi F., Manfrini S. et al. Poorly controlled elderly Type 2 diabetic patients: the effects of increasing sulphonylurea dosages or adding metformin // Diabet Med. 1999; 16 (12): 1016–1024.
- Hermans M. P., Nobels F. R., De Leeuw I. Insulin lispro (Humalog?), a novel fast-acting insulin analogue for treatment of diabetes mellitus: overview of pharmacological a clinical data // Acta Clinica Belgica. 1999. Vol. 54. P. 233–240.
- Hosker J. P. et al. // Metabolism. 1989; 38: 767–772.
- Kimmel B., Inzucchi E. M. Oral Agents for Type 2 Diabetes: An Update // Clin. Diabetes. 2005; 23 (2): 64–76.
- Krentz A. J., Bailey C. J. // Drugs. 2005; 65: 385–411.
- Malone J. K., Yang H., Woodworth J. R. et al. Humalog Mix 25 offers better mealtime glycaemic control in patients with type 1 or type 2 diabetes // Diabetes & Metabolism. 2000. Vol. 26. P. 481–487.
- Nathan D. M., Buse J. B., Davidson M. B. et al. Medical Management of Hyperglycemia in Type 2 Diabetes: a Consensus Algorithm for the Initiation and Adjustment of Therapy // Diabetes Care. 2008, 31: 1–11.
- Wild S. et al. // Diabetes Care. 2004; 27: 1047–1053.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







