Введение
Бронхиальная астма (БА) — хроническое воспалительное заболевание дыхательных путей, которое в настоящее время является глобальной медико-социальной проблемой. БА рассматривают как гетерогенное заболевание, которое имеет высокую распространенность и вариабельность течения [1, 2]. С учетом триггерного фактора, возраста дебюта, сопутствующих заболеваний выделяют различные клинические фенотипы БА [3]. Персонифицированный подход с учетом фенотипа заболевания очень важен для оптимизации терапии.
Несмотря на то, что аллергическая БА остается наиболее распространенным и изученным клиническим фенотипом БА, существует множество противоречивых моментов, особенно в отношении роли сенсибилизирующих аллергенов для определения тяжести и прогноза заболевания. Важное место среди известных источников аэроаллергенов занимают микроскопические грибы (микромицеты). Плесневые грибы распространены повсеместно, и поэтому микогенная сенсибилизация может быть выявлена у людей во всем мире. По данным различных исследований, распространенность гиперчувствительности к плесневым грибам составляет от 3% до 10% среди населения в целом. Описаны взаимосвязи между сенсибилизацией к микромицетам и развитием тяжелой, жизнеугрожающей БА. Согласно результатам ряда исследований сенсибилизация к одному или нескольким грибковым аллергенам ассоциирована с более низкой функцией легких, а также высокой частотой обострений и госпитализаций [4–6].
Для того чтобы подчеркнуть важную роль микроскопических грибов в патогенезе БА, в 2006 г. предложен термин «тяжелая БА с микогенной сенсибилизацией» (ТБАМС). Для ТБАМС характерно неконтролируемое течение заболевания с большим количеством обострений. При аллергологическом обследовании in vivo и/или in vitro определяют сенсибилизацию к антигенам микромицетов. Наиболее значимыми источниками грибковых аллергенов являются Alternaria spp. и Aspergillus spp. Кроме того, в отличие от больных аллергическим бронхолегочным аспергиллезом, при ТБАМС не выявляют бронхоэктазы и скопления слизи, а уровень общего IgE в сыворотке крови составляет менее 1000 МЕ/мл [7]. Таким образом, это группа больных, заболевание у которых недостаточно контролируется, несмотря на максимальные дозы ингаляционных глюкокортикостероидов (ГКС), они могут нуждаться в противогрибковой терапии [8]. Однако данные об истинной распространенности ТБАМС и результатах лечения противоречивы.
Исследования, посвященные грибковой сенсибилизации при БА, неоднородны и на сегодняшний день включают данные о пациентах с заболеванием разной степени тяжести, в то время как особый интерес представляют именно больные тяжелой БА, рефрактерные к традиционной терапии. Для того чтобы снизить частоту обострений и добиться лучшего контроля над заболеванием, необходима дальнейшая характеристика фенотипа ТБАМС и разработка альтернативных вариантов терапии.
Цель исследования — оценить клинико-иммунологические характеристики больных тяжелой БА с сенсибилизацией к Aspergillus и изучить возможности применения теста активации базофилов с использованием проточной цитометрии для выявления микогенной сенсибилизации.
Материал и методы
В исследование включили 93 взрослых больных тяжелой БА. Все больные получали лечение, которое соответствовало 4-й или 5-й ступени по GINA (Global Initiative for Asthma — Глобальная инициатива по бронхиальной астме) [1].
Согласно международным критериям неконтролируемую БА определяли по наличию по крайней мере одного из следующих признаков [9]:
плохой контроль симптомов БА: Asthma Control Questionnaire ≥1,5; Asthma Control Test (ACT) <20;
частые, тяжелые обострения БА: 2 курса системных ГКС и более (продолжительностью более 3 дней каждый) в предыдущий год;
серьезные обострения: по крайней мере 1 госпитализация, пребывание в отделении интенсивной терапии или механическая вентиляция легких в предыдущий год;
ограничение бронхиальной проходимости: объем форсированного выдоха за 1-ю секунду (ОФВ1) <80% должного (в условиях редуцированного ОФВ1/ФЖЕЛ, определяемого как уровень меньше нижней границы нормальных значений) при соблюдении рекомендации относительно соответствующего перерыва после бронходилататоров.
Всем больным, включенным в исследование, методом иммуноферментного анализа определяли уровень общего IgE (ООО «Полигност», Россия) и специфических IgE (sIgE) к 10 аллергенам в сыворотке крови. Использовали панель биотинилированных аллергенов «Алкор Био» (Россия). Критерием микогенной сенсибилизации считали повышение уровня sIgE к грибковому аллергену в сыворотке крови выше ≥0,35 ME/мл [10].
Определение концентрации TARC (thymus and activation regulated chemokine, тимус-ассоциированный регуляторный хемокин) в сыворотке крови осуществляли с помощью иммуноферментных тест-систем (R&D Systems, США), концентрация аналита была рассчитана по стандартным кривым и выражена в пг/мл.
Для выполнения теста активации базофилов к образцам крови добавляли моноклональные антитела CD203c-РЕ, CD3-PC7, CRTH2-FITC, входящие в состав набора Allerginicity kit (Beckman Coulter, США). Пробу крови каждого субъекта инкубировали в течение 15 мин при 37 °C в темноте: с буферным раствором — отрицательный контроль; с моноклональными антителами к IgE — положительный контроль; с аллергеном Aspergillus fumigatus — опытный образец. Затем проводили лизис эритроцитов. Подсчет не менее чем 500 базофилов проводили на проточном цитометре Navios (Beckman Coulter, США). Активированные базофилы идентифицировали как клетки с высокой экспрессией CD203c.
Для оценки выраженности и обратимости бронхиальной обструкции всем включенным в исследование пациентам выполняли спирометрию и пробу с бронхолитическим препаратом.
Для субъективной оценки уровня контроля БА использовали опросник АСТ, который больные заполняли ежедневно в течение последних 4 нед. АСТ содержит 5 вопросов с 5-балльной оценкой ответов, сумма 25 баллов означает полный контроль заболевания.
Полученные в процессе исследования данные обрабатывали с помощью программной системы Statistica 10. Данные представляли в виде медианы и нижнего и верхнего квартилей (Ме (Q0,25–Q0,75)). Сопоставление частотных характеристик качественных показателей проводили с помощью непараметрических методов χ2 Пирсона с поправкой Йетса, двусторонний точный тест Фишера. Сравнение количественных параметров в исследуемых группах осуществляли с применением критериев Манна — Уитни. Корреляции были проверены с помощью теста Спирмена. Различия считали статистически значимыми при р<0,05.
Результаты исследования
В микологической клинике ФГБОУ ВО СЗГМУ
им. И.И. Мечникова Минздрава России обследованы 93 больных тяжелой БА. Медиана возраста составила 52 года (40–63), мужчин было 24, женщин — 69. Характеристики больных представлены в таблице 1.

Все пациенты для базисной терапии БА получали 2 и более препаратов. Из них 54 (58,0%) больных для контроля симптомов использовали 3 препарата, 8 (8,6%) — 4 и более.
Низкий балл при заполнении анкеты АСТ (<20 баллов) выявили у 65 больных. У 22 (23,7%) больных были серьезные обострения, которые потребовали ≥2 курсов системных ГКС в предыдущий год; у 16 (17,2%) больных была по крайней мере 1 госпитализация по поводу обострения БА в прошлом году, 41 (44,1%) больной имел ОФВ1<80% и ОФВ1/ФЖЕЛ <0,7 при тестировании функции легких. В целом у 65 (70%) пациентов был один или несколько из вышеперечисленных показателей неконтролируемой БА.
Микогенную сенсибилизацию к Aspergillus выявили у 33 больных БА, что составило 35,4% от общего числа обследованных. Уровень sIgE к Aspergillus варьировал от 0,35 МЕ/мл до 2,30 МЕ/мл.
На следующем этапе выделили группы больных тяжелой БА с сенсибилизацией к Aspergillus и без сенсибилизации к Aspergillus. Сравнили базовые характеристики у больных обследованных групп. Данные представлены в таблице 2.
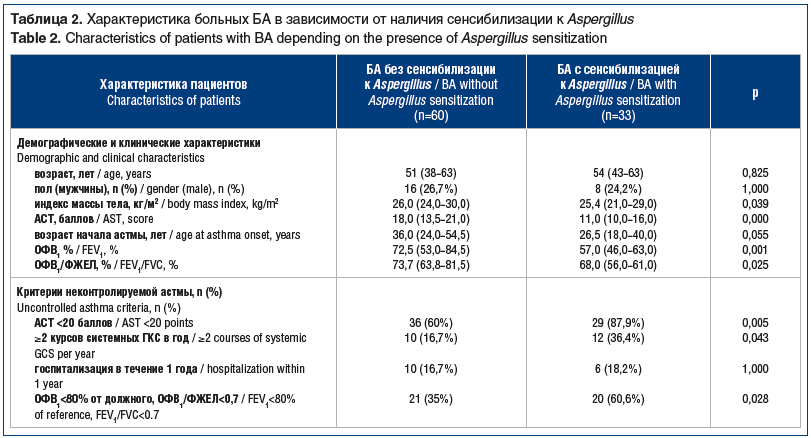
Группы не отличались между собой по полу и возрасту. Индекс массы тела у больных БА с сенсибилизацией к Aspergillus составил 25,4 (21,0–29,0) кг/м2 и был достоверно ниже, чем в группе сравнения (p=0,039).
При заполнении анкеты АСТ в группе больных с сенсибилизацией к Aspergillus зарегистрирован более низкий балл, который достоверно отличался от результатов больных БА без сенсибилизации к Aspergillus (11,0 (10,0–16,0) баллов против 18 (13,5–21,0) баллов; p=0,000). Кроме того, при исследовании функции внешнего дыхания больные БА с сенсибилизацией к Aspergillus демонстрировали достоверно более низкие показатели ОФВ1 (57,0 (46,0–63,0) % против 72,5 (53,0–84,5) %; p=0,001) и индекса Тиффно (68,0 (56,0–61,0) % против 73,7 (63,8–81,5) %; p=0,025).
Анализ критериев неконтролируемой БА выявил, что в группе БА с сенсибилизацией к Aspergillus преобладали больные, у которых был низкий балл (<20 баллов) при заполнении анкеты АСТ (87,9% против 60,0%; p=0,005), а также больные с худшими спирометрическими характеристиками (60,6% против 35,0%; p=0,028). Кроме того, в группе больных с микогенной сенсибилизацией для купирования тяжелых обострений чаще использовали курсы системных ГКС (36,4% против 16,7%; p=0,043). Между группами не установлено различий по частоте госпитализации в течение 1 года по поводу тяжелых обострений заболевания.
В целом у 28 (84,8%) больных с сенсибилизацией к Aspergillus был один или несколько показателей неконтролируемой БА по сравнению с 22 (36,0%) пациентами без сенсибилизации Aspergillus (p=0,001).
Кроме того, на следующем этапе для подтверждения IgE-опосредованного механизма гиперчувствительности к плесневым микромицетам провели дополнительное исследование. В настоящее время одним из наиболее перспективных направлений иммунодиагностики in vitro является проточная цитометрия. Больным тяжелой БА выполнили тест активации базофилов с аллергеном A. fumigatus с использованием метода проточной цитометрии.
Количество базофилов, активированных аллергеном A. fumigatus, у больных БА с сенсибилизацией к Aspergillus было 9,9 (6,0–24,0) %. Этот показатель достоверно отличался от значений в группе сравнения — 3,6 (2,0–5,4) %; p=0,000. В ходе исследования учитывали значение индекса стимуляции (ИС): отношение процента активированных базофилов в пробе с аллергеном к проценту их спонтанной активации в отрицательном контроле. ИС у больных БА с сенсибилизацией к Aspergillus составил 4,25 (2,49–9,30) и был достоверно выше, чем ИС больных БА, — 0,94 (0,75–1,16); p=0,000 (рис. 1).
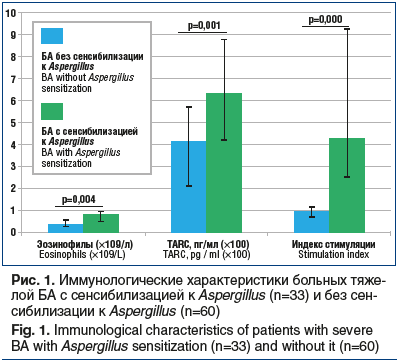
Известно, что вследствие продолжительной аллергенной стимуляции гуморального иммунного ответа у больных БА c микогенной сенсибилизацией содержание общего IgE в сыворотке крови может значительно повышаться. В ходе нашего исследования у больных БА с сенсибилизацией к Aspergillus установлено более высокое значение уровня общего IgE МЕ/мл по отношению к показателю группы сравнения (369,0 (40,0–804,0) МЕ/мл против 114,0 (10,0–565,0) МЕ/мл; p=0,122), но различия не были достоверны.
Абсолютное количество эозинофилов у больных БА с сенсибилизацией к Aspergillus было 0,78 (0,48–0,94) ×109/л. Эти показатели были достоверно выше по сравнению с показателями группы сравнения — 0,32 (0,23–0,53) ×109/л; p=0,004. При дальнейшем иммунологическом обследовании получены значимые различия содержания TARC в группе больных тяжелой БА с сенсибилизацией к Aspergillus и больных БА (625,0 (418,4–875,0) пг/мг против 406,0 (210,0–561,0) пг/мг; p=0,001).
Выявленные достоверные различия в иммунологических характеристиках больных тяжелой БА с сенсибилизацией к Aspergillus и без сенсибилизации к Aspergillus представлены на рисунке 1.
В ходе работы выявлена отрицательная корреляционная связь между уровнями TARC в сыворотке крови и снижением ОФВ1 (r=-0,70, p<0,05) и положительная корреляционная связь с абсолютным числом эозинофилов (r=0,81, p<0,05), уровнем sIgE к A. fumigatus (r=0,36, p<0,05). Полученные результаты свидетельствуют о важной патогенетической роли TARC в формировании ответа Т-хелперов 2 типа (Th2) у больных с микогенной сенсибилизацией и подтверждают взаимосвязь гиперчувствительности немедленного типа к грибам рода Aspergillus с тяжестью течения БА.
Обсуждение
Опубликованы данные, согласно которым частота микогенной сенсибилизации у больных БА варьирует в широких пределах. Результаты метаанализа 21 исследования свидетельствуют, что частота сенсибилизации к Aspergillus spp. у больных БА различной степени тяжести составляет около 28% [11].
Исследования, проведенные в группе тяжелой БА, немногочисленны. Результаты исследования в Северной Индии свидетельствуют о высокой частоте (50,9%) сенсибилизации к Aspergillus у пациентов с тяжелой БА. Однако эта работа включала только больных, поступивших в отделение интенсивной терапии, не учитывая другие критерии тяжелого течения заболевания [12].
В Великобритании получены данные о более высокой степени распространенности микогенной сенсибилизации. В исследовании O’Driscoll et al. 66% больных БА, которые находились на 4-й или 5-й ступени терапии по GINA, были сенсибилизированы к различным грибковым аллергенам [13].
В 2017 г. опубликованы результаты исследования J.G. Ken et al., проведенного в многоэтнической азиатской когорте больных тяжелой БА. Авторы проанализировали результаты кожных прик-тестов, на основании которых распространенность сенсибилизации к Asergillus составила 11,7%. Важно отметить, что именно сенсибилизация к Aspergillus, а не к другим аллергенам, была независимо связана с более низкими показателями функции внешнего дыхания и частыми обострениями БА [14].
Такие широкие расхождения в распространенности, вероятно, можно объяснить различными методологическими подходами. Британские исследователи применяли для диагностики как прик-тест, так и определение sIgE к различным грибам (Aspergillus, Candida, Alternaria) в сыворотке крови. Несмотря на это, распространенность сенсибилизации только к A. fumigatus составляла 45%. Также вероятно влияние генетических факторов и различий в окружающей среде. В азиатской когорте также были выявлены различия в частоте микогенной сенсибилизации среди разных этнических групп, хотя они не были статистически достоверны.
В проведенном исследовании частота сенсибилизации к Aspergillus у больных тяжелой БА составила 35,4%. Следует отметить, что наше исследование является одним из немногих, которые оценивают распространенность сенсибилизации к Aspergillus у больных тяжелой БА.
По мнению ряда экспертов, микогенная сенсибилизация ассоциирована с тяжелым, неконтролируемым течением БА. В исследовании R. Agarwal et al. описывают ассоциацию между сенсибилизацией к Aspergillus и низкими показателями функции внешнего дыхания у больных БА [15]. Кроме того, результаты ряда работ свидетельствуют о влиянии сенсибилизации к A. fumigatus на ухудшение функции легких и развитие бронхоэктазов у больных БА [16]. Также опубликованы данные о том, что сенсибилизация к A. fumigatus связана с более низкой функцией легких при некоторых хронических респираторных заболеваниях, включая муковисцидоз [17] и хроническую обструктивную болезнь легких [18].
Эти данные согласуются с полученными нами результатами. У обследованных больных выявлена взаимо-связь между сенсибилизацией к Aspergillus и неконтролируемым течением БА. У пациентов с сенсибилизацией к Aspergillus было зафиксировано большее количество обострений, требующих назначения пероральных ГКС, а также более выраженные обструктивные нарушения функции внешнего дыхания.
Известно, что диагностические грибковые аллергены для кожных проб в нашей стране, к сожалению, отсутствуют. Использование экстрактов плесневых грибов в определении sIgE может приводить как к ложноположительным результатам — из-за компонентов с перекрестной реактивностью, так и к ложноотрицательным результатам — из-за отсутствия мажорных белков в экстракте. Кроме того, выполнение провокационных исследований с плесневыми грибами связано с риском развития системных реакций. Поэтому поиск новых тестов для выявления микоаллергозов является актуальной задачей современной аллергологии.
Среди перспективных направлений лабораторной диагностики особое место занимает тест активации базофилов специфическими аллергенами с помощью проточной цитометрии. Проведение данного теста может быть рекомендовано как дополнение к традиционному подтверждению аллергических реакций 1-го типа, которое обычно включает определение sIgE в сыворотке крови и кожное тестирование.
По данным отечественных исследователей, применение теста активации базофилов возможно в диагностике инсектной, лекарственной аллергии, а также хронической крапивницы [19, 20]. Полученные в ходе нашей работы результаты свидетельствуют о том, что тест может быть использован в качестве дополнительного метода выявления сенсибилизации к плесневым грибам у больных БА.
Согласно современным представлениям тяжелая БА — это та астма, контроль которой может быть достигнут только на максимально высоком уровне терапии. В ряде случаев больные вынуждены принимать системные ГКС, что приводит к развитию большого количества побочных эффектов. Изучение роли различных иммунологических медиаторов в формировании хронического аллергического воспаления у больных тяжелой БА необходимо для определения оптимального терапевтического подхода и разработки новых иммунобиологических препаратов.
Распространено мнение, что патогенез тяжелой БА с микогенной сенсибилизацией связан с инициированием иммунного ответа при продолжительном или повторном воздействии грибковых спор [21]. Сходный патогенетический механизм описан у больных аллергическим бронхолегочным аспергиллезом (АБЛА), когда преобладает воспалительный ответ Th2 на антигены Aspergillus, колонизирующие дыхательные пути [22].
Известно, что TARC участвует в патогенезе аллергических заболеваний, привлекая Th2-клетки в очаг воспаления [23]. Важная роль TARC в возникновении гиперчувствительности немедленного типа к A. fumigates подтверждена на экспериментальных животных [24]. В клинических исследованиях показано, что TARC в отличие от других цитокинов и хемокинов является высокочувствительным и специфическим маркером АБЛА у больных муковисцидозом. Опубликованы результаты исследований, в которых высокие уровни TARC в сыворотке крови определяли у больных муковисцидозом еще до развития АБЛА. Повышение уровня этого хемокина было зафиксировано до нарастания уровня общего IgE. Авторы предложили использовать определение TARC для прогнозирования развития АБЛА у больных из групп риска [25, 26].
Концентрация TARC была достоверно выше у больных тяжелой БА с сенсибилизацией к Aspergillus, чем у больных тяжелой БА без сенсибилизации к Aspergillus. Полученные данные согласуются с нашей предыдущей работой, в которой концентрацию данного хемокина оценивали в группах больных АБЛА и БА с микогенной сенсибилизацией [27]. Таким образом, повышение содержания TARC у больных БА с сенсибилизацией к Aspergillus и его связь со степенью выраженности микогенной сенсибилизации и клиническими проявлениями заболевания позволяют рассматривать данный показатель в качестве биомаркера активной воспалительной реакции у этой категории больных.
В нашем исследовании среди пациентов с тяжелой БА была выделена группа больных с сенсибилизацией к грибам рода Aspergillus, у которых в дальнейшем для достижения контроля заболевания может быть рассмотрено применение антимикотической терапии и моноклональных антител.
Выводы
Частота сенсибилизации к Aspergillus больных тяжелой БА составила 35,4%.
Выявлена взаимосвязь между сенсибилизацией к Aspergillus и неконтролируемым течением БА. У больных тяжелой БА с сенсибилизацией к Aspergillus было зафиксировано большее количество обострений, требующих назначения системных ГКС, а также более выраженные обструктивные нарушения функции внешнего дыхания.
Перспективным методом лабораторной диагностики микогенной сенсибилизации у больных БА является тест активации базофилов с аллергенами A. fumigatus с использованием проточной цитометрии.
Концентрация TARC, повышенная в группе больных тяжелой БА с сенсибилизацией к Aspergillus, может использоваться в качестве биомаркера активной воспалительной реакции.
Сведения об авторах:
1Козлова Яна Игоревна — к.м.н., доцент, доцент кафедры клинической микологии, аллергологии и иммунологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-4602-2438.
2Фролова Екатерина Васильевна — к.м.н., заведующая научно-исследовательской лаборатории иммунологии и аллергологии НИИ медицинской микологии им. П.Н. Кашкина, ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-0002-7696-2236.
2Учеваткина Александра Евгеньевна — к.м.н., старший научный сотрудник научно-исследовательской лаборатории иммунологии и аллергологии НИИ медицинской микологии им. П.Н. Кашкина, ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-0001-6688-7781.
2Филиппова Лариса Вячеславовна — к.м.н., старший научный сотрудник научно-исследовательской лаборатории иммунологии и аллергологии, НИИ медицинской микологии им. П.Н. Кашкина, ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-003-4167-7440.
2Аак Олег Владимирович — к.х.н., ведущий научный сотрудник научно-исследовательской лаборатории иммунологии и аллергологии, НИИ медицинской микологии им. П.Н. Кашкина, ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-0001-8130-7503.
1Кузнецов Валерий Дмитриевич — аспирант кафедры клинической микологии, аллергологии и иммунологии
ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-9439-4749.
2Васильева Наталья Всеволодовна — д.б.н., директор НИИ медицинской микологии им. П.Н. Кашкина; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-0003-3693-5468.
1Климко Николай Николаевич — д.м.н., профессор, заведующий кафедрой клинической микологии, аллергологии и иммунологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-6095-7531.
Контактная информация: Козлова Яна Игоревна, e-mail: kozlova510@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 06.04.2020, поступила после рецензирования 05.05.2020, принята в печать 28.05.2020.
About the authors:
1Yana I. Kozlova — Cand. of Sci. (Med.), Associate Professor, Associate Professor of the Department of Clinical Mycology, Allergology and Immunology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-4602-2438.
2Ekaterina V. Frolova — Cand. of Sci. (Med.), Head of the Research Laboratory of Immunology and Allergology, P.N. Kashkin Research Institute of Medical Mycology, I.I. Mechnikov North-Western State Medical University; 1/28, Santiago-de-Cuba str., St. Petersburg, 194291, Russian Federation; ORCID iD 0000-0002-7696-2236.
2Alexandra E. Uchevatkina — Cand. of Sci. (Med.), Senior Researcher of the Research Laboratory of Immunology and Allergology, P.N. Kashkin Research Institute of Medical Mycology, I.I. Mechnikov North-Western State Medical University; 1/28, Santiago-de-Cuba str., St. Petersburg, 194291, Russian Federation; ORCID iD 0000-0001-6688-7781.
2Larisa V. Filippova — Cand. of Sci. (Med.), Senior Researcher of the Research Laboratory of Immunology and Allergology, P.N. Kashkin Research Institute of Medical Mycology, I.I. Mechnikov North-Western State Medical University; 1/28, Santiago-de-Cuba str., St. Petersburg, 194291, Russian Federation; ORCID iD 0000-003-4167-7440.
2Oleg V. Aak — Cand. of Sci. (Chemistry), Senior Researcher of the Research Laboratory of Immunology and Allergology, P.N. Kashkin Research Institute of Medical Mycology, I.I. Mechnikov North-Western State Medical University; 1/28, Santiago-de-Cuba str., St. Petersburg, 194291, Russian Federation; ORCID iD 0000-0001-8130-7503.
1Valery D. Kuznetsov — post-graduate student of the Department of Clinical Mycology, Allergology and Immunology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-9439-4749.
2Natalia V. Vasileva — Dr. of Sci. (Biology), Director of the P.N. Kashkin Research Institute of Medical Mycology; 1/28, Santiago-de-Cuba str, St. Petersburg, 194291, Russia; ORCID iD 0000-0003-3693-5468.
1Nikolay N. Klimko — Dr. of Sci (Med.), Professor, Head of the Department of Clinical Mycology, Allergology and Immunology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-6095-7531.
Contact information: Yana Kozlova, e-mail: kozlova510@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 06.04.2020, revised 05.05.2020, accepted 28.05.2020.
.
Информация с rmj.ru





