Ингибиторы ГМГ-КоА-редуктазы (статины) являются ключевыми препаратами для профилактики и лечения атеросклероза, они активно применяются в клинической практике уже более 45 лет [1–9]. В 1971 г. японские ученые Акира Эндо и Масао Курода из отдела прикладной биологии Токийского университета начали поиск микробных агентов, угнетающих внутриклеточный синтез холестерина (ХС) [2]. Гипотеза, которая лежала в основе этих опытов, заключалась в том, что определенные микроорганизмы продуцируют ингибиторы фермента 3-гидроксиметил-глютарил-коэнзим А-редуктазы (ГМК-КоА-редуктазы) для защиты от других микроорганизмов. Этот фермент катализирует переход ацетилкоэнзима А в мевалонат на начальном этапе синтеза ХС.
В 1971–1973 гг. было протестировано более 6000 микробных штаммов, и в результате этого труда были получены первые субстанции, ингибирующие синтез ХС: цитринин (citrinin) из грибка
[2]. Независимо от научной группы А. Эндо, американский исследователь A. Brown в 1976 г. выделил компактин из грибка
brevicompactum [3]. В 1978 г. сотрудники американской компании Merck Sharp and Dohme (MSD) из грибка
terreus выделили субстрат для препарата ловастатин (мевакор); годом позже японские ученые из компании SANKIO Co. Ltd. получили мевинолин, субстрат для правастатина. До внедрения в клиническую практику этот первый статин был подробно изучен на животных моделях в довольно высоких дозах — до 200 мг/кг [3].
За последние десятилетия класс ингибиторов ГМГ-КоА-редуктазы прошел большой путь клинических исследований, благодаря которым были внесены существенные изменения во многие международные рекомендации и консенсусы по диагностике и лечению липидного обмена в разных популяциях в 2004–2019 гг. [4–11]. Из 10 представителей класса статинов в текущем десятилетии активно используются только 4: симвастатин, аторвастатин, питавастатин и розувастатин. Ввиду разных причин (в основном по причине безопасности) на разных этапах клинических исследований исключались такие препараты, как гленвастатин (Hoecht), церивастатин (Bayer, Германия), практически не используются ловастатин, флувастатин и правастатин (за исключением Мексики). Более 30 лет потребовалось для того, чтобы выяснить, что статины (как и другие гиполипидемические препараты) несут в себе гипотетический риск развития сахарного диабета (+9%; 95% ДИ 1,02–1,17) [12]. Вместе с тем эти риски перекрываются снижением сердечно-сосудистых (СС) осложнений и ассоциированы не со статинами
, а с предрасположенностью пациентов к сахарному диабету (с исходным повышением уровня глюкозы плазмы и гликированного гемоглобина HBA1c) [9, 12].
Статины — самый изученный и, пожалуй, самый безопасный класс препаратов для снижения содержания ХС, о чем, помимо 40-летней истории клинических исследований, свидетельствует недавно опубликованный Консенсус Европейского Общества Атеросклероза 2018 г. [9]. Осенью 2018 г. вышли новые американские Рекомендации по дислипидемиям [10], в начале 2019 г. опубликован Консенсус по безопасности лечения статинами Американской Ассоциации Сердца (AHA) и Американского Колледжа Кардиологов [11]. В новых американских Рекомендациях впервые акцентирован приоритет максимального снижения ХС липопротеинов низкой плотности (ХС-ЛНП) перед их целевым уровнем не более 1,8 ммоль/л, что делает приоритетным назначение умеренных и высоких доз статинов (например, оригинального аторвастатина 40–80 мг/сут или оригинального розувастатина (Крестора) 20–40 мг/сут). Именно умеренные (а не начальные дозы) статинов обеспечивают 40–50% снижение уровня ХС-ЛНП у больных высокого или очень высокого CC-риска. Впервые в американских Рекомендациях появилась «нижняя граница» в снижении ХС-ЛНП — 0,67 ммоль/л (в разделе, посвященном терапии ингибиторами PCSK9). Подробно обзор новых липидных Рекомендаций и Консенсуса AHA по статинам планируется дать в отдельной публикации.
Розувастатин (Крестор) — статин 4-го поколения с максимальной липидснижающей активностью в отношении «плохого холестерина» ХС-ЛНП (– 65%), хорошей переносимостью и безопасностью, включая высокие дозы (40 мг/сут) [13, 14]. В начале 2000-х гг. для этого статина была запланирована и завершена большая международная программа клинических исследований GALAXY [13, 14]. В первой части обзора [13] обсуждались перспективы розувастатина (Крестора) в контексте последних Европейских рекомендаций по диагностике и лечению дислипидемий 2016 г. [4], значение для современной практики завершенных исследований розувастатина из проекта GALAXY [15], базовые принципы применения статинов в первичной профилактике, а также значение завершенных исследований Крестора у больных с дислипидемиями, коронарным атеросклерозом, метаболическим синдромом, сахарным диабетом 2 типа, атеросклерозом сонных артерий. Кроме того, в этом обзоре обсуждаются значение завершенных исследований статинов (розувастатина) у больных с хронической почечной недостаточностью (ХПН) и риском первого или повторного ишемического инсульта, эффективность и безопасность применения высоких доз розувастатина и аторвастатина, установленных в исследовании VOYAGER.
Многие заболевания почек (хронический пиелонефрит и гломерулонефрит) и их прогрессирование до ХПН являются независимыми факторами риска развития атеросклероза и его осложнений [15–17]. Хроническая почечная недостаточность классифицируется на 5 стадий и положительно коррелирует с дебютом и прогрессированием ишемической болезни сердца (ИБС) независимо от других факторов риска атеросклероза [15–17]. Хроническая болезнь почек диагностируется как нарушение структуры и функции почек, которое сохраняется более 3 мес. при скорости клубочковой фильтрации (СКФ) 2 и оказывает негативное влияние на здоровье человека [18, 19]. Симптомы ХПН развиваются медленно и вызывают уремическую дислипидемию, которая и приводит к развитию атеросклероза и ИБС. Известно, что пациенты с сочетанием ХПН и ИБС имеют гораздо более высокую смертность в отличие от больных с ИБC и нормальной функцией почек [20].
Как правило, уремическая дислипидемия сопровождается инсулинорезистентностью, сахарным диабетом 2 типа и зависит от степени ХПН и методов лечения (консервативная терапия или диализ) [19, 21]. В патогенезе дислипидемии при ХПН также играет роль низкая экспрессия ЛНП-рецепторов (будучи белками, они теряются с мочой), что, в свою очередь, приводит к снижению концентрации ХС-ЛНП в гепатоцитах, повышению активности ГМГ-КоА-редуктазы и ацетил-коэнзим-холестерол-ацилтрансферазы. Эти реакции, в свою очередь, способствуют повышению синтеза ХС в печени, снижению активности 7-α-гидролазы (меньше ХС эвакуируется через пул желчных кислот) и в конечном итоге повышению концентрации ХС-ЛНП в плазме крови [22].
Согласно Рекомендациям Европейского Общества Атеросклероза 2016 г. выраженная ХПН (III–V степени) является индикатором высокого или очень высокого СС-риска, что требует терапии статинами в монотерапии или в комбинации с достижением целевого уровня ХС-ЛНП
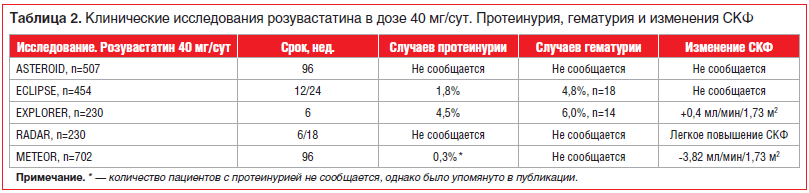
Более того, согласно результатам исследований PLANET I, II и ECLIPSE [24] розувастатин (40 мг/сут) имеет более высокий риск протеинурии (до 1,8%) и гематурии (до 4%) по сравнению с аторвастатином 80 мг/сут (протеинурия — 0,4%, гематурия — 2,1% соответственно), в то же время начальные дозы Крестора (10 мг/сут) такими эффектами не обладают [23, 24].
![Таблица 1. Коррекция дозы статинов в зависимости от СКФ (адаптировано с изменениями из: [22]) Таблица 1. Коррекция дозы статинов в зависимости от СКФ (адаптировано с изменениями из: [22])](https://medblog.su/wp-content/uploads/2019/04/klinicheskie-issledovaniya-rozuvastatina-v-kontekste-aktualnyh-rekomendatsij-eas-esc-po-dislipidemiyam-a-v-susekov.png)
В рутинной клинической практике бессимптомная протеинурия встречается не так уж и редко — до 10% случаев при анализе с помощью dip stick (палочки). Протеинурия может быть физиологической (при физической нагрузке, беременности) и патологической. Существуют 2 вида протеинурии. При гломерулярной протеинурии в проксимальных почечных канальцах теряются высокомолекулярные белки, включая большие количества альбумина. Этот вид протеинурии считается клинически значимым и неблагоприятным для прогноза ХПН. Тубулярная протеинурия развивается по причине сниженной реабсорбции низкомолекулярных белков (небольшое количество альбумина, α1-микроглобулин, β2-микроглобулин). Тубулярная протеинурия не является клинически значимой, и именно она встречается при применении высокой дозы розувастатина 40 мг/сут [24].
Розувастатин более активен в отношении ГМГ-КоА-редуктазы, чем аторвастатин, и, кроме печени, проявляет свою активность также в почках, что может обусловливать физиологическую тубулярную протеинурию. В литературе есть указания на то, что механизм протеинурии при приеме розувастатина 40 мг/сут может быть связан со снижением рецептор-опосредованного эндоцитоза у лабораторных животных, однако подобных данных в отношении человека не имеется [25].
Автор настоящей работы не стал бы назначать высокие дозы статинов (аторвастатина 80 мг/сут и розувастатина 40 мг/сут) больным с ХПН прежде всего из-за риска миопатий и рабдомиолиза. Больные с выраженной ХПН и клинически значимым атеросклерозом в повседневной клинической практике встречаются крайне редко, об этом можно судить, к примеру, по исходным характеристикам пациентов из исследования SHARP [26]. Исследовалась когорта пациентов с ХПН со средним возрастом 62 года, 63% мужчин, 23% больных СД 2 типа, средняя СКФ 27 мл/мин/1,73 м2. Лишь 15% больных исходно имели в анамнезе СС-заболевания. В исследовании AURORA по изучению розувастатина 10 мг/сут [27] участвовали больные с ХПН на гемодиализе (средний возраст 64 года, исходный уровень ХС был в норме —174 мг/дл, или 4,53 ммоль/л). В анамнезе этих больных инфаркт миокарда был лишь у 10%, операция реваскуляризации — у 6%. Можно допустить, что наличие начальной степени ХПН per se не является абсолютным показанием к назначению статинов, и, по мнению автора, пациента надо реклассифицировать относительно других значительных факторов СС-риска (например, с использованием алгоритма SCORE).
С другой стороны, при ХПН III–V степени со сниженной СКФ вряд ли имеет смысл назначать высокие дозы аторвастатина и розувастатина. В этих случаях комбинированная терапия статинами и эзетемибом не менее эффективна в отношении контроля дислипидемии и более безопасна.
В таблице 2 представлены основные данные по частоте встречаемости протеинурии и гематурии и динамика СКФ в ключевых исследованиях розувастатина в дозе 40 мг/сут. В соответствии с инструкцией по использованию оригинального розувастатина у менее 1% пациентов может выявляться протеинурия при приеме 10 и 20 мг/сут, незначительная протеинурия при приеме 20 мг/сут, у 3% больных при приеме 40 мг/сут. В большинстве случаев протеинурия уменьшается или исчезает в процессе лечения и не ведет к острому или прогрессирующему заболеванию почек. Очевидно, что частота этих осложнений крайне мала, а снижение СКФ незначительно (0,41 мл/мин/1,73 м2). Анализ безопасности не показал ухудшения ХПН в сравниваемых группах, включая принимавших розувастатин [28].
Содержание статьи
Монотерапия статинами и снижение риска ишемического инсульта
К настоящему времени нет опубликованных исследований с участием больных каротидным атеросклерозом, которые показали бы, что снижение уровня ХС-ЛНП может уменьшить количество СС-риска в первичной профилактике. Несмотря на это, в мировой научной литературе (международные рекомендации) содержатся объективные сведения о том, что терапия статинами снижает риски первого или повторного ишемических инсультов [4–7, 29, 30]. Дебют ишемического инсульта, как правило, вызывают основные факторы СС-риска: артериальная гипертония, курение, сахарный диабет, ожирение, несбалансированное питание, низкая физическая активность, фибрилляция предсердий, дислипидемия и психосоциальные причины (стресс, депрессия) [30]. Один из главных факторов ишемического инсульта — атеросклероз с наличием бляшек в сонных артериях. Атеросклероз — причина почти трети инсультов, около 50% инсультов развиваются в связи с каротидным атеросклерозом [30]. По данным литературы, почти 80% инсультов, вызванных эмболом из каротидной зоны, происходит внезапно, без всяких предшествующих симптомов [30].
В ретроспективных анализах ранних исследований статинов (вторичная профилактика) относительное снижение фатального ишемического инсульта составило 19–50%, самое большое снижение риска инсульта зарегистрировано в исследовании MIRACLE с применением высокой дозы аторвастатина (80 мг/сут) у больных ОКС (-48%; p=0,045) [31]. В исследовании вторичной профилактики TNT показано, что в группе больных, получавших высокую дозу аторвастатина 80 мг/сут, снижение риска инсульта составило 25% (p=0,02) [32].
В первой обзорной статье уже обсуждалось значение исследования JUPITER для первичной профилактики CC-осложнений [13]. По комбинированной конечной точке этого знакового для международных рекомендаций исследования снижение риска фатального и нефатального инсульта у больных с повышенным уровнем высокочувствительного С-реактивного белка (вч-СРБ) было высокодостоверным и составило значимые -48% (p
Все статины, помимо липидомодулирующих эффектов, обладают многочисленными нелипидными (плейотропными) эффектами [30–40]. От 35 до 80% пользы «позитивного плейотропизма» статинов может быть непосредственно связано с их основным эффектом — снижением уровня ХС-ЛНП. Важное клиническое значение имеет стабилизация бляшек в коронарных и сонных артериях: снижение количества макрофагов, усиленная пролиферация гладких мышечных клеток, стабилизация покрышки атеромы и снижение количества окисленных липопротеинов в кровотоке и в составе бляшек. Ранние плейотропные эффекты статинов у больных с атеросклерозом (в т. ч. у пациентов до и после ишемического инсульта) реализуются также через улучшение эндотелиальной функции, снижение агрегации тромбоцитов и улучшение фибринолитических свойств крови [37–39].
В научной литературе обсуждаются также механизмы снижения риска мозговых осложнений у больных, перенесших ишемический инсульт: небольшое снижение АД при терапии статинами, уменьшение риска ишемического инсульта и образования муральных тромбов в левом желудочке сердца. Статины обладают нейропротективными эффектами (за счет повышения продукции NO), увеличением мозгового кровотока и уменьшением размера мозгового инфаркта [38]. Другие плейотропные механизмы действия статинов связаны с блокадой синтеза изопреноидов, которые являются промежуточными продуктами биосинтеза ХС (Rho, Rac и Cdc42) [41]. Что касается применения статинов для профилактики первого или второго инсульта, российские врачи (особенно неврологи) все еще консервативно относятся к такому лечению, несмотря на то, что степень доказательности такой стратегии, согласно Европейским рекомендациям 2016 г., самая высокая — IA [4].
Опасения по поводу риска геморрагического инсульта необоснованны, поскольку еще в 2009 г. на сессиях Конгресса Международного Общества Атеросклероза в Бостоне (США) обсуждалось, что такие клинические переменные в исследовании SPARCL [42], как геморрагия в анамнезе (отношение шансов (ОШ) 5,81); пожилой возраст (на каждые +10 лет; ОШ 1,37), гипертония II степени с систолическим АД 160 мм рт. ст. (ОШ 6,19), являются главными предикторами геморрагического инсульта у больных, принимавших аторвастатин 80 мг/сут. Можно посоветовать практикующему врачу: прежде чем назначать высокие дозы статинов для профилактики первого или повторного ишемического инсульта, нужно убедиться, что: 1) первый инсульт (если он был) не геморрагический; 2) нормализовать артериальное давление; 3) с осторожностью назначать высокие дозы ингибиторов ГМГ-КоА-редуктазы пожилым людям. Основные положения Рекомендаций 2016 г., регламентирующие назначение статинов для профилактики ишемического инсульта, представлены в таблице 3.![Таблица 3. Рекомендации по контролю липидов для пер- вичной и вторичной профилактики инсульта (адаптировано с изменениями из: [5]) Таблица 3. Рекомендации по контролю липидов для пер- вичной и вторичной профилактики инсульта (адаптировано с изменениями из: [5])](https://medblog.su/wp-content/uploads/2019/04/1556584212_442_klinicheskie-issledovaniya-rozuvastatina-v-kontekste-aktualnyh-rekomendatsij-eas-esc-po-dislipidemiyam-a-v-susekov.png)
В недавних Рекомендациях AHA по безопасности терапии статинами указано, что назначения статинов больным, имеющим геморрагический инсульт (особенно в лобной доле головного мозга), надо избегать [11]. Однако в этих же Рекомендациях авторы советуют не отменять статины у больных с геморрагическим инсультом в анамнезе, если риск ишемического инфаркта мозга или ишемического инсульта остается высоким.
Современная доказательная база статинов: метаанализ исследования VOYAGER
Одно из последних рандомизированных исследований статинов (монотерапия, сравнение head to head) SATURN закончилось в 2011 г. [43]. Начиная с 2014 г. основные новости по эффективности липидснижающей терапии по «твердым» конечным точкам были уже получены на комбинированной терапии (статины + новые липидснижающие агенты) — с эзетимибом (IMPROVE-IT), эвалокумабом (FOURIER), алирокумабом (ODYSSEY-OUTCOMES) и анацетрапибом (HPS3/TIMI55-REVEAL) [44–47]. Важно заметить, что в контрольных группах этих исследований пациенты высокого и очень высокого СС-риска принимали статины в средних (FOURIER) [45] и, преимущественно, высоких дозах (ODYSSEY-OUTCOMES) [46].
В последние 3–4 года новые данные по эффективности, переносимости и безопасности терапии статинами публикуются либо по результатам крупных метаанализов, либо по базам данных больших ретроспективных исследований, например VOYAGER (An indiVidual patient data meta-analysis Of statin therapY in At risk Groups: Effects of Rosuvastatin, Atorvastatin and Simvastatin) [48–52]. Вся популяция исследования VOYAGER составила 32 258 человек, из них подгруппа пациентов с очень высоким СС-риском — 21 656 человек [48]. Больше трети составили пациенты с сахарным диабетом 2 типа (n=8859), 6061 — с атерогенной дислипидемией, 15 498 — с документированным атеросклерозом различных сосудистых бассейнов [48]. Средний возраст больных составил 60 лет, мужчин было 57%, больных белой расы — 79,9%. Исходно средние уровни липидов в популяции пациентов VOYAGER были следующими: средний уровень ХС-ЛНП 4,38 ммоль/л, ХС-ЛВП — 1,25 ммоль/л (достаточно высокий); медиана уровня триглицеридов (Тг) 1,81 ммоль/л. Среднее снижение уровня Хс-ЛНП при удвоении доз симвастатина составило -27% (n=365, 10 мг/сут); -33% (n=2929, 20 мг/сут), -39% (n=548, 40 мг/сут) и -45% (n=479, 80 мг/сут) (мы говорим о публикации 2010 г., когда эта доза симвастатина еще была разрешена) [48]. У пациентов, принимавших аторвастатин, среднее снижение уровня ХС-ЛНП составило 36, 41, 46 и 50% при применении суточных доз этого статина 10, 20, 40 и 80 мг соответственно. Как и ожидалось, максимальное снижение липидов, в частности ХС-ЛНП, было достоверным (получено у больных на фоне приема оригинального розувастатина). При начальной дозе 5 мг/сут уровень ХС-ЛНП снизился на 39%, при 10 мг/сут — на 44%, при 20 мг — на 50% и при максимальной дозе 40 мг — на 55% [48]. Примечательно, что у больных с исходно высоким уровнем ХС-ЛНП >160 мг/дл (>4,1 ммоль/л) липидснижающая способность розувастатина была максимальной, даже при дозе 5 мг/сут целевых значений ХС-ЛНП достигли 38% больных, а при дозе 40 мг/сут — 74,1% (при 10 мг аторвастатина — 28,7%, при 80 мг — 71%) [48]. Что касается уровня Тг (был исходно нормальным), то на возрастающих дозах розувастатина снижение их уровня было 18–21%, на терапии аторвастатином — 18–25% и на симвастатине — 12–14%. В субпопуляции VOYAGER у больных с СД 2 типа [49] были получены аналогичные результаты, максимальная липидснижающая эффективность снижалась в ряду розувастатина, аторвастатина и симвастатина. Максимальное снижение уровня ХС-ЛНП было достигнуто при лечении розувастатином 40 мг/сут и составило 56%, что было выше, чем при лечении максимальными дозами (80 мг/сут) аторвастатина и симвастатина (-51%).
Особое значение при лечении статинами больных с СД 2 типа имеет повышение уровня ХС-ЛВП, который является суррогатом для процесса обратного транспорта ХС из периферии в печень. В этой субпопуляции анализа VOYAGER (СД 2) на максимальной дозе оригинального розувастатина повышение этого показателя было максимальным по сравнению с двумя другими статинами (+5,8%), в то время как при лечении симвастатином 40 мг/сут уровень ХС-ЛВП изменился с +5,8% до +1,8%. В контексте новых Рекомендаций по дислипидемиям 2016 г. (помимо безопасности) интересуют сравнительные аспекты эффективности и безопасности двух основных статинов — аторвастатина и розувастатина. В публикации по исследованию VOYAGER (2015 г.) представлен современный ретроспективный анализ терапии статинами 8496 пациентов 4 подгрупп (А — с СС-заболеваниями атеросклеротического генеза; Б — с выраженной гиперхолестеринемией с уровнем ХС-ЛНП >190 мг/дл (>4,1 ммоль/л); В — c сахарным диабетом 2 типа; Г — с первичной профилактикой атеросклероза (10-летний риск СС-осложнений ≥7,5%). При сравнении аторвастатина 80 мг/сут и розувастатина 40 мг/сут в этих 4 подгруппах выявлены различия в их ХС-снижающей эффективности: розувастатин 40 мг по сравнению с аторвастатином с высокой дозой имел небольшие, но достоверные преимущества (табл. 4). В этом анализе показано преимущество розувастатина перед аторвастатином также и в средних дозах (в среднем на 3–5%), различия были достоверны (p![Таблица 4. Сравнительная эффективность аторвастатина и розувастатина в снижении уровня ХС-ЛНП у разных категорий пациентов (адаптировано с изменениями из: [51]) Таблица 4. Сравнительная эффективность аторвастатина и розувастатина в снижении уровня ХС-ЛНП у разных категорий пациентов (адаптировано с изменениями из: [51])](https://medblog.su/wp-content/uploads/2019/04/1556584212_877_klinicheskie-issledovaniya-rozuvastatina-v-kontekste-aktualnyh-rekomendatsij-eas-esc-po-dislipidemiyam-a-v-susekov.png)
Заключение
Ингибиторы ГМГ-КоА-редуктазы являются фундаментальным классом препаратов для профилактики и лечения атеросклероза и его осложнений. За 45 лет эволюции этого класса препаратов проведены сотни клинических исследований в разных популяциях, была установлена сильная положительная корреляция между степенью снижения ХС-ЛНП и снижением СС-риска, а также с улучшением прогноза у пациентов, получавших статины. Доказательная база трех основных статинов первоначально получена в плацебо-контролируемых исследованиях 1994–2001 гг. (симвастатин), далее в сравнительных исследованиях 1998–2005 гг. (начальных и высоких доз аторвастатина), затем в исследованиях 2000–2011 гг. по изучению сравнительной эффективности двух сильных статинов. Ключевые результаты рандомизированных исследований со статинами широко цитируются в трех больших метаанализах 2010, 2012, 2015 гг. [51–55]. К середине 2000-х гг. уже было невозможно планировать и проводить плацебо-контролируемые исследования у больных с атеросклерозом, как в середине 1990-х (4S), поэтому доказательная база всего класса статинов по «твердым» конечным должна быть взаимозаменяема. Снижение СС-риска и улучшение прогноза, полученное в исследовании JUPITER по первичной профилактике, — это лицензия для более широкого использования розувастатина именно во вторичной профилактике, поскольку этот статин, применяемый в средней и высокой дозе, обладает максимальным эффектом в снижении ХС-ЛНП и, соответственно, степени СС-риска у тяжелых пациентов с документированным атеросклерозом. Это хорошо проиллюстрировано активным назначением розувастатина во вторичной профилактике по данным фармакоэпидемиологических исследований DYSIS I, II и метаанализа базы данных VOYAGER. В этой статье и другой обзорной публикации [13] обсуждались разные аспекты международной программы GALAXY в контексте последних Европейских рекомендаций [4], а также позиционирование основных результатов исследований оригинального розувастатина на российскую рутинную клиническую практику. Современные исследования комбинированной гиполипидемической терапии (FOURIER, ODYSSEY OUTCOMES) еще раз подтвердили безопасность средних и высоких доз статинов уже в нынешнем десятилетии. В частности, в контрольной группе на статинах в ODYSSEY-OUTCOMES частота повышения АСТ и АЛТ в этих проектах не превысила 2,4%, повышение КФК наблюдалось у не более 0,7%, нейрокогнитивные расстройства встречались лишь у 1,5% больных (столько же в основной группе). В 2018 г. был опубликован новый Консенсус Европейского Общества Атеросклероза [9], в котором эксперты обобщили данные по безопасности статинотерапии в отношении печени, почек, обмена глюкозы, когнитивной функции, риска геморрагического инсульта и риска развития катаракты. Оригинальная публикация этого Консенсуса размещена на сайте www.липидология.рф. Вместе с тем терапия статинами в РФ пока далека от идеальной по стартовым и поддерживающим дозам и, особенно, длительности лечения. Резидуальный (остаточный) риск, связанный с неадекватной терапией статинами, в нашей стране составляет примерно 90% (DYSIS I Study) [56] и практически не меняется в последние годы (DYSIS II, 2014). Оптимизация терапии статинами больных высокого и очень высокого риска для снижения сердечно-сосудистой смертности и увеличения продолжительности жизни в нашей стране — одна из самых важных задач в отечественной медицине [57–59]. В последние годы в РФ активно регистрируются новые классы гиполипидемических средств, однако альтернативы статинам ни в мире, ни в нашей стране на сегодня нет.
Информация с rmj.ru






