Содержание статьи
Введение
Боль в области нижней части спины (БНЧС) предполагает неприятные ощущения или дискомфорт в области, располагающейся между нижними ребрами и ягодичными складками, с проекцией или без проекции в нижнюю конечность и возникает ежегодно у 25–40% людей во всем мире, а вероятность того, что в течение жизни у человека возникнет острая БНЧС, составляет 70% [1]. Острая БНЧС продолжается не больше 6 нед., в случае рациональной терапии или вследствие естественных причин (саногенез) регрессирует, но примерно у трети больных хронизируется — сохраняется более года, а еще примерно у 50–80% больных в первый год после неполного купирования острой БНЧС те или иные симптомы основного заболевания (дорсопатия, сакроилеит и др.) повторяются [1, 2].
Острая боль может быть первичной или вторичной (обострение хронически протекающего заболевания); в любом случае она инициируется триггерами, формирующимися вследствие развития дегенеративно-дистрофических процессов в дугоотростчатых суставах, межпозвонковых дисках и крестцово-подвздошном сочленении, а также стеноза позвоночного канала и др. Несмотря на повсеместное применение нейровизуализационного обследования (МРТ, КТ пояснично-крестцового отдела позвоночника) в дифференциальной диагностике патогенетических форм острой БНЧС, достоверной корреляции между выявленными по данным МРТ изменениями и степенью выраженности болевого синдрома, снижением качества жизни, а также психоэмоциональными расстройствами у данной категории пациентов выявлено не было [3, 4].
Учитывая главенство воспалительной составляющей в генезе острой БНЧС, в базовую схему медикаментозного лечения пациентов данного профиля обычно включают нестероидные противовоспалительные препараты (НПВП), миорелаксанты, витамины группы В, хондропротекторы и лечебные блокады, что позволяет дезактивировать триггеры боли и предупредить хронизацию болевого синдрома и других проявлений основного заболевания (например, нарушение статической и динамической функции позвоночника) [2]. Базовая терапия, как правило, дополняется немедикаментозными методами лечения, такими как мануальная терапия, массаж, кинезиологическое тейпирование, лечебная гимнастика, вытяжение позвоночника, физиотерапия, направленные на постепенное увеличение двигательных возможностей больного, коррекцию осанки и неадаптивного двигательного стереотипа.
Однако разные НПВП неодинаково контролируют острую БНЧС, особенно в части длительности обезболивающего эффекта и качества жизни пациента во время лечения.
Цель исследования: анализ эффективности (скорость наступления, сила и продолжительность обез-боливания) и безопасности НПВП Ракстан-сановель (флурбипрофен, далее — Ракстан) в комплексном лечении пациентов с острой БНЧС. Выбор данного препарата обусловлен тем, что флурбипрофен обладает выраженным обезболивающим и противовоспалительным действием при высокой биодоступности [4].
Материал и методы
Для реализации поставленной цели на территории Российской Федерации было проведено многоцентровое постмаркетинговое обсервационное исследование. Препарат Ракстанназначался в рамках рутинной клинической практики согласно утвержденной локальной инструкции по применению препарата с указанием доз, продолжительности терапии, популяции и показаний.
Критерии включения в исследование:
возраст пациентов от 18 до 65 лет;
длительность БНЧС не менее 1 нед. и не более 6 нед. независимо от наличия данных о БНЧС в анамнезе;
интенсивность боли по ВАШ не менее 30 баллов;
отсутствие указаний на непереносимость флурбипрофена в анамнезе;
подписанное пациентом информированное согласие на участие в наблюдательной программе.
Критерии невключения в исследование:
применение НПВП менее чем за 1 мес. до момента включения в программу;
наличие органических заболеваний нервной системы, психических заболеваний или онкологической патологии;
гиперчувствительность к исследуемому препарату или вспомогательным компонентам, в том числе к другим НПВП или ацетилсалициловой кислоте;
эрозивно-язвенные поражения или воспалительные заболевания ЖКТ в стадии обострения;
бронхиальная астма в сочетании с полипозом слизистой носа;
тяжелая почечная и печеночная недостаточность;
применение антидепрессантов, антиконвульсантов, опиоидных анальгетиков в период проведения исследования;
беременность или лактация;
лечение глюкокортикоидами в течение последних 2 мес.;
другие состояния, которые делали участие пациента в исследовании невозможным (по мнению исследователя).
Критерии исключения из исследования. Пациент считался исключенным из исследования, если его участие было прекращено до завершения планируемых визитов/оценок, указанных в протоколе. Пациенты могли быть исключены из исследования по любой из следующих причин: развитие нежелательных явлений, непереносимость препарата Ракстан, добровольный отказ пациента от участия, по решению исследователя, другие причины.
В программу были включены 210 пациентов с острой БНЧС, не требующей хирургического лечения. Большинство пациентов составили женщины (количественная пропорция мужчин и женщин 1:1,4); средний возраст 43,5 [29; 57] года с длительностью заболевания 14,4±6,3 сут.
Спондилоартрит на уровне поясничного отдела позвоночника оказался преимущественным триггером боли у 105 (50%) пациентов, поражение крестцово-подвздошного сочленения — у 39 (18,6%), дегенеративно-дистрофические изменения межпозвонкового диска — у 66 (31,4%). Наибольшее количество (68%) пациентов в обеих группах имели умеренный уровень боли с оценкой по ВАШ 45–74 баллов, 20% — сильную боль (75–100 баллов по ВАШ).
До включения в программу все пациенты в полном объеме были проинформированы об условиях участия в программе и подписали форму информированного согласия.
Пациенты, включенные в исследование, были случайным образом (методом конвертов) рандомизированы в 2 однотипные группы. В контрольной группе (КГ) применялась стандартная схема лечения в течение 10 дней: медикаментозная терапия — любой неселективный НПВП, кроме изучаемого препарата (диклофенак по 50 мг 3 р/сут у 70% пациентов и мелоксикам по 15 мг/сут у 30%), миорелаксанты в дозах, рекомендованных в инструкции по применению препарата; немедикаментозная терапия — физические упражнения или физиотерапия (пациенты могли получать один из этих методов лечения или их комбинацию) по усмотрению врача. В основной группе (ОГ) для купирования болевого синдрома использовался Ракстан (по 100 мг 2 р/сут) в сочетании с другой необходимой сопутствующей терапией — миорелаксантами, физическими упражнениями и физиотерапией. Каждый пациент, включенный в исследование, находился под наблюдением в течение 10 дней приема препаратов, а также последующие 2 нед. (всего 4 визита: визит 0 — скрининг, визит 1 — через 1 нед. от начала лечения, визит 2 — через 2 нед. от начала лечения, визит 3 — через 2 нед. после завершения лечения).
Первичной конечной точкой исследования являлась оценка степени снижения интенсивности болевого синдрома после курса лечения препаратом Ракстан (10 дней) по ВАШ в сравнении с другими НПВП. Минимальное клинически значимое различие (МКЗР) для показателя ВАШ составляет 15 пунктов, или 30%. В качестве вторичных конечных точек приняты оценка динамики качества жизни и длительность бессимптомного периода после курса лечения на основании общепринятых критериев:
оценка интенсивности боли и связанных с ней функциональных расстройств по опроснику Роланда — Морриса (МКЗР для показателя составляет 5 пунктов);
определение качества жизни по опроснику EQ-5D-5L;
впечатления врача и пациента об эффективности лечения (7-балльная система оценки общего клинического впечатления по шкале CGI);
наличие или отсутствие БНЧС через 2 нед. после окончания лечения.
Особое внимание уделялось контролю безопасности применения исследуемого препарата. Каждое нежелательное явление было задокументировано со ссылкой на интенсивность, дату начала, продолжительность, частоту, лечение, результаты, изменения и дату окончания.
Все данные о включенных пациентах вводили в специально разработанные индивидуальные регистрационные карты для статистической обработки результатов и были обезличены для сохранения конфиденциальности пациентов. Для статистического анализа полученные в ходе исследования данные вносили в базу, сформированную на основе программного обеспечения Excel. Для статистического анализа результатов исследования использовали общепринятые методы из пакета программ Statisticа 7.0 (StatSoft, Inc., США) в соответствии с рекомендациями по обработке результатов медико-биологических исследований [17]. Для сравнительного анализа качественных параметров пользовались критерием χ2 или критерием Фишера. Значимость различий между количественными величинами оценивали по критерию t Стьюдента в модификации Уэлча (для нормально распределенных величин) или критерию Манна — Уитни (в случае непараметрических данных). Пороговый уровень значимости был принят равным 0,05. Сравнение показателей по ВАШ в группах между визитами осуществляли с использованием непараметрического критерия Вилкоксона для зависимых выборок и теста Краскела — Уоллиса. Разницу терапевтического эффекта между визитами оценивали с помощью теста Бхапкара с поправкой Бонферрони для всех парных сравнений.
Результаты исследования
Группы были сопоставимы по половому составу (χ2=0,02, p=0,088), большинство составили женщины — 60 и 62 пациентки в КГ и ОГ соответственно. Средний возраст пациентов КГ составил 44 [33; 52] года, ОГ — 46 [29; 57] лет (p=0,43, критерий Манна — Уитни). Все пациенты завершили исследование. Базовое среднее значение интенсивности боли во всей выборке (n=210) по ВАШ составило 60 [50; 70] мм; в рассматриваемых группах по 60 [50; 70] мм, что соответствовало «умеренно выраженной» боли и не имело достоверного различия между группами (p=0,833, критерий Манна — Уитни). При этом количество больных из общей выборки со слабой интенсивностью боли (5–44 мм) составило 25 (12%), умеренной (45–74 мм) — 143 (68%), сильной (75–100 мм) — 42 (20%).
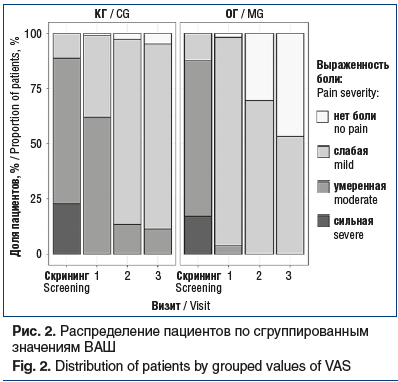
В обеих группах от проводимого лечения получен достоверный позитивный эффект по ВАШ, причем улучшение оцениваемых параметров в ОГ оказалось значимо выше на всех визитах (рис. 1). На момент завершения исследования (визит 3, через 2 нед. после терапии) в ОГ отмечался значимо более полный контроль над БНЧС по данным ВАШ по сравнению с КГ — количество (доля) больных с отсутствием боли и слабой болью было статистически значимо выше. Оценка по ВАШ составила 20 [20; 30] мм в КГ и 5 [0; 10] мм — в ОГ (рис. 1, 2). При межгрупповом сравнении на каждом визите получены статистически значимые различия (критерий Манна — Уитни, p<0,0001).
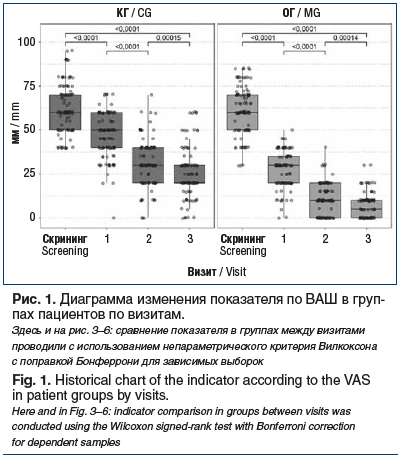
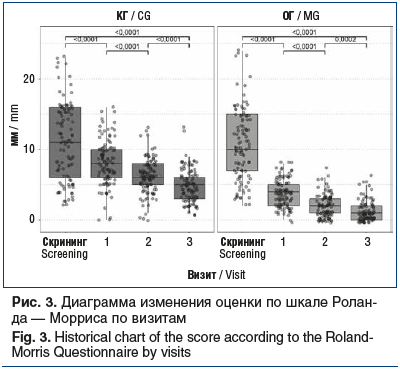
Согласно данным опросника Роланда — Морриса интенсивность острой БНЧС была непосредственно связана с функциональными расстройствами у пострадавших, исходная оценка в КГ составила 11 [6; 16], в ОГ — 10 [7; 15] (p=0,496). В процессе лечения в обеих группах наблюдалось клинически и статистически значимое снижение значений показателя между визитами (p<0,0001); однако эффективность снижения функциональных расстройств по шкале Роланда — Морриса между группами статистически значимо различалась на всех визитах (критерий Манна — Уитни, p<0,0001). Так, в ОГ уже на визите 2 рассматриваемый показатель составил 2 [1; 3], в то время как у больных КГ — 6 [5; 8]; величина эффекта снижения относительно исходных значений составила 0,868 и 0,641 соответственно. К визиту 3 значения показателя в ОГ и КГ были равны 1 [0; 2] и 5 [3; 6] соответственно (рис. 3).
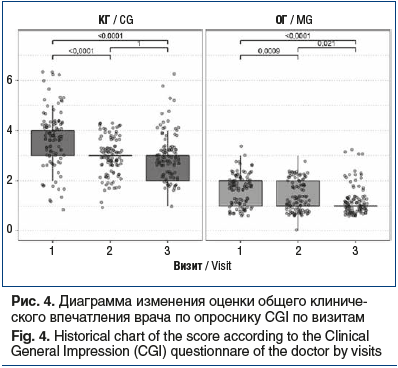
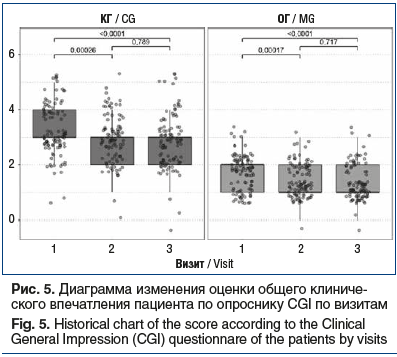
Снижение интенсивности болевого синдрома и уменьшение степени функциональных нарушений у обследованных больных в обеих группах коррелировало с позитивными изменениями общего клинического впечатления врача по опроснику CGI в виде статистически значимого снижения тяжести расстройств между 1-м и 3-м визитами (p<0,0001): у больных ОГ с 2 [1; 2] до 1 [1; 1], у больных КГ с 4 [3; 4] до 3 [2; 3] (рис. 4). При этом эффективность терапевтического снижения тяжести расстройств по шкале CGI между группами достоверно различалась на визите 2 по абсолютным значениям (p=0,0041) и на визите 3 по относительным (p=0,047).
Для системного анализа эффективности терапии по общему клиническому впечатлению врача больные в обеих группах были распределены по категории «тяжесть состояния» (табл. 1). Как видно из представленных данных, количество больных в категориях субъективной оценки «нормально, совсем не больно», «пограничное состояние», «слегка больно» было значительно большим в ОГ; а больных в категориях субъективной оценки «умеренно больно», «выраженно больно» и «серьезно больно» не было совсем. Анализ перераспределения пациентов между категориями тяжести по шкале CGI показал статистическую значимость (p<0,0001, тест Бхапкара) в обеих группах между визитами 1 и 3.
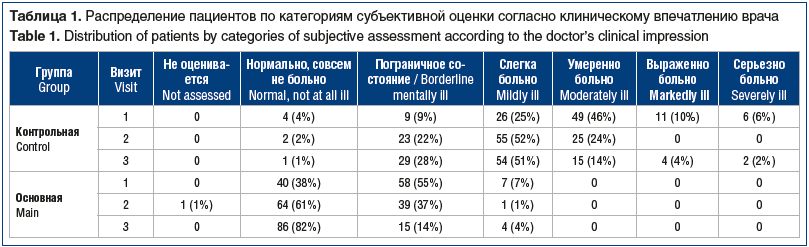
Аналогичные позитивные изменения общего клинического впечатления по опроснику CGI выявлены с точки зрения пациентов. В обеих группах (рис. 5) наблюдалось статистически значимое снижение тяжести расстройств, вызванных острой БНЧС, по данным оценки общего клинического впечатления пациента по опроснику CGI между 1-м (в ОГ — 2 [1; 2], в КГ — 3 [3; 4]) и 2-м (в ОГ — 1 [1; 2], в КГ — 3 [2; 3]) (p<0,001) и 1-м и 3-м (в ОГ — 1 [1; 2], в КГ — 3 [2; 3]) визитами (p<0,0001).
Кроме сравнительного анализа отдельных параметров состояния здоровья больных с острой БНЧС (ВАШ, шкала функциональных нарушений Роланда — Морриса, общее клиническое впечатление по опроснику CGI) особое внимание было уделено оценке конечного терапевтического эффекта по мнению врача, в соответствии с которым больные распределялись на следующие категории: «значительное улучшение», «умеренное улучшение», «минимальное (незначительное) улучшение, которое не меняет состояние больного», «без эффекта или ухудшение» (табл. 2).

В обеих группах наблюдался статистически значимый терапевтический эффект между 1-м (в ОГ — 54 человека со значительным улучшением, 51 — с умеренным; в КГ — 6 и 30 человек соответственно) и 2-м (в ОГ — 79 человек со значительным улучшением, 25 — с умеренным; в КГ — 3 и 56 человек соответственно) визитами по тесту Бхапкара с поправкой Бонферрони для всех парных сравнений (p<0,01) и между визитами 1 и 3 (в ОГ 89 человек со значительным улучшением, 16 — с умеренным; в КГ — 4 и 55 человек соответственно) (p<0,01).
Изменение терапевтического эффекта между визитами 2 и 3 было статистически незначимо в обеих группах (в ОГ р=0,935, в КГ р=0,072). Однако на каждом визите наблюдались статистически значимые (p<0,01) различия между группами; более того, отсутствие эффекта или ухудшение на последнем визите наблюдалось у 8 (7,6%) пациентов КГ, в то время как в ОГ таких больных не было.
Острая БНЧС, по данным опросника EQ-5D-5L, влияла на качество жизни больных, особенно на подвижность (умеренное влияние у 42,9% пациентов), уход за собой (умеренное влияние у 38,6%), привычную повседневную деятельность (умеренное влияние у 38,1%) и дискомфорт (умеренное влияние у 39,5%). При этом только у 25,2% больных выявлено минимальное влияние на формирование тревоги/депрессии, а крайне серьезное влияние обнаружено в части некоторых показателей (уход за собой, привычная повседневная деятельность, дискомфорт, тревога/депрессия) в 1,9–7,6% случаев (табл. 3).
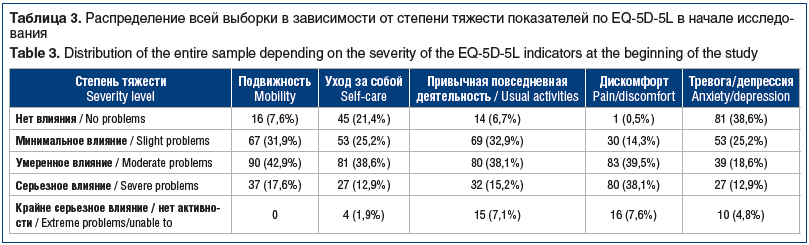
В процессе лечения в обеих группах наблюдалось статистически значимое улучшение качества жизни пациентов по данным опросника EQ-5D-5L относительно скрининга на визитах 2 и 3 (табл. 4). В КГ на визите 3 сохранялось от 2 до 4 пациентов (2–4%) с крайне серьезным влиянием по всем показателям опросника (подвижность, уход за собой, привычная повседневная деятельность, дискомфорт, тревога/депрессия) и от 16 до 29 (15–27%) — с умеренным влиянием.
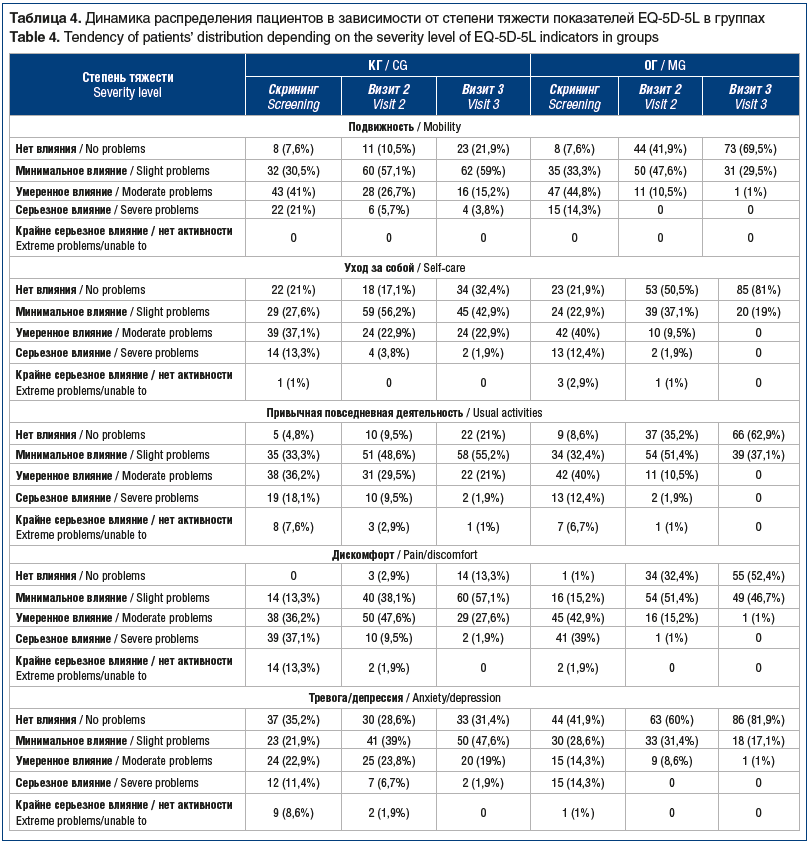
В ОГ к визиту 3 отсутствовали пациенты с серьезным влиянием, а умеренное влияние на качество жизни наблюдалось в единичных случаях (1%). При этом на визитах 2 и 3 различия показателей (подвижность, уход за собой, привычная повседневная деятельность, дискомфорт, тревога/депрессия) между группами были статистически значимыми (тест Бхапкара, р<0,0001 с поправкой на множественные сравнения Бонферрони). На этапе скрининга статистической значимости достигали только различия показателей «дискомфорт» и «тревога/депрессия» (р=0,017, р=0,32 соответственно).
Изменение тяжести нарушений согласно опроснику EQ-5D-5L в каждой группе на визитах 2 и 3 по сравнению с базовым значением, полученным на этапе скрининга, во всех случаях было статистически значимым (p<0,0001).
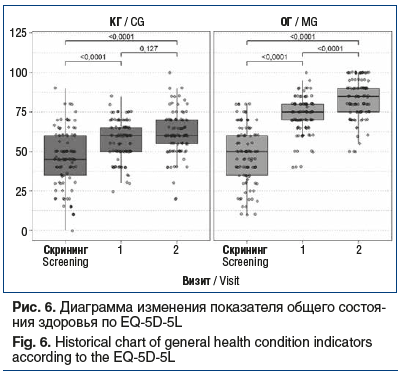
С учетом представленных выше данных закономерным было статистически значимое улучшение общего состояния здоровья на основании суммарного балла по опроснику EQ-5D-5L в обеих группах между скрининговым визитом и визитами 2 и 3 (p<0,0001). Динамика общего состояния здоровья по EQ-5D-5L статистически значимо (p<0,0001) различалась в обеих группах: суммарный балл на визите 2 в ОГ составил 75 [70; 80], в КГ — 60 [50; 65], на визите 3 — 85 [75; 90] и 60 [55; 70] соответственно (рис. 6). Это свидетельствует в пользу большей терапевтической эффективности противовоспалительного препарата Ракстан в составе комплексной терапии больных с острой БНЧС.
Кроме этого, включение препарата Ракстан в комплексное лечение острой БНЧС позволило добиться значительного сокращения количества нежелательных реакций, которые обычно свойственны препаратам группы НПВП: в ОГ, принимавшей исследуемый препарат, не было зафиксировано ни одной нежелательной реакции, в то время как в КГ они отмечены у 4 пациентов (у 1-го — тошнота, боль в желудке; у 2-го — тошнота, головокружение; у 3-го — боль в желудке, диарея; у 4-го — тошнота), что потребовало применения симптоматических средств лечения. Данное обстоятельство представляется очень важным аргументом в пользу выбора препарата Ракстан, поскольку нежелательные реакции отрицательно влияют на приверженность пациентов терапии и на долгосрочный прогноз развития основного заболевания, сопровождающегося острой БНЧС.
Обсуждение
Выполненное исследование согласуется с современной доктриной рациональной терапии острой БНЧС, в основе которой лежит применение НПВП, обладающих противоболевым и противовоспалительным действием, в качестве препаратов первой линии. Несмотря на относительную сопоставимость выраженности обезболивающего действия различных НПВП, назначаемых в терапевтических дозировках, соотношение противоболевого и противовоспалительного эффектов данных лекарственных средств может различаться, что следует учитывать при выборе оптимального препарата для конкретного пациента с острой БНЧС [5, 6].
Особенно это связано с тем, что качественное купирование острых болевых синдромов при патологии позвоночника является обязательным условием для профилактики хронизации боли вследствие «лечебно-обусловленного истощения ноцицептивного трафика». Поэтому проблема выбора НПВП в зависимости от патогенетического варианта дорсопатии с учетом анализа триггеров боли (структурных изменений опорно-двигательного аппарата позвоночника) находится в стадии интенсивного изучения [2, 3, 5, 6].
Флурбипрофен (Ракстан) — производное фенилпропионовой кислоты — является типичным представителем НПВП. Данный препарат угнетает активность циклооксигеназ 1-го и 2-го типов, подавляя реакции арахидонового каскада и ингибируя синтез как простагландинов, так и тромбоксана A2, что позволяет ему оказывать мощное системное противоболевое и противовоспалительное действие. Флурбипрофен отличается от других НПВП длительной историей клинического применения, которая насчитывает несколько десятилетий, так же как и некоторые другие широко используемые в клинической практике препараты данной группы, например диклофенак [7, 8].
Проведенные клинические исследования позволили установить высокую терапевтическую эффективность флурбипрофена (быстрое наступление обезболивающего эффекта и продолжительное действие) для купирования острой боли средней и высокой интенсивности наряду с высоким профилем безопасности и хорошей переносимостью [7]. Особенно это относится к такой распространенной группе заболеваний, как дорсопатии.
В одном из исследований, включившем 40 пациентов с хронической дорсалгией, проведен сравнительный анализ эффективности флурбипрофена (20 пациентов получали его по 100 мг 2 р/сут в течение 4 нед.) и плацебо в отношении влияния на выраженность болевого синдрома, сроки купирования боли, результаты лечения по мнению самого пациента и лечащего врача, выраженность депрессивных проявлений, а также значимость влияния заболевания на качество жизни больного [7]. Авторами установлено, что флурбипрофен приводит к более полному и раннему купированию болевого синдрома, более раннему расширению возможности самообслуживания по сравнению с группой больных, получавших плацебо. Кроме того, лечение флурбипрофеном оказалось более эффективным по сравнению с плацебо, по мнению как врача, так и больного; а нежелательные явления одинаково часто регистрировались в обеих группах.
Аналогичный профиль результатов получен в нашем исследовании с участием 210 пациентов с острой БНЧС. Все пациенты были случайным образом рандомизированы на 2 однотипные группы: ОГ, в которой для лечения больных в составе комплексной терапии использовался флурбипрофен, и КГ, в которой для лечения больных в составе комплексной терапии использовались другие НПВП. В большинстве (68%) случаев боль характеризовалась как умеренная. Разница в темпах снижения выраженности боли по ВАШ между группами была очевидна уже с визита 1 (7 дней от начала лечения) и в среднем составляла 20 баллов на каждом последующем визите. К концу наблюдения средняя разница между группами составляла 19 баллов (75%) по ВАШ в пользу больных ОГ; в частности, на визите 3 90% пациентов ОГ достигли нулевого уровня боли по ВАШ, в то время как в КГ — только 50%.
Кроме того, пациенты, получавшие Ракстан, через 2 нед. после окончания лечения (визит 3) продемонстрировали 100% отсутствие рецидива болевого синдрома после курса лечения препаратом — ни у одного пациента не было отмечено рецидива болевого синдрома.
Кроме обезболивающего эффекта, большое значение имеет оценка безопасности флурбипрофена. Так, в одном из исследований на основании анализа данных 200 пациентов (средний возраст 52,7 (22–72) года, 71% — женщины) с остеоартритом (n=50), ревматоидным артритом (n=130), анкилозирующим спондилитом (n=20), которые ежедневно принимали по 200 мг флурбипрофена, были получены убедительные доказательства безопасности данного препарата [8]. Это согласуется с результатами нашего и других исследований [9].
Существенным преимуществом флурбипрофена является умеренное хондропротективное действие, что очень важно при лечении дорсопатий, поскольку, к сожалению, некоторые представители НПВП негативно влияют на костную и хрящевую ткань, что продемонстрировано в условиях эксперимента и в клинических исследованиях [10, 11]. Применение флурбипрофена способно замедлять резорбцию костной ткани, предупреждать внекостное накопление солей кальция, что предотвращает оссификацию связок при остеоартрите [12, 13]. Наличие указанных свойств флурбипрофена дает веские основания рассматривать его не только как обезболивающее лекарственное средство, но и как болезньмодифицирующее средство, замедляющее прогрессирование спондилоартрита. В связи с этим становится понятным более значительное снижение степени функциональных нарушений, связанных с острой БНЧС, у больных ОГ по опроснику Роланда — Морриса: в среднем улучшение повседневной активности составило 69% (41,6 балла), в то время как в КГ — 24% (14,3 балла).
Наше прямое сравнительное исследование — первое в своем роде, в котором предпринята попытка оценить эффективность и безопасность кратковременного применения флурбипрофена в лечении пациентов с острой БНЧС. Поэтому была проведена оценка эффективности терапии на основании общего клинического впечатления врача и пациента по опроснику CGI; в ОГ 86 пациентов из 105 оценили свое состояние как «полностью нормальное», в то время как в КГ только 1 пациент дал такую оценку. В свою очередь, индекс эффективности лечения статистически значимо различался между группами на каждом визите; к окончанию курса терапии значительное улучшение и ремиссия наблюдались у 89 пациентов ОГ, в то время как в КГ — лишь у 4 пациентов, а у 50% пациентов этой группы удалось добиться только частичной ремиссии. Отсутствие эффекта или ухудшение на последнем визите в КГ наблюдалось у 8 (7,6%) пациентов, тогда как в ОГ таких пациентов не было, что позволяет рассматривать флурбипрофен в качестве препарата выбора для лечения пациентов с острой БНЧС.
Одним из преимуществ флурбипрофена, по нашим данным и сведениям других авторов, является низкий риск лекарственных взаимодействий, что обеспечило возможность его применения в комбинации с другими средствами противоболевого действия (миорелаксанты, витамины группы В), а также хорошая переносимость [14].
Заключение
Таким образом, кратковременное (до 10 сут) применение флурбипрофена (Ракстан-сановель) в дозе 200 мг/сут эффективно и безопасно при острой БНЧС. Данный препарат уменьшает выраженность болевого синдрома (по ВАШ), увеличивает повседневную активность пациентов и улучшает качество их жизни (по опросникам Роланда — Морриса и EQ-5D-5L) уже к 7-м суткам лечения достоверно значительнее, чем другие НПВП, в частности диклофенак. С учетом отсутствия нежелательных явлений (по нашим данным) это позволяет рекомендовать флурбипрофен в качестве эффективного обезболивающего средства для широкой клинической практики.
Сведения об авторах:
Данилов Алексей Борисович — д.м.н., заведующий кафедрой нервных болезней ИПО ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-2958-4479.
Меркулова Дина Мироновна — д.м.н., профессор, врач-невролог высшей квалификационной категории, главный невролог Центральной дирекции здравоохранения — филиала ОАО «РЖД», руководитель Неврологического центра им. Б.М. Гехта ЧУЗ «Центральная клиническая больница «РЖД-медицина»; 129128, Россия, г. Москва, ул. Будайская, д. 2; ORCID iD 0000-0003-0368-683X.
Живолупов Сергей Анатольевич — д.м.н., полковник медицинской службы, профессор кафедры нервных болезней Военно-медицинской академии имени С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6, литера Ж; ORCID iD 0000-0003-0363-102X.
Девликамова Фарида Ильдусовна — д.м.н., профессор кафедры неврологии и мануальной терапии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11.
Доронин Борис Матвеевич — д.м.н., профессор, заведующий кафедрой неврологии ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0001-7213-759X.
Широков Василий Афанасьевич — д.м.н., профессор кафедры нервных болезней с курсом нейрохирургии, мануальной терапии ФГБОУ ВО УГМУ Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; ведущий научный сотрудник ФБУН ЕМНЦ ПОЗРПП Роспотребнадзора; 620014, Россия, г. Екатеринбург, ул. Попова, д. 30; ORCID iD 0000-0003-1461-1761.
Балязина Елена Викторовна — д.м.н., профессор кафед-ры неврологии и нейрохирургии с курсом мануальной терапии и рефлексотерапии ФПК и ППС ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0002-9967-4405.
Комаров Александр Николаевич — д.м.н., доцент кафедры фундаментальной и клинической неврологии и нейрохирургии РНИМУ им. Н.И. Пирогова Минздрава России; 117437, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-5373-4006.
Контактная информация: Данилов Алексей Борисович, e-mail: danilov@intermeda.ru.
Источник финансирования: исследование проведено при поддержке «ASFARMA Медикал Дентал Урюнлер Ве Илач Санайи Тиджарет Аноним Ширкети» в г. Москве.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.07.2022.
Поступила после рецензирования 16.08.2022.
Принята в печать 08.09.2022.
About the authors:
Alexey B. Danilov — Dr. Sc. (Med.), Head of the Department of Nervous System Diseases, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-2958-4479.
Dina M. Merkulova — Dr. Sc. (Med.), Professor, neurologist, Chief Neurologist of the Central Directorate of Health Care — Branch of JSC «Russian Railways», Head of the B.M. Gekht Neurological Center, Central Clinical Hospital «Russian Railways-Medicine»; 2, Budayskaya str., Moscow, 129128, Russian Federation; ORCID iD 0000-0003-0368-683X.
Sergey A. Zhivolupov — Dr. Sc. (Med.), Colonel of the Medical Service, Professor of the Department of Nervous Diseases; S.M. Kirov Military Medical Academy; 6Zh, Academician Lebedev str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0003-0363-102X.
Farida I. Devlikamova — Dr. Sc. (Med.), Professor of the Department of Neurology and Manual Therapy, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation.
Boris M. Doronin — Dr. Sc. (Med.), Professor, Head of the Department of Neurology, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0001-7213-759X.
Vasily A. Shirokov — Dr. Sc. (Med.), Professor of the Department of Nervous Diseases with Faculty of Neurosurgery and Manual Therapy, Ural State Medical University; 3, Repin str., Yekaterinburg, 620028, Russian Federation; Leading Researcher of the Medical Research Center for Prevention and Health Protection of Workers of Industrial Enterprises of Rospotrebnadzor; 30, Popov str., Yekaterinburg, 620014, Russian Federation; ORCID iD 0000-0003-1461-1761.
Elena V. Balyazina — Dr. Sc. (Med.), Professor of the Department of Neurology and Neurosurgery with Faculty of Manual Therapy and Reflexology of the ATF and Faculty Staff, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; ORCID iD 0000-0002-9967-4405.
Alexander N. Komarov — Dr. Sc. (Med.), Associate Professor of the Department of Fundamental and Clinical Neurology and Neurosurgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-5373-4006.
Contact information: Alexey B. Danilov, e-mail: danilov@intermeda.ru.
Funding Source: the study was conducted with the support of ASFARMA Medikal Dental Urunler ve Ilac Sanayi Ticaret Anonim Shirketi.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 23.07.2022.
Revised 16.08.2022.
Accepted 08.09.2022.
Информация с rmj.ru





