Содержание статьи
Введение
Нейроэндокринные новообразования (НЭН) представляют собой группу гетерогенных опухолей, которые возникают из диссеминированной эндокринной клеточной системы, в основном из органов желудочно-кишечного тракта и поджелудочной железы (ПЖ). Классифицируются НЭН в соответствии с морфологией их клеток и индексом пролиферации (Кi-67) как высокодифференцированные нейроэндокринные опухоли (НЭО), включая G1 (Кi-67≤2), G2 (Кi-67 3–20%) и хорошо дифференцированный G3 (Кi-67>20%), демонстрируя более благоприятное поведение по сравнению с плохо дифференцированными G3 и нейроэндокринными карциномами (НЭК, мелко- и крупноклеточные). Реже встречаются опухоли бронхолегочного тракта (20–25%), которые в настоящее время классифицируются как типичные и атипичные карциноидные опухоли. Большинство НЭН не функционируют, в то время как у меньшинства наблюдаются симптомы, связанные с гиперсекрецией биоактивных соединений [1]. Панкреатические НЭН (ПанНЭН) являются редкими новообразованиями, проявляются симптомами гиперпродукции гормонов. Наиболее распространенным вариантом ПанНЭО является инсулинома, происходящая из β-клеток ПЖ и обусловливающая развитие гипогликемического симптомокомплекса. Согласно данным эпидемиологических исследований частота новых случаев заболевания за последние годы не увеличилась, составляя 1–3 случая на 1 млн человек в год в любом возрасте [2]. Основной пик распространенности приходится на пятое десятилетие жизни, заболеваемость у женщин несколько выше, чем у мужчин [2, 3]. В 85–90% случаев инсулиномы представляют собой солитарные доброкачественные опухоли, в 10–15% выявляются множественные опухоли, менее 6% опухолей оказываются злокачественными [4]. Множественные синхронные или метахронные ПанНЭО/инсулиномы могут возникать при множественной эндокринной неоплазии типа 1 (MЭН-1). Практически 50% пациентов с МЭН-1 имеют ПанНЭО [2].
Клинические проявления инсулином
В основе клинических проявлений лежит автономная гиперпродукция инсулина, провоцируемая голоданием или физическими упражнениями. Не подчиняясь физиологическим механизмам, регулирующим гомеостаз глюкозы, инсулиномы приводят к развитию гипогликемии, в ответ на которую происходит выброс контринсулярных гормонов, вызывающих характерную симптоматику. Отличительными чертами клинических проявлений инсулином являются вегетативные симптомы, связанные с компенсаторной активацией симпатической нервной системы, и нейрогликопенические вследствие снижения в крови уровня глюкозы — основного энергетического субстрата для головного мозга (табл. 1) [2].
![Таблица 1. Отличительные симптомы гипогликемии [2] Таблица 1. Отличительные симптомы гипогликемии [2]](https://medblog.su/wp-content/uploads/2023/04/Insulinoma-Klinicheskoe-nablyudenie-Druk-IV-Safronova-SS-Podolskij-EN.png)
Важным клиническим проявлением инсулиномы считается увеличение массы тела (вплоть до развития морбидного ожирения) вследствие вынужденного частого приема пищи для устранения симптомов гипогликемии [5].
Первым шагом в диагностике инсулиномы является выявление гиперинсулинемической гипогликемии, которая может возникнуть спонтанно, но чаще требуется проведение пробы с голоданием. «Золотым стандартом» диагностики гипогликемического синдрома является проба с трехдневным голоданием, цель которого — провокация патогномоничной для инсулиномы триады Уиппла [2]:
-
возникновение приступов гипогликемии натощак;
-
падение уровня глюкозы в крови ниже 3,0 ммоль/л во время приступа;
-
купирование приступа внутривенным введением глюкозы.
Более 95% случаев можно диагностировать на основе результатов этого простого теста. Во время проведения пробы пациент находится под пристальным наблюдением медицинского персонала. Начало голодания — это время последнего употребления пищи. Во время голодания следует прекратить прием всех второстепенных лекарств. В начале голодания берутся образцы крови для определения уровня глюкозы, инсулина, С-пептида [6]. В ходе проведения пробы исключается любой прием пищи, и каждые 6 ч проводится определение уровня глюкозы крови. Когда уровень глюкозы в плазме падает ниже уровня 3,3 ммоль/л (60 мг/дл), образцы следует брать каждые 1–2 ч под тщательным наблюдением. Голодание продолжается до тех пор, пока уровень глюкозы в плазме не упадет ниже 2,5 ммоль/л (уровень глюкозы в плазме менее 3,0 ммоль/л является альтернативной конечной точкой, если ранее была задокументирована триада Уиппла) и не проявятся симптомы нейроглюкопении [6].
При гликемии менее 3,0 ммоль/л в сочетании с симптомами гипогликемии проводится забор венозной крови для определения уровня инсулина, проинсулина и С-пептида. Поскольку абсолютный уровень инсулина повышен не у всех пациентов с инсулиномами, неопределяемый или неповышенный уровень инсулина не исключает инсулиному. Значения инсулина, равные или превышающие 3 мкЕд/мл при уровне глюкозы в крови менее 3 ммоль/л, с высокой вероятностью свидетельствуют в пользу инсулиномы. Большинство специалистов предпочитают ориентироваться на более строгие предельные значения глюкозы, составляющие 2,2 ммоль/л или менее для повышения диагностической специфичности. Из-за потенциальной повышенной секреции проинсулина, которая не обнаруживается с помощью используемых в настоящее время анализов на инсулин, обычно рекомендуется также измерять уровни проинсулина и/или С-пептида, особенно в тех случаях, когда уровень инсулина в крови низкий или неопределяемый [1]. Результат определения указанных маркеров, а также содержания в крови пероральных сахароснижающих препаратов позволяет проводить дифференциальную диагностику между эндогенным и экзогенным гиперинсулинизмом (табл. 2).
![Таблица 2. Дифференциальная диагностика симптоматической гипогликемии (уровень глюкозы <3,0 ммоль/л) после длительного голодания [6] Таблица 2. Дифференциальная диагностика симптоматической гипогликемии (уровень глюкозы <3,0 ммоль/л) после длительного голодания [6]](https://medblog.su/wp-content/uploads/2023/04/1681340254_971_Insulinoma-Klinicheskoe-nablyudenie-Druk-IV-Safronova-SS-Podolskij-EN.png)
Примерно у 75% пациентов с инсулиномами гипогликемия диагностируется после 24-часового голодания, у 90–94% — через 48 ч. Тем не менее некоторые эксперты утверждают, что продление голодания до 72 ч сводит к минимуму ошибочный диагноз и максимизирует вероятность диагностики инсулиномы [6].
Визуализация инсулином
При наличии эндогенной гиперинсулинемической гипогликемии проводятся визуализирующие исследования, успешно выявляющие примерно 75% инсулином. Анатомическая локализация доброкачественных инсулином также важна для выбора между лапароскопической, роботизированной и открытой хирургической операцией, а также для выбора между энуклеацией или частичной панкреатэктомией [2]. Процедуры визуализации могут включать традиционные методы: компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ), трансабдоминальное и эндоскопическое ультразвуковое исследование (УЗИ), а также методы молекулярной визуализации.
Методы, наиболее часто используемые для выявления опухолей в ПЖ, включают трехфазную КТ и МРТ, а также эндоскопическое УЗИ [2]. По результатам КТ инсулиномы, как правило, небольшие (0,5–2 см) образования, гиперваскулярные на ранних и поздних постконтрастных изображениях, в то время как нефункционирующие ПанНЭН, как правило, большие по размеру, могут быть кистозными или демонстрировать некротические изменения. Метастазы в печень при злокачественных инсулиномах могут сочетаться с признаками стеатоза печени. МРТ с большей вероятностью выявляет небольшие образования из-за лучшего контраста мягких тканей, однако это различие часто не считается клинически значимым из-за более длительного времени обследования и доступности МРТ. Типичные нейроэндокринные опухоли проявляются в виде темных образований на Т1-взвешенных МР-изображениях и в виде ярких образований на Т2-взвешенных МР-изображениях. В остальном контрастное усиление и морфологические характеристики часто схожи с КТ (табл. 3).
![Таблица 3. Чувствительность различных методов визуализации инсулином, % [2] Таблица 3. Чувствительность различных методов визуализации инсулином, % [2]](https://medblog.su/wp-content/uploads/2023/04/1681340254_847_Insulinoma-Klinicheskoe-nablyudenie-Druk-IV-Safronova-SS-Podolskij-EN.png)
Открытие молекулярных мишеней из-за сверхэкспрессии специфических рецепторов пептидных гормонов на поверхности НЭО привело к разработке нескольких методов радионуклидной визуализации, в том числе и для определения локализации ПанНЭН. Рецептор глюкагоноподобного пептида-1 (рГПП-1) в основном экспрессируется на β-клетках ПЖ и поэтому является основной мишенью для визуализации инсулином, которые сложно диагностировать из-за их небольшого размера и анатомической близости к почкам. Инсулинома обычно экспрессирует малое количество рецепторов соматостатина (рССТ), что приводит к низкой частоте выявления при использовании рССТ-визуализации. Однако рГПП-1 экспрессируются с высокой частотой и высокой плотностью в инсулиномах [7]. В отличие от доброкачес-твенных инсулином, в злокачественных часто отсутствует ГПП-1 [8]. Были разработаны ГПП-1-подобные радиолиганды, сохраняющие высокую аффинность к рГПП-1. Один из таких радиолигандов — эксендин-4. Процедура 68Ga-DOTA-exendin-4 ПЭТ/КТ с использованием эксендина-4, нацеленного на рГПП-1, вероятно, станет методом выбора при подозрении на инсулиному, не выявленную при обычной визуализации, а также при оценке множественных поражений ПЖ у пациентов с МЭН-1. Благодаря дополнительному преимуществу, заключающемуся в более коротком времени исследования и меньшей лучевой нагрузке, ПЭТ/КТ 68Ga-DOTA-exendin-4 был предложен в качестве метода диагностики выбора при подозрении на инсулиному и отрицательном результате обычной визуализации, что позволяет избежать громоздкой селективной внутриартериальной стимуляции кальцием с забором проб венозной крови [7].
При злокачественной инсулиноме экспрессия рГПП-1 ограничена, но часто сохраняется экспрессия рецепторов соматостатина, что делает их также пригодными для визуализации с помощью 68Ga-SSTR-ПЭТ/КТ. Экспрессируются рССТ на поверхности большинства хорошо дифференцированных нейроэндокринных опухолей, при этом плотность экспрессии снижается в плохо дифференцированных образованиях. Долгое время рССТ подтипа 2 был единственным объектом визуализации и терапии, в настоящее время большое значение приобрели подтипы 3 и 5. Визуализация опухолей с различными характеристиками чувствительности возможна при применении однофотонной эмиссионной КТ (ОФЭКТ)/КТ с октреосканом (на протяжении многих прежних лет — «золотой стандарт» визуализации рССТ), ПЭТ/КТ с галлием (68Gallium-SSTR-ПЭТ на основе 68Ga-DOTATOC (аффинность к рССТ подтипов 2, 3, 5), 68Ga-NOC (аффинность к рССТ подтипов 2, 3, 5) и 68Ga-DOTATATЕ (аффинность к рССТ подтипа 2)); применяется в качестве стандартного метода визуализации для определения стадии нейроэндокринных опухолей. Поскольку доброкачественные инсулиномы часто небольшие и обычно имеют низкую экспрессию рССТ, правильная локализация не всегда возможна с использованием 68Ga-SSTR-ПЭТ/КТ [7]. Альтернативными методами визуализации рССТ являются ПЭТ с 18F-фтордезоксиглюкозой (показана высокая клиническая значимость для выявления прогрессирования заболевания с неблагоприятным клиническим исходом), ПЭТ с F-18 фтордигидроксифенилаланином (18F-ДОРА, описана роль в дифференциальной диагностике эндогенного гиперинсулинизма, является альтернативным ПЭТ-индикатором для стран, где недоступна визуализация 68Ga-SSTR) (табл. 3).
В настоящее время 68Ga-exendin-4 ПЭТ/КТ используется только в рамках клинических исследований и доступна лишь в нескольких центрах, однако многообещающие данные об эффективности при выявлении небольших рГПП-1-позитивных инсулином, вероятно, приведут к увеличению использования в клинической практике. По мнению большинства участников международного консенсуса экспертов по молекулярной визуализации и тераностике НЭН, 68Ga-exendin-4 ПЭТ/КТ станет методом первого выбора для выявления доброкачественной инсулиномы. При инсулиноме со значительной экспрессией рССТ (рГПП-1-негативная, злокачественная инсулинома) 68Gallium-DOTA-SSA также является диагностическим и терапевтическим вариантом, когда применение 18F-DOPA ПЭТ может быть затруднено физиологическим биораспределением в ПЖ [1].
Гистопатология НЭО
Панкреатические НЭО имеют выраженную нейроэндокринную дифференцировку, которая проявляется особенностями морфологической структуры и иммуногистохимической экспрессией синаптофизина — маркера мелких везикул, а также в большинстве случаев хромогранина А — характерного неспецифического маркера, связанного с плотными секреторными гранулами [2, 5, 13]. Экспрессия хромогранина А может варьировать или отсутствовать в низкодифференцированных формах, при этом наличие синаптофизина обязательно для постановки диагноза НЭО. Для подтверждения эпителиальной природы НЭО используют иммуногистохимическое окрашивание на кератины, большинство демонстрируют положительную экспрессию при окрашивании антителами к панцитокератину (AE1/AE3) и антителами к низкомолекулярным цитокератинам (СК8, СК18, САМ 5.2) [5]. Окрашивание инсулином не всегда положительное при инсулиномах и обычно не является обязательным требованием после постановки клинического диагноза [2].
Классификация НЭО
В классификации НЭО введена градация (G1, G2 и G3) степени злокачественности панкреатических опухолей, основанная на оценках степени дифференцировки (митотического индекса) и пролиферативной активности опухоли, которую необходимо определять при помощи окрашивания на маркер пролиферации Ki-67 (табл. 4) [5].
![Таблица 4. Классификация и градация ПанНЭН (ВОЗ, 2017 г.) [5] Таблица 4. Классификация и градация ПанНЭН (ВОЗ, 2017 г.) [5]](https://medblog.su/wp-content/uploads/2023/04/1681340254_350_Insulinoma-Klinicheskoe-nablyudenie-Druk-IV-Safronova-SS-Podolskij-EN.png)
Дифференциальная диагностика
У пациентов без сахарного диабета спектр заболеваний и состояний для дифференциальной диагностики гипогликемии довольно широк. Среди причин гипогликемии у взрослых выделяют (по [6]):
-
прием лекарственных средств (сахароснижающие средства, глюкагон (во время эндоскопии), индаметацин, фторхинолоны, сульфониламиды, салицилаты, иАПФ, неселективные антагонисты β-адренорецепторов, инсулиноподобный фактор роста 1 и др.);
-
алкоголь;
-
печеночную, почечную или сердечную недостаточность;
-
сепсис, травму, ожоги;
-
недостаточное питание;
-
гормональный дефицит (кортизол, глюкагон, адреналин);
-
опухоли неостровковых клеток (опухоли, секрети-рующие инсулиноподобный фактор роста 2);
-
инсулиному (опухоли, секретирующие инсулин);
-
панкреатогенную гипогликемию, не связанную с инсулиномой (незидиобластоз);
-
операции желудочного шунтирования;
-
антитела к инсулину или антитела к рецептору инсулина (болезнь Хирата, применение клопидогрела или α-липоевой кислоты);
-
случайно скрытую или преднамеренную гипогликемию;
-
генетические нарушения (мутация в гене ABCC8).
При дифференциальной диагностике гипогликемических состояний необходимо учитывать гипогликемию, связанную с приемом медикаментозных средств, стимулирующих секрецию инсулина, — производных сульфонилмочевины, меглитинидов или введения инсулина, а также возможные случаи при приеме неселективных β-адреноблокаторов, ингибиторов АПФ, фторхинолоновых антибиотиков (ципрофлоксацина, левофлоксацина, моксифлоксацина) и противогрибкового лекарственного препарата пентамидина [6, 8, 9]. Риск гипогликемии повышается при почечной недостаточности, заболеваниях печени, сепсисе, расстройствах пищевого поведения, употреблении алкоголя и наркотиков, перенесенной бариатрической операции [6, 11]. Также дифференциальная диагностика проводится с инсулиновым аутоиммунным синдромом, для которого характерно наличие антител к инсулину и/или проинсулину, или рецептору инсулина у лиц, ранее не получавших экзогенный инсулин [6, 12]. Воздействие препаратов, содержащих сульфгидрильную группу, таких как клопидогрел или α-липоевая кислота, которая также содержит серу, может вызвать инсулиновый аутоиммунный синдром. Предполагается, что сульфгидрильная группа разрушает дисульфидную связь инсулина, увеличивая ее иммуногенность [6].
Лечение инсулином
В настоящее время единственным радикальным методом лечения инсулином ПЖ является хирургический, а именно энуклеация опухоли или резекция части железы, поэтому важна точная локализация опухоли до или во время операции. Операция в подавляющем большинстве случаев обеспечивает полное излечение. Однако это должно выполняться только тогда, когда диагноз установлен, и только хирургом, который имеет опыт в хирургии ПЖ. Инсулиномы обычно удаляются путем энуклеации опухоли, редко опухоли в головке ПЖ требуют панкреатодуоденэктомии. Доказано, что лапароскопическая или роботизированная энуклеация инсулиномы возможна, особенно если поражение визуализируется до операции на КТ или УЗИ [1, 11]. Когда гипогликемию можно контролировать только с помощью диеты или небольших, хорошо переносимых доз диазоксида, и/или когда состояние здоровья пациента значительно повышает риск хирургического вмешательства, может быть рассмотрено только медикаментозное лечение. Консервативная тактика при доброкачественных инсулинамах включает в себя изменение рациона питания с включением легких углеводов или нерафинированных углеводов, которые дают так часто, как требуется для предотвращения гипогликемии. Нередко пациенты могут избежать симптомов гипогликемии в течение различных периодов времени, сокращая количество часов между приемами пищи. Для некоторых достаточно дополнительного питания перед сном (в 23:00); для других необходим перекус в середине утра, в середине дня и/или ночью в 3:00. Как правило, предпочтительны более медленно усваиваемые формы углеводов (например, крахмалы, хлеб, картофель, рис). Во время эпизодов гипогликемии для их купирования используются легкоусвояемые углеводы быстро (например, фруктовые соки с добавлением глюкозы или сахарозы) [1].
Осложнения и прогноз
Осложнения, связанные с инсулиномой, включают стойкую гипогликемию, вызывающую нарушения повседневной деятельности, необратимые нейрокогнитивные нарушения и смерть. У пациентов с инсулиномой 10-летняя выживае-мость составляет 88% после успешного хирургического удаления, 87,5% пациентов излечиваются (без симптомов не менее 6 мес.) после операции. По некоторым данным, 10-летняя выживаемость при злокачественных инсулиномах составляет 29% после успешного хирургического лечения. Пациенты с синдромом MЭН-1 или со злокачес-твенными инсулиномами имеют более высокую частоту неудачных первоначальных операций или рецидивов заболевания. Частота рецидивов среди пациентов с MЭН-1 составляет около 21% в течение 10 и 20 лет, в то время как у пациентов без MЭН-1 сообщается о 5% рецидивов в течение 10 лет и 7% рецидивов — в течение 20 лет [13].
Клиническое наблюдение
Пациентка Н., 73 года, поступила в ФГБУЗ ЗСМЦ ФМБА России (г. Омск) с жалобами на слабость, головокружение, эпизоды потери сознания, сонливость.
Считает себя больной с июня 2022 г., когда на фоне относительного здоровья стала отмечать эпизоды выраженной общей слабости, головокружения, появление которых объясняла пропуском приема пищи (примерно 6-часовое голодание), а полное устранение связывала с приемом пищи. В связи с этим в течение 1–1,5 мес. пациентка увеличила кратность приема пищи до 5–6 раз день, на фоне чего отметила постепенное увеличение массы тела. В июле 2022 г. впервые при пропуске приема пищи в обед возник эпизод резкой слабости, нарушения координации движений и потери сознания. Со слов пациентки, очнулась глубоким вечером, расценив время суток как раннее утро. В связи с указанными жалобами пациентка обратилась за медицинской помощью амбулаторно, была консультирована неврологом, обследована (включая МРТ головного мозга). Ввиду отсутствия данных за неврологическую патологию было рекомендовано наблюдение и обследование у терапевта, чем пациентка пренебрегла. Через несколько недель пациентка была госпитализирована бригадой скорой медицинской помощи, вызванной соседями по подъезду, которые обнаружили пациентку стоящей на улице босиком, не ориентирующейся в месте пребывания и плохо поддерживающей контакт. По данным медицинской документации, была впервые зарегистрирована гипогликемия с уровнем глюкозы крови <1,1 ммоль/л. По лабораторным данным, в стационаре отмечалось колебание уровня глюкозы от 1,7 до 6,6 ммоль/л. Была проведена МСКТ органов брюшной полости, выявлено образование тела ПЖ. От оперативного лечения пациентка отказалась и была выписана с рекомендациями соблюдения дробного режима питания и разъяснениями способов выявления и купирования гипогликемии. В дальнейшем Н. периодически отмечала эпизоды легких симптомных вероятных гипогликемий, которые купировала приемом углеводов, уровень гликемии при этом не определяла. Через 1 мес. пациентка самостоятельно обратилась для проведения планового хирургичес-кого лечения в ФГБУЗ ЗСМЦ ФМБА России.
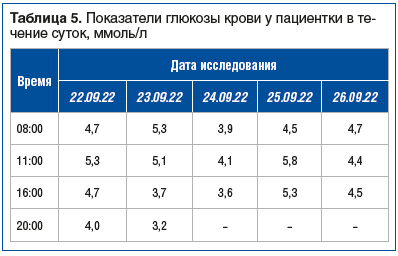
Из анамнеза жизни: отягощенная наследственность по онкологическим заболеваниям (у отца и деда по линии отца — рак желудка), ранний климакс (в 39 лет), артериальная гипертензия (в течение 20 лет; максимальное артериальное давление (АД) 160/100 мм рт. ст., адаптированное АД 130/80 мм рт. ст.; постоянный прием в течение 3 лет гипотензивной терапии: индапамид 1,5 мг, торасемид 5 мг, бисопролол 5 мг, лозартан 100 мг/сут. При физикальном осмотре состояние пациентки расценено как удовлетворительное, сознание ясное, положение активное. Из особенностей клинического статуса: избыточное питание, рост 154 см, масса тела 106,3 кг (индекс массы тела 46,2 кг/м2), кожные покровы умеренной влажности, гиперпигментация кожи в области естественных складок (черный акантоз), липома в области верхней трети спины около 10 см в диаметре; АД 120/80 мм рт. ст.; живот правильной формы, увеличен за счет подкожно-жировой клетчатки, отеков нет. При лабораторном обследовании в общем анализе крови, общем анализе мочи, биохимическом анализе крови, коагулограмме отклонений от нормы не выявлено. При определении гликемического профиля (глюкоза плазмы капиллярной крови) выявлялась тенденция к низконормальной гликемии, эпизод биохимической бессимптомной гипогликемии (табл. 5).
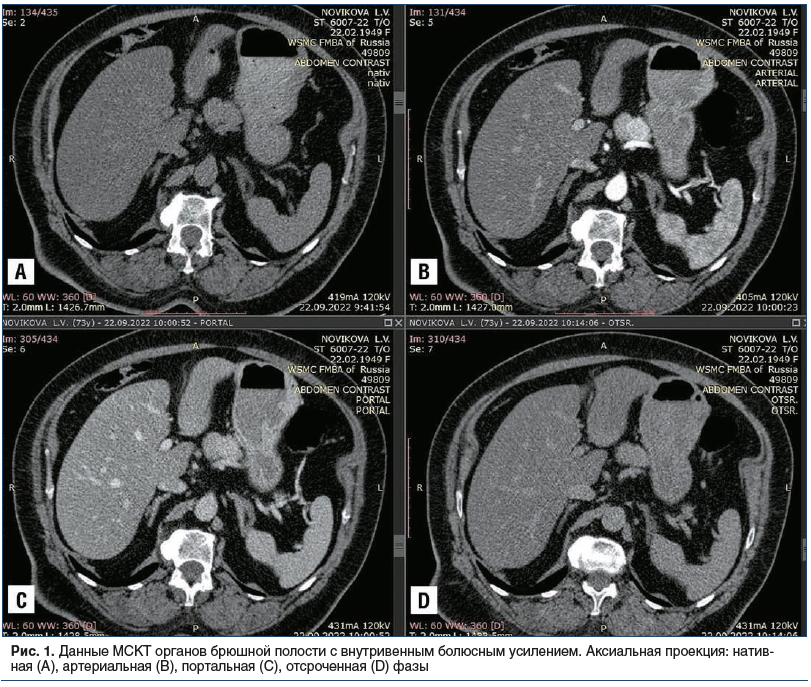
При проведении МСКТ органов брюшной полости с внутривенным болюсным усилением (ультравист 370–100 мл) в задневерхних отделах тела ПЖ выявлено очаговое образование с довольно четкими ровными контурами, незначительно выступающее за наружный контур железы, не вызывающее обструкцию вирсунгова протока, примерными размерами до 23,5×20×20 мм. Образование изоденсно паренхиме железы в нативную фазу (до 35 единиц Хаунсфилда (HU)), однородной структуры, при внутривенном усилении равномерно накапливало контрастный препарат с пиком контрастирования в артериальную фазу (до 132–140 HU); в портальную фазу образование выглядело несколько гиперденсным (110–116 HU); в отсроченную фазу образование нивелировалось. Перифокально ткань ПЖ не изменена, парапанкреатическая клетчатка не инфильтрирована (рис. 1).
С учетом неопределенных клинико-лабораторных данных была проведена проба с голоданием, во время которой у пациентки проявилась симптоматика гипогликемии (резкая слабость, потливость, головокружение, нарушение сознания) в течение первых 3 ч пробы, уровень глюкозы снизился до 2,5 ммоль/л. Результаты оценки уровня гормонов крови во время гипогликемии: инсулин 406 мЕд/мл (норма 2,3–28,4 мЕд/мл), С-пептид 17,1 нг/мл (норма 0,78–5,19 нг/мл), СА 19–9 2,0 МЕ/мл (норма 0–37 МЕ/мл), проинсулин 147,6 пмоль/мл (норма 0,7–4,3 пмоль/мл).
На основании анамнестических, клинических, лабораторно-инструментальных данных был установлен диагноз инсулиномы. Пациентке проведено оперативное лечение — атипичная резекция ПЖ. Удаленная опухоль была представлена хорошо отграниченным образованием округлой формы диаметром 2,2 см плотноэластической однородной консистенции, на разрезе поверхность имела желто-белый цвет (рис. 2A). При морфологическом исследовании (рис. 2B, C) опухоль имела трабекулярно-гнездный тип строения. Комплексы клеток разделены тяжами гиалинизированной стромы, опухолевые клетки мономорфные, цилиндрической и кубической формы с обильной светлой эозинофильной цитоплазмой, с центрально расположенными округлыми ядрами и зернистым хроматином (крупно- и мелкозернистый хроматин по типу «соли и перца»). Картин митозов нет. Окончательная верификация проводилась иммуногистохимическим методом, согласно которому в опухолевых клетках определялась выраженная экспрессия нейроэндокринных маркеров: маркер мелких везикул — синаптофизин, маркер плотных секреторных гранул — хромогранин А, нейронспецифическая енолаза. Экспрессия маркера пролиферации Ki-67 составляла не более 3% (рис. 2D–F). Таким образом, морфологическая картина соответствовала высокодифференцированной ПанНЭО, G1, 8240/3.

В послеоперационном периоде эпизодов гипогликемий зарегистрировано не было, состояние пациентки было удовлетворительным. На этапе последующего амбулаторного наблюдения эпизодов гипогликемии не отмечалось, уровень глюкозы крови натощак варьировал от 7,4 до 9,6 ммоль/л, на основании чего был верифицирован сахарный диабет 2 типа. Пациентка соблюдает соответствующие рекомендации по модификации образа жизни, получает сахароснижающую терапию (метформин пролонгированного действия 1,5 г/сут), наблюдается у эндокринолога.
Заключение
Представленное клиническое наблюдение демонстрирует классические клинические проявления доброкачественной инсулиномы, информативность основных лабораторно-инструментальных методов диагностичес-кого поиска, включая типичные результаты пробы с голоданием, первого этапа визуализации (МСКТ-позитивная инсулинома) и иммуногистохимического исследования, в также эффективность оперативного лечения как метода выбора терапии солитарных доброкачественных инсулином. В клиническом наблюдении обращает на себя внимание тот факт, что органический гиперинсулинизм маскировал клинические проявления сахарного диабета 2 типа у пациентки с факторами риска последнего (возраст ≥45 лет, ожирение, низкая физическая активность, артериальная гипертензия).
Информация с rmj.ru






