Для цитирования: Горячкина М.В., Белоусова Т.А. Хлоропирамин: клинические аспекты применения // РМЖ. Медицинское обозрение. 2014. №24. С. 1785
С конца XX в. наблюдается неуклонный рост и широкое распространение аллергических заболеваний среди населения во всем мире. Кроме того, повсеместно отмечается нарастание тяжести аллергозов, несмотря на явные успехи в изучении их этиологии, иммунопатогенеза и совершенствование фармакотерапии. Если в 1980-е гг. прошлого столетия аллергией страдало 20% населения в промышленно развитых странах, то в настоящее время этот показатель уже приблизился к 40% [1–4].
При этом следует отметить, что в последние десятилетия появляется все больше больных, которые становятся аллергиками в зрелом и пожилом возрасте. Аллергические заболевания – это болезни современной цивилизации, обратная сторона развития прогресса, плата человека за комфортную жизнь. Аллергодерматозы в структуре аллергических заболеваний, согласно ряду отечественных и зарубежных исследований, занимают от 7 до 73%. Заболеваемость атопическим дерматитом (АД), экземой, крапивницей, контактным дерматитом неуклонно растет, в ряде стран данными болезнями страдает около 25% населения [1, 5, 6].
Аллергодерматозы, являясь по большей части хроническими заболеваниями, сопровождающимися не только высыпаниями на коже, но и сильным зудом, представляют собой серьезную медико-социальную проблему. Тяжелое течение дерматоза нередко лишает пациента возможности активно заниматься профессиональной деятельностью, приводит к длительной нетрудоспособности, а порой и к инвалидизации, что отрицательным образом сказывается на качестве жизни больного и вызывает нарушения в психоэмоциональной сфере. Так, эпидемиологические исследования, проведенные зарубежными дерматологами, показали, что у 25–40% пациентов с хроническими дерматозами выявляются те или иные психопатологические расстройства. По данным G. Schneider и соавт., у 70% больных с зудящими дерматозами отмечаются депрессивные расстройства. А на основании анкетирования, проведенного Британской ассоциацией дерматологов, было установлено, что определенный вид дерматоза увеличивает риск суицидальных попыток. Элементы самоповреждающего поведения, в ряде случаев приведшие к завершенному суициду, чаще наблюдались при экземе, крапивнице, акне и псориазе [7, 8].
Неблагоприятная динамика роста этой группы заболеваний обусловлена рядом эндогенных и экзогенных факторов [1, 3, 5, 9].
К внешним факторам относят:
• отсутствие грудного вскармливания;
• загрязнение окружающей среды, особенно в промышленно развитых странах;
• постоянный контакт в быту и/или на производстве с разнообразными химическими веществами (продукты бытовой химии, строительные материалы, косметические средства, синтетическая одежда и обувь и др.), в частности возрастание заболеваемости аллергодерматозами связано с увеличением числа лиц, имеющих аллергогенные профессии (химики, медики, особенно стоматологи, хирурги, пищевики, парикмахеры, строители);
• употребление большого количества лекарственных средств, прежде всего антибиотиков, сульфаниламидов, вакцин, барбитуратов, а также витаминов, пищевых добавок, генно-модифицированных продуктов, фаст-фуда;
• бытовые аллергены, прежде всего домашняя пыль;
• курение.
К внутренним факторам относятся:
• генетическая предрасположенность (АД);
• болезни желудочно-кишечного тракта (ЖКТ);
• эндокринопатии;
• очаги локальной хронической инфекции;
• повышенная нагрузка на психоэмоциональную сферу;
• нервно-психические заболевания.
Во многих исследованиях отечественных и зарубежных авторов выявлено, что городское население болеет аллергодерматозами чаще, чем сельские жители. Подмечено, что в высокоразвитых странах процент страдающих аллергическими заболеваниями среди молодежи значительно выше, чем в развивающихся и слаборазвитых государствах. Так, в странах Западной Европы от 10 до 30% городского населения имеют тот или иной аллергоз. Среди причин, способствующих высокой заболеваемости в городе, выделяют несколько. Во-первых, более сильное загрязнение окружающей среды различными промышленными выбросами, выхлопными газами, парами бензина. Во-вторых, горожане чаще испытывают разнообразные стрессовые ситуации из-за напряженного ритма жизни, в-третьих, в их квартирах скапливается множество бытовых аллергенов (ковры, мягкая мебель, шторы, пуховые одеяла и подушки, строительные лаки и краски и др.). В-четвертых, городские жители часто злоупотребляют высокоаллергенной пищей и, наконец, содержание домашних животных и птиц в условиях города также часто приводит к развитию аллергозов [1, 3, 5].
Теория влияния образа жизни также рассматривается аллергологами как причина увеличения частоты аллергических заболеваний в популяции. Она основана на том, что в результате улучшения санитарных условий жизни человека и пересмотра его гигиенических привычек современные дети меньше контактируют с микробами и гельминтами, а это в свою очередь приводит к недостаточной стимуляции развивающейся иммунной системы. В частности, теория влияния гигиены используется для объяснения более широкой распространенности аллергических болезней в высокоразвитых индустриальных странах по сравнению с развивающимися. Аллергологи также предполагают, что рост числа аллергиков может определять эпигенетика, т. е. способность окружающей среды оказывать влияние на ДНК, активируя одни гены и «приглушая» другие [3, 10].
В современной клинической практике наиболее распространенными аллергодерматозами являются АД, экзема, крапивница и аллергический контактный дерматит (АКД). Они имеют возрастные, половые и клинико-патогенетические особенности.
Так, АД относится к аллергопатологии детского возраста и выявляется в основном на первом году жизни, в структуре детских аллергозов он занимает 50–66,4%. Дерматоз характеризуется полигенным типом наследования. Предполагают, что если один из родителей болен АД, риск развития заболевания составляет 60%, а если оба – 81%. Считается, что у 35% грудных детей, страдающих АД, впоследствии развивается бронхиальная астма. В основе патогенеза заболевания лежит генетически детерминированный патологический иммунный ответ, характеризующийся гиперчувствительностью как к аллергенам, так и к неспецифическим раздражителям [9, 11].
Выделяют IgЕ-зависимый (экзогенный) и IgЕ-независимый (эндогенный) типы АД. IgЕ-зависимый тип характеризуется взаимодействием аллергена с высокоаффинными IgЕ-рецепторами клеток Лангерганса, которое запускает иммунопатологическую воспалительную реакцию. Активация Т-лимфоцитов в острой стадии приводит к инфильтрации кожи Т-хелперами 2-го типа, секретирующими ИЛ-4, ИЛ-13, вследствие чего повышается уровень IgЕ-антител. Взаимодействие аллергена с IgЕ-антителами, фиксированными на поверхности базофилов и тучных клеток, приводит к активации этих клеток и выбросу вазоактивных веществ. При хронической стадии заболевания кожа инфильтрируется Т-хелперами 1-го типа, которые увеличивают уровни ИЛ-5, ИЛ-12, гранулоцитарно-макрофагального колониестимулирующего фактора, гамма-интерферона. При IgЕ-независимом, неаллергическом типе АД уровень IgЕ остается нормальным, отсутствуют специфические IgЕ-антитела, отмечается низкая экспрессия ИЛ-4, ИЛ-13, ИЛ-5 и высокая экспрессия гамма-интерферона. Это более редкая форма АД, встречающаяся у 15–30% лиц, в основном у женщин, и характеризующаяся поздним дебютом болезни [9, 12].
К провоцирующим заболевание факторам относят воздействие различных аллергенов (воздушных, микробных, пищевых), нарушение барьерной функции кожи, способствующее увеличению потери воды и активному проникновению аллергенов через кожу во внутренние среды организма. Синтетическая и шерстяная одежда, пыль, шерсть домашних животных, стрессы и психоэмоциональные перегрузки, сухость кожи, особенно в зимний период, также способствуют обострению патологического процесса. В многочисленных исследованиях, проведенных за рубежом, среди микробных агентов доказана патологическая роль Staphylococcus aureus, который обнаруживается практически всегда при тяжелых формах АД [9, 13].
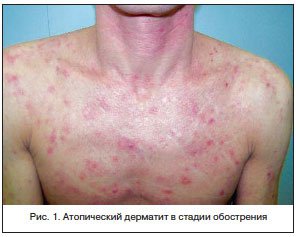
Главным и неизменным симптомом аллергодерматозов, и прежде всего АД, является зуд кожи. В зависимости от стадии патологического процесса на коже пациента с АД можно наблюдать различные элементы сыпи: отечные розово-красные пятна, папулы, бляшки, пустулы при присоединении вторичной инфекции, экскориации, корочки, явления лихенификации и ксероза. Кожа приобретает бледно-серый оттенок, патогномоничным признаком является белый дермографизм (рис. 1). Излюбленная локализация высыпаний – сгибательные поверхности суставов, тыльная сторона кистей и стоп предплечья, запястья, боковые поверхности шеи и лицо [9].
Экзема редко наблюдается до 20 лет, пик заболеваемости приходится на возраст 20–40 лет, и в структуре аллергодерматозов она составляет 30%. Экзема относится к нервно-аллергическим заболеваниям с поливалентной сенсибилизацией, возникающей в ответ на внутренние и внешние раздражители, порой без видимой причины, и характеризуется капризным, упорным течением с частыми рецидивами. Заболевание часто провоцируется профессиональными факторами. Экзема чаще всего возникает у химиков, стоматологов, хирургов, парикмахеров. По мере увеличения профессионального стажа, с годами число пациентов с экземой растет, нередко наличие экземы связано с потерей дохода или вынужденной сменой профессии. Экзема кистей, например, считается одним из основных заболеваний, сопряженных с потерей доходов [5, 6].
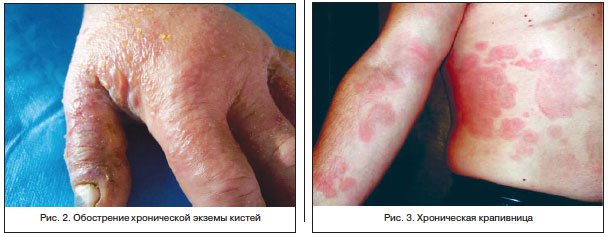
Патогенез экземы связан с нарушением деятельности трех интегративных систем организма: нервной, иммунной и эндокринной. Таким образом, ведущая роль в патогенезе заболевания отводится психовегетативным факторам, эндокринно-гуморальным расстройствам, а также неадекватному ответу иммунной системы (формирование замедленной реакции гиперчувствительности Т-лимфоцитов) на эндогенные и экзогенные раздражители. Рецидивы заболевания возникают на прием лекарственных препаратов, пищевые продукты, косметические средства, продукты бытовой химии, при стрессах, гормональных сбоях, а также при изменениях климата (температуры и влажности). Среди клинических форм экземы наиболее распространенной является истинная экзема, характеризующаяся симметричностью, нечеткостью очагов, полиморфизмом кожной сыпи, хроническим упорным клиническим течением, резистентностью к проводимой терапии (рис. 2). Микробная экзема также широко распространена в популяции и составляет от 12 до 27% всех случаев заболеваемости экземой. Экзематозный процесс развивается на фоне грибкового или микробного поражения кожи как реакция на сенсибилизацию к продуктам жизнедеятельности бактериальных или микотических возбудителей. Высыпания возникают вокруг длительно незаживающих ран, язв, пролежней, свищей от остеомиелита, на фоне длительно текущего, часто нелеченного микотического процесса. Очаги при микробной экземе в большинстве случаев ассиметричные, с четкими границами овальных или округлых очертаний. При профессиональной экземе четко прослеживается «профессиональная отягощенность», высыпания локализуются на открытых участках кожи, патологический процесс характеризуется моновалентной сенсибилизацией, ограниченными высыпаниями, благоприятным исходом при перемене профессии. Себорейная экзема развивается как у взрослых, так и у детей, мужчины болеют чаще, локализуется на себорейных участках кожи, протекает без мокнутия, часто развивается на фоне себорейного дерматита, у ВИЧ-инфицированных может быть одним из проявлений СПИДа [5, 6, 9].
Клинически одним из основных симптомов экземы является зуд кожи. Клинические проявления экземы характеризуется разнообразием форм и вариантов, что зависит от стадии и локализации патологического процесса, характера причинных факторов и особенностей макроорганизма. Большинство разновидностей экземы протекают по единому сценарию, который отражает стадии экзематозного процесса: эритроматозную, везикулезную, мокнущую, крустозную и сквамозную. Некоторые формы экземы могут протекать без мокнутия [9].
Крапивница встречается в основном у взрослых людей. Считается, что каждый четвертый человек хотя бы раз в жизни перенес данное заболевание. В настоящие время под термином «крапивница» понимают целую группу заболеваний с различными этиопатогенетическими механизмами, протекающих остро и хронически и имеющих различный прогноз и исход. Патогенетические аспекты крапивницы включают в себя прежде всего иммунные механизмы, наследственные и физические факторы. Этиологические механизмы включают как экзогенные, так и эндогенные факторы. Экзогенные факторы разделяют на физические (холодовая, аквагенная, холинергическая крапивница), химические (крапивница, связанная с приемом лекарственных средств, пищевых продуктов) и механические (уртикарный дермографизм, отек Квинке от давления). Эндогенные факторы связаны с патологией в органах и системах (очаги хронической инфекции, нарушения функции печени и болезни ЖКТ). В настоящие время этиологическая классификация крапивницы не используется, у одного и того же больного могут встретиться несколько ее вариантов, однако выявление причин заболевания необходимо для эффективного лечения болезни [9, 14, 15].
Клинически крапивница характеризуется появлением распространенных волдырей бледно-розового цвета, сопровождающимся сильным зудом или жжением кожи. Крупные волдыри (диаметром более 8 см) имеют белый центр с красным ободком по периферии (рис. 3). Для крапивницы характерен красный разлитой возвышающийся дермографизм. Высыпания недолговечные, один элемент существует не более 24 ч. Часто элементы исчезают в одном месте и появляются в другом, за счет чего образуются кольца, дуги и линии [9, 15].
АКД одинаково широко распространен как среди мужчин, так и среди женщин и встречается в любом возрасте, тем не менее у маленьких детей и пожилых людей риск развития АКД ниже. Контактные аллергены при АКД разнообразны: лаки, краски, косметические средства, металлы, моющие средства, топические лекарственные препараты. Патогенез АКД сходен с экземой (реакция гиперчувствительности Т-лимфоцитов замедленного типа). Однако в отличие от экземы при АКД не задействованы отягощающие психовегетативные и эндокринно-гуморальные факторы, а в ее основе лежит моновалентная сенсибилизация. Высыпания при АКД представлены отечными папулами и бляшками, везикулами, пузырями, эрозиями и корками в острой стадии, инфильтрацией, шелушением, сухостью – в хронической стадии. Кожная сыпь сопровождается зудом разной степени интенсивности, жжением, горением кожи. Сыпь локализуется не только на месте контакта с раздражителем, но и выходит за его пределы [9].
Одним из главных медиаторов аллергических реакций, принимающих участие в патогенезе большинства аллергодерматозов, является гистамин, который высвобождается при дегрануляции тучных клеток. Обязательное участие гистамина в патогенетических механизмах аллергических заболеваний делает блокаторы Н1-гистаминовых рецепторов средствами терапии первой линии, необходимыми для купирования любого аллергического поражения кожи. В настоящие время все антигистаминные средства принято делить на классические Н1-антагонисты, или противогистаминные препараты первого поколения, и Н1-антагонисты второго поколения. Кроме того, из Н1-антагонистов второго поколения выделяют препараты, являющиеся фармакологически активными конечными метаболитами (они получили название антигистаминные препараты третьего поколения), т. е. пролекарствами, которые в организме преобразуются в необходимое лекарственное средство. Несмотря на появление новых препаратов второго и третьего поколения, характеризующихся отсутствием ряда нежелательных явлений, таких как проходимость через гематоэнцефалический барьер и связанный с ней седативный эффект, стимуляция аппетита, прибавка массы тела, хининоподобный и кокаиноподобный эффект, развитие тахифилоксии при длительном использовании, кратковременность действия, обусловливающая многократность приема, антигистаминные препараты первого поколения до сих пор остаются в арсенале средств для широкого применения в дерматологии и аллергологии для лечения аллергодерматозов. Данная группа лекарственных средств хорошо изучена, накоплен большой опыт использования их на практике, время от времени появляются новые клинические данные об эффективности тех или иных антигистаминных препаратов первого поколения. К тому же каждое антигистаминное средство имеет свои преимущества и недостатки, а выбор врачом наиболее подходящего препарата для пациента определяется конкретной клинической ситуацией, его знаниями характеристик препарата и собственным опытом применения [16, 17].
Одним из наиболее эффективных препаратов, нашедших широкое применение в клинической практике, является хлоропирамин (Супрастин). Препарат представлен в двух формах: таблетированная (содержащая 25 мг хлоропирамина) и инъекционная (2% раствор хлоропирамина в ампулах по 1,0 мл). Препарат можно применять с месячного возраста. Хлоропирамин быстро и полностью всасывается из ЖКТ, его терапевтический эффект развивается в течение 15–30 мин после приема. Максимальная концентрация в крови достигается в течение первого часа, терапевтический уровень концентрации сохраняется в течение 3–6 ч. Препарат распределяется в разных органах, включая ЦНС. Метаболизм хлоропирамина происходит в печени; выделяется он преимущественно через почки с мочой в виде продуктов распада. Выделение препарата у детей может происходить быстрее, чем у взрослых [18–20].
При рассмотрении терапевтических возможностей хлоропирамина следует учитывать следующие аспекты [17–21]:
• Наличие инъекционной формы препарата, у антигистаминных средств второго поколения она отсутствует. Это является неоспоримым преимуществом препарата при использовании его в экстренных клинических случаях, когда необходим немедленный лечебный эффект. Заметный клинический эффект при приеме per os антигистаминных препаратов второго и третьего поколения (цетиризин, дезлоратадин, фексофенадин) наступает не ранее чем через 30 мин.
• Наличие седативного эффекта хлоропирамина необходимо в некоторых клинических случаях: при сильном, изнуряющем зуде, нарушениях сна из-за болезни, чувстве тревоги и беспокойства. В данном случае седативный эффект препарата является терапевтическим.
• Экономический аспект. Относительно невысокая стоимость препарата является привлекательной для пациентов.
В последние годы появились новые данные о механизмах действия Супрастина. Так, в 2003 г. американскими аллергологами был опубликован метаанализ сравнительных данных по изучению седативного действия Н1-блокаторов первого и второго поколения. Согласно исследованиям, разница в частоте седативного действия между антигистаминными препаратами первого и второго поколений не является столь существенной, как предполагалось ранее [21].
По мнению Т. Фицпатрика, при сильном зуде, который сопровождает АД, экзему, крапивницу и др., целесообразно отдавать предпочтение антигистаминным препаратам с выраженным седативным действием, т. е. препаратам первого поколения, например хлоропирамину [22].
Доказано, что дополнительный антихолинергический эффект хлоропирамина значительно уменьшает зуд и кожные высыпания при АД у детей, снижает объем назальной секреции и обеспечивает купирование чихания при ОРВИ [23, 24].
Известно, что при холинергической крапивнице отмечается повышенная плотность холинорецепторов в коже. Согласно проведенным исследованиям российских аллергологов, хлоропирамин является препаратом выбора в лечении данного вида крапивницы и проявляет большую эффективность по сравнению с препаратами второго поколения. В другом исследовании, проведенном во Франции, выявлено, что не только антигистаминное, но и антихолинергическое действие является необходимым в терапии аллергических заболеваний, в т. ч. и аллергодерматозов. Это объясняется тем, что в поздней фазе анафилактической реакции происходит высвобождение ацетилхолина и субстанции Р из пресинаптических нервных окончаний, которые могут поддерживать реакцию аллергического воспаления на уровне холинергической реакции. Препараты первого поколения, в частности хлоропирамин, в отличие от селективных антигистаминов (цетиризин, лоратадин, эбастин), оказывают антихолинергическое действие, блокируя позднюю фазу анафилактической реакции [20, 25].
Прием хлоропирамина также показан перед рентгеноконтрастными исследованиями, когда пациенту, в особенности с отягощенным аллергоанамнезом, осуществляют инфузии высокомолекулярных йодсодержащих средств (верографин, урографин и др.), потенциально способных вызвать развитие побочных реакций (зуд, гиперемия, крапивница, в тяжелых случаях – отек Квинке, анафилактический шок), выявляемых у 3–14% больных. В случаях острых аллергических реакций, когда необходимо парентеральное введение антигистаминных лекарственных препаратов, наличие инъекционной формы хлоропирамина определяет его выбор в качестве препарата первого ряда. При анафилактическом шоке после введения адреналина хлоропирамин вводится в/в медленно (по 1–2 мл 2% раствора), обязательным условием является контроль уровня систолического артериального давления, которое не должно быть ниже 90 мм рт. ст. [20].
Таким образом, использование в клинической практике антигистаминных препаратов 1-го поколения не утратило своей актуальности. Всегда стоит взвешивать целесообразность применения того или иного лекарственного средства в терапии аллергических заболеваний исходя не из его новизны, а с учетом этиопатогенетических, клинических особенностей заболевания и индивидуальных данных больного. Хлоропирамин (Супрастин) благодаря накопленному большому опыту применения имеет широкие показания для использования в различных областях практической медицины и остается испытанным средством для лечения аллергодерматозов у взрослых и детей.
Литература
1. Общая аллергология / Под ред. Г.Б. Федосеева. СПб, 2001. Т. 1. С. 9–169.
2. Лусс Л.В. Выбор антигистаминных препаратов в лечении аллергических и псевдоаллергических реакций // Российский аллергологический журнал. 2009. № 1. С. 1–7.
3. Никитин К.А., Шавгулидзе М.А. К вопросу об антигистаминной терапии аллергического ринита // Медицинский совет. 2014. С. 64–66.
4. Bach J.F. Infections and autoimmune diseases // J. Autoimmun. 2005. Vol. 25 (Suppl). P. 74–80.
5. Белоусова Т.А., Горячкина М.В. Антигистаминные препараты в современной клинической практике: проблемы выбора // РМЖ. 2011. С. 2102–2107.
6. Van Coevorden A.M., Coenraads P.J., Svensson A. et al. Overview of studies of treatments for hand eczema–the EDEN hand eczema survey // Br. J. Dermatol. 2004. № 2. P. 446–451.
7. Cotterill J.A., Cunliffe W. Suicide in dermatological patients // Brit. Assoc. Dermatologists. 1997. Vol. 137. P. 246–250.
8. Schneider G., Driesch G., Heuft G. et al. Psychosomatic cofactors and psychiatric comorbidity in patients with chronic itch // Clin. Experim. Dermatol. 2006. Vol. 31 (6). P. 762–767.
9. Дерматология Фицпарика в клинической практике. М.: Бином, 2012. Т. 1 С. 173–180, 357–372.
10. Bloomfield S.F., Stanwell-Smith R., Crevel R., Pickup J. Too clean, or not too clean: the Hygiene Hypothesis and home hygiene // Clin. Exp. Allergy, 2006. Vol. 36 (4). P. 402–425.
11. Самцов А.В., Сухарев А.В., Патрушев А.В. Лечение атопического дерматита: преимущества такролимуса перед топическими глюкокортикостероидами // Эффективная фармакотерапия. 2014. № 19. C. 4.
12. Мельниченко А.Б.., Григорян Н.С., Кочергин Н.Г. Фенотипический подход к гетерогенности атопического дерматита //Аллергология и дерматология. 2011. № 3(62). С. 56–59.
13. Sehgal V.N., Srivastava G., Dogra S. Atopic dermatitis current options and treatment plan // Skinmed. 2010. Vol.8. № 6. P. 335–344.
14. Ненашева Н.М. Эффективность рупатадина при кожных аллергических заболеваниях // Эффективная фармакотерапия. 2014. № 4. С. 16–17.
15. Аравийская Е.Р., Соколовский Е.В. Принципы ведения пациентов с крапивницей: отечественные и международные рекомендации // Клиническая дерматология и венерология. 2008. № 2. С. 38–41.
16. Гущин Н.С. Антигистаминные препараты: пособие для врачей. М., 2000.
17. Ревякина В.А. Антигистаминные препараты в практике поликлинического врача // Лечащий врач. 2011. .№4 (http://www.lvrach.ru/2011/04/15435162/)
18. http://medi.ru/doc/a02401.htm
19. Царев С.В. Хлоропирамин (Супрастин) в лечении аллергических заболеваний // Российский аллергологический журнал. 2006. № 6. С. 63–64.
20. Морозова С.В., Лусс Л.В. Хлоропирамин: современные аспекты применения // Вопросы современной педиатрии. 2007. Т. 6. №1. С. 137–139.
21. . Bender B.G., Berning S., Dudden R.et al. Sedation and performance impairment of diphenhydramine and second-generation antihistamines: a meta-analysis. 2003. Vol. 111.:№ 4. Р. 770–776.
22. Fitzpatrick T.B. et al. Clinical Dermatology. McGraw-Hill , 1999.
23. Muether P.S., Gwaltney J.M. Jr.Variant effect of first- and second-generation antihistamines as clues to their mechanism of action on the sneeze reflex in the common cold // Clin. Infect. Dis. 2001. Vol. 33. № 9. P. 1483–1488.
24. Стремоухов А.А., Мищенко Е.Б. Лечение ринита при острых респираторных вирусных инфекциях антигистаминными препаратами первого поколения // Лечащий врач. 2003. № 2. С. 77.
25. Alain Didier, Sandrine Doussau-Thuron, Marilene Murris-Espin. Service de Pneumonologie et Allergologie. CHR Rangueil, Toulouse, France CTR 2000. Vol. 61. № 11. Р. 770–780.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru






