Успехи современной диабетологии неразрывно связаны с достижениями последних лет в области изучения особенностей обмена веществ при сахарном
диабете (СД). Существенным прорывом в понимании патогенеза заболевания явилось обнаружение при СД таких метаболических феноменов, как усиление полиолового пути окисления глюкозы, неферментативное гликирование, глюкозотоксичность, липотоксичность, активация процессов липопероксидации и ряда других.
В последние годы все чаще стали появляться сведения о возможном участии в патогенезе СД и нарушений пуринового обмена. По крайней мере есть основания полагать, что в процессы диабетогенеза и формирования диабетических осложнений могут быть вовлечены нарушения пуринового обмена, касающиеся его заключительного этапа — образования при участии фермента ксантиноксидазы мочевой кислоты (МК).
У человека из-за утраты в процессе эволюции фермента уратоксидазы МК стала конечным продуктом пуринового обмена, тогда как у других млекопитающих (за исключением приматов) с помощью этого фермента она подвергается дальнейшему окислению до аллантоина — соединения, которое, в отличие от МК, является легкорастворимым. То, что МК стала у человека метаболическим «тупиком» пуринового обмена, имеет как положительные, так и отрицательные стороны. Полагают, что МК как производное ксантина обладает психостимулирующим, «кофеиноподобным» действием. Она может выступать в роли эндогенного антиоксиданта, заменяя тем самым аналогичные эффекты аскорбиновой кислоты, способность к синтезу которой у человека и приматов также утрачена. Вместе с тем из-за относительно плохой растворимости МК подвержена кристаллизации, что при определенных условиях обусловливает развитие у человека таких заболеваний, как подагра, мочекаменная болезнь. Отрицательное воздействие МК способна оказывать на организм и в растворенном состоянии, особенно когда ее уровень в крови превышает физиологические значения. Имеются сведения о неблагоприятном влиянии гиперурикемии (ГУ) на эндотелий сосудов, гемостаз, структурные элементы почек и других органов. Отдельные исследования показали, что ГУ оказывает прогипертензивное, провоспалительное и, в определенных случаях, прооксидантное действие [1].
Имеет значение увеличение концентрации МК в крови и при СД, причем на всех этапах его развития и прогрессирования: начиная со стадии предиабета и кончая манифестными формами заболевания с поздними диабетическими осложнениями.
Целью настоящей статьи явилось рассмотрение некоторых важных аспектов взаимовлияния ГУ и СД.
МК и ее метаболиты имеют структурную схожесть с известным диабетогенным веществом аллоксаном [2–4]. В эксперименте ГУ способствует развитию и прогрессированию СД. При этом большое значение имеет фоновое состояние углеводного обмена: диабетогенность МК выше у животных с исходно «скомпрометированным» углеводным обменом. В эксперименте также установлено, что как самостоятельный этиологический фактор развития диабета МК по своей активности значительно уступает аллоксану; вместе с тем ГУ, вызванная экзогенным введением МК, существенно потенцирует диабетогенные эффекты малых (субдиабетогенных) доз аллоксана. А это значит, что если даже уровень МК не оказывает прямого влияния на индукцию СД, он может способствовать реализации диабетогенных эффектов других факторов риска.
Экспериментальные данные позволяют предположить, что потенциальным фактором, способствующим развитию диабета, является не только уровень МК, но и сам процесс ее повышенного производства. Речь идет о заключительном этапе окисления пуринов при участии фермента ксантиноксидазы. Как было показано нами, развитие аллоксанового диабета сопровождается усилением активности ксантиноксидазы в инсулярном аппарате поджелудочной железы. Предварительная (до инъекции аллоксана) ингибиция этого фермента аллопуринолом способна улучшить течение СД — снизить выраженность последующей гипергликемии и отсрочить летальность аллоксандиабетных животных.
Результаты оценки распространенности ГУ в различных популяциях достаточно вариабельны. В значительной степени это связано с неоднозначностью критериев, используемых разными авторами при диагностике ГУ. В зависимости от решаемых задач одни исследователи оперируют популяционными нормативами содержания МК в крови, другие используют фиксированные критерии. Среди последних чаще других ориентиром служит уровень МК ? 420 мкмоль/л (7 мг/дл), при котором существенно возрастает риск преципитации уратов.
При диагностике ГУ мы рекомендуем придерживаться возрастно-половых популяционных нормативов содержания МК и вместе с тем в пределах ГУ выделять «жесткие» (МК ? 420 мкмоль/л) и «мягкие» (МК
По нашим данным, в популяционной выборке практически здоровых (по эпидемиологическим понятиям) лиц явно преобладают «мягкие» формы ГУ (9,9%), распространенность которых в 1,8 раза превосходит частоту «жестких» форм ГУ (5,4%). При этом обнаруживается четкая связь повышения уровня МК в крови с метаболическим синдромом и его компонентами. Наибольший коэффициент ассоциации зафиксирован между ГУ и углеводными нарушениями (+0,62), далее в порядке убывания следуют гиперинсулинемия (+0,57), абдоминальное ожирение (+0,51), гиперлипопротеидемия IV типа (+0,5) и артериальная гипертензия (+0,46). Установлено, что случайное обнаружение у человека ГУ в 3,7 раза увеличивает вероятность выявления у него нарушенной толерантности к глюкозе или СД 2 типа.
Таким образом, существующие на сегодняшний день данные позволяют причислить ГУ к числу известных факторов риска СД, таких как ожирение, инсулинорезистентность, дислипидемия и др.
Содержание статьи
Особенности пуринового обмена при сахарном диабете
В формировании общего пула пуринов в организме задействовано три основных источника:
использование пуринов, поступающих в составе пищи;
синтез de novo (активный синтез пуринов из низкомолекулярных составляющих);
реутилизация — повторное использование «отработанных» пуринов.
Из трех основных источников пуринов самым надежным и, пожалуй, основным является синтез de novo, для которого используются вполне доступные низкомолекулярные соединения. Поэтому ограничение поступления пуринов с пищей может не приводить к ожидаемому снижению уровня МК в организме. Большое значение для поддержания баланса пуринов имеет процесс реутилизации пуринов, который энергетически более выгоден, чем синтез de novo. Важнейшую роль в этом процессе играет фермент гипоксантин-гуанинфосфорибозилтрансфераза, который обеспечивает возврат в пуриновый цикл гуанина и гипоксантина.
Манифестные формы СД характеризуются чрезвычайно высоким пуриновым катаболизмом. При обоих типах СД отмечено нарастание в крови содержания пуриновых оснований (аденина, гуанина), что указывает на их плохую ассимиляцию тканями. Кроме того, при СД зафиксированы достоверное усиление активности ксантиноксидазы — ключевого фермента окисления пуринов, а также существенное угнетение процессов реутилизации пуринов — активность гипоксантин-гуанинфосфорибозилтрансферазы снижена более чем у половины больных СД. Все это в конечном итоге обусловливает чрезмерную продукцию МК, которая выражается в умеренно высокой (>4,8 ммоль/сут, но ?6 ммоль/сут) или сверхвысокой (>6,6 ммоль/сут) урикурии. Согласно нашим данным, гиперпродукция МК при декомпенсации углеводного обмена обнаруживается у 63,2% больных СД 1 типа и 76,7% больных СД 2 типа.
Отличительной чертой СД является то, что при преодолении гипергликемией «почечного порога» содержание МК практически утрачивает свое значение в качестве индикатора пуринового катаболизма. Гипергликемия, глюкозурия, присущие СД, через блокаду канальцевой реабсорции МК оказывают выраженное урикозурическое и гипоурикемическое действие, а это значит, что ГУ при манифестных формах СД — явление уже другого порядка, нежели высокие концентрации МК в крови на доклинических стадиях диабета.
Механизмы развития гиперурикемии
Примерно у каждого пятого пациента с СД 1 типа (22,5%) и у каждого третьего больного СД 2 типа (29,2%) встречается ГУ. При СД, в отличие от практически здоровых лиц, преобладают «жесткие» формы ГУ. При СД 2 типа их частота превосходит частоту «мягких» форм в 1,4 раза (17,0% против 12,2%), при СД 1 типа — в 1,6 раза (13,9% против 8,6%).
Если говорить о механизмах развития ГУ, то она может быть обусловлена:
повышенной продукцией МК при относительно сохранных механизмах ее выведения через почки (метаболический или гиперпродуктивный тип ГУ);
нарушенной ренальной экскрецией МК при ее нормальной продукции (почечный или гипоэкскреторный тип ГУ);
комбинацией повышенной продукции МК и сниженной способности почек к элиминации уратов (смешанный или гиперпродуктивно-гипоэкскреторый тип ГУ).
При СД имеют место все три перечисленных механизма, но их вовлеченность в процесс формирования ГУ существенно зависит от типа диабета (рис. 1).
При СД 2 типа преобладает смешанный тип ГУ, который встречается почти у каждого второго (44,5%) пациента с ГУ, тогда как при СД 1 типа в генезе ГУ у значительной части больных (60,9%) доминирующее место занимает низкая ренальная элиминация уратов (гипоэкскреторный тип ГУ).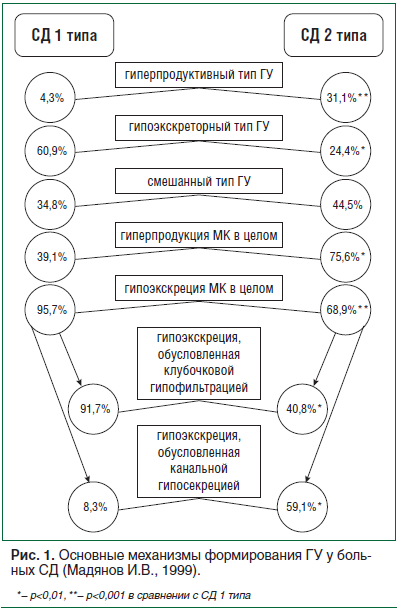
Если при СД 1 типа «почечный» фактор присутствует практически при любой ГУ, то при СД 2 типа он становится облигатным только при «жесткой» ГУ (МК ? 420 мкмоль/л). В этих случаях СД 2 типа, как правило, характеризуется более тяжелым течением. Это касается не столько возможности достижения компенсации углеводных нарушений, сколько возникновения сложностей при лечении коморбидных состояний. В первую очередь речь идет о сердечно-сосудистой патологии, которая у больных СД 2 типа с «жесткой» ГУ зачастую выходит на первый план и требует привлечения к ведению этой категории пациентов кардиологов и других смежных специалистов.
Таким образом, формирование ГУ при СД очень тесно связано с поражением почек.
Гиперурикемия и поражение почек
Снижение ренальной экскреции уратов при ГУ фиксируется у 95,7% больных СД 1 типа и 68,9% пациентов с СД 2 типа (рис. 1), что указывает на значительный вклад «почечного фактора» в формирование ГУ при СД.
В этой связи уместно заметить, что в ходе многих эпидемиологических исследований авторы пришли к выводу, что ГУ необходимо рассматривать в качестве независимого фактора риска развития и прогрессирования почечной недостаточности. При СД уратная нефропатия, как правило, предшествует ГУ. При сохранной функции почек гиперпродукция МК, свойственная СД, как правило, компенсируется повышенной урикурией. Этому в немалой степени способствует гипергликемия. По мере поражения почек «уратэлиминирующая» функция почек начинает страдать, и урикозурическую стадию повышенной продукции МК сменяет гиперурикемическая. Поэтому в формировании ГУ при СД в большинстве случаев задействован «почечный» компонент. При СД 1 типа развитие ГУ в большей мере обусловлено низкой клубочковой фильтрацией МК (диабетический гломерулосклероз), тогда как при СД 2 типа преимущественное значение имеет угнетение канальцевой секреции уратов (рис. 1). При этом поражение почек при ГУ у больных СД 2 типа в большей мере соответствует уратному тубулоинтерстициальному нефриту, который протекает со снижением плотности мочи, характеризуется никтурией, «следовой» протеинурией, микрогематурией и практически всегда артериальной гипертензией.
Если раньше к ГУ относились как к одному из показателей, отражающих нарушение экскреторной функции почек, не имеющему самостоятельного значения в почечном повреждении, то в настоящее время роль повышенного уровня МК в крови серьезно пересмотрена. Многочисленные данные позволяют говорить о прямой «нефротоксичности» МК, и поэтому ГУ стали рассматривать как одну из мишеней терапевтического воздействия для профилактики и снижения прогрессирования почечной недостаточности.
Таким образом, при СД, с одной стороны, повышение уровня МК в крови может быть следствием ухудшения функции почек, с другой стороны, ГУ сама по себе может способствовать их поражению.
Медикаментозная коррекция гиперурикемии
При лечении СД и коморбидной патологии следует всегда учитывать фактор ГУ. К примеру, известно, что большинство диуретиков и малые дозы аспирина за счет снижения ренальной экскреции МК способствуют развитию ГУ. Повышают уровень МК в крови никотиновая кислота, препараты, содержащие инозин, и целый ряд других лекарственных средств. Поэтому при прочих равных условиях желательно отдавать предпочтение или метаболически нейтральным средствам, или препаратам, способствующим снижению уровня МК в крови. К последним относят гипотензивные средства: лозартан, амлодипин, липидснижающие: аторвастатин и фенофибрат. Снижают продукцию МК производные оротовой кислоты.
Улучшение углеводного обмена при СД, как правило, не устраняет ГУ. Уровень МК в крови может даже повыситься, потому что по мере компенсации углеводного обмена снижается урикозурическое действие гипергликемии. Исключение составляет относительная новая группа сахароснижающих средств — ингибиторы натрий-глюкозного котранспортера 2 типа (sodium-glucose co-transporter 2 inhibitor — SGLT2), обладающие рядом позитивных негликемических эффектов, среди которых снижение артериального давления, уменьшение массы тела и улучшение ренальной элиминации МК.
Если на ранних этапах СД (например, при метаболическом синдроме) общепринятые меры, направленные на предупреждение ГУ, еще имеют определенное значение (соблюдение диеты, контроль за массой тела, рациональная фармакотерапия и т. п.), то при манифестных формах, когда задействован «почечный фактор», для устранения ГУ уже требуется активное медикаментозное вмешательство.
Показанием для уратснижающей терапии у больных СД, по нашему мнению, должна являться «жесткая» ГУ — уровень МК ? 420 мкмоль/л (7 мг/дл), при которой существенно возрастает риск преципитации уратов. Целью терапии в этих случаях является достижение уровня МК
Так же как и при подагре, при СД в качестве препаратов первой линии уратснижающей терапии должны рассматриваться ингибиторы ксантиноксидазы — аллопуринол и фебуксостат. Другая группа уратснижающих препаратов — урикозурические средства не только значительно уступают ингибиторам ксантиноксидазы в плане снижения уровня МК в крови, но и зачастую имеют ограничения из-за свойственных больным СД поражений почек. Кроме того, при СД важно не только снизить уровень МК в крови, но и уменьшить ее производство, что достигается только при использовании ингибиторов ксантиноксидазы [5–9].
Аллопуринол — наиболее популярный ингибитор ксантиноксидазы, который широко используется в клинической практике уже более полувека, зарекомендовал себя как эффективное средство коррекции ГУ у большинства больных СД. Рекомендуется назначать аллопуринол в дозе 100 мг/сут. По мере необходимости дозу его увеличивают на 100 мг/сут до достижения целевого уровня МК. Как правило, у больных СД целевого уровня МК удается достичь при дозах аллопуринола, не превышающих 300 мг/сут. Согласно нашим данным, при назначении больным СД 2 типа аллопуринола отмечается не только четкий уратснижающий эффект, но и умеренные позитивные сдвиги в углеводном, липидном обмене, а также в показателях перекисного окисления липидов. Аллопуринол способствует более быстрому достижению компенсации СД у больных с ГУ, а также снижению в крови концентрации холестерина, промежуточных (ацилгидроперекиси) и конечных (малоновый диальдегид) продуктов липопероксидации. Сам факт того, что ингибитор ключевого фермента окисления пуринов — аллопуринол способен не только снизить продукцию МК, но и положительно повлиять на состояние углеводного, липидного обмена и оказать при этом еще и антиоксидантное действие, является косвенным свидетельством взаимообусловленности этих метаболических расстройств при СД, среди которых пуриновые нарушения играют, видимо, далеко не последнюю роль.
Вместе с тем аллопуринол имеет свои недостатки. Самым, на наш взгляд, существенным из них является необходимость снижения его дозы по мере прогрессирования почечной недостаточности. Так, в наиболее эффективных дозах ? 300 мг/сут аллопуринол рекомендуется назначать только при скорости клубочковой фильтрации (СКФ) более 80 мл/мин, тогда как при СКФ 60–80 мл/мин безопасной уже является доза 200 мг/сут, при СКФ 40–60 мл/мин — 150 мг/сут, а при СКФ 20–40 мл/мин — не более 100 мг/сут. Кроме того, аллопуринол имеет хоть и редкие, но достаточно многообразные нежелательные реакции (кожные проявления, транзиторное увеличение «печеночных» ферментов, диарея, миопатия и др.), и его сочетание с отдельными группами препаратов (статины, ингибиторы АПФ, тиазидные диуретики, ампициллин и др.) требует особой осторожности.
Фебуксостат в сравнении с аллопуринолом имеет ряд серьезных преимуществ.
В отличие от аллопуринола фебуксостат является непуриновым селективным и неконкурентным ингибитором ксантиноксидазы, а потому не влияет на другие этапы пуринового обмена [7]. По уратснижающему эффекту, позволяющему достичь целевого уровня МК в крови, фебуксостат в дозе 80 мг/сут превосходит аллопуринол в дозе 300 мг/сут. При этом ощутимый уратснижающий эффект у фебуксостата наступает сравнительно быстрее (через 5–7 дней), чем у аллопуринола (через 7–15 дней).
Фебуксостат имеет двойной путь экскреции (печеночный и почечный), что позволяет применять его у лиц с умеренной почечной недостаточностью (СКФ > 30 мл/мин) без коррекции дозы. Поэтому при сниженной функции почек вероятность достижения целевого уровня МК в крови при использовании фебуксостата выше, чем при лечении аллопуринолом. К примеру, если у больного СД диабетическая нефропатия сопровождается СКФ 35 мл/мин, фебуксостат без особых опасений можно назначить в дозе 80 мг/сут, тогда как доза аллопуринола в этом случае не должна превышать 100 мг/сут. Рекомендуемая начальная доза фебуксостата составляет 80 мг 1 р./сут независимо от приема пищи. В случае если концентрация МК в сыворотке крови превышает 360 мкмоль/л (?6 мг/дл), через 2–4 нед. доза препарата может быть увеличена до 120 мг 1 р./сут.
Несмотря на все преимущества фебуксостата, назначать его имеет смысл (по причине более высокой стоимости по сравнению с аллопуринолом) при непереносимости последнего и/или наличии почечной недостаточности, ограничивающей применение аллопуринола в эффективной дозе.
Таким образом, ГУ имеет значение на всех этапах развития и прогрессирования СД. В популяционной выборке она указывает на риск развития СД, при клинических формах СД свидетельствует о метаболическом неблагополучии и поражении почек. При этом ГУ, судя по всему, патогенетически воздействует на инсулярный аппарат поджелудочной железы, почки и сосуды, а потому ее коррекция посредством использования ингибиторов ксантиноксидазы аллопуринола или фебуксостата при СД оправданна и положительно влияет не только на пуриновый, но и на углеводный, липидный обмен, а также на процессы перекисного окисления липидов.
Информация с rmj.ru