Введение
Лабиальный герпес — широко распространенное и высококонтагиозное инфекционное заболевание, вызываемое вирусами простого герпеса 1-го (ВПГ-1) и, реже, 2-го (ВПГ-2) типов. Клинически лабиальный герпес характеризуется везикулярными высыпаниями на слизистой оболочке ротовой полости, красной кайме губ, периоральной области.
Содержание статьи
Эпидемиология
По разным оценкам, от 60 до 90% населения мира инфицированы ВПГ, однако в большинстве случаев ВПГ-инфекция протекает бессимптомно [1]. Инфицирование ВПГ-1, как правило, происходит в детском возрасте, пик заболеваемости достигается к 2–3 годам, и к 5 годам бывает поражено около 33% детей [2]. За последние два десятилетия заболеваемость лабиальным герпесом возросла — отмечается более 23 млн новых случаев в год, при этом рецидивирующими формами страдают от 15 до 40% инфицированных [3]. Количество рецидивов лабиального герпеса, как правило, невысоко — до двух эпизодов в год, и лишь в 5–10% случаев отмечается высокая частота обострений — 6 и более эпизодов в год [3].
Провоцирующими факторами развития рецидива являются экзогенные и эндогенные условия, способствующие локальной или системной иммуносупрессии: инфекции верхних дыхательных путей, включая COVID-19, лихорадка, локальная травматизация эпителия, менструация, беременность, переутомление, психологический стресс, стоматологические и косметологические процедуры, воздействие солнечного света или ультрафиолета, диета, богатая продуктами с содержанием аргинина (например, шоколад, орехи, семена) [3, 4].
Передача
Вирусы простого герпеса, как и вся группа α-герпесвирусов, относятся к антропонозам, источником инфицирования является человек. Основные механизмы передачи — воздушно-капельный, контактный и контактно-бытовой. В большинстве случаев ВПГ-1 передается через слюну или травмированную кожу. Инфицирование разными типами ВПГ, как правило, происходит в разные возрастные периоды: ВПГ-1 — в детском возрасте контактно-бытовым путем, ВПГ-2 — с началом половой жизни при орально-генитальных контактах. Передача ВПГ-1 при орально-генитальном контакте также может привести к развитию генитального герпеса. ВПГ наиболее контагиозны в первые 24–48 ч от начала клинических проявлений [4, 5].
Патогенез
Попадая на слизистые оболочки или поврежденную кожу, ВПГ проникают в эпителиоциты, где активно реплицируются и проникают в нервные окончания сенсорных нейронов, иннервирующих область инфицирования. Далее ретроградным аксональным потоком ВПГ транспортируются через сенсорные нейроны в нейрональные ядра тройничного или спинального сенсорных ганглиев, где переходят в латентное состояние. При реактивации вирионы перемещаются с антероградным аксональным потоком от спинного нервного ганглия в нервные окончания, иннервирующие кожу или слизистые оболочки, где произошло первоначальное инфицирование (красная кайма губ, слизистая оболочка ротоглотки и т. д.). Здесь вирионы могут выделяться бессимптомно или провоцировать характерную клиническую картину вирус-индуцированного воспаления [4, 6].
Иммунологические аспекты ВПГ-инфекции
Иммунологическая защита против ВПГ-инфекции включает факторы врожденного и приобретенного иммунитета. При попадании вирусного патогена в эпителиоциты происходит активация эндосомальных Toll-подобных рецепторов, которые в свою очередь индуцируют интерфероновые регуляторные факторы, запуская противовирусный иммунный ответ. Интерфероны (ИФН) I типа инициируют экспрессию молекул адгезии, активируя хемотаксис нейтрофилов и макрофагов в очаг воспаления, усиливают фагоцитарную и бактерицидную активность макрофагов. Активированные макрофаги в свою очередь секретируют широкий спектр цитокинов, привлекая дополнительные факторы врожденного иммунного ответа. Рекрутированные нейтрофилы способствуют апоптозу и фагоцитозу инфицированных клеток. Сигнализация ИФН I типа при вирусной инфекции необходима также для созревания дендритных клеток (ДК) и активации NK-клеток (natural killers, естественные киллеры). NK-клетки являются представителями врожденного иммунного ответа, они способны непосредственно уничтожать инфицированные вирусом клетки, не несущие маркеров MHC класса I (МНС-I) или экспрессирующие NK-активирующие молекулы, что указывает на инфицирование. Являясь ранними продуцентами ИФН-γ, NK-клетки активируют CD4+ Т-лимфоциты и ограничивают репликацию и распространение вирусной инфекции [4].
Клетками, регулирующими врожденный и адаптивный иммунный ответ, выступают ДК, которые в большом количестве представлены в коже и слизистых оболочках. Это антигенпрезентирующие клетки (АПК): фагоцитоз вирионов запускает их созревание и дифференцировку, после чего зрелые ДК мигрируют в регионарные лимфатические узлы, где презентируют поглощенные антигены в составе комплексов MHC-I или MHC-II наивным Т-лимфоцитам, тем самым запуская адаптивный иммунный ответ.
Презентация вирусных антигенов в комплексе с молекулами MHC-I индуцирует дифференцировку Т-лимфоцитов в эффекторные CD8+ Т-клетки, мигрирующие в пораженные ткани. Здесь они непосредственно уничтожают инфицированные клетки путем апоптоза с помощью внутриклеточных цитотоксических белков (гранзимов, перфоринов, гранулизинов), а также секретируют ИФН-γ. ИФН-γ — основной эффектор CD8+ Т-лимфоцитов — способствует презентации вирусных пептидов, подавляет репликацию вируса и клеточный цикл, запускает дифференцировку наивных Т-лимфоцитов в Th1-клетки. ИФН-γ также активирует презентацию антигена в составе MHC-II, что в свою очередь активирует CD4+ Т-клетки, необходимые для полной активации цитотоксических CD8+ Т-лимфоцитов и для продукции противовирусных антител В-лимфоцитами. CD4+ Т-лимфоциты также секретируют ИФН-γ и интерлейкин 2 (ИЛ-2), что приводит к подавлению внутриклеточной репликации вируса, способствует пролиферации CD8+ Т-лимфоцитов, стимуляции фагоцитоза макрофагами, активации NK-клеток. Кроме того, под влиянием ИФН-γ и ИЛ-2 происходит усиление экспрессии MHC-I и MHC-II вторичными АПК, включая эпителиоциты. И в дополнение активированные CD4+ Т-клетки активируют В-лимфоциты, индуцируя синтез вирус-специфических антител [4].
Особенностью Т-клеточного иммунного ответа при инфицировании ВПГ является вовлечение в иммунные защитные реакции не только системного, но и местного пула Т-лимфоцитов, локализованных в коже и слизистых оболочках, нейрональных ганглиях. CD4+ Т-клетки инфильтрируют слизистые оболочки на ранних этапах и остаются преобладающим классом лимфоцитов в первые 12–48 ч после инфицирования, инфильтрация CD8+ Т-лимфоцитами происходит на более поздних этапах. После первичной инфекции ВПГ-специфичные, активированные эффекторные Т-лимфоциты памяти CD4+ и CD8+, экспрессирующие ИФН-γ и фактор некроза опухоли α, инфильтрируют нейрональные ганглии, контролируя герпесвирусную инфекцию. Таким образом, латентное присутствие ВПГ в нервных ганглиях сопровождается местным Т-клеточным контролем за счет клеток памяти. Под влиянием неблагоприятных факторов, описанных выше, ВПГ способны периодически реактивироваться, мигрировать из нервных ганглиев через сенсорные нейроны на поверхность кожи или слизистых оболочек и провоцировать развитие клинических проявлений ВПГ-инфекции [4].
Клинические проявления лабиального герпеса
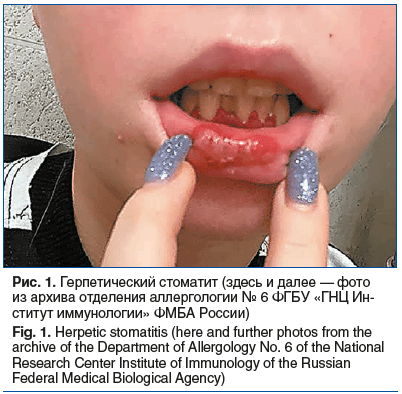
Первичное инфицирование ВПГ-1 может проявляться в виде герпетического гингивостоматита — множественных пузырьковых высыпаний на слизистой оболочке внутренней поверхности губ, щек, нижней поверхности языка и дна полости рта, сопровождающихся покалыванием, зудом, раздражением, онемением, болью и жжением (рис. 1) [4–6].
При типичной форме лабиального герпеса на красной кайме губ, периоральной области развиваются сгруппированные пузырьковые элементы на гиперемированном фоне, которые разрешаются с образованием эрозий и корочек (рис. 2). Высыпания могут сопровождаться субъективными симптомами в виде покалывания, зуда, жжения или боли.
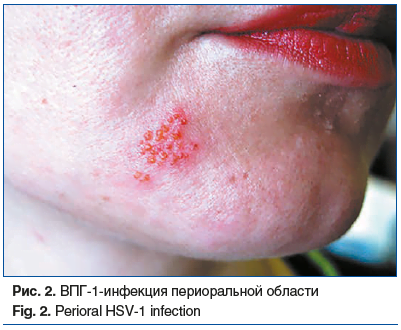
Клинические проявления возникают через 2–20 дней после инфицирования, пик вирусной нагрузки приходится на первые 24–48 ч после появления высыпаний и постепенно снижается по мере превращения высыпаний в эрозии и корочки [7].
Первичный эпизод характеризуется впервые возникшими клиническими проявлениями на фоне серонегативности, протекает, как правило, тяжело, с большой площадью поражения и симптомами общей интоксикации (лихорадкой, недомоганием, головной болью), регионарной лимф-аденопатией и длится дольше, чем рецидив. Первичное инфицирование может протекать бессимптомно, переходя сразу в латентную фазу.
Первый эпизод непервичной ВПГ-инфекции характеризуется впервые возникшими клиническими проявлениями при наличии вирус-специфических антител. Симптоматика при этом менее интенсивна, чем при первичном эпизоде, но более выраженна, чем при рецидивирующей форме заболевания [4–6].
Рецидивы герпеса могут протекать бессимптомно или с неинтенсивной клинической симптоматикой — с небольшой площадью поражения и меньшей продолжительностью, чаще ограничиваясь локальным очагом воспаления без общих симптомов.
При атипичной форме простого герпеса изменяется последовательность развития элементов в очаге поражения и характер местных симптомов. Например, для зудящей формы свойственно периодическое появление зуда на фоне практически неизмененной слизистой оболочки или кожи; местные симптомы отечной формы проявляются только гиперемией и отеком без формирования везикулярного элемента. Иногда атипичная форма заболевания протекает в виде рецидивирующих трещин слизистых оболочек или красной каймы губ, кожи, сопровождающихся резкой болезненностью.
Бессимптомная форма характеризуется репликацией вируса без развития классических симптомов заболевания [4–6].
Диагностика
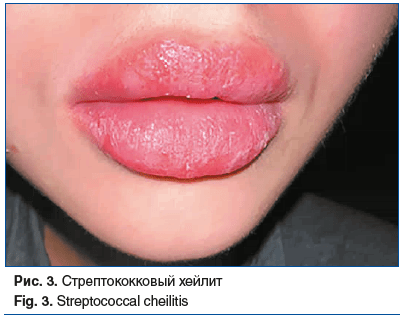
Типичную форму лабиального герпеса легко установить при объективном осмотре по характерным сгруппированным поверхностным округлым везикулам на гипер-емированном фоне. У взрослых с атипичным течением заболевания диагностика затруднена. Визуальное определение герпетического стоматита, гингивита также часто приводит к диагностическим ошибкам. Дифференциальную диагностику следует проводить с бактериальными инфекциями красной каймы губ и кожи периоральной области (стрепто- и стафилодермией), хейлитами, стоматитами другой этиологии (грибковой, аутоиммунной) (рис. 3).
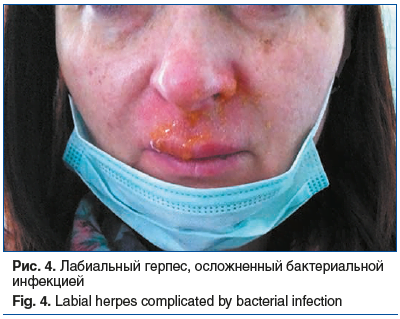
Также следует помнить, что герпесвирусная инфекция может осложняться сопутствующей бактериальной инфекцией, что также затрудняет правильную постановку диагноза (рис. 4).
В настоящее время ПЦР-исследование является «золотым стандартом» лабораторной диагностики ВПГ-инфекции. Исследованию подлежат биологические образцы в зависимости от клинических проявлений (соскобы/мазки с везикул или эрозий, слизистых оболочек, слюна). Благодаря высокой чувствительности метод позволяет выявить возбудителя даже при его минимальном содержании в биологическом образце, а также типировать ВПГ-1 и ВПГ-2. ПЦР-исследование дает возможность не только установить этиологию заболевания, но и контролировать течение инфекционного процесса, оценивать эффективность проводимой терапии. Особенно актуален этот метод для диагностики атипичной или бессимптомной формы ВПГ-инфекции [4, 8].
Вирус-специфические IgМ определяются на 4–6-й день после инфицирования и достигают максимального значения на 15–20-е сутки. Выявление IgМ не всегда является достоверным признаком первичной инфекции, они могут формироваться и при реинфекции другим штаммом или типом вируса, а также в случае перекрестных реакций. С 10–14-х суток появляются вирус-специфические IgG, которые сохраняются пожизненно.
Серологическое исследование применяют для определения стадии герпесвирусной инфекции при атипичном течении, отрицательном ПЦР-тесте, первичном эпизоде простого герпеса, когда необходима дифференциальная диагностика между первичной инфекцией и рецидивом для выбора тактики терапии [4, 8].
Лечение
Согласно международным и отечественным стандартам препаратами выбора для лечения ВПГ-инфекции являются ациклические нуклеозиды — ацикловир, валацикловир, фамцикловир [4, 9, 10]. Системные противовирусные препараты не направлены на элиминацию вируса, однако позволяют контролировать симптомы ВПГ-инфекции. Противовирусные препараты применяют либо эпизодически (при возникновении рецидива), либо пролонгированно (независимо от наличия рецидива). Эпизодическая терапия предпочтительна для пациентов, имеющих редкие и нетяжелые обострения. В этом случае противовирусный препарат назначают коротким курсом в течение 5–10 дней. Для пациентов с высокой частотой рецидивов (более 6 раз в год) рекомендована пролонгированная схема лечения — ежедневный прием в течение нескольких месяцев или лет [4, 9, 10].
Иммуномодулирующая терапия является вспомогательным методом лечения и применяется с целью сокращения сроков выздоровления, снижения рисков развития осложнений, уменьшения частоты, продолжительности и выраженности обострений хронической рецидивирующей инфекции. Как правило, иммуномодуляторы применяют в комбинации с противовирусными препаратами на разных этапах воспалительного процесса, а также в период медикаментозной ремиссии. В период ремиссии возможно применение иммуномодуляторов в виде монотерапии с целью иммунореабилитации и профилактики развития обострений [4, 11]. Одним из препаратов, сочетающих индукцию ИФН, а также противовирусную активность, является оригинальный отечественный иммуномодулирующий препарат растительного происхождения Панавир®, который успешно применяется в клинической практике в течение 25 лет. Основной его компонент — высокомолекулярный гексозный гликозид, полученный из меристемы побегов растения Solanum tuberosum (паслен клубненосный).
По данным исследования Р.Р. Климовой и соавт. [12], Панавир® обладает противовирусными эффектами против ВПГ, которые основаны на предотвращении цитопатогенного вирус-индуцированного действия и нарушении экспрессии вирусных белков. Эффективность применения Панавира у пациенток с рецидивирующим генитальным герпесом показана для комбинированной терапии, включающей гель для наружного применения 0,002% и внутривенные инъекции (0,04 мг/мл раствор 5 мл 1 р/день) в течение 5 дней [13].
Иммуномодулирующие эффекты Панавира основаны на способности индуцировать синтез собственных ИФН. По данным исследования, проведенного в НИИ вирусологии им. Д.И. Ивановского РАМН [14], однократное системное введение Панавира повышает уровень сывороточных ИФН в 2–3 раза. Помимо иммуномодулирующих свойств, индукторы интерфероногенеза обладают опосредованными противовирусными, противоопухолевыми и другими эффектами, характерными для ИФН. Комбинированное использование препаратов индукторов ИФН с другими иммуномодулирующими или противовирусными средствами в ряде случаев дает аддитивный и даже синергический эффект [11]. Недавно показано, что активность Панавира на клеточном уровне также опосредуется фагоцитозом его наночастиц с последующим активным выбросом во внеклеточное пространство АТФ и фактора ингибирования миграции макрофагов. Посредством такого механизма активируются все виды иммунных клеток, в том числе зрелые нейтрофилы, и усиливается фагоцитоз [15].
Исследования по применению препарата Панавир® показали его хорошую переносимость, отсутствие тератогенного, мутагенного, эмбриотоксического, канцерогенного и аллергизирующего действия. Препарат представлен широкой линейкой лекарственных форм, как системных (раствор для внутривенного введения 0,04 мг/мл 5 мл, суппозитории ректальные 200 мкг), так и топических (суппозитории вагинальные 200 мкг, гель 0,002% и капли глазные 0,04 мг/мл для лечения офтальмогерпеса и аденовирусной инфекции), что позволяет эффективно и с удобством использовать его в условиях реальной клинической практики, а также дает возможность подобрать оптимальную терапию в сложных случаях.
Для вспомогательного лечения инфекционно-воспалительных заболеваний кожи и/или слизистых оболочек, обусловленных ВПГ-1 и ВПГ-2, а также папилломавирусной инфекции кожи и/или слизистой оболочки гениталий и перианальной области в комбинации с лазерной деструкцией остроконечных кондилом с успехом применяется Панавир® гель 0,002%.
Представляем клинические наблюдения пациенток с рецидивом лабиального герпеса, демонстрирующие эффективность использования топической формы (гель) Панавира.
Клиническое наблюдение 1
Пациентка П., 46 лет, обратилась с жалобами на пузырьковые высыпания на коже под нижней губой, выраженный зуд, болезненность, жжение в области высыпаний; такие высыпания появляются до 5 раз в год.
Диагноз: хроническая рецидивирующая герпесвирусная инфекция, Herpes simplex; лабиальная форма, обострение (В00.1).
Анамнез жизни. Росла и развивалась соответственно возрасту. Перенесенные заболевания: ветряная оспа, новая коронавирусная инфекция без осложнений. Оперативные вмешательства: в 18 лет проведена тонзиллэктомия. Аллергоанамнез не отягощен. Гемотрансфузии отрицает. Онкологический анамнез: отрицает. Хронические заболевания: простой хронический бронхит (J41.0), левосторонняя смешанная тугоухость (H90), артериальная гипертензия (I10).
Анамнез заболевания. Лабиальная форма герпесвирусной инфекции беспокоит с подросткового возраста. Ранее редкие (1–2 раза в год) высыпания купировались в течение 3–5 дней. Провоцирующие факторы: переохлаждение, ОРВИ. В последние 3 года стала отмечать учащение высыпаний до 4–5 раз в год, в основном в осенне-зимний период на фоне ОРВИ. Отмечает увеличение длительности рецидива до 7–10 дней, иногда с присоединением мокнутия. По назначению дерматолога применяет валацикловир 500 мг 2 р/сут в течение 5 дней, местно — крем ацикловир 5%.
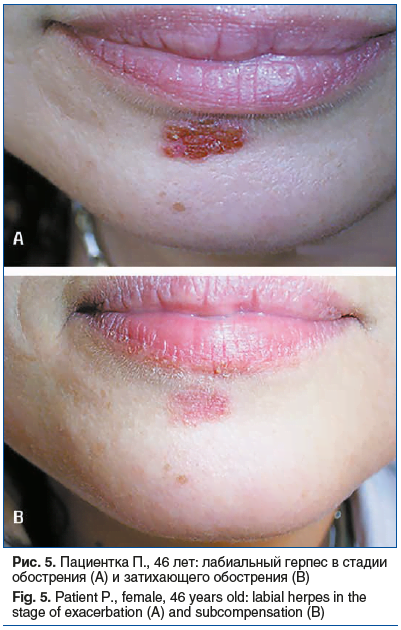
Данные осмотра. На коже под нижней губой очаг сгруппированных пузырьковых высыпаний размером 2,0 см в диаметре (рис. 5А).
Данные лабораторных методов обследования: мазок с области высыпаний на ПЦР-исследование — обнаружена ДНК ВПГ-1 и ВПГ-2.
Терапия. Противовирусная терапия: валацикловир 500 мг перорально 2 р/сут в течение 5 дней, Панавир® гель 0,002% для наружного и местного применения тонким слоем на пораженные участки кожи 5 р/сут до полного заживления высыпаний.
Повторный осмотр. Через 5 дней проведен повторный осмотр. На фоне лечения пациентка отмечает более быстрое купирование местных симптомов: зуда, болезненности, жжения на 3-и сутки лечения (в сравнении с предыдущим рецидивом, когда длительность местных симптомов достигала 5–6 дней). Пациентка отмечает более быстрое заживление высыпаний, отсутствие мокнутия, быстрое отпадение корочек к 5-м суткам лечения (ранее на 7–10-е сутки). Пациентка отмечает хорошую переносимость препарата и удобство применения, поскольку гель прозрачный, не оставляет следов на коже, не имеет запаха (рис. 5B).
Клиническое наблюдение 2
Пациентка П., 26 лет, обратилась с жалобами на пузырьковые высыпания на красной кайме губ, сопровождающиеся зудом, болезненностью, жжением.
Диагноз: хроническая рецидивирующая герпесвирусная инфекция, Herpes simplex; лабиальная форма, обострение (В00.1).
Анамнез жизни. Росла и развивалась соответственно возрастной норме. Перенесенные заболевания: ОРВИ. Оперативные вмешательства отрицает. Аллергоанамнез не отягощен. Гемотрансфузии отрицает. Онкологический анамнез: отрицает. Хронические заболевания: хронический тонзиллит (J35.0), хронический гастрит (K29).
Анамнез заболевания. Лабиальная форма герпесвирусной инфекции беспокоит с детского возраста, высыпания редкие (1–2 раза в год), купируются в течение 3–5 дней. Провоцирующие факторы: переохлаждение, ОРВИ, смена климата. В последний год отмечает учащение высыпаний до 3 раз в год, в основном в осенне-зимний период, увеличение длительности рецидива до 7 дней. Системные противовирусные препараты для купирования рецидива принимать отказывается в связи с плохой переносимостью из-за сопутствующего хронического гастрита.
Данные осмотра. На красной кайме нижней губы очаг сгруппированных пузырьковых высыпаний размером 0,5 см.
Данные лабораторных методов обследования: мазок с области высыпаний на ПЦР-исследование — обнаружена ДНК ВПГ-1 и ВПГ-2.
Терапия. Учитывая невысокую частоту обострений, нетяжелое течение рецидива, а также в связи с отказом принимать системную противовирусную терапию, рекомендована местная терапия: Панавир® гель 0,002% для наружного местного применения тонким слоем на пораженные участки кожи 5 р/сут до полного заживления высыпаний.
Повторный осмотр. Через 5 дней проведен повторный осмотр. На фоне лечения пациентка отмечает более быстрое купирование местных симптомов: зуда, болезненности, жжения на 2–3-и сутки лечения, быстрое заживление очага воспаления и отпадение корочек к 5-м суткам лечения (ранее на 7–10-е сутки). Как и в предыдущем случае, отмечается хорошая переносимость препарата и удобство применения, связанное с прозрачностью и тонкой структурой геля.
Заключение
В настоящее время разработаны и с успехом применяются стандартизованные схемы лечения герпесвирусной инфекции классическими противовирусными химиопрепаратами. Кроме того, существуют и продолжают исследоваться разнообразные методы лечения с применением иммуномодулирующей терапии. Выбор тактики лечения определяется клинической формой, тяжестью течения заболевания и эффективностью предшествующей терапии.
Панавир® гель 0,002% обладает иммуномодулирующим, противовирусным свойствами, а также способностью ускорять регенерацию тканей, в связи с чем успешно применяется в комплексной терапии лабиального герпеса. Как видно из описанных клинических наблюдений, применение препарата способствует ускорению заживления пораженных участков кожи, красной каймы губ, сокращению выраженности и длительности рецидива. Кроме того, при нетяжелом течении герпесвирусной инфекции и/или отсутствии приверженности системной противовирусной терапии можно рекомендовать применение местного лечения лабиального герпеса топическими противовирусными и иммуномодулирующими препаратами, что позволит уменьшить дискомфорт для пациента и сократит период восстановления.
Сведения об авторах:
Шульженко Андрей Евгеньевич — д.м.н., профессор, заведующий отделением аллергологии № 6 ФГБУ «ГНЦ Институт иммунологии» ФМБА России; 115522, Россия, г. Москва, Каширское ш., д. 24; ORCID iD 0000-0003-0268-9350
Щубелко Розалия Васильевна — к.м.н., врач аллерголог-иммунолог, старший научный сотрудник отделения аллергологии, № 6 ФГБУ «ГНЦ Институт иммунологии» ФМБА России; 115522, Россия, г. Москва, Каширское ш., д. 24; ORCID iD 0000-0001-6993-9831
Зуйкова Ирина Николаевна — к.м.н., врач аллерголог-иммунолог, старший научный сотрудник отделения аллергологии № 6 ФГБУ «ГНЦ Институт иммунологии» ФМБА России; 115522, Россия, г. Москва, Каширское ш., д. 24; ORCID iD 0000-0002-9373-4681
Контактная информация: Зуйкова Ирина Николаевна, e-mail: zuikova_i@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 16.09.2024.
Поступила после рецензирования 09.10.2024.
Принята в печать 30.10.2024.
About the authors:
Andrey E. Shulzhenko — Dr. Sc. (Med.), Professor, Head of the Department of Allergology No. 6, National Research Center Institute of Immunology of the Russian Federal Medical Biological Agency; 24, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0003-0268-9350
Rosalia V. Shchubelko — C. Sc. (Med.), allergologist-immunologist, Senior Researcher at the Department of Allergology No. 6, National Research Center Institute of Immunology of the Russian Federal Medical Biological Agency; 24, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0001-6993-9831
Irina N. Zuikova — C. Sc. (Med.), allergologist-immunologist, Senior Researcher at the Department of Allergology No. 6, National Research Center Institute of Immunology of the Russian Federal Medical Biological Agency; 24, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0002-9373-4681
Contact information: Irina N. Zuikova, e-mail: zuikova_i@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 16.09.2024.
Revised 09.10.2024.
Accepted 30.10.2024.
Информация с rmj.ru






