Функциональная
диспепсия в свете Римских критериев IV
пересмотра (2016 г.)
И.В. Маев, Д.Т.
Дичева, М.П. Щегланова, Д.Н. Андреев, А.В.
Заборовский
ФГБОУВО
Московский государственный
медико-стоматологический университет им. А.И.
Евдокимова Минздрава России
В обзорной статье отражены современные
представления о функциональной диспепсии (ФД),
основанные на положениях Римского консенсуса
IV пересмотра (2016 г.). Рассмотрены вопросы
дефиниции, классификации, этиологии и
патогенеза, особенностей клинической картины и
критериев диагностики ФД. Представлены
актуальные данные о фармакотерапии ФД с
позиций доказательной медицины.
Ключевые слова: функциональная
диспепсия, Римские критерии IV, диагностика,
лечение, итоприд.
Введение
Функциональные заболевания желудочно-кишечного
тракта (ЖКТ) достаточно часто встречаются в
практике любого врача-интерниста. Адекватная
диагностика и терапевтическое ведение данной
патологии порой требуют преодоления целого
ряда различных трудностей. Римские критерии IV
пересмотра, опубликованные в мае 2016 г.,
обобщили мировой опыт лечения пациентов с
функциональными заболеваниями ЖКТ. Публикация
новых рекомендаций была ожидаема и вызвала
неподдельный интерес практикующих врачей [1,
2].
Римские критерии IV пересмотра — это
согласительный консенсус, созданный в ходе
работы международной группы экспертов,
объединившей, как исследователей, так и
практикующих специалистов в области
гастроэнтерологии. В основу данного документа
положены результаты последних фундаментальных
исследований, посвященных изучению механизмов
формирования патологических симптомов, в том
числе и на животных моделях, а также данные
многочисленных клинических исследований,
изучавших факторы риска, клинические
проявления и эффективность разных
терапевтических подходов при функциональных
заболеваниях ЖКТ [1].
Активное участие психофизиологов и клинических
психотерапевтов в изучении функциональной
патологии позволило обобщить уже имевшиеся
клинические данные и сформулировать
биопсихосоциальную модель формирования этой
группы патологий (см. рисунок) [1, 3,4]. В
новых Римских критериях большое внимание было
уделено нейрогастроэнтерологии как научному
направлению, изучающему, во-первых, условия
синтеза и эффекты местных гормонов на всем
протяжении ЖКТ, а во-вторых, механизмы
регуляции звеньев центральной и периферической
нервной системы и связанную с нарушением этой
регуляции патологию [5]. В соответствии с
новой дефиницией функциональные заболевания
ЖКТ в настоящее время рассматриваются как
патологические состояния, в основе которых
лежит дисрегуляция оси «головной мозг-ЖКТ»
[3].
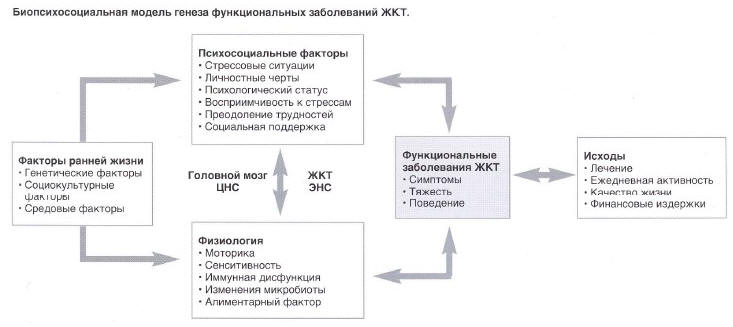
Рис.
Биопсихосоциальная модель генеза
функциональных заболеваний ЖКТ
Ось «головной мозг-ЖКТ» представляет собой
нейроанатомический субстрат, обеспечивающий
передачу информации от
эмоционально-когнитивных центров центральной
нервной системы (ЦНС) посредством
нейротрансмиттеров в структуры периферической
нервной системы, обеспечивающие
функционирование ЖКТ [3, б]. К настоящему
моменту изучены прямые связи между ЦНС и
структурами энтеральной нервной системы (ЭНС),
к которым относятся межмышечное нервное
сплетение Ауэрбаха и подслизистое — Мейсснера,
оказывающие влияние на сенсорную, моторную,
эндокринную, автономную и иммунную функции ЖКТ
[7]. В силу этого такие эмоции, как страх,
ненависть, тревога, могут оказывать влияние на
эвакуаторную функцию желудка,
перистальтическую активность кишечника, что
может индуцировать клиническую симптоматику
[8,9].
Клинические критерии и диагностика ФД
Новыми Римскими критериями предлагается
выделять легкую, умеренную и тяжелую степени
выраженности функциональных заболеваний.
Согласно статистическим данным слабовыраженные
симптомы встречаются у 40% пациентов, которые,
как правило, наблюдаются у врачей общей
практики. В силу того, что проявления
симптомов не столь значительны, они могут не
оказывать влияния на психоэмоциональное
состояние пациента. Умеренная симптоматика
выявляется примерно у 30-35% пациентов с
функциональными нарушениями ЖКТ, как правило,
именно у этих лиц симптомы приводят к снижению
социальной активности и качества жизни.
Тяжелая степень выраженности симптомов
выявляется у 20-25% больных с функциональными
заболеваниями ЖКТ, и в этих случаях пациенты
отмечают значительное снижение качества жизни,
социальной активности, ограничение
профессиональной реализации, внутрисемейные
конфликты. Подобные случаи характеризуются
рефрактерностью к терапии и требуют активного
участия тандема специалистов гастроэнтеролога,
психотерапевта и/или психиатра [1].
Отдельный раздел Римских критериев IV
пересмотра посвящен функциональной диспепсии (ФД).
Клинически по-прежнему выделяется два варианта
ФД: постпрандиальный дистресс-синдром (ПДС) и
синдром эпигастральной боли (СЭБ). К
симптомам, характерным для ФД, относят:
ощущение переполнения и раннего насыщения,
боль и жжение в эпигастрии (см. таблицу).
Данные клинические признаки должны проявляться
с достаточной интенсивностью, чтобы повлиять
на повседневную деятельность пациента, другими
словами определяться, как «беспокоящие»,
«причиняющий беспокойство» (от англ.
bothersome) [2]. Минимальные установленные
пороги частоты возникновения симптомов для ПДС
составили по меньшей мере 3 дня в неделю, а
для СЭБ — не менее 1 дня в неделю.
Диагностические
критерии ФД и ее форм, предложенные Римским
консенсусом IV пересмотра
|
ФД: диагностические критерии* 1. Один и более из: a. Беспокоящее постпрандиальное ощущение переполнения b. беспокоящее раннее насыщение c. Беспокоящая боль в эпигастрии d. Беспокоящее жжение 2. Отсутствие признаков органических заболеваний или других факторов (прием лекарственных средств), способных объяснить данные симптомы |
|
ПДС: диагностические критерии* Должен включать в себя один или оба из следующих симптомов (по меньшей мере 3 дня в неделю): 1. Беспокоящее ощущение переполнения после еды (достаточное, чтобы повлиять на обычную деятельность) 2. Беспокоящее раннее насыщение (способное прервать прием пищи, привычного размера порции). При отсутствии признаков органического, системного или метаболического заболеваний (выявляющихся при рутинных исследованиях, в том числе эндоскопии), способных объяснить симптомы Примечания |
|
СЭБ: диагностические критерии* Должен включать в себя минимум 1 из следующих симптомов, по крайней мере 1 день в неделю: 1. Беспокоящая боль в эпигастрии (достаточная, чтобы повлиять на обычную деятельность) и/или 2. Беспокоящее ощущение жжения в области эпигастрия (достаточное, чтобы повлиять на обычную деятельность). При отсутствии признаков органического, системного или метаболического заболеваний (выявляющихся при рутинных исследованиях, в том числе эндоскопии), способных объяснить симптомы Примечания • Боль может быть вызвана приемом пищи, |
| *Соответствие критериям должно иметь место при наличии симптомов в течение 3 мес с момента их появления, по крайней мере за 6 мес до установления диагноза). |
Рассматриваемые симптомы должны присутствовать
в течение последних 3 мес, при общей
продолжительности заболевания по крайней мере
6 мес [2].
Отдельное внимание экспертов было уделено
описанию смыслового значения используемых
терминов. Так, характерный для ПДС симптом
«раннего насыщения» подразумевается в том
случае, если пациент прерывает прием порции
привычного размера за счет появляющегося
гнетущего ощущения. Симптом тяжести после еды
является беспокоящим, когда наличие жалобы
сказывается на выполнении повседневной
деятельности. Аналогично боль и жжение в
эпигастральной области считаются симптомами
СЭБ при достаточной для нарушения повседневной
деятельности интенсивности. Помимо этого в
новой редакции Римских критериев IV пересмотра
сделано уточнение о том, что симптомы,
характерные для ПДС, всегда возникают после
приема пищи, тогда как при СЭБ болевой
абдоминальный синдром и чувство жжения в
эпигастрии могут как появляться после еды, так
и исчезать после приема пищи, а также
возникать натощак [1,2].
Симптом «изжоги», как и в Римских критериях
III пересмотра, не включен в определение ФД.
Данный симптом подразумевает чувство
ретростернального жжения, распространяющегося
вверх от мечевидного отростка. Функциональная
изжога вынесена в качестве самостоятельного
нарушения ЖКТ, которое, как и синдром
раздраженного кишечника (СРК), нередко
сочетается с ФД. В Римских критериях IV
пересмотра достаточное внимание уделено именно
сочетанию функциональных заболеваний различных
отделов ЖКТ, что получило название
«перекреста» функциональной патологии [1].
Рвота не относится к типичным симптомам
функциональных расстройств и должна вызвать у
интерниста определенную настороженность,
требующую более детального обследования с
целью поиска иных причин возникновения этого
симптома [10]. Нередко пациенты отмечают
облегчение состояния после дефекации или
отхождения кишечных газов, тем не менее данные
особенности не должны восприниматься как
проявления функциональной патологии верхних
отделов ЖКТ и требуют в первую очередь
исключения органической и функциональной
патологии кишечника [1].
Таким образом, ФД определяется как состояние,
существенно влияющее на обычные виды
деятельности пациента и характеризующееся
одним или несколькими из перечисленных
симптомов: постпрандиальное ощущение
переполнения, раннее насыщение, боль и жжение
в эпигастральной области, которые не находят
объяснения после рутинных клинических
исследований [2].
При консультации пациента, предъявляющего
вышеуказанные жалобы, необходимо провести
опрос для конкретизации жалоб, тщательно
собрать анамнез, внимательно осмотреть
пациента с целью выявления симптомов
«тревоги». Все перечисленное позволит очертить
круг лабораторно-инструментальных исследований
с целью исключения причины «вторичной
диспепсии» и подтвердить тем самым диагноз
собственно ФД.
Патофизиология ФД
Патофизиология ФД на данный момент не в полной
мере ясна, в силу своей многофакторности и
сложности. На данном этапе накопления научных
знаний считается, что в появлении симптомов
участвуют гастродуоденальная моторная и
сенсорная дисфункции, снижение активности
иммунной системы, а также нарушение регуляции
в системе оси «головной мозг-ЖКТ» [3,11,12].
В качестве одного из ведущих
патофизиологических механизмов ФД
исследователи рассматривают замедление
эвакуаторной функции желудка. Повторяющиеся
тонические сокращения проксимального отдела
желудка способствуют дистальному продвижению
его содержимого, а далее за счет
перистальтической активности тела органа химус
перемещается в направлении антрального отдела
[12]. Наряду с сокращениями проксимальных и
дистальных отделов желудка возникает открытие
и закрытие привратника желудка. Так
осуществляется контролируемая желудочная
эвакуация. Дисрегуляция рассматриваемого
механизма ассоциирована с замедлением
эвакуационной функции желудка, обуславливая
длительную задержку химуса и индуцируя
появление симптомов ФД [10]. Согласно ряду
исследований, данный механизм выявляется у
20-50% пациентов с ФД [13-15]. В одном из
крупнейших метаанализов, включившем 868
пациентов с симптомами диспепсии, существенное
замедление функции опорожнения желудка
выявлялось у 40% обследованных [15].
Вторым по порядку, но не по значимости,
патогенетическим механизмом ФД является
нарушение релаксационной аккомодации желудка.
Во многом работами отечественных физиологов
было продемонстрировано, что именно
проксимальный отдел желудка выполняет роль
основного резервуара для принятия пищевого
комка, в то время как в дистальном отделе
происходит его смешивание и «дробление» на
более мелкие части для дальнейшего продвижения
через пилорический канал [16]. Гармонично
скоординированная работа между дном, телом и
антральным отделом желудка крайне важна для
адекватной желудочной аккомодации и
своевременной эвакуации содержимого в
двенадцатиперстную кишку. Процесс желудочной
аккомодации состоит из расслабления
проксимального отдела, что позволяет
обеспечить резервуар для проглоченной пищи без
увеличения внутрипросветного давления [12].
При этом процесс релаксации мышечных волокон
дна желудка управляется блуждающим нервом,
т.е. требует участия ацетилхолина [17]. При
нарушении релаксационной аккомодации желудка
не происходит адекватного расслабления
проксимального отдела органа, что приводит к
быстрому поступлению пищи в антральный отдел
желудка, растяжение которого и приводит к
появлению симптомов ФД [18]. В целом нарушение
релаксационной аккомодации желудка выявляется
у примерно 40% пациентов с ФД, однако значение
этого механизма в индукции симптоматики
заболевания продолжает изучаться [11,12].
Наряду с нарушением моторной функции желудка
выраженное влияние на формирование симптомов
ФД, по всей видимости, оказывает так
называемая висцеральная гиперчувствительность
(ВГ). Под этим термином понимают состояние
нервно-мышечного аппарата желудка, связанное с
нарушением сенсорных и афферентных связей
между ЦНС и ЖКТ [6, 11]. Вероятно, в основе ВГ
лежат нарушения механизма передачи болевых
импульсов от желудка в ЦНС, такие как
увеличение частоты передаваемых сигналов от
желудка, амплификация нормального сигнала при
прохождении через спинной мозг или
амплификация сигнала в головном мозге [12].
Помимо этого определенную роль в развитии ВГ у
пациентов с ФД могут играть генетические
факторы (полиморфизмы гена GNB3 и гена TRPV1),
а также гормональные, связанные с
высвобождением кортикотропин-рилизинг-гормона
[10, 12, 19]. В ходе ряда исследований
установлено значительное снижение порога
болевой чувствительности в эпигастрии у
пациентов с ВГ при гораздо меньшем повышении
внутрижелудочного давления в сравнении со
здоровыми испытуемыми [20]. Среди пациентов,
страдающих ФД, распространенность ВГ к
растяжению желудка достигает 34-66% [20, 21].
Учитывая, что симптомы диспепсии зачастую
развиваются или усиливаются после приема пищи,
ВГ в постпрандиальный период может иметь
прямую связь с симптоматикой заболевания, в
большей степени у пациентов с ПДС.
В новых Римских критериях инфекция
Helicobacter pylori рассматривается в
качестве одной из возможных причин
возникновения ФД [2]. Явным доказательным
базисом роли инфекции Н. pylori в генезе
явлений диспепсии у ряда пациентов считаются
данные клинических исследований,
демонстрирующих небольшой, но статистически
значимый положительный эффект в купировании
симптоматики после эрадикации микроорганизма с
показателем NNT равным 14 и 8 [22-24]. В силу
этого экспертная группа нового Римского
консенсуса считает целесообразным сделать
выбор в пользу проведения эрадикационной
терапии для инфицированных Н. pylori пациентов
с диспепсией, особенно в тех случаях, когда
речь идет о СЭБ [2].
Лечение
Согласно Римским критериям IV пересмотра
терапевтическая тактика не претерпела
существенных изменений в сравнении с более
ранней редакцией рекомендаций. Помимо
медикаментозной терапии важная роль отводится
модификации образа жизни, диетическим
рекомендациям, а в случае необходимости —
коррекции психоэмоционального статуса. Всем
пациентам с ФД рекомендуется отказ от курения,
употребления алкоголя, желателен отказ от
приема нестероидных противовоспалительных
препаратов.
Согласно принципам доказательной медицины,
выделяют три фармакотерапевтических
направления лечения ФД антисекреторная
терапия, прокинетическая терапия, эрадикация
инфекции Н. pylori [25-27].
Рекомендации, предложенные Римскими критериями
IV пересмотра, подразумевают назначение
ингибиторов протонной помпы (ИПП) при СЭБ,
а препаратов, стимулирующих моторику ЖКТ (прокинетики)
— при ПДС. В случае смешанных и
недифференцированных клинических вариантов ФД
целесообразно использование комбинации
прокинетика и ИПП [2].
Метаанализ, включивший 3725 пациентов,
страдающих ФД, показал более высокую
эффективность использования ИПП в сравнении с
плацебо (40,3% против 32,7% соответственно)
[28]. Высокой эффективностью характеризуется
применение ИПП при СЭБ и в сочетании ФД с
гастроэзофагеальной рефлюксной болезнью,
значительно хуже результаты монотерапии ИПП
при ПДС [26, 29]. Отметим, что среди ИПП
зарегистрированное показание «лечение
симптомов неязвенной диспепсии» имеют только
омепразол и лансопразол [10, 30].
Эрадикационная терапия может проводиться на
фоне любых ИПП, однако предпочтительнее
использование ИПП последнего поколения —
рабепразола и эзомепразола, эффективность
которых для эрадикации Н.pylori достоверно выше [31].
Изучение кислотообразующей функции с помощью
суточной рН-метрии позволило нам сделать
вывод о том, что у большинства пациентов с СЭБ
отмечается умеренная гиперацидность, в то
время как у пациентов с ПДС чаще выявляется
нормацидность. Знание патофизиологических
механизмов, лежащих в основе формирования ФД,
позволяет более глубоко проанализировать
симптомы конкретного пациента с целью
построения индивидуальной терапевтической
модели. Как известно, уровень кислотности
желудочного сока влияет на эвакуаторную
активность органа, замедляя моторику и
усиливая спазм пилорического сфинктера. Таким
образом, при СЭБ важно выявлять наличие
постпрандиального вздутия в области эпигастрия,
отрыжки и/или тошноты как критериев
необходимости дополнительного включения в
терапию прокинетиков, что позволяет добиться
более быстрого и выраженного терапевтического
эффекта.
Среди препаратов с прокинетическим действием
широкое распространение получили антагонисты
дофаминовых D2-рецепторов (метоклопрамид,
домперидон), а в настоящее время и прокинетики с двойным комбинированным
механизмом действия (итоприда гидрохлорид).
Эффективность данной группы препаратов у
пациентов с ФД подтверждена целым рядом
исследований. В частности, в метаанализе из
Кохрановской библиотеки, обобщившем результаты
24 исследований (3178 пациентов),
эффективность прокинетиков в лечении ФД
составила 57%, что достоверно превышало
таковую при приеме плацебо [32].
Систематизация данных клинических исследований
демонстрирует, что при наличии признаков ПДС
прокинетики являются препаратами выбора [2].
Однако необходимо отметить, что данные
результаты получены в ходе исследований
цизаприда (с 2000 г. запрещен в РФ) и
домперидона. Однако в настоящее время
применение антагонистов D2-рецепторов
значительно ограничено в силу того, что
домперидон имеет электрофизиологические
свойства аналогичные III классу
антиаритмических средств, а следовательно,
может продлевать интервал QT и тем самым
предрасполагать к желудочковой аритмии. В
наиболее крупном популяционном исследовании
дизайна случай-контроль С. van Noord и соавт.
(2010 г.) был продемонстрирован высокий риск
внезапной сердечно-сосудистой смерти у лиц,
принимающих домперидон (ОШ 3,72; 95% ДИ
1,72-8,08) [33]. Вследствие этого назначение
домперидона пациентам, страдающим ФД, не
рекомендовано.
В качестве основного средства из группы
прокинетиков в арсенале врача для борьбы с ФД
Римскими критериями IV пересмотра предложен
итоприда гидрохлорид (Итомед, PRO.MED.CS Praha
a.s.). Препарат является антагонистом
дофаминовых D2-рецепторов и
ингибитором ацетилхолинэстеразы. За счет этого
итоприда гидрохлорид оказывает двойное
действие: активизирует высвобождение
ацетилхолина, в то же время препятствуя его
деградации, что обусловливает его высокую
активность в усилении пропульсивной моторики
желудка и ускорении его опорожнения, а также
оказывает выраженное противорвотное действие.
Рассмотренные выше особенности итоприда
гидрохлорида позволяют назвать его препаратом
выбора для лечения ФД, что подтверждено
многочисленными многоцентровыми
исследованиями, посвященными оценке
эффективности данного препарата [34, 35].
Недавний метаанализ, включивший в себя 9
контролируемых исследований (2620 пациентов с
ФД), подтвердил эффективность итоприда у
пациентов с преобладанием ПДС с низким риском
развития побочных явлений [36]. Эффективность
применения итоприда при терапии ФД была
показана и в России. Исследователи обнаружили
полное исчезновение жалоб у 46,6% больных ФД и
значительное уменьшение их выраженности у
47,3% пациентов. При этом итоприд, оказывал
хороший эффект и в отношении других
функциональных гастроэнтерологических жалоб
(тошноты, метеоризма, изжоги и пр.) [37].
Согласно нашему опыту достаточно часто
встречается перекрест ПДС с функциональным
метеоризмом. В случае крайне выраженного
вздутия живота прокинетики лучше сочетать с
пеногасителями (симетикон).
Как известно, избыточное газообразование и
повышенное давление в нижележащих отделах ЖКТ
приводят к повышению внутрипросветного
давления в тонкой кишке и, как следствие, к
нарушению эвакуации из верхних отделов ЖКТ.
Усиление терапии ПДС пеногасителями приводит к
более быстрому эффекту нормализации моторной
активности ЖКТ.
Длительность назначения прокинетиков в
рутинной клинической практике колеблется от 4
до 8 нед, что делает крайне актуальным вопрос
о профиле безопасности при длительном
применении. Итоприда гидрохлорид не проникает
через гематоэнцефалический барьер и не
оказывает влияния на продолжительность
интервала QT, Современные схемы лечения ФД
часто предполагают комбинированную терапию
прокинетиками и ИПП. Итоприда гидрохлорид
метаболизируется флавинзависимой
монооксигеназой и не взаимодействует с
лекарственными средствами, в частности ИПП,
метаболизирующимися ферментами системы
цитохрома Р450. Это также чрезвычайно важно у
пациентов, получающих терапию по поводу
сопутствующих заболеваний [10]. Собственный
опыт работы с препаратом Итомед позволяет
сделать вывод о его высокой терапевтической
активности и хорошей безопасности даже при
длительном применении.
Заключение
Таким образом, ФД является часто встречающимся
заболеванием, требующим адекватной
медикаментозной терапии в силу значительного
снижения качества жизни пациентов.
Терапевтические подходы в лечении СЭБ и ПДС
отличаются. В случае наличия ПДС предпочтение
отдается монотерапии итопридом гидрохлоридом,
а в случае СЭБ чаще приходится прибегать к
комплексной терапии ИПП и прокинетиками, в
силу моторных нарушений, обусловленных
гиперацид-ностью. Высокая терапевтическая
эффективность итоприда гидрохлорида
подтверждена обширной доказательной базой.
Необходимость применения прокинетиков в
течение 4-8 нед в лечении ФД заставляет
считать итоприда гидрохлорид препаратом выбора
в силу высокого профиля безопасности.
Литература/References
- Drossman DA. Functional Gastrointestinal
Disorders: History, Pathophysiology,
Clinical Features and Rome IV.
Gastroentcrology 2016; 150:1262-79. - Stanghellini V. Chan FK, Hasler WL et al
Gastroduodenal Disorders. GastroenteroIogy
20l6; 150 (6): 1380-92. -
Drossman DA, Hasler WL. Rome IV-Functional
GI Disorders: Disorders of Gut-Brain
Interaction. Gastroenterology 2016; 150 (6):
1257-61. - Levy RL, Olden KW, Naliboff BD et al.
Psychosocial aspects of the functional
gastrointestinal disorders. Gastroenterology
2006; 130:1447-58. - Pasricha PJ. Neurogastroenterology: a
great career choice for aspiring
gastroenterologists thinking about thefumre.
Gastroenterology 2011; 140:1126-8. - Sleisenger and Fordtran’s
Gastrointestinaland Liver Disease:
Pathophysiology, Diagnosis, Management.
Edited by Mark Feldman, Lawrence S Friedman,
Laurence J Brandt. 10th cd. 2015. - Jones MP, Dilley JB, Drossman D, et al.
Brain-gut connections in functional GI
disorders: anatomic and physiologic
relationships. Neurogastroenterol Motil
2006; 18:91-103. - Gaman A, Kuo B. Neuromodulatory
processes of thebrain-gut axis.
Neuromodulation 2008; 11:249-59. - Mittal R, Debs LH, Patel AP et al
Neurotransmitters: The Critical Modulators
Regulating Gut-Brain Axis. J Cell Physiol
2016. DOI: 10.1002/jcp.25518. [Epub ahead of
print] -
Маев И.В., Кучерявый Ю.А., Андреев Д.Н.
Функциональная диспепсия: эпидемиология,
классификация, этиопатогенез, диагностика и
лечение. М., 2015. / Maev I.V., Kucheriavyi
Iu.A., Andreev D.N. Funktsional’naia
dispepsiia: epidemiologiia, klassifikatsiia,
etiopatogenez, diagnostika i lechenie. M.,
2015. [in Russian] - Vanned H, Farre R. Changes in
gastrointestinal tract function and
structure in functional dyspepsia. Nat Rev
Gastroenterol Hepatol 2013; 10:142-9. - Маев И.В., Андреев Д.Н., Кучерявый Ю.А.
и др. Современные представления о
патофизиологических основах синдрома
функциональной диспепсии. Российский журнал
гастроэнтерологии, гепатологии,
колопроктологии. 2015; 4: 15-22. / Maev
I.V., Andreev D.N., Kucheriavyi Iu.A. i dr.
Sovremennye predstavleniia о
patofiziologicheskikh osnovakh sindroma
funktsionai’noi dispepsii. Rossiiskii
zhurnal gastroenterologii, gepatologii,
koloproktologii. 2015; 4:15-22. [in Russian] - Rahim MK, Durr-e-Sabih, Mateen A et al.
Studies of gastric emptying time in patients
with non-ulcer dyspepsia. Nucl Med Commun
2007; 28:852-8. - Maes BD, Ghoos YF, Hide ML Rutgeerts PJ.
Gastric emptying rate of solids in patients
with nonulcer dyspepsia. Dig Dis Sci 1997;
42 (6): 1158-62. - Quartero АО, de Wit NJ, Lodder AC et al.
Disturbed solid-phase gastric emptying in
functional dyspepsia: a meta-analysis. Dig
Dis Sci 1998; 43 (9): 2028-33- - Маев И.В., Самсонов А.А., Андреев Д.Н.
Болезни желудка. М.: ГЭОТАР-Медиа, 2015. /
Maev I.V, Samsonov A.A, Andreev D.N. Bolezni
zheludka. M.: GEOTAR-Media, 2015. [in
Russian] - Kindt S, Tack J. Impaired gastric
accommodation and its role in dyspepsia. Gut
2006; 55 (12): 1685-91. - Piessevaux H, Tack J, Walrand S et al.
Intragastric distribution of a standardized
meal in health and functional dyspepsia:
correlation with specific symptoms.
Neurogastroenterol Motil 2003; 15:447-55. - Vandenberghe J, Vos R, Persoons P et al.
Dyspeptic patients with visceral
hypersensitivity: sensitisation of pain
specific or multimodal pathways? Gut 2005;
54:914-9. - Tack J, Caenepeel P, Fischler В et al.
Symptoms associated with hypersensitivity to
gastric distention in functional dyspepsia.
Gastroenterology 2001; 121 (3): 526-35. - Mertz H, Fullerton S, Naliboff B, Mayer
EA. Symptoms and visceral perception in
severe functional and organic dyspepsia. Gut
1998; 42 (6): 814-22. - Маев И.В., Самсонов А.А., Андреев Д.Н.
Инфекция Helicobacter pylori. M.:
ГЭОТАР-Медиа, 2016. / Maev I.V., Samsonov
A.A., Andreev D.N. Infektsiia Helicobacter
pylori. M.: GEOTAR-Media, 2016. [in Russian] - Moayyedi P, Soo S, Decks J et al.
Eradication of Helicobacter pylori fos
non-ulcer dyspepsia. Cochrane Database Syst
Rev 2005; Is. 2: CD002096. - Zhao B, Zhao J, Cheng WF et al. Efficacy
of Helicobacter pylori eradication therapy
on functional dyspepsia: a meta-analysis of
randomized controlled studies with 12-month
follow-up. J Clin Gastroenterol 2014;
48:241-7. - Маев И.В., Андреев Д.Н., Дичева Д.Т. и
др. Функциональная диспепсия: современное
состояние проблемы. Мед. вест. МВД. 2013; 4:
38-45. / Maev I.V., Andreev D.N., Dicheva
D.T. i dr. Funktsional’naia dispepsiia:
sovremennoe sostoianie problemy Med. vest.
MVD. 2013; 4: 38-45. [in Russian] - Маев И.В., Самсонов А.А., Андреев Д.Н.,
Кочетов С.А. Дифференцированная тактика
лечения синдрома функциональной диспепсии.
Мед. совет. 2012; 9:13-20. / Maev I.V.,
Samsonov A.A., Andreev D.N., Kochetov S.A.
Differentsirovannaia taktika lecheniia
sindroma funktsionai’noi dispepsii. Med.
sovet. 2012; 9:13-20. [in Russian] - Руководство по внутренней медицине. Под
ред. Г.П. Арутюнова, А.И. Мартынова, А.А.
Спасского. М, 2015. / Rukovodstvo po
vnutrennei meditsine. Pod red. G.P.
Arutiunova, A.L. Martynova, A.A. Spasskogo.
M, 2015. [in Russian] - Wang WH, Huang JQ, Zheng GF et al.
Effects of proton-pump inhibitors on
functional dyspepsia: a meta-analysis of
randomized placebo-controlled trials. Clin
Gastroenterol Hepatol 2007; 5 (2): 178-85. - Маев И.В., Самсонов А.А., Андреев Д.Н.
Клиническое значение синдрома «перекреста»
функциональной диспепсии и
гастроэзофагеальной рефлюксной болезни.
Клин, перспективы гастроэнтерологии,
гепатологии. 2013; 5: 17-22. / Maev I.V.,
Samsonov A.A., Andreev D.N. Klinicheskoe
znachenie sindroma «perekresta»
funktsionai’noi dispepsii i
gastroezofageal’noi refliuksnoi bolezni.
Klin. perspektivy gastroenterologii,
gepatologii. 2013; 5:17-22. [in Russian] - Кучерявый Ю.А., Андреев Д.Н.
Функциональная диспепсия; современный
алгоритм терапии и реалии российской
практики. Consilium Medicum,
Гастроэнтерология. 2014; 1: 27-32. /
Kucheriavyi Iu.A., Andreev D.N.
Funktsional’naia dispepsiia: sovremennyi
algoritm terapii i realii rossiiskoi
praktiki. Consilium Medicum.
Gastroenterology (Suppl.). 2014:1: 27-32. [in
Russian] - McNicholl AG, Linares PM, Nyssen OP et
al. Meta-analysis: esomeprazole or
rabeprazole vs. first-generation pump
inhibitors in the treatment of Helicobacter
pylori infection. Alimentary Pharmacology
and Therapeutics 2012; 36:414-25. - Moayyedi P, Soo S, Deeks J et al.
Pharmacological interventions for non-ulcer
dyspepsia. Cochrane Database Syst Rev 2006;
4: CD001960. - Van Noord C, Dieleman JP, van Herpen G
et al. Domperidone and ventricular
arrhythmia or sudden cardiac death: a
population-based case-control study in the
Netherlands. Drug Saf 2010; 33 (11):
1003-14. - Holtmann G, Talley NJ, Liebregts T et al.
A Placebo-Controlled Trial of Itopride in
Functional Dyspepsia. NEJM 2006; 23 (354):
832-40. - Sun J, Yuan YZ, Holtmann G. Itopride in
the treatment of functional dyspepsia in
Chinese patients: a prospective, multicentre,
post-marketing observational study. din Drug
Investig 2011; 31 (12): 865-75. - Huang X, Lv B, Zhang S et al. Itopride
therapy for functional dyspepsia: a
meta-analysis. World J Gastroenterol 2012;
18 (48): 7371-7. - Ивашкин В.Т., Шептулин А.А., Трухманов
А.С. Эффективность применения ганатона (итоприда
гидрохлорида) в лечении больных
функциональной диспепсией. Фарматека. 2009;
13:50-4. / Ivashkin V.T., Sheptulin A.A.,
Trukhmanov A.S. Effektivnost’ primeneniia
ganatona (itoprida gidrokhlorida) v lechenii
bol’nykh funktsional’noi dispepsici.
Farmateka. 2009; 13: 50-4. [in Russian]
Статья опубликована на сайте
http://www.gastroscan.ru
материал MedLinks.ru