Содержание статьи
Фармакоэкономическое обоснование применения телапревира в комбинированной противовирусной терапии у больных хроническим гепатитом С
Н. А. Якушечкина*
Н. Д. Ющук**, доктор медицинских наук, профессор, академик РАМН
О. О. Знойко**, доктор медицинских наук, профессор
К. Р. Дудина**, доктор медицинских наук
Н. Х. Сафиуллина**, кандидат медицинских наук
П. А. Белый**, кандидат медицинских наук
Е. А. Луговских**
*ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ,
**ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Гепатит С (ГС) — вирусный гепатит с парентеральным механизмом передачи возбудителя, вируса гепатита С (ВГС), характеризующийся высокой (50–80% случаев) частотой формирования хронических форм болезни и риском последующего развития у части больных фибротических изменений печеночной ткани вплоть до цирроза печени (ЦП), а также гепатоцеллюлярной карциномы (ГЦК) [1, 30]. Через 10 лет от момента инфицирования ЦП формируется у 5–10% больных хроническим гепатитом С (ХГС), а через 20–30 лет — уже у 20–25% пациентов. Риск развития ГЦК у пациентов с ВГС-инфекцией в 17 раз выше, чем в общей популяции, и через 20 лет с момента инфицирования ГЦК регистрируется у 4% больных ХГС [2–4].
ГС представляет собой значимую медико-социальную проблему во многих странах мира, в том числе и в нашей стране, где за весь период официальной регистрации больных ГС в РФ выявлено суммарно более 500 тыс. больных ХГС и 1,8 млн носителей ВГС [28]. Увеличивающиеся темпы распространения инфекции среди населения, преимущественно молодого возраста (до 30 лет) [29], накопление в популяции числа больных с длительным сроком инфицирования (более 10–20 лет) и растущие риски развития у них неблагоприятных исходов, ограниченный доступ к противовирусной терапии (ПВТ) и ее недостаточная эффективность, особенно при первом генотипе ГС, приводят к росту инвалидизации больных в трудоспособном возрасте вследствие неблагоприятных исходов ХГС — ЦП и ГЦК. Это сопряжено с высокими медицинскими и социальными затратами и наносит значительный ущерб экономике страны.
Так, данные исследования экономического бремени ГС в РФ показывают, что его величина в 2010 г. по минимальным оценкам составила более 48 млрд руб. Только на лечение заболеваний в исходе ХГС и связанные с ними выплаты по инвалидности государство затратило более 22 млрд руб. [5]. Ежегодные прямые медицинские затраты в расчете на больного существенно возрастают по мере прогрессирования заболевания — от 27 263 руб. на пациента с фиброзом 2–3 степени по классификации METAVIR до 210 292 руб. на пациента с декомпенсированным ЦП. Помимо медицинских затрат, государство несет значительные потери по причине инвалидизации больных ЦП и ГЦК в исходе ХГС (выплаты социальных пособий по инвалидности) и недополученного валового внутреннего продукта (ВВП), которые в 2010 г. составили в этой группе больных более 480 тыс. руб. на 1 человека. При сохранении темпов роста заболеваемости ХГС затраты государства, связанные с неблагоприятными исходами, будут только увеличиваться.
В условиях отсутствия вакцины против ГС особенную важность приобретает повышение охвата больных ХГС существующими методами ПВТ в рамках программ государственного лекарственного обеспечения и внедрение в клиническую практику высокоэффективных препаратов новых классов, таких как ингибиторы протеазы. Своевременно начатое успешное лечение ХГС является одним из главных путей сокращения масштабов проблемы ГС и его последствий в РФ, так как позволяет остановить дальнейшее прогрессирование заболевания в ЦП и ГЦК и предотвратить дальнейшее распространение вируса.
Цель современной терапии ГС — эрадикация ВГС из организма человека. Принятым критерием эффективности лечения ГС является достижение устойчивого вирусологического ответа (УВО), то есть отсутствия определяемой современными средствами РНК ВГС в сыворотке крови пациента в течение 6 месяцев после полного окончания курса ПВТ [6]. У пациентов с формированием УВО фиброз печени не прогрессирует, при наличии у них ЦП не развивается хроническая печеночная недостаточность, значительно снижается риск развития ГЦК [7–15].
С учетом результатов исследования бремени ГС в РФ и данных о возможности изменения естественного течения ГС путем прерывания патологической цепи перехода от гепатита к тяжелому фиброзу, а затем с более высокой скоростью к ЦП [16–19], больные с выраженным фиброзом печени (F3 по METAVIR) и компенсированным ЦП (класс А по классификации Чайлда–Пью) являются целевыми группами для применения современной тройной схемы ПВТ. Их излечение предупредит дальнейшее прогрессирование заболевания и развитие смертельных осложнений. Это в краткосрочной перспективе позволит предотвратить значительные ежегодные затраты системы здравоохранения на пациентов с компенсированным ЦП, декомпенсированным ЦП и ГЦК.
До недавнего времени возможности успешного лечения этой группы больных стандартной двойной схемой терапии ХГС с применением пегилированных интерферонов (Пег-ИФН) и рибавирина были ограничены ее малой эффективностью, так как стадия фиброза является независимым предиктором уменьшения частоты достижения УВО. По данным одного из самых крупных исследований применения пегилированных интерферонов IDEAL эффективность этиотропной терапии у больных с выраженным фиброзом печени и компенсированным ЦП, инфицированных генотипом 1 ВГС, составляет всего 20,7% для комбинации Пег-ИФН-α-2b с рибавирином и 23,6% для комбинации Пег-ИФН-α-2а с рибавирином в стандартных дозах [20]. Общая эффективность ПВТ у всех групп больных ХГС составила около 40%. Необходимо учитывать, что доминирующим в РФ является именно 1-й генотип ВГС, который особенно трудно поддается противовирусной терапии [28].
С появлением в 2012 г. на российском фармацевтическом рынке препарата телапревир новой фармакологической группы (ингибиторы протеазы ВГС) возможности терапии для больных ХГС, инфицированных генотипом 1 ВГС, существенно расширились. По данным регистрационных исследований эффективность лечения телапревиром в сочетании с пегилированными интерферонами и рибавирином у больных ХГС 1-го генотипа возрастает до 62–95% [21–22].
В развитых странах мира комбинация пегилированного интерферона и рибавирина с ингибиторами протеазы ВГС является стандартом лечения больных ХГС, инфицированных генотипом 1 ВГС, с выраженным фиброзом печени и ЦП в стадии компенсации [23–25]. В России, учитывая ограниченность выделяемых на здравоохранение ресурсов, для ранее нелеченных пациентов этой группы можно рассматривать, по меньшей мере, два альтернативных пути терапии: пациенты получают тройную терапию (телапревир в комбинации с пегилированными интерферонами и рибавирином) — одноступенчатая схема, либо они сначала получают двойную терапию пегилированными интерферонами и рибавирином, а затем пациенты с неудачей лечения (больные с рецидивом или полным или частичным отсутствием ответа на лечение) получают тройную терапию — двухступенчатая схема.
Целью настоящего исследования была фармакоэкономическая оценка применения телапревира в различных схемах терапии больных ХГС, инфицированных генотипом 1 ВГС, с выраженным фиброзом печени (F3 по METAVIR) или циррозом печени в стадии компенсации (класс А по Чайлду–Пью), ранее не получавших ПВТ.
Материалы и методы исследования
Одноступенчатая схема терапии
Данная стратегия подразумевает, что все больные выбранной целевой группы получают телапревир в комбинации с пегилированным интерфероном и рибавирином в стандартных дозах в первой линии терапии. Для оценки затрат использовались показатели эффективности данной схемы по результатам исследования ILLUMINATE [22]. Выбор исследования определяется участием в нем большого количества пациентов целевой группы и возможностью точно описать эффективность и продолжительность терапии для различных ее подгрупп. В исследование было включено 149 больных — 88 пациентов с фиброзом печени третьей стадии (F3 по METAVIR) и 61 с ЦП класса А по Чайлду–Пью. При описании параметров эффективности учитывались все пациенты, получившие хотя бы одну дозу лекарственных препаратов в исследовании, что объективно приближает эффективность препаратов к реальной практике. Все пациенты вначале получали тройную терапию указанными препаратами в стандартных дозах в течение 12 недель. На 20-й неделе пациенты с продленным быстрым вирусологическим ответом (п-БВО), что означало отсутствие определяемой РНК ВГС на 4-й и 12-й неделях терапии, были рандомизированы на две группы: с продолжительностью дальнейшей терапии пегилированными интерферонами и рибавирином в течение 4 или 28 недель. Пациенты, не достигшие п-БВО, получали двойную терапию еще 28 недель. Таким образом, общая длительность терапии составляла 24 недели у достигших п-БВО пациентов или 48 недель — у не достигших п-БВО. Из 149 человек 36 завершили исследование ранее 20 недель, но при оценке эффективности эти больные отнесены к группе не достигших п-БВО, то есть были включены в оценку общей эффективности. Распределение пациентов в исследовании по подгруппам отражено в табл. 1.
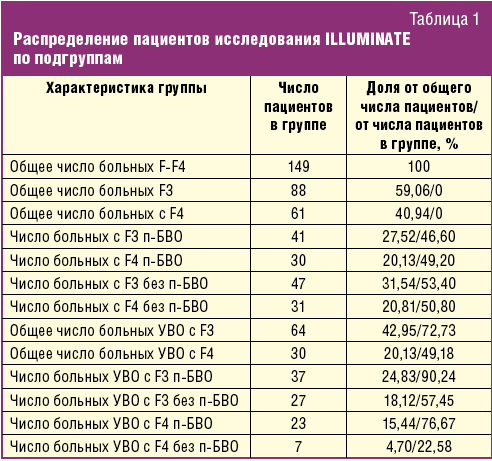
В исследовании было показано, что эффективность терапии больных с выраженным фиброзом (F3) с п-БВО не имела статистически значимых отличий в группах с общей продолжительностью лечения 24 недели или 48 недель и составила 95% и 86% соответственно. Как видно из табл. 1, доля пациентов с F3, достигших п-БВО, составила 27,5% от общего числа пациентов. В соответствии с выводами исследования эта доля может получать терапию продолжительностью 24 недели без ущерба для ее эффективности — 12 недель тройную и далее 12 недель — двойную терапию. Для расчетов использовалась эффективность терапии у данной группы 95%, что соответствует значению эффективности в исследовании ILLUMINATE при продолжительности терапии 24 недели.
В то же время в исследовании было показано, что больные с ЦП класса А вне зависимости от достижения п-БВО должны получать терапию суммарной продолжительностью 48 недель, так как в исследовании эти больные при продолжительности лечения 24 недели достигли УВО в 67% случаев, а при продолжительности лечения 48 недель — в 92%. Далее при расчетах для этой группы использовалось значение эффективности — 92%.
Из табл. 1 видно, что среди больных, не достигших п-БВО, эффективность по критерию достижения УВО составила 57,45% для пациентов с F3 и 22,58% — для пациентов с ЦП класса А. Общая продолжительность лечения у этих двух подгрупп больных составляла 48 недель.
Общая эффективность по критерию достижения УВО для всех пациентов для одноступенчатой схемы рассчитывается по формуле:
((эффективность для пациентов F3 с п-БВО × число пациентов F3 с п-БВО) +
(эффективность для пациентов F3 без п-БВО × число пациентов F3 без п-БВО) +
(эффективность для пациентов ЦП класса А с п-БВО × число пациентов ЦП класса А с п-БВО) +
(эффективность для пациентов ЦП класса А без п-БВО × число пациентов ЦП класса А без п-БВО))/общее число пациентов в исследовании =
(0,95 × 41 + 0,5745 × 47 + 0,92 × 30 + 0,2258 × 31)/149 = 0,672
Таким образом, для дальнейших расчетов эффективность одноступенчатой схемы терапии принималась равной 67,2%, доля больных с суммарной продолжительностью терапии 24 недели — 27,5% (пациенты с F3 и п-БВО), 48 недель — 72,5%.
Двухступенчатая схема терапии
Данная стратегия подразумевает, что больные сначала получают терапию пегилированным интерфероном и рибавирином, а затем все пациенты с неудачной терапией (больные с рецидивом, а также различные группы пациентов, не достигших УВО) получают тройную терапию. Параметры эффективности первой линии терапии основаны на данных исследования IDEAL, а второй линии — на данных исследования REALIZE [20, 26].
Целью исследования IDEAL было оценить эффективность двух пегилированных интерферонов Пег-ИФН-α-2b и Пег-ИФН-α-2а в стандартных дозах и низких дозах Пег-ИФН-α-2b в комбинации с рибавирином у ранее нелеченных пациентов с ВГС 1-го генотипа. В данной работе использованы выборочные результаты исследования для группы пациентов с фиброзом печени F3 и ЦП класса А по Чайлду–Пью (n = 221), получавших указанные комбинации препаратов в стандартных дозах. Длительность терапии составляла 48 недель. Эффективность по критерию достижения УВО составила 20,7% для комбинации Пег-ИФН-α-2b с рибавирином и 23,6% для комбинации Пег-ИФН-α-2а с рибавирином в стандартных дозах. В группах Пег-ИФН-α-2b и Пег-ИФН-α-2а было 111 и 110 пациентов соответственно, и средняя эффективность для всех больных составила 22,17%. В исследовании нет данных о частоте рецидивов в группе больных с фиброзом печени F3 и ЦП, поэтому в дальнейшем она будет приниматься равной общей частоте рецидивов в исследовании для групп со стандартными дозами — 27,84%.
Таким образом, по причине неэффективности первой линии терапии на вторую линию перейдет 77,83% пациентов, а доля больных с рецидивом среди них составит 35,8%.
Целью исследования REALIZE была оценка эффективности применения тройной терапии телапревира с пегилированными интерферонами и рибавирином у различных групп больных ХГС, инфицированных генотипом 1 ВГС, с предшествующим неудачным лечением двойной терапией. В данной работе использованы выборочные результаты исследования для группы пациентов с фиброзом печени F3 и ЦП класса А по Чайлду–Пью. При этом также, как и для исследования IDEAL, используются данные эффективности по объединенной группе. Для больных с предыдущим рецидивом она составила по критерию достижения УВО 84,4%, для всех остальных больных — 35,3%. Продолжительность курса терапии для всех больных составляла 48 недель. Общая эффективность выбранной группы пациентов с учетом их распределения по исследованию IDEAL и эффективностью у данных групп по исследованию REALIZE рассчитывалась следующим образом:
(доля больных с рецидивом в IDEAL/общая доля не ответивших в IDEAL) × эффективность для больных с рецидивом в REALIZE +
(1 – (доля больных с рецидивом в IDEAL/общая доля не ответивших в IDEAL)) × эффективность для больных с нулевым и частичным ответом в REALIZE =
(0,278/0,7783) × 84,4% + (1 – (0,278/0,7783)) × 35,3% = 52,9%
Таким образом, эффективность тройной терапии выбранной группы пациентов с фиброзом печени F3 и ЦП класса А по Чайлду–Пью, неудачно лечившихся в исследовании IDEAL, для целей настоящего исследования принималась равной 52,9%.
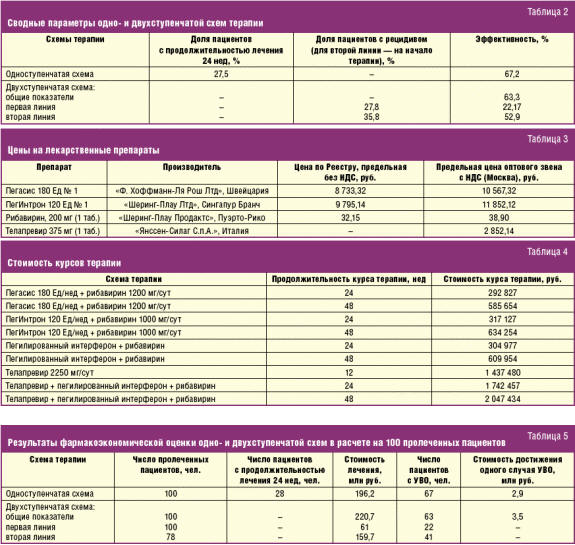
В табл. 2 суммированы параметры одно- и двухступенчатой схем терапии, которые использовались при проведении фармакоэкономического анализа.
При проведении фармакоэкономического анализа использован метод «затраты/эффективность» [27]. При расчете затрат учитывались только прямые медицинские затраты на ПВТ. В качестве параметра эффективности использовалось количество пациентов, достигших УВО. Рассчитаны значения затрат на достижение УВО в расчете на 1 пациента, а также коэффициент приращения затрат по формуле:
(затраты 1 — затраты 2)/
(эффективность 1 — эффективность 2),
где затраты 1, 2 — затраты на каждую стратегию терапии, эффективность 1, 2 — эффективности каждой стратегии терапии.
Все расчеты выполнены в ценах 2013 г., для наглядности представления результатов анализ проводился в расчете на 100 человек в каждой из сравниваемых групп.
При расчетах использованы цены препаратов по данным Государственного реестра предельных отпускных цен по состоянию на 27.03.2013 с учетом НДС (10%) и предельной оптовой надбавки по г. Москва (10%). Цена препарата телапревир рассчитана на основании прайс-листа компании-производителя и предельной оптовой надбавки по г. Москва с учетом НДС. При определении суточных и недельных доз пегилированных интерферонов и рибавирина расчеты велись из среднего веса пациента 80 кг и учитывали российские рекомендации — доза ПегИнтрона определяется из расчета 1,5 мг на 1 кг массы тела/нед. Доза рибавирина также зависит от массы тела: менее 65 кг — 800 мг/сут, 65–85 кг — 1000 мг/сут, 86–105 кг — 1200 мг/сут, более 105 кг — 1400 мг/сут. Доза Пегасиса является фиксированной — 180 мкг/нед. При этом доза рибавирина составляет 1000 мг/сут для пациентов с массой тела до 75 кг и 1200 мг/сут при ее величине более 75 кг [30].
В табл. 3 представлены цены на лекарственные препараты. Для пегилированных интерферонов выбраны формы выпуска в соответствии с дозами по российским рекомендациям выбранному весу больных. Пегилированные интерфероны представлены на российском рынке только оригинальными препаратами, что определило однозначность представленных производителей. Препараты рибавирина в Государственном реестре цен представлены четырьмя фирмами-производителями во множестве форм выпуска. Цены в расчете на таблетку 200 мг варьируются в широком диапазоне от 9,9 руб. до 82 руб. без НДС. В исследовании используется цена препарата Ребетол («Шеринг-Плау Продактс», Пуэрто-Рико).
В табл. 4 представлены данные о стоимости курсов изучаемых препаратов в зависимости от продолжительности и схемы лечения.
В табл. 4 приведены стоимости курсов терапии. При расчетах делалось допущение, что доли схем с Пегасисом и ПегИнтроном на рынке одинаковы и использовалась средняя стоимость двух схем.
Результаты исследования
В табл. 5 представлены результаты фармакоэкономической оценки одно- и двухступенчатой схем терапии больных ГС с выраженным фиброзом печени и компенсированным ЦП, исходя из расчета, что в каждой из сравниваемых групп начинает лечение 100 пациентов.
Результаты фармакоэкономического анализа убедительно свидетельствуют, что у ранее не получавших ПВТ больных ХГС генотипа 1 с фиброзом печени F3 и ЦП класса А по Чайлду–Пью применение одноступенчатой схемы терапии в виде комбинации телапревира, пегилированных интерферонов и рибавирина в стандартных дозировках экономически более выгодно по сравнению с применением двухступенчатого подхода, в котором пациенты сначала получают комбинированную терапию пегилированными интерферонами и рибавирином, а затем, в случае недостижения УВО, получают тройную терапию с добавлением к указанной комбинации телапревира. Важно отметить, что преимущества одноступенчатого подхода выражаются не только в меньшей стоимости достижения одного случая УВО — 2,9 млн руб. против 3,5 млн, но и в меньшей суммарной стоимости терапии в расчете на выбранную популяцию пациентов — 196,2 млн руб. против 220,7 млн, что особенно актуально в условиях ограниченности ресурсов системы здравоохранения.
При более высокой эффективности одноступенчатой схемы терапии данный факт подчеркивается отрицательным значением коэффициента приращения стоимости эффекта (–6,13 млн руб./дополнительный случай УВО).
При этом необходимо отметить, что одноступенчатая схема терапии позволит сократить продолжительность лечения до 24 недель почти у трети пациентов, тогда как двухступенчатый подход потребует терапии общей длительностью почти 2 года для более чем 2/3 пациентов, что не только увеличивает затраты на саму терапию, но и на амбулаторные визиты, мониторинг эффективности терапии и, что особенно важно, негативно влияет на приверженность больных к получаемой терапии. Значительная длительность терапии и связанное с этим увеличение вероятности развития побочных эффектов лечения может снижать и без того невысокую эффективность двухступенчатого подхода.
Заключение
У больных ХГС, инфицированных генотипом 1 ВГС, ранее не получавших ПВТ, с выраженным фиброзом печени и компенсированным ЦП применение одноступенчатой схемы терапии в виде комбинации телапревира, пегилированных интерферонов и рибавирина в стандартных дозировках является клинически и экономически более выгодной стратегией по сравнению с двухступенчатым подходом, при котором терапия начинается с применения комбинации пегилированных интерферонов и рибавирина, а при ее неэффективности продолжается с применением тройной терапии уже в рамках повторного курса лечения. Одноступенчатая схема позволяет вылечить дополнительно 4-х человек и сберечь почти 25 млн руб. при расчете на курс лечения для 100 пациентов и должна рассматриваться как терапия выбора у указанной категории больных. Более того, у вылеченных пациентов удается остановить прогрессирование патологического процесса в печени, что в краткосрочной перспективе позволит предотвратить ежегодные затраты системы здравоохранения на пациентов с декомпенсированным ЦП и ГЦК в размере до 210 тыс. руб. на пациента, а также ежегодные потери ВВП за счет снижения инвалидности и преждевременной смертности на сумму до 400 тыс. руб. на пациента [5].
Часть данного исследования выполнена в рамках реализации Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009–2013 г. (приложение № 2.2 к Федеральной целевой программе «Научные и научно-педагогические кадры инновационной России» на 2009–2013 гг., утвержденной Постановлением Правительства Российской Федерации от 28 июля 2008 г. № 568), соглашение № 8288 от 10.08.2012 гг.
Литература
- Протокол диагностики и лечения больных вирусными гепатитами В и С // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2010. № 6. С. 4–60.
- Donato F., Boffetta P., Puoti M. (1998) A meta-analysis of epidemiological studies on the combined effect of hepatitis B and C virus infections in causing hepatocellular carcinoma. // Int J Cancer. 1998, 75 (3): 347–354.
- Coverdale S. A., Khan M. H., Byth K., Lin R., Weltman M. et al. (2004) Effects of interferon treatment response on liver complications of chronic hepatitis C: 9-year follow-up study. // Am J Gastroenterol. 2004, 99 (4): 636–644.
- Zein N. N. (2003) The epidemiology and natural history of hepatitis C virus infection. // Cleve Clin J Med. 2003, 70, Suppl 4, S2-S6.
- Ющук Н. Д., Знойко О. О., Дудина К. Р., Шутько С. А., Козина А. Н., Сафиуллина Н. Х., Федосеева Н. В., Белый П. А., Луговских Е. А., Огарев В. В., Рахманова А. Г., Хубутия М. Ш., Якушечкина Н. А., Пименов Н. Н., Чуланов В. П., Чесноков Е. В. Оценка социально-экономического бремени гепатита С в Российской Федерации // «Эпидемиология и Ввакцинопрофилактика». 2012. № 2 (69). С. 18–33.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. // J Hepatol. 2011; 55: 245–264.
- Bruno S., Battezzati P. M., Bellati G. et al. Long-term beneficial effects in sustained responders to interferon-alfa therapy for chronic hepatitis C. // J Hepatol. 2001; 34: 748–755.
- Duchatelle V., Marcellin P., Giostra E. et al. Changes in liver fibrosis at the end of alpha interferon therapy and 6 to 18 months later in patients with chronic hepatitis C: quantitative assessment by a morphometric method. // J Hepatol. 1998; 29: 20–28.
- Veldt B. J., Saracco G., Boyer N. et al. Long term clinical outcome of chronic hepatitis C patients with sustained virological response to interferon monotherapy. // Gut. 2004; 53: 1504–1508.
- Buti M., Esteban R. Long-term outcome after interferon therapy in patients with chronic hepatitis C. // Ann Hepatol. 2007; 6: 267–269.
- Reddy K. R., Govindarajan S., Marcellin P. et al. Hepatic steatosis in chronic hepatitis C: baseline host and viral characteristics and influence on response to therapy with peginterferon alpha-2 a plus ribavirin. // J Viral Hepat. 2008. 15: 129–136.
- Yasushi Shiratori et al. 2000, Histologic Improvement of Fibrosis in Patients with Hepatitis C Who Have Sustained Response to Interferon Therapy // Annals of internal Medicine. 2000. V. 132 (7), 517–524.
- Pradat P., Voirin N., Tillmann H. L. et al. Progression to cirrhosis in hepatitis C persons: an age-dependent process. // Liver Int. 2007; 27: 335–339.
- Pradat P., Tillmann H. L., Sauleda S., Braconier J. H., Saracco G. et al. Long-term follow-up of the hepatitis C HENCORE cohort: response to therapy and occurrence of liver-related complications. // J Viral Hepat. 2007, 14 (8): 556–563.
- Bruno S., Stroffolini T., Colombo M., Bollani S., Benvegnu L. et al. Sustained virological response to interferon-alpha is associated with improved outcome in HCV-related cirrhosis: a retrospective study. // Hepatology. 2007, 45 (3): 579–587.
- Grishchenko M., Grieve R. D., Sweeting M. J. et al. Cost-effectiveness of pegylated interferon and ribavirin for patients with chronic hepatitis C treated in routine clinical practice. // Int. J. Technol. Assess. Health Care. 2009; 25: 171–180.
- Shepherd J. Interferon alfa (pegylated and non-pegylated) and ribavirin for the treatment of mild chronic hepatitis C: A systematic review and economic evaluation // Health Technology Assessment. 2007. 11 (11): iii-106.
- Wright M., Grieve R., Roberts J. et al. Health benefits of antiviral therapy for mild chronic hepatitis C: randomised controlled trial and economic evaluation. // Health Technol. Assess. 2006; 10: 1–113, iii.
- Bennett W. G., Inoue Y., Beck J. R. et al. Estimates of the cost-effectiveness of a single course of interferon-alpha 2 b in patients with histologically mild chronic hepatitis C. // Ann. Intern. Med. 1997; 127: 855–865.
- McHutchison J. G., Lawitz E. J., Shiffman M. L., Muir A. J., Galler G. W. et al. (2009 b) Peginterferon alfa-2 b or alfa-2 a with ribavirin for treatment of hepatitis C infection. // N Engl J Med. 2009, 361 (6): 580–593.
- Jacobson II. M., McHutchinson J., Dusheiko G., Di Bisceglie A. M., Reddy K. R. et al. (2011) Telaprevir for previously untreated chronic Hepatitis C Virus Infection. // N Engl J Med. 2011. 364; 25, 2405–2416.
- Kenneth E.. Sherman, Steven L.. Flamm, Nezam H. Afdhal, David R. Nelson, Mark S. Sulkowski, Gregory T. Everson, Michael W. Fried, Michael Adler, Hendrik W. Reesink, Marie Martin, Abdul J. Sankoh, Nathalie Adda, Robert S. Kauffman, Shelley George, Christopher I. Wright, and Fred Poordad for the ILLUMINATE Study Team Response-Guided Telaprevir Combination Treatment for Hepatitis C Virus Infection // N Engl J Med. 2011; 365: 1014–1024.
- FDA. Antiviral Drugs Advisory Committee. http://www.fda.gov/downloads/advisorycom mittees/committees/meeting%20materials/drugs/antiviraldrugsadvisorycommittee/UCM252562.pdf. accessed December 6, 2011.
- Boceprevir (Victrelis). European Medicines Agency. Available at: http://www.ema.europa.eu/ema/index.jsp? curl=pages/medicines/human/medicines/002332/human_med_001464.jsp&mid=WC0b01ac058001d124. Accessed November 11, 2011.
- Telaprevir (Incivo). European Medicines Agency. Available at: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/002313/human_med_001487.jsp&mid=WC0b01ac058001d124. Accessed November 11, 2011.
- Zeuzem S., Andreone P., Pol S., Lawitz E., Diago M. et al. (2011) Telaprevir for retreatment of HCV infection. // N Engl J Med. 2011. 364; 25, 2417–2428.
- Приложение к приказу МЗ РФ № 163 от 27.05.2002 «Отраслевой стандарт. Система стандартизации в здравоохранении РФ. Клинико-экономические исследования. Общие положения».
- Пименов Н. Н., Чуланов В. П., Комарова С. В. и др. Гепатит С в России: эпидемиологическая характеристика и пути совершенствования диагностики и надзора // Эпидемиология и инфекционные болезни. 2012. № 3. С. 4–10.
- Вирусные гепатиты в РФ 2010. Справочник. Под ред. Г. Г. Онищенко, А. Б. Жебруна. Спб.: НИИЭМ им. Пастера. 2010.
- Рекомендации по диагностике и лечению взрослых больных гепатитом C // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2013. Т. 23. № 2. С. 41–70.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru





