Для цитирования: Полевщиков А.В. Фактор активации тромбоцитов в развитии аллергического воспаления: значение рупатадина (Рупафина) // РМЖ. Медицинское обозрение. 2014. №24. С. 1777
Антигистаминные препараты используются в клинической практике свыше 60 лет [2]. За эти годы картина аллергического воспаления, его запуска и хронизации изучена весьма обстоятельно. Важнейшим прорывом стало описание в конце 1960-х гг. и изучение биологических свойств антител класса IgE, их роли в дегрануляции тучных клеток и базофилов, что привело к разработке и широкому клиническому применению принципиально новых антигистаминных препаратов сначала первого, а затем и второго поколения [3]. Достижения фундаментальной науки обеспечили базу и раскрытие механизма действия не только антигистаминных препаратов, но и кортикостероидных гормонов, кромогликатов, антагонистов лейкотриенов, ингибиторов липоксигеназы и обосновали элиминационную терапию и специфическую иммунотерапию аллергии [1]. Тем не менее, время от времени выявляются новые существенные аспекты патогенеза аллергических заболеваний.
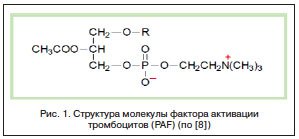
Одним из таких достижений стало открытие в 1979 г. фактора активации тромбоцитов (platelet-activating factor, PAF), раскрывшее как механизм самоподдержания воспаления любой этиологии, так и указавшее на механизмы хронизации аллергического воспаления (рис. 1) [5, 6, 8]. PAF стал первым фосфолипидом с доказанной медиаторной функцией. Исходно для него была установлена способность в очень низких концентрациях, порядка 10–11М, агрегировать кровяные пластинки, что стало основанием для его названия. Оказалось, что продукция PAF, наряду с продукцией гистамина, гепарина и метаболитов арахидоновой кислоты является одним из важнейших последствий активации тучных клеток (рис. 2).
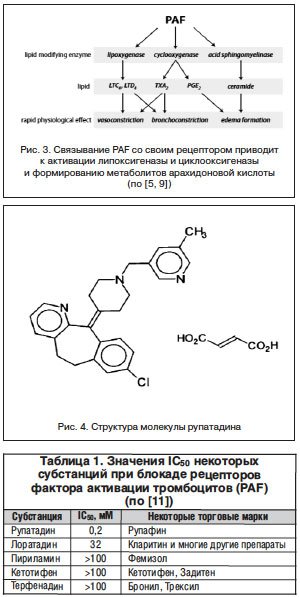
Через свой рецептор, который является типичным G-белком, прошивающим клеточную мембрану 7 раз, PAF, уже без зависимости от связывания IgE-антител, вызывает новый виток клеточной активации, связанный с продукцией циклооксигеназы и липоксигеназы. Эти ключевые ферменты каскада арахидоновой кислоты в свою очередь вызывают образование простагландинов, тромбоксанов и лейкотриенов и увеличение пула клеток воспаления. Кроме тучных клеток и базофилов способностью к продукции PAF обладают кровяные пластинки, клетки эндотелия сосудов, нейтрофилы, моноциты/макрофаги, т. е. все клетки, формирующие клетки воспаления при его хронизации. При формировании пула клеток воспаления их способность к продукции PAF возрастает в десятки раз, а воспаление из острого локального может стать хроническим (рис. 3).
В этой связи поиск противоаллергического препарата, обладающего комбинированной активностью в отношении гистаминовых Н1- и PAF-рецепторов, стал крайне актуальной задачей. Эта задача была решена в 1994 г. созданием молекулы рупатадина, одна часть которой способна связываться с Н1-рецептором, а другая – блокировать рецептор PAF (рис. 4) [7]. Эффективность рупатадина в блокировании аллергических реакций в условиях модельного эксперимента и клинических испытаний была столь велика, что всего через 3 года, уже в 1997 г., рупатадин был зарегистрирован под торговой маркой Рупафин [11].
Рупафин стал первым и, по сути, единственным препаратом с доказанной анти-PAF-активностью (табл. 1). Если для Рупафина способность к блокаде рецептора PAF является специфической активностью, связанной с наличием специального домена в молекуле рупатадина – активного начала препарата, то для лоратадина низкая способность к блокаде рецептора PAF, по-видимому, является побочным действием, основанным на колокализации на клеточной мембране рецепторного для PAF G-белка и гистаминовых H1-рецепторов [3]. Другие антигистаминные препараты фактически лишены способности к нейтрализации рецепторов PAF (табл. 1).
Однако уникальная эффективность противоаллергического действия Рупафина основывается не только на блокаде рецепторов PAF, но и очень высоком сродстве к гистаминовым Н1-рецепторам (табл. 2). Из всех имеющихся на отечественном рынке антигистаминных препаратов Рупафин обладает самым низким значением IC50 (т. е. минимальной ингибирующей концентрацией, вызывающей блокаду 50% Н1-рецепторов), равным 3,8 нМ. Нельзя не обратить внимание, что значение IC50 рупатадина в 6,6 раза ниже, чем для дезлоратадина, в 11,8 раза – чем для левоцетиризина, в 12,6 раза по сравнению с эбастином и в 23,4 раза ниже по сравнению с цетиризином. При этом следует принять во внимание, что значение IC50 для дезлоратадина, по другим источникам, оказывается гораздо выше 25 нМ и составляет от 30 до 50 нМ [2]. Иными словами, для ингибиции 50% Н1-рецепторов требуется количество рупатадина, меньшее в указанное выше число раз по сравнению с другими антигистаминными препаратами. Низкие эффективные концентрации Рупафина лежат в основе рекордной скорости развития его антигистаминного эффекта, наступающего, по данным клинических испытаний, уже через 15 мин после применения [10]. Нельзя не признать, что значения IC50 существенно варьируют в зависимости от использованного метода оценки. Так, по другим данным, этот показатель для фексофенадина равен 40,3 нМ, для левоцетиризина – 9,3 нМ, для дезлоратадина – 1,6 нМ, но для рупатадина в этой же модели значение IC50 оказалось равным 1,4 нМ, что все равно указывает на наибольшее сродство молекулы рупатадина к Н1-рецепторам среди всех самых распространенных антигистаминных препаратов [11, 12].
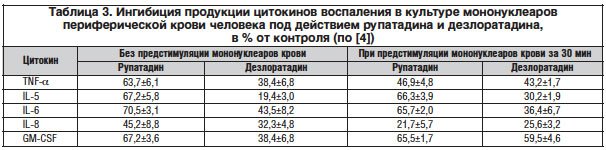
Однако сам по себе факт комбинированной блокады Н1 и PAF-рецепторов еще не объясняет отмены хронизации аллергического воспаления под действием Рупафина. Как известно, важными элементами хронизации аллергического воспаления являются хемотаксис нейтрофилов, вызванный PAF и лейкотриеном LTB4, миграция в очаг воспаления эозинофилов под действием эотаксина (что особенно актуально при аллергических заболеваниях верхних дыхательных путей), а также продукция цитокинов воспаления Т-лимфоцитами. В результате серии весьма тонких экспериментов in vitro на суспензии стимулированных лимфоцитов и моноцитов периферической крови человека обнаружено выраженное (по многим точкам двукратное) превышение ингибирующей способности рупатадина по сравнению с дезлоратадином в отношении ингибиции продукции важнейших провоспалительных цитокинов (фактора некроза опухоли-α (TNF-α), интерлейкинов (IL)-5, -6 и -8, а также гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF)) (табл. 3). Оба препарата (как рупатадин, так и дезлоратадин) не влияли на жизнеспособность клеток в культуре, поэтому снижение продукции цитокинов воспаления в культуре является прямым следствием специфического действия препаратов, а не гибели клеток. Важно, что выраженный ингибирующий эффект Рупафина в отношении цитокинов воспаления развивался как при запуске клеточной активации, так и в отношении предстимулированных ранее (за 30 мин) клеток, что является весомым свидетельством эффективности препарата в условиях длительного воспалительного процесса [4].
Именно эти результаты еще раз показывают глубокий физиологический характер действия Рупафина и объясняют как быстрое развитие его эффектов, так и их стабильность при длительном применении, которая, по ряду оценок, не снижается даже при непрерывном применении препарата в течение 24 мес. [12].
Иными словами, Рупафин за счет наличия двух частей в молекуле его активного начала – рупатадина – оказывает выраженное противоаллергическое действие на всех этапах развития реакции. В условиях ранней фазы аллергической реакции эффективность Рупафина связана с высочайшим сродством его участка, полностью блокирующего в самых низких концентрациях гистаминовые Н1-рецепторы, что обеспечивает быстрое развитие терапевтического эффекта и заметное снижение симптомов аллергического воспаления. Эффективность Рупафина на дальнейших стадиях аллергического воспаления связана также с высокоспецифичной блокадой рецепторов фактора активации тромбоцитов (PAF) за счет другого участка молекулы рупатадина (рис. 4). Однако блокада рецепторов PAF приводит к снижению синтеза метаболитов арахидоновой кислоты, миграции клеток в очаг воспаления и достоверному снижению синтеза ключевых цитокинов воспаления (TNF-α, IL-6, IL-8 и др.), что препятствует как хронизации аллергического воспаления, так и снижает остроту уже развившегося хронического процесса. Последние обстоятельства (блокада каскада арахидоновой кислоты и синтеза цитокинов воспаления) позволяют сравнивать эффекты Рупафина не столько с эффектами других антигистаминных препаратов, сколько с эффектами кортикостероидных гормонов. По-видимому, не будет слишком смелым предположение о том, что на основании механизма действия, эффективности при остром и хроническом аллергическом воспалении Рупафин может рассматриваться как реальная альтернатива применению топических кортикостероидов, не оказывая при этом присущего глюкокортикоидам иммуносупрессорного воздействия. Именно поэтому Рупафин должен войти в арсенал аллергологов, оториноларинголов, дерматологов и врачей других специальностей.




Литература
1. Аллергология и иммунология: Национальное руководство / Под ред. Р.М. Хаитова, Н.М. Ильиной. М.: ГЭОТАР Медиа, 2009. 656 с.
2. Горячкина Л.А. Современные антигистаминные препараты в лечении аллергических заболеваний // Рос. мед. журнал. 2001. Т.9, № 21. С.945–950.
3. Гущин И.С. Перспективы совершенствования противоаллергического действия Н1-антигистаминных препаратов // Лечащий врач. 2009. № 5.
4. Barron S., Ramis I., Merlos M. Rupatadine inhibits the inflammatory component of allergic response: cytokine release, adhesion molecule expression and inflammatory cell recruitment // XXIII EAACI Congress. Amsterdam, 2004. Abs. 366.
5. Benveniste J., Le Couedic J.P., Polonsky J., Tence M. Structural analysis of purified platelet-activating factor by lipases // Nature. 1977. Vol. 269, № 5624. P.170–171.
6. Blank M.L., Snyder F., Byers L.W. et al. Antihypertensive activity of an alkyl ether analog of phosphatidylcholine // Biochem. Biophys. Res. Commun. 1979. Vol.90, № 4. P.1194–1200.
7. Carceller E., Merlos M., Giral M. et al. [(3-Pyridyalkyl) piperidylidene] benzocycloheptapyrididine derivates as dual antagonists of PAF and histamine // J. Med. Chem. 1994. Vol. 37, №17. P.2697–2703.
8. Demopoulos C.A., Pinckard R.N., Hanahan D.J. Platelet-activating factor. Evidence for 1-O-alkyl-2-acetyl-sn-glyceryl-3-phosphorylcholine as the active component (a new class of lipid chemical mediators) // J. Biol. Chem. 1979. Vol.254, №19. P.9355–9358.
9. Kumar N., Abbas A.K., Fausto N., Aster J. Pathologic basis of deseases 8th ed., Elsevier, 2009. 1464 p.
10. Maiti R., Rahman J., Jaida J., Allala U., Palani A. Rupatadine and levocetirizine for seasonal allergic rhinitis: a comparative study of efficacy and safety // Arch. Otolaryngol. Head Neck Surg. 2010. Vol.136, № 8. P.796–800.
11. Merlos M., Giral M., Balsa D. et al. Rupatadine, a new potent, orally active dual antagonist of histamine and platelet activating factor (PAF) // J. Pharmacol. Exp. Ther. 1997. Vol. 280, № 1. P.114–121.
12. Valero A., de la Torre F., Castillo J.A. et al. Safety of rupatadine administered over a period of 1 year in the treatment of persistent allergic rhinitis: a multicentre, open-label study in Spain // Drug Safety. 2009.Vol.32, № 1. P.33–42.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru

