Эволюция глобальной инициативы по хронической обструктивной болезни легких и новый подход к противовоспалительной терапии
С. И. Овчаренко, доктор медицинских наук, профессор
Я. К. Галецкайте
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова, Москва
Выделение хронической обструктивной болезни легких (ХОБЛ) в самостоятельную нозологическую единицу произошло относительно недавно и было связано с ростом частоты встречаемости, инвалидизации и, соответственно, затрат на лечение пациентов с этой патологией. Однако на начальных этапах изучения и разработки лечения ХОБЛ основное внимание уделялось лишь легочным ее проявлениям: необратимому либо не полностью обратимому ограничению скорости воздушного потока, главным показателем которого служил объем форсированного выдоха за первую секунду (ОФВ1). На основании этого показателя в 1997 г. в первой редакции Глобальной инициативы по хронической обструктивной болезни легких (Global Initiative for Chronic Obstructive Lung Disease, GOLD) [1] была предпринята первая попытка классификации заболевания. В документе оговаривалось, что приведенные стадии болезни должны восприниматься как очень общие указания на подходы к проводимой терапии. Последующие за первым изданием GOLD десять лет ознаменовались большим количеством исследований, посвященных особенностям патогенеза, патоморфологии, течения и лечения ХОБЛ. Результатом многолетней работы стал первый пересмотр GOLD 2007 г. [2], где были введены привычные нам 4 спирометрические стадии ХОБЛ (табл. 1). Следует отметить, что уже тогда обращалось внимание на то, что заболевание может иметь «некоторые значимые внелегочные проявления, которые могут вносить вклад в тяжесть течения ХОБЛ у конкретного больного», а также на то, что величина ОФВ1 должна рассматриваться лишь как показатель для спирометрической классификации, а не как маркер тяжести заболевания. Несмотря на это, рекомендации по оценке тяжести пациентов с ХОБЛ продолжали базироваться на степени ограничения скорости воздушного потока. Главную роль в обосновании необходимости пересмотра классификации ХОБЛ сыграли проведенные за последние 5 лет рандомизированные исследования, показавшие слабую корреляцию между значением ОФВ1 и симптомами заболевания, ответом на терапию и прогнозом, выявившие также большую гетерогенность среди больных той или иной стадии ХОБЛ [3]. На первый план в определении прогноза прогрессирующего снижения функциональных показателей [4], статуса здоровья [5] и смертности выступают обострения заболевания [6].
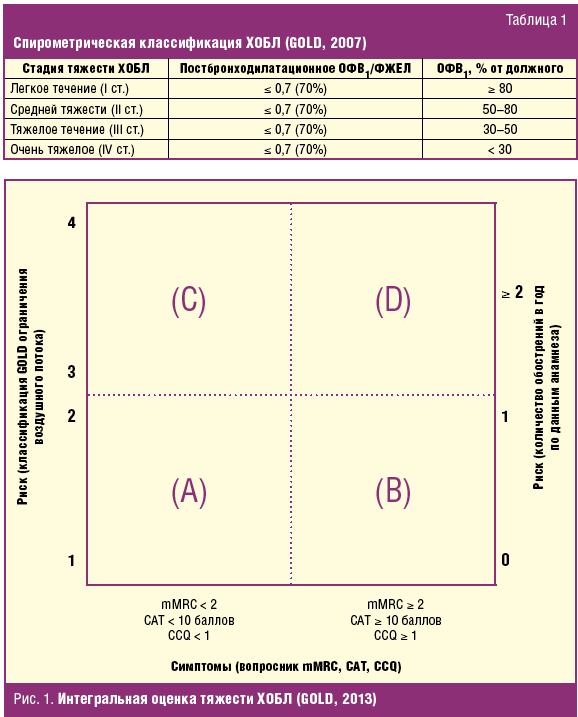
В 2011 г. издан новый пересмотр GOLD [7], в котором в определении тяжести ХОБЛ особая роль отведена частоте обострений, выраженности клинических проявлений ХОБЛ и сочетанным (сопутствующим) заболеваниям, способным утяжелять течение ХОБЛ. Разработана кардинально новая классификация тяжести ХОБЛ, опирающаяся на интегральную оценку симптомов (по шкалам mMRC (модифицированная шкала одышки Medical Research Council (MRC) Dyspnea Scale) и CAT (COPD Assessment Test, оценочный тест по ХОБЛ)), спирометрического показателя (ОФВ1), отражающего степень нарушения бронхиальной проходимости, а также анамнеза обострений (количество обострений за прошедший год) (рис. 1). Согласно этим критериям каждый пациент может быть отнесен к одной из четырех групп (условно называемым A, B, C, D). К примеру, категория А характеризуется низким индексом симптомов (CAT < 10, mMRC 0–1) и низким риском обострений (0–1 обострение в год), а также I–II степенью ограничения воздушного потока — ОФВ1 > 50% от должного. Характеристики всех четырех категорий пациентов представлены в табл. 2.
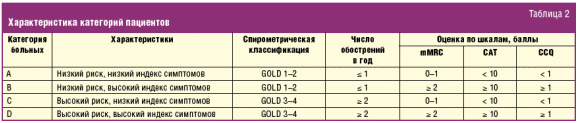
Соответственно этим категориям может быть сформулирован диагноз, отражающий следующие параметры:
1) низкий/высокий индекс симптомов;
2) низкий/высокий риск обострений;
3) степень нарушения бронхиальной проходимости (I–II, III–IV);
4) имеющиеся сопутствующие заболевания.
Цели лечения были определены как уменьшение клинических проявлений (кашля и медленно прогрессирующей одышки, приводящих к ухудшению статуса здоровья) и риска прогрессирования заболевания. Все рекомендуемые препараты были разделены на три группы: первого выбора, второго выбора, альтернативного выбора.
Базисным классом препаратов, значимо и непосредственно влияющим на перечисленные показатели при ХОБЛ, являются длительно действующие бронходилататоры (М-холиноблокаторы, бета-адреномиметики), которые используются при любой тяжести заболевания как монотерапия, так и в сочетании друг с другом. У больных с нерезкой выраженностью бронхиальной обструкции (ОФВ1 > 50% от должного), малым количеством обострений, включая как низкий, так и высокий индекс симптомов, лечение ХОБЛ может ограничиваться применением только этих препаратов.
Принадлежность больного к той или иной лечебной категории в большой мере определяется и частотой обострений, значительно зависящей от выраженности воспаления. Главными клетками воспаления при ХОБЛ являются нейтрофилы, макрофаги и Т-лимфоциты. Усиление воспаления связано с обострением заболевания. С утяжелением течения ХОБЛ возникает необходимость контроля этого специфического воспаления при помощи медикаментозной терапии и к бронходилататорам добавляются мощные противовоспалительные средства — ингаляционные кортикостероиды (иГКС). Однако иГКС, имея точкой приложения своего действия эозинофильное воспаление, непосредственно не воздействуют на воспалительные реакции при ХОБЛ [8]. Вероятнее всего, их противовоспалительный эффект связан с общими противовоспалительными свойствами и снижением активности эозинофильного звена реакций, усиливающегося при ХОБЛ только во время обострений. Ставит под сомнение полноценность эффекта данных препаратов и растущее число сообщений о резистентности к кортикостероидам, развивающейся у курящих пациентов (а курение — основной фактор развития ХОБЛ) [9]. Ситуацию осложняют и данные, показывающие увеличение частоты пневмоний при применении иГКС [10–14].
Наибольшей выраженностью воспаления характеризуются обострения заболевания. Под обострением понимается острое состояние, характеризующееся ухудшением респираторных симптомов, выходящим за пределы обычных колебаний день ото дня у данного больного, требующее коррекции плановой терапии [15]. Показано, что у больных, переносящих более двух обострений ХОБЛ в год, увеличивается уровень воспалительных маркеров в мокроте и крови, возрастает риск повторных обострений, снижается качество жизни [16, 17], быстрее происходит падение функциональных показателей [16–18], достоверно увеличивается смертность [16, 18–20]. В то же время лекарственных средств, способных направленно действовать на нейтрофильное воспаление, характерное для ХОБЛ, до недавних лет не существовало.
Все вышеперечисленное определило поиск лекарственных веществ, влияющих на специфичное воспаление, и привело к появлению ингибитора фосфодиэстеразы 4-го типа (иФДЭ-4) — рофлумиласта, зарегистрированного под названием Даксас®. Мишенью действия рофлумиласта служит фосфодиэстераза (ФДЭ) 4 — ключевой фермент, участвующий в метаболизме цАМФ — субстанции, регулирующей функцию всех провоспалительных, иммунных и структурных клеток (нейтрофилов, гладкомышечных клеток дыхательных путей и сосудов легких, эндотелиальных и эпителиальных клеток дыхательных путей, а также фибробластов) [21, 22].
Проведенные исследования эффективности применения рофлумиласта (Даксас®) показали, что он в большей мере проявлял свой противовоспалительный эффект в группе больных с частыми (≥ 2 раз в год) обострениями, клинически — хроническим кашлем с выделением мокроты (так называемым «бронхитическим фенотипом ХОБЛ»). Как выяснилось, путем уменьшения количества воспалительных клеток и цитокинов в бронхиальном секрете и крови препарат значимо снижает частоту обострений, увеличивает время до следующего обострения [23–26], а по мере ликвидации воспалительного отека стенки бронхов и гиперсекреции улучшает бронхиальную проходимость и усиливает действие бронхолитиков [23, 24, 27–29]. При одновременном использовании с иГКС рофлумиласт не увеличивал частоту нежелательных явлений, связанных с приемом иГКС.
Через год после регистрации рофлумиласт (Даксас®) включен в рекомендации GOLD 2011 г. в качестве препарата второго выбора у пациентов группы «с высоким риском обострений, высоким индексом симптомов» и альтернативного выбора в группе «с высоким риском обострений, низким индексом симптомов» [7].
В настоящее время, по мере накопления опыта как использования рофлумиласта (Даксас®), так и алгоритма выбора терапии по приведенной классификации GOLD 2011 г., в основной международный документ по менеджменту ХОБЛ к 2013 г. был внесен ряд важных изменений [15].
В связи с тем, что для современной интегральной оценки клинических проявлений необходимы тесты с широким охватом симптомов, влияющих на повседневную активность пациентов ХОБЛ и их самочувствие, в GOLD 2013 г. был включен еще один опросник Сlinical COPD Questionnaire (CCQ). Полученные с его помощью данные свидетельствуют о достоверности, высокой чувствительности и надежности этого короткого, простого в применении, заполняемого самим пациентом опросника [32–34].
В то же время не уменьшается использование опросника CAT, состоящего из 8 пунктов, охватывающих возможные нарушения статуса здоровья в связи с ХОБЛ, при валидизации хорошо коррелирующего с результатами опросника госпиталя Святого Георгия [30, 31].
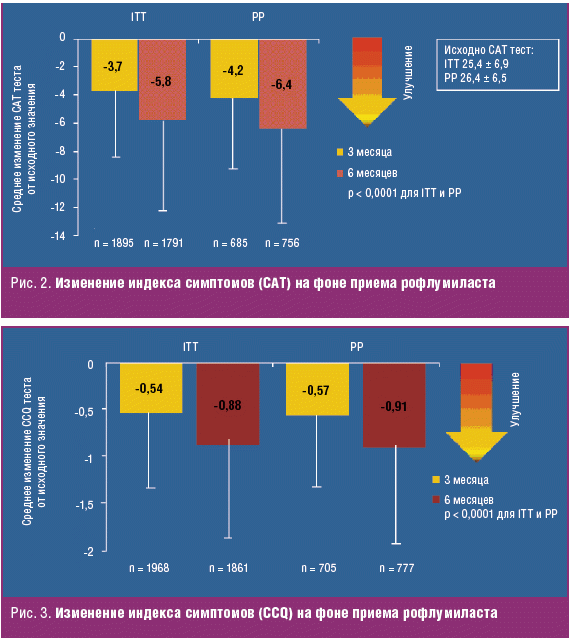
Соответственно методам комплексной оценки симптомов (CAT и CCQ) было проведено проспективное мультицентровое (739 центров в Германии) полугодовое исследование среди 3597 пациентов с ХОБЛ (ОФВ1 < 50% от должного, с частыми обострениями и хроническим бронхитом) влияния на показатели CAT и CCQ рофлумиласта (Даксас®). Уже после 3 месяцев применения с дальнейшим улучшением к 6-му месяцу, обнаружено значимое снижение количества баллов по опроснику CAT (–4,2 ± 5,7; –6,4 ± 7,3 соответственно) и CCQ (изменения общего балла: –0,57 ± 0,74; –0,91 ± 1,0; при минимальном клинически значимом 0,41 балла) с наибольшими изменениями в разделе симптомов [35, 36] (рис. 2, 3).
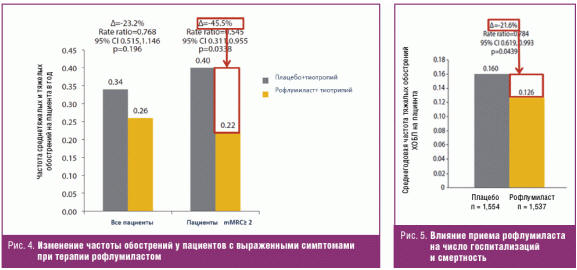
Не утратила свою актуальность и давно известная шкала mMRC (Modified British Medical Research Council), которая хорошо соотносится с другими измеряющими статус здоровья шкалами, а ее максимальные значения могут служить предиктором будущего риска смерти [37, 38]. При дополнительном анализе 24-недельного исследования М-128 (40% ≤ ОФВ1 ≤ 70% от должного) в группе рофлумиласта вне зависимости от предшествующего анамнеза обострений выявлены достоверное улучшение легочной функции и снижение частоты среднетяжелых и тяжелых обострений (на 45,5%) у пациентов со значительно выраженными симптомами (по шкале mMRC ≥ 2) (рис. 4). Это в очередной раз оправдывает интегральную оценку тяжести ХОБЛ и ее роль в назначении лечения [39].
В свете обсуждения влияния обострений на определение тяжести течения ХОБЛ в новой редакции GOLD 2013 г. добавлено положение о том, что при наличии у пациента в предыдущем году даже одного обострения, приведшего к госпитализации (то есть тяжелого обострения), больного необходимо относить к группе высокого риска. Данное положение вынесено для объективизации тяжести обострений и их количества. Как известно, пациенты ХОБЛ далеко не всегда сообщают об имеющихся у них обострениях, что затрудняет стратификацию риска, наличие же документальных данных о госпитализации больного ее облегчает.
В отношении этих тяжелых обострений, приводящих к госпитализации, также доказан положительный эффект рофлумиласта (Даксас®). Проанализировано два 52-недельных исследования рофлумиласта (M2–124 и М2–125), в которые вошел 3091 пациент с ОФВ1 < 50% от должного, с хроническим кашлем и продукцией мокроты, с как минимум одним тяжелым обострением в предыдущий год. В группе рофлумиласта получено статистически значимое снижение на 21,6% числа тяжелых обострений, приводящих к госпитализации или смерти, что может уменьшать затраты на лечение, риск будущих обострений и даже смерти [40] (рис. 5).
В новой редакции GOLD 2013 г. изменено деление препаратов по приоритетности их назначения. В отличие от выделения в GOLD 2011 г. препаратов первого выбора, второго выбора и альтернативного выбора [7], в GOLD 2013 существует тоже три группы препаратов, но называемых соответственно как рекомендованные препараты первого выбора, препараты альтернативного выбора и другая возможная терапия [15] (табл. 3).
Изменилась официальная точка зрения на использование иГКС. На настоящий момент документально закреплено, что «чрезмерное назначение иГКС не рекомендуется из-за риска развития пневмоний и на фоне их длительного применения — переломов» [15]. Показанием к применению иГКС служит сочетание тяжелой или крайне тяжелой степени бронхиальной обструкции с частыми обострениями. Учитывая это, становится понятным целесообразность включения рофлумиласта (Даксас®) как препарата альтернативного выбора в схему лечения как самых тяжелых пациентов категории D («с высоким риском обострений, высоким индексом симптомов»), так и категории С («с высоким риском обострений, низким индексом симптомов») (табл. 3).
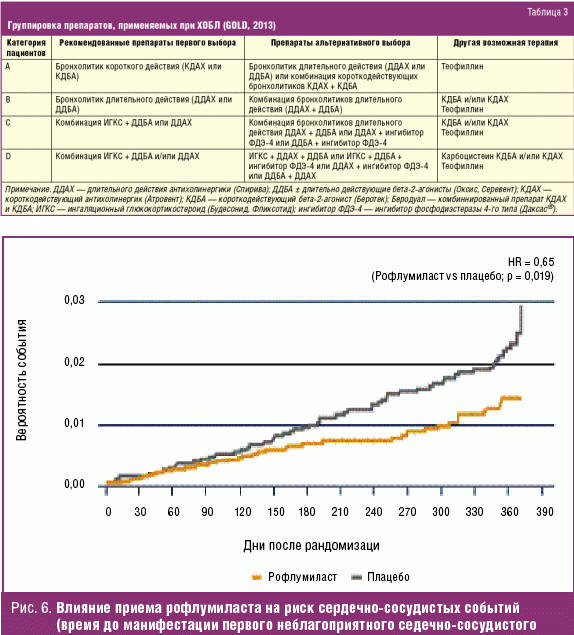
Учитывая то, что во всех рекомендациях по ведению больных ХОБЛ подчеркивается роль полиморбидности, новые лекарственные препараты проходят многочисленные исследования по выявлению нежелательных явлений со стороны других систем и органов. Особенно важно оценить влияние рофлумиласта на сердечно-сосудистую систему. В различных рандомизированных плацебо-контролируемых исследованиях по применению рофлумиласта (Даксас®) было показано отсуствие побочных реакций со стороны сердечно-сосудистой системы. В новом обзоре 14 проведенных исследований по применению рофлумиласта (Даксас®) отмечено даже снижение риска развития основных неблагоприятных сердечно-сосудистых событий на фоне его приема (рис. 6). Авторы связывают такие результаты с возможным действием рофлумиласта (Даксас®) на воспаление в сосудистой стенке при атеросклерозе [41].
Помимо сердечно-сосудистых заболеваний, которые встречаются практически у каждого второго больного ХОБЛ, велика роль и сопутствующих метаболических нарушений при этом заболевании. Так, метаболическим синдромом страдает по различным данным от 21% до 53% больных ХОБЛ, а сахарным диабетом — 2–37% [42]. При исследовании безопасности рофлумиласта (Даксас®) обнаружено, что препарат может воздействовать на уровень глюкозы и уменьшать выраженность имеющегося нарушения толерантности к глюкозе. В новом исследовании FORTUNA на фоне 12-недельного приема препарата больными с впервые выявленным сахарным диабетом 2-го типа без ХОБЛ отмечено достоверное снижение уровня гликемии, гликозилированного гемоглобина (с достижением целевых значений) [43].
Из нежелательных явлений при применении рофлумиласта (Даксас®), регистрируемых в 16% по сравнению с 5% в группе плацебо, чаще встречается диарея, однако в многочисленных исследованиях показана незначительная тяжесть и быстрая самостоятельная регрессия симптоматики на фоне продолжающегося приема препарата [44]. Снижение веса, отмечаемое пациентами, как правило, наблюдалось у больных с повышенной массой тела и имело тенденцию к восстановлению нормальных показателей индекса массы тела [24, 45].
Внедрение алгоритмов стратификации ХОБЛ и персонализированного лечения продолжается. Не стоит на месте разработка и изучение новых лекарственных средств, ярким примером которых является появление ингибитора ФДЭ-4 высокоэффективного и безопасного препарата — рофлумиласта (Даксас®). Направленно действуя на воспаление, рофлумиласт (Даксас®) значительно уменьшает риск прогрессирования заболевания и облегчает симптомы хронического бронхита. Одновременно он способен оказывать влияние и на выраженное при ХОБЛ системное воспаление.
Литература
- Pauwels R. A., Buist A. S., Calverley P. M. et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO Global Initiative for Chronic Obstructive Lung Disease (GOLD) Workshop summary // Am J Respir Crit Care Med. 2001; 163: 1256–1276.
- Rabe K. F., Hurd S., Anzueto A. et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary // Am J Respir Crit Care Med. 2007; 176: 532–555.
- Agusti A., Calverley P. M., Celli B. et al. Characterisation of COPD heterogeneity in the ECLIPSE cohort // Respir Res. 2010; 11: 122.
- Donaldson G. C., Seemungal T. A., Bhowmik A. et al. Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease // Thorax. 2002; 57: 847–852.
- Seemungal T. A., Donaldson G. C., Paul E. A. et al. Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease // Am J Respir Crit Care Med. 1998; 157: 1418–1422.
- Soler-Cataluna J. J., Martinez-Garcia M. A., Roman Sanchez P. et al. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease // Thorax. 2005; 60: 925–931.
- Global Initiative for Chronic Obstructive Lung Diseases. Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease. (Revised 2011). Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких. Пересмотр 2011 г. Перевод с англ. под ред. А. С. Белевского. М.: Российское респираторное общество, 2012.
- Keatings V. M., Jatakanon A., Worsde. Y. M. et al. Effects of inhaled and oral glucocorticoids on inflammatory indices in asthma and COPD // Am J Respir Crit Care Med. 1997; 155: 542–548.
- Barnes P. J., Adcock I. M. Glucocorticosteroid resistance in inflammatory diseases // Lancet. 2009; 373: 1905–1913.
- Calverley P. M., Anderson J. A., Celly B. et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease // N Engl J Med. 2007; 356: 775–789.
- Drummond M. B., Dasenbrook E. C., Pitz M. W., Murphy D. J., Fan E. Inhaled corticosteroids in patients with stable chronic obstructive pulmonary disease: a systematic rewiew and metaanalysis // JAMA. 2008; 300: 2407–2416.
- Singh S., Amin A. V., Loke Y. K. Long-term use of inhaled corticosteroids and the risk of pneumonia in chronic obstructive pulmonary disease: a meta-analysis // Arch Intern Med. 2009; 169: 219–229.
- Carveley P. M., Stockley R. A., Seemungal T. A. et al. Reported pneumonia in patients with COPD: findings from INSPIRE study // Chest. 2011; 139: 505–512.
- Janson C. et al. Pneumonia and pneumonia related mortality in patients with COPD treated fixed combination of inhaled corticosteroid and long acting β2-agonist: observational matched cohort study (PATHOS) // J Intern Med. 2013; Jun; 273 (6): 584–594.
- Global Initiative for Chronic Obstructive Lung Diseases. Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease. (Revised 2013).
- Wedzicha J. A., Seemungal T. A. COPD exacerbations: defining their cause and prevention // Lancet. 2007; 370: 786–796.
- Decramer M., Celli B., Kesten S. et al. Frequency of exacerbations adversely impacts the course of COPD // Am J Respir Crit Care Med. 2010; 181: A1526.
- Donaldson G. C., Wedzicha J. A. COPD exacerbations: Epidemiology // Thorax. 2006; 61: 164–168.
- Soler-Cataluna J. J., Martinez-Garcia M. A., Roman Sanchez P. et al. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease // Thorax. 2005; 60: 925–931.
- Groenewegen K. H., Schols A. M. W. J., Wouters E. F. M. Mortality and mortality-related factors after hospitalization for acute exacerbation of COPD // Chest. 2003; 124: 459–467.
- Rabe K. F. Roflumilast for the treatment of chronic obstructive pulmonary disease. Expert Rev Resp Med. 2010; 4: 543–555.
- Hatzelmann A., Morcillo E. J., Lungarella G. et al. The preclinical pharmacology of roflumilast selective oral phosphodiesterase 4 inhibitor in development for chronic obstructive pulmonary disease // Pulmonary Pharm Therapeutics. 2010; 23: 235–256.
- Rabe K. F., Bateman E. D., O’Donnell D. et al. Roflumilast — an oral anti-inflammatory treatment for chronic obstructive pulmonary disease: a randomised controlled trial // Lancet. 2005; 366: 563–571.
- Calverley P. M., Rabe K. F., Goehring U. M. et al. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomized clinical trials // Lancet. 2009; 374: 685–694.
- Hanania N. A., Brose M., Larsson T. et al. Efficacy of roflumilast in patients receiving concomitant treatments for chronic obstructive pulmonary disease over 12 months // Am J Respir Crit Care Med. 2010; 181: A4435.
- Martinez F., Calverley P., Goehring U. et al. Defining patient populations in COPD: Experience with roflumilast. COPD7 2010; poster 12. www.copdconferences.org.
- Calverley P. M., Sanchez-Toril F., McIvor A., Teichmann P., Bredenbroeker D., Fabbri L. M. Effect of 1-year treatment with roflumilast in severe chronic obstructive pulmonary disease // Am J Respir Crit Care Med. 2007; 176: 154–161.
- Bateman E., Calverley P. M. A., Fabbri L. et al. Efficacy of roflumilast in patients with a history of frequent exacerbations: Pooled data from pivotal 12-month studies // Eur Respir J. 2010; 36: P. 4003.
- Grootendorst D. C., Gauw S. A., Verhoosel R. M. et al. Reduction in sputum neutrophils and eosinophil numbers by the PDE4 inhibitor roflumilast in patients with COPD // Thorax. 2007; 62: 1081–1087.
- Jones P. W., Harding G., Berry P., Wiklund I., Chen W. H., Kline Leidy N. Development and first validation of the COPD Assessment Test // Eur Respir J. 2009; 34: 648–702.
- Dodd J. W., Hogg I., Nolan J. et al. The COPD Assessment Test (CAT): response to pulmonary rehabilitation. A multicenter, prospective study // Thorax. 2011; 66: 425–434.
- Van der Molen T., Willemse B. W., Schokker S., ten Hacken N. H., Postma D. S., Juniper E. F. Development, validity and responsiveness of the Clinical COPD Questionnaire // Health Qual Life Outcomes. 2003, Apr 28; 1: 13.
- Reda A. A., Kotz D., Kocks J. W., Wesseling G., van Schayck C. P. Reliability and validity of the clinical COPD questionnaire and the chronic respiratory questionnaire // Respir Med. 2010, Nov; 104 (11): 1675–1682.
- Trappenburg J. C., Touwen I., de Weert-van Oene G. H., Bourbeau J., Monnikhof E. M., Verheij et al. Detecting exacerbation using the Clinical COPD Questionnaire // Health Qual Life Outcomes. 2010, Sep 16; 8: 102.
- Kardos P., Bethke T. D., Vogelmeier C. Symptom assessment by means of the COPD-Assessment Test (CAT) in patients treated with Roflumilast — a 6 month non-interventional study // Pneumologie. 2013; 67: 407.
- Kardos P., Bethke T. D., Vogelmeier C. Improvement in Quality of Life (QoL) in COPD patients treated with Roflumilast as assessed by the Clinical COPD Questionnaire (CCQ) // Pneumologie. 2013; 67: 359.
- Bestall J. C., Paul E. A., Garrod R., Gamham R., Jones P. W., Wedzicha J. A. Usefulness of the Medical Research Council (MRC) dyspnoea scale as a measure of disability in patients with chronic obstructive pulmonary disease // Thorax. 1999. 54: 581–586.
- Nishimura K., Izumi T., Tsukino M., Oga T. Dyspnea is a better predictor of 5-year survival than airway obstruction in patients with COPD // Chest. 2002; 121: 1434–49.
- Leonardo M. Fabbri, Udo-Michael Goehring, Manja Brose, Klaus F. Rabe. Effects of roflumilast in highly symptomatic COPD patients // European Respiratory Society Annual Congress. 2012. P742.
- Eric D. Bateman, Jose Jardim, Udo-Michael Goehring, Manja Brose, Peter M. A. Calverley. Effect of roflumilast on hospitalizations in COPD patients: a post-hoc analysis // European Respiratory Society Annual Congress. 2012. P2109.
- White W. B. et al. Cardiovascular Safety in Patients Receiving Roflumilast for the Treatment of COPD // Chest. 2013; 144/3: 758–765.
- Claire E., W. & E. H. Baker. Metabolic syndrome and diabetes mellitus in COPD // Eur Respir Monogr. 2013; 59: 117–134.
- Wouters E. F., Bredenbroker D., Telchmann P., Brose M., Rabe K. F., Fabbri L. M., Goke B. Effect of the phosphodiesterase 4 inhibitor roflumilast on glucose metabolism in patients with treatment naive newly diagnosed type 2 diabetes mellitus // J Clin Endocrinol Metab. 2012; 97 (9): E 1720–1725.
- Calverley P. M. A., Fabbri L. M., Rabe K. F., Mosberg H. Roflumilast in the treatment of COPD: a pooled safety analysis. Presented at the European Respiratory Society Annual Congress 2010: Poster 4732.
- Wouters E. F. M., Teichmann P., Brose M. et al. Effects of roflumilast, a phosphodiesterase 4 inhibitor, on body composition in chronic obstructive pulmonary disease // Am J Respir Crit Care Med. 2010; 181: A4473.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







