Цель исследования: изучить патогенез возникновения эрозии стенки влагалища с помощью гистологического, иммуногистохимического исследования.
Материал и методы: основной группой послужили пациентки в возрасте от 45 до 75 лет с возникшей эрозией влагалища. Контрольной группой стали пациентки такого же возраста, которым устанавливались синтетические имплантаты. При гистологическом исследовании эрозии влагалища и фрагмента стенки влагалища у пациенток контрольной группы определялись такие параметры, как тип и выраженность воспаления, васкуляризация. При иммуногистохимическом исследовании определялись основные маркеры воспаления СD8, CD20, CD128. Также оценивались рецепторы эстрогенов α и β как возможная причина формирования пролапса тазовых органов и одна из причин возникновения эрозии стенки влагалища.
Результаты исследования: полученные результаты указывают на наличие различных патогенетических механизмов формирования эрозий стенки влагалища. В одном случае эрозия влагалища формируется на фоне выраженного воспаления, повышенной васкуляризации и выраженного гормонального дисбаланса, в другом, наоборот, — при минимальных признаках воспаления, пониженной васкуляризации и гормональном статусе, подобно имеющему место в контрольной группе.
Заключение: результаты иммуногистохимического исследования подтвердили результаты гистологического исследования. Процессы, происходящие при формировании эрозий слизистой оболочки стенки влагалища после постановки синтетических имплантатов, отличаются от процессов в тканях пациенток контрольной группы. Эти процессы указывают на наличие двух патогенетических механизмов формирования эрозий. В одних случаях эрозия влагалища формируется на фоне выраженного воспаления и гормонального дисбаланса, в других — при минимальных признаках воспаления и гормональном статусе, как в контрольной группе.
Ключевые слова: пролапс тазовых органов, эрозия стенки влагалища, иммуногистохимическое исследование, маркеры воспаления СD8, CD20, CD128, рецепторы эстрогенов, васкуляризация.
Для цитирования: Беженарь В.Ф., Паластин П.М., Толибова Г.Х. Эрозии влагалища в отдаленные сроки после постановки синтетических имплантатов при гинекологических операциях // РМЖ. Медицинское обозрение. 2019. №10. С. 17-21
V.F. Bezhenar1, P.M. Palastin1, G.Kh. Tolibova2
1 Pavlov First St. Petersburg State Medical University, Saint Petersburg
2 Ott Research Institute of Obstetrics, Gynecology and Reproductology, Saint Petersburg
A frequency of pelvic prolapse, depending on the age group, can be found, according to various authors, from 26 to 80% of cases. A number of synthetic implants used to correct pelvic prolapse increase every year. The number of implant-associated complications increases together with them.
Aim: to study the pathogenesis of the vaginal wall erosion, using histological, immunohistochemical study.
Patients and Methods: the main group consisted of patients aged 45 to 75 years with the vaginal erosion. The control group included patients of the same age with inserted synthetic implants. During a histological examination of the vaginal erosion and a fragment of the vaginal wall from the control group, such parameters as the type and severity of inflammation, vascularization was determined. The immunohistochemical study determined the main markers of inflammation: CD8, CD20, CD128. α and β estrogen receptors were also evaluated as a possible cause of not only the formation of pelvic organ prolapse but also of the pathogenesis of the vaginal wall erosion.
Results: received results indicate the presence of various pathogenetic mechanisms of formation of the vaginal wall erosion. In one case, vaginal erosion is formed against the background of pronounced inflammation, increased vascularization and pronounced hormonal imbalance. In the other, on the contrary, with minimal signs of inflammation, reduced vascularization and hormonal status, similar to that in the control group.
Conclusion: the results of immunohistochemical studies confirmed the results of histological studies. The processes occurring during the formation of erosions of the vaginal wall mucous membrane after the insertion of synthetic implants differ from the processes in the tissues of patients in the control group. These processes indicate the presence of two pathogenetic mechanisms of erosion formation. In some cases, vaginal erosion is formed against the background of pronounced inflammation and hormonal imbalance. In others, with minimal signs of inflammation and hormonal status, as in the control group.
Key words: pelvic prolapse, vaginal wall erosion, immunohistochemistry, inflammatory markers CD8, CD20, CD128, estrogen receptors, vascularization.
For citation: Bezhenar V.F., Palastin P.M., Tolibova G.Kh. Vaginal erosion at a long time after synthetic implants insertion during gynecological surgery // RMJ. Medical Review. 2018. № 10. P. 17–21.
Статья посвящена проблеме возникновения эрозии влагалища в отдаленные сроки после постановки синтетических имплантатов при гинекологических операциях. Представлены результаты исследования, целью которого явилось изучение патогенеза возникновения эрозии стенки влагалища с помощью гистологического, иммуногистохимического исследования.
Содержание статьи
Актуальность проблемы
Пролапс тазовых органов (ПТО) — состояние, которое значимо влияет на качество жизни пациенток. Нередко сочетаясь со стрессовым недержанием мочи (СНМ), ПТО приводит как к физическому страданию, так и к психологической травме, снижая самооценку и нарушая сексуальную жизнь пациенток [1–3]. Заболевание нередко манифестирует в репродуктивном возрасте и, как правило, носит прогрессирующий характер [4]. В последние десятилетия наблюдается тенденция к «омоложению» данной патологии [5, 6]. При этом увеличивается число пациенток с легкими степенями пролапса, возникающими даже после неосложненных родов [7]. Малосимптомные, но значимые для пациенток формы ПТО, по данным разных авторов, встречаются в диапазоне от 26 до 80% случаев [8, 9].
В последние десятилетия ХХ в. в хирургическом лечении ПТО и СНМ начали широко использоваться различные синтетические материалы [10–12]. В настоящее время применение синтетических имплантатов признано многими авторами «золотым стандартом» хирургического лечения СНМ и ПТО у женщин [13, 14].
В то же время интенсивное применение синтетических материалов привело к накоплению информации о так называемых имплантат-ассоциированных (или mesh-ассоциированных) осложнениях (ИАО), таких как эрозии слизистой стенок влагалища, хронический болевой синдром, диспареуния, нарушения мочеиспускания, дефекации
и др. [15, 16]. Средняя частота эрозий слизистой стенок влагалища после такого рода операций составляет, по данным разных авторов, 7,6–10,6% [17]. В ряде случаев рубцовые изменения влагалища и протрузия протеза приводят к стойкому, значительному снижению качества жизни в связи с болью, дискомфортом и диспареунией [18].
Все это послужило поводом для исследований, посвященных анализу факторов риска и поиску методов профилактики ИАО [19, 20]. Следует отметить, что проблемы, связанные с ИАО, еще очень далеки от своего окончательного решения [21, 22]. Требуют уточнения не только практические вопросы, связанные с оценкой качества и биосовместимости имплантируемых протезов, методикой операции, но и методологические вопросы — классификация послеоперационных осложнений, а также фундаментальные исследования — изучение патогенетических механизмов их развития, реакции тканей в зоне контакта с имплантатом и др. [23].
Цель исследования: изучить гистологические и иммуногистохимические особенности эрозий стенки влагалища, возникших после выполнения корригирующих пролапс гинекологических операций с использованием синтетических имплантатов.
Материал и методы
В исследование включили 47 пациенток в возрасте от 45 до 75 лет (средний возраст — 57,3±9,1 года). Основную группу составили 32 пациентки с послеоперационной эрозией стенки влагалища, развившейся после коррекции генитального пролапса синтетическими имплантатами. Средний возраст пациенток основной группы составил 56,7±9,3 года. Для коррекции ПТО использовали легкие крупноячеистые полипропиленовые имплантаты (Prolift), а для коррекции СНМ —
имплантаты из аналогичной сетки (TVT и TVT-Obturator). В контрольную группу (группу сравнения) вошли 15 пациенток с пролапсом стенок влагалища, которым не проводилась хирургическая коррекция. Средний возраст пациенток контрольной группы составил 58,7±8,7 года.
Материалом для исследования послужили биоптаты стенки влагалища. Биопсию стенки влагалища в зоне эрозии слизистой оболочки и в аналогичной анатомически зоне (здоровой ткани) у пациенток контрольной группы выполняли под местной инфильтративной анестезией с забором материала примерно 5×5 мм на глубину слизистой острым путем. Манипуляция не сопровождалась значимым кровотечением и не требовала специальных хирургических гемостатических мероприятий.
После выполнения биопсии стенки влагалища в зоне эрозии полученный материал фиксировали в 10% растворе нейтрального забуференного формалина в течение 24 ч.
В последующем материал обезвоживали с помощью автоматической станции Leica TP1020 по стандартной схеме в спиртах нарастающей концентрации (70–95%), затем в ксилоле и парафине для изготовления гистологических и иммуногистохимических препаратов. Толщина серийных срезов составила 3–7 мкм. Для обзорной окраски использовали гематоксилин и эозин.
В ходе иммуногистохимического исследования (ИГИ) для оценки экспрессии рецепторов эстрогенов использовали антитела к рецепторам эстрогенов α и β с использованием первичных моноклональных мышиных античеловеческих антител производства DakoCytomation в стандартном разведении 1:40 для рецепторов слизистой оболочки влагалища.
Воспалительные изменения оценивались с помощью противовоспалительных маркеров: СD 8 клон (СD 8/144B) в стандартном разведении 1:50; СD 20 (клон L26) в разведении 1:40; СD 138 (клон М115) в стандартном разведении 1:50. При работе со всеми указанными антителами использовались первичные моноклональные мышиные античеловеческие антитела производства DakoCytomation.
ИГИ проводили на парафиновых срезах толщиной 5 мкм, которые помещали на предметные стекла, покрытые пленкой из поли-L-лизина (Sigma). В качестве системы визуализации использовали набор DakoCytomation LSAB2 System-HRP (Dako), содержащий биотинилированные козьи антикроличьи и антимышиные антитела, стрептавидин, конъюгированный с пероксидазой хрена, и 3,3’-диаминобензидин.
В качестве позитивного контроля для рецепторов эстрогенов использовался эндометрий, полученный при обследовании здоровых фертильных женщин. Негативный контроль выполнен с применением блокирующей сыворотки (DAKOLSAB 2 kit).
Для проведения иммуногистохимической реакции (ИГР) использовали стандартный одноэтапный протокол с демаскировкой антигена (высокотемпературной обработкой ткани) в 0,01 М цитратном буфере рН 7,6.
Визуализация ИГР выполнялась по общепринятой методике [24].
Результаты исследования
Количественная оценка результатов
Pentium 4, программного обеспечения «АСТ-1», версия 2.12. Из фотосъемки исключались поля зрения, содержащие дефекты ткани, дефекты окрашивания и артефакты.
Фотосъемку производили на увеличении ×400 (окуляр ×10, объектив ×40) с полным закрытием апертурной диафрагмы, при поднятом конденсоре, в режиме Photo, время экспозиции — 1/20 с, чувствительность камеры — максимальная, размер изображения — 1280×1024 пикселей, графический формат изображения — JPEG (normal). Для количественного анализа экспрессии рецепторов эстрогенов α и эстрогенов β использовали систему компьютерного анализа изображений «Морфология 5.2».
Результаты гистологического исследования
При гистологическом исследовании биоптатов стенки влагалища в основной группе в 100% случаев выявлены морфологические признаки хронического воспалительного процесса (лимфоцитарно-плазмоцитарная инфильтрация) в сочетании с экссудативным воспалением. При слабой и средней степени хронического воспаления, которая была выявлена в 12 (37,5%) случаях, инфильтрат был представлен лимфоцитами (рис. 1). Средняя степень воспалительных изменений, характеризовавшаяся лимфоцитарным инфильтратом и начальными этапами экссудативного воспаления, выявлена в 4 (12,5%) случаях (рис. 2).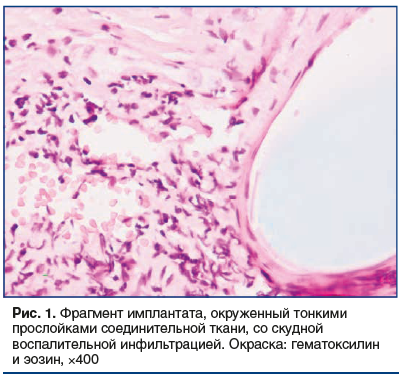
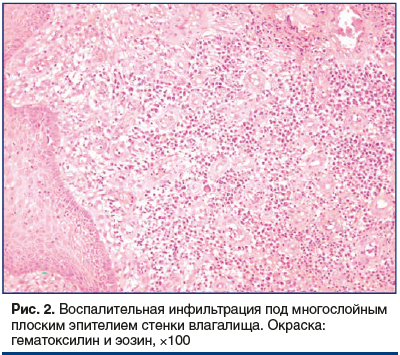
Следует подчеркнуть, что тяжелый воспалительный процесс, вплоть до отека тканей, был выявлен в 16 (50,8%) случаях (рис. 3).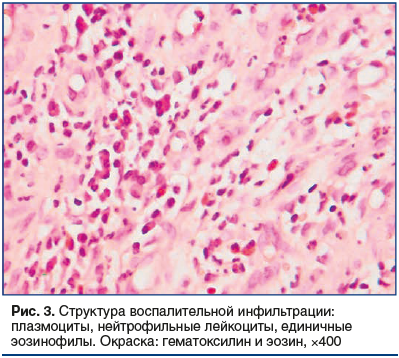
В контрольной группе морфологическая картина была несколько иная. Четких признаков воспаления не выявлено в 2 (13,3%) образцах. У большинства пациенток было выявлено воспаление легкой степени — в 9 (60,0%) образцах. Средняя степень воспаления отмечалась в 4 (26,7%) образцах. Признаков тяжелого воспаления выявлено не было.
При оценке степени васкуляризации исследуемой ткани в основной группе в большинстве случаев (17 наблюдений) отмечалась слабая степень разрастания сосудистой сети, что составило 53,1% от общего количества исследуемого материала (р
Помимо степени васкуляризации обращали на себя внимание циркуляторные нарушения в виде тромбоза капиллярного русла с периваскулярными диапедезными кровоизлияниями (рис. 4).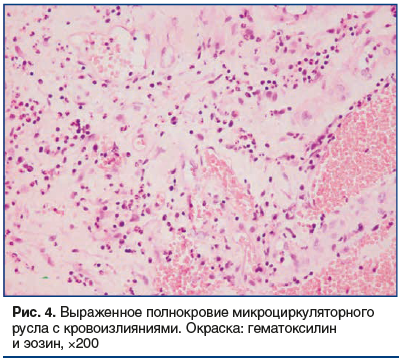
Основное количество циркуляторных нарушений было представлено низкой степенью выраженности в 11 (34,4%) случаях. Далее следовала средняя степень нарушения циркуляции в 9 случаях, что составило 28,1% от общего числа. Выраженная степень отмечалась в 7 случаях (21,9%).
В 5 исследуемых биоптатах циркуляторных нарушений выявлено не было, что составило 15,6%.
При исследовании реципиентной зоны у пациенток со слабой степенью выраженности хронического воспаления, представленного лимфоцитами, и сниженной васкуляризацией, отмечено выраженное разрастание тонких прослоек соединительной ткани вокруг инородного компонента.
В контрольной группе циркуляторные нарушения слабой степени были выявлены у 3 пациенток (20,0%), средней степени — у 1 пациентки (6,7%). Выраженных циркуляторных нарушений в биоптатах данной группы выявлено не было.
Таким образом, у пациенток с эрозией слизистой оболочки влагалища после установки синтетических полипропиленовых имплантатов в отличие пациенток контрольной группы отмечались более выраженные признаки воспалительного процесса. С одной стороны, данное обстоятельство выглядит естественным в связи с наличием отторгающегося инородного субстрата в тканях, с другой стороны, мы выявили полярные проявления васкуляризации ткани. Так, если в контрольной группе васкуляризация была в основном умеренной, то в основной группе преобладала либо слабо, либо интенсивно выраженная васкуляризация. Это наталкивает на мысль о гетерогенности механизма отторжения имплантата. Косвенным подтверждением данного наблюдения является усиление соединительнотканного компонента у части пациенток основной группы. Для подтверждения вышеуказанного предположения нами был проведен этап ИГИ полученных биоптатов.
Результаты иммуногистохимического исследования
Несмотря на то, что патофизиология ПТО до сих пор окончательно не ясна, считается, что в ее развитии участвуют генетические и средовые факторы, гормональный фон и т. д., т. е. заболевание имеет многофакторную природу [25]. Так, эстрогены и их рецепторы являются общепризнанными факторами, участвующими в формировании пролапса гениталий. У человека были идентифицированы два типа рецепторов: рецепторы эстрогенов альфа (РЭα) и рецепторы эстрогенов бета (РЭβ). Эти рецепторы по-разному экспрессируются в период пре- и постменопаузы. Так, РЭα в стенке влагалища присутствуют в указанные периоды, тогда как экспрессия РЭβ отсутствует или выявляется на крайне низком уровне.
В ходе исследования было установлено, что экспрессия РЭα отмечалась во всех исследуемых образцах как в основной группе, так и в группе сравнения, вне зависимости от возраста пациенток и использования местных эстрогеновых препаратов. Оценка экспрессии РЭβ в исследуемых биоптатах показала, что она носит разнонаправленный характер. В группе сравнения площадь экспрессии была минимальной, тогда как в основной группе были образцы с более высокой
экспрессией РЭβ.
При всей трудности трактовки изменений экспрессии РЭ в тканях очевидно, что полученные результаты свидетельствуют о более выраженном гормональном дисбалансе в тканях пациенток с эрозией слизистой стенки влагалища после установки синтетического имплантата, что, по нашему мнению, могло иметь значение в патогенезе данного осложнения.
Для исследования хронического воспалительного процесса в биоптатах влагалища иммуногистохимическим методом были использованы воспалительные маркеры: CD8+ (цитотоксические Т-лимфоциты), CD20+ (В-лимфоциты) и CD 138+ (плазмоциты).
СD8+ является поверхностным клеточным гликопротеином, экспрессирующимся на популяции Т-лимфоцитов с цитотоксическим или супрессивным эффектом. Повышение относительного числа CD8+ Т-клеток происходит в случае инфекционного заболевания, онкологических процессов, в поствакцинальном периоде, а также при аллотрансплантации. В норме количество CD8+ клеток составляет до 10 в поле зрения.
СD20+ (В-лимфоциты) — поверхностный антиген В-лимфоцитов. Экспрессируется на всех этапах онтогенеза В-лимфоцитов, начиная с самых ранних этапов вплоть до формирования плазматических клеток. В норме их количество — до 3–5 клеток в поле зрения.
CD138+ является маркером плазматических клеток. Это поверхностный клеточный протеогликан, преимущественно экспрессирующийся на эпителиальных клетках и регулирующий их взаимодействие с внеклеточным матриксом или факторами роста. Кроме эпителиальных клеток CD138+ активно экспрессируется в популяции В-лимфоцитов в стадии плазматических клеток. В норме данные клетки отсутствуют.
Общее заключение о степени выраженности воспалительных изменений устанавливали по совокупности CD8+, CD20+ и CD138+, взяв за основу, классификацию, предложенную Г.Х. Толибовой с соавт. [26] (табл. 1).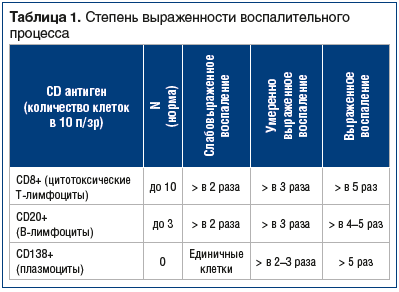
Проведенное ИГИ показало, что в биоптатах основной группы хронический воспалительный процесс выявлялся в 100% случаев, тогда как в группе сравнения подобные изменения присутствовали только в 26,7% случаев (4 образца, р
Слабовыраженное воспаление было диагностировано в 16 (50%) биоптатах у пациенток основной группы и 2 (13,3%) биоптатах у женщин контрольной группы (р
Заключение
Результаты ИГИ полностью подтвердили выводы, сделанные на основании гистологического исследования. С одной стороны, процессы, происходящие в тканях при формировании эрозий слизистой оболочки стенки влагалища после установки синтетических имплантатов, по степени выраженности воспаления, васкуляризации и гормонального дисбаланса выраженно отличаются от процессов, происходящих в тканях у пациенток контрольной группы. С другой стороны, сами эти процессы с высокой долей вероятности указывают на наличие двух различных патогенетических механизмов формирования эрозий стенки влагалища. В одних случаях эрозия влагалища формируется на фоне выраженного воспаления, повышенной васкуляризации и выраженного гормонального дисбаланса; в других — наоборот, при минимальных признаках воспаления, пониженной васкуляризации и гормональном статусе, подобном таковому в контрольной группе.
Литература
1. Jelovsek J.E., Barber M.D. Women seeking treatment for advanced pelvic organ prolapse have decreased body image and quality of life // Am J Obstet Gynecol. 2006. Vol. 194 (5). P. 145–1461.
2. Segedi L.M., Ilić K.P., Curcić A., Visnjevac N. Quality of life in women with pelvic floor dysfunction // Vojnosanit Pregl. 2011. Vol. 68 (11). P. 940–947.
3. De Tayrac R., Deval B., Fernandez H., Marus P. Development of a linguistically validated French version of two short-form, condition-specific quality of life questionnaires for women with pelvic floor disorders (PFDI-20 and PFIQ-7) // J Gynecol Obstet Biol Reprod (Paris). 2007. Vol. 36 (8). P. 738–748.
4. Бахаев В.В., Горин В.С. Выпадение половых органов у женщин: этиология и патогенез // Акушерство и гинекология. 2009. № 3. C. 7–10 [Bakhayev V.V., Gorin V.S. Vypadeniye polovykh organov u zhenshchin: etiologiya i patogenez // Akusherstvo i ginekologiya. 2009. № 3. S. 7–10 (in Russian)].
5. Barber M.D., Visco A.G., Wyman J.F. et al. Sexual function in women with urinary incontinence and pelvic organ prolapse // Obstet. Gynecol. 2002. Vol. 99 (2). P. 281–289.
6. Zyczynski H.М., Slack M., Reisenauer C. et al. A new operation for vaginal prolapse repair using mesh and a vaginal support device: 1 year anatomic and functional results of an international multicentre study // Int. Urogynecol. J. 2009. Vol. 181 (4). Suppl. 2. P. 157–158.
7. Mathlouthi N., Ben Ayed B., Dhouib et al. Genital prolapse in young women: a study of risk factors // Tunis Med. 2011. Vol. 89 (7). P. 627–631.
8. Cervigni M., Natale F. The use of synthetics in the treatment of pelvic organ prolapse // Curr Opin Urol. 2001. Vol. 11 (4). P. 429–435.
9. Cundiff G.W., Weidner A.C., Visco A.G. et al. An anatomic and functional assessment of the discrete defect rectocele repair // Am J Obstet Gynecol. 1998. Vol. 179. P. 1451–1456.
10. Попов А.А., Краснопольская И.В., Тюрина С.С. и др. Сакроспинальная фиксация в лечении женщин с пролапсом гениталий в эру mesh-технологий // Российский вестник акушера-гинеколога. 2013. Т. 13. № 2. С. 36–41 [Popov A.A., Krasnopol’skaya I.V., Tyurina S.S. i dr. Sakrospinal’naya fiksatsiya v lechenii zhenshchin s prolapsom genitaliy v eru mesh-tekhnologiy // Rossiyskiy vestnik akushera-ginekologa. 2013. T. 13. № 2. S. 36–41 (in Russian)].
11. Hinoul P., Ombelet W.U., Burger M.P. et al. A prospective study to evaluate the anatomic and functional outcome of a transobturator mesh kit (Prolift anterior) for symptomatic cystocele repair // J Minim Invasive Gynecol. 2008. Vol. 15 (5). P. 615–620.
12. Lucioni A., Rapp D.E., Gong E.M. et al. The surgical technique and early postoperative complications of the Gynecare Prolift pelvic floor repair system // Can. J. Urol. 2008. Vol. 15 (2). P. 4004–4008.
13. Беженарь В.Ф., Богатырева Е.В. Новые возможности хирургической коррекции тазового пролапса с использованием синтетических имплантов: пути профилактики послеоперационных осложнений // Акушерство. Гинекология. Репродукция. 2012. Т. 6, № 2. С. 6–13 [Bezhenar’ V.F., Bogatyreva Ye.V. Novyye vozmozhnosti khirurgicheskoy korrektsii tazovogo prolapsa s ispol’zovaniyem sinteticheskikh implantov: puti profilaktiki posleoperatsionnykh oslozhneniy // Akusherstvo. Ginekologiya. Reproduktsiya. 2012. T. 6, № 2. S. 6–13 (in Russian)].
14. Rogo-Gupta L., Rodriguez L.V., Litwin M.S. et al. Trends in surgical mesh use for pelvic organ prolapse from 2000 to 2010 // Obstet. Gynecol. 2012. Vol. 120 (5). P. 1105–1115.
15. Barber M.D., Walters M.D., Bump R.C. Short forms of two condition-specific quality-of-life questionnaires for women with pelvic floor disorders (PFDI-20 and PFIQ-7) // Am J Obstet Gynecol. 2005. Vol. 193. P. 103–113.
16. Muffly T., Barber M.D. Insertion and Removal of Vaginal Mesh for Pelvic Organ Prolapse // Clinical Obstetrics and Gynecology. 2010. Vol. 53 (1). P. 99–114.
17. Попов A.A., Мананникова Т.Н., Мачанските О.В. Анализ осложнений операции Prolift: Материалы 2-го Российского конгресса по эндоурологии и новым технологиям. М., 2010. С. 142–143 [Popov A.A., Manannikova T.N., Machanskite O.V. Analiz oslozhneniy operatsiy Prolift: Materialy 2 Rossiyskiy kongress po endourologii i novym tekhnologiyam. М., 2010. S. 142–143 (in Russian)].
18. Беженарь В.Ф. Осложнения при коррекции тазового пролапса с использованием проленовой системы Prolift // Акушерство и гинекология. 2012. № 4–2. С. 116–121 [Bezhenar’ V.F. Oslozhneniya pri korrektsii tazovogo prolapsa s ispol’zovaniyem prolenovoy sistemy Prolift // Akusherstvo i ginekologiya. 2012. № 4–2. S. 116–121 (in Russian)].
19. Ищенко А.И., Шульгина И.В., Ищенко А.А. и др. MESH-ассоциированные осложнения, факторы риска // Архив акушерства и гинекологии им. В.Ф. Снегирева. 2014. № 2. С. 4–7 [Ishchenko A.I., Shul’gina I.V., Ishchenko A.A. i dr. MESH-assotsiirovannyye oslozhneniya, faktory riska // Arkhiv akusherstva i ginekologii im. V.f. Snegirova. 2014. № 2. S. 4–7 (in Russian)].
20. Shah H.N., Badlani G.H. Mesh complications in female pelvic floor reconstructive surgery and their management: A systematic review // Ind. J. Urology. 2012. Vol. 28 (2). P. 129–153. DOI: 10.4103/0970–1591.98453.
21. Nieminen K., Hiltunen R., Takala T. et al. Outcomes after anterior vaginal wall repair with mesh: A randomized, controlled trial with a 3 year follow-up // Am. J. Obstet. Gynecol. 2010. Vol. 203 (3). Р. 235.e1–8. DOI: 10.1016/j.ajog.2010.03.030.
22. Withagen M.I., Milani A.L., den Boon J. et al. Trocar-guided mesh compared with conventional vaginal repair in recurrent prolapse: A randomized controlled trial // Obstet. Gynecol. 2011. Vol. 117 (2 Pt 1). P. 242–250.
23. Ignjatovic I., Stojkovic I., Basic D. et al. Optimal primary minimally invasive treatment for patients with stress urinary incontinence and symptomatic pelvic organ prolapse: Tension free slings with colporrhaphy, or Prolift with the tension free midurethral sling? // Eur. J. Obstet. Gynecol. Reprod. Biol. 2010. Vol. 150 (1). P. 97–101.
24. Руководство по иммуногистохимической диагностике опухолей человека / под ред. С.В. Петрова, Н.Т. Райхлина. 4-е изд., доп. и перераб. Казань: Татмедиа, 2012. 623 с. [Rukovodstvo po immunogistokhimicheskoy diagnostike opukholey cheloveka / pod red. S.V. Petrova, N.T. Raykhlina. 4-ye izd., Dop. i pererab. Kazan’: Tatmedia, 2012. 623 s. (in Russian)].
25. Беженарь В.Ф., Русина Л.К., Цуладзе А.А. и др. Эффективный клинический опыт использования субуретральных слингов в лечении недержания мочи у женщин // Журнал акушерства и женских болезней. 2012. Т. 61. № 5. С. 30–37 [Bezhenar’ V.F., Rusina L.K., Tsuladze A.A. i dr. Effektivnyy klinicheskiy opyt ispol’zovaniya suburetral’nykh slingov v lechenii nederzhaniya mochi u zhenshchin // Zhurnal akusherstva i zhenskikh bolezney. 2012. T. 61. № 5. S. 30–37 (in Russian)].
26. Толибова Г.Х., Траль Т.Г., Клещев М.А. и др. Эндометриальная дисфункция: Алгоритм гистологического и иммуногистохимического исследования // Журнал акушерства и женских болезней. 2015. № 4. С. 69–74 [Tolibova G. Kh., Trail T.G., Kleschev M.A. Endometrial dysfunction: Algorithm of histological and immunohistochemical studies // Journal of Obstetrics and Women’s Diseases. 2015. № 4. P. 69–74 (in Russian)].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru

