Содержание статьи
Эндотипическая классификация хронической спонтанной
крапивницы — путь к персонифицированной терапии
П. В. Колхир, кандидат медицинских наук
О. Ю. Олисова, доктор медицинских наук, профессор
Н. Г. Кочергин, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Хроническая спонтанная крапивница (ХСК) — заболевание кожи, механизм развития
которой связан с дегрануляцией тучных клеток и появлением волдырей, зуда и/или
ангиоотеков в течение > 6 недель при отсутствии диагностируемых специфических
причин. Проблема ХСК остается одной из наиболее актуальных как в дерматологии,
так и в аллергологии в связи с широким распространением, высокой частотой
госпитализаций, значительным снижением качества жизни пациентов и недостаточной
эффективностью и безопасностью существующих методов лечения. Антигистаминные
препараты (АГП) II поколения в стандартных дневных дозах являются средствами
выбора для лечения ХСК, но эффективны лишь у ~50% больных. Последнее может
объясняться различиями в индивидуальных патофизиологических механизмах у разных
больных с крапивницей.
Согласно современным представлениям ХСК рассматривается как аутоиммунное
заболевание как минимум у части больных. На это указывает Т-лимфоцитарная
инфильтрация в области высыпаний, характерный для аутоиммунитета цитокиновый
профиль, положительный ответ на внутрикожный тест с аутологичной сывороткой (ТАС)
и иммуносупрессивную терапию, например циклоспорин, и высокая частота
сопутствующих аутоиммунных заболеваний, например аутоиммунный тиреоидит.
Считается, что у 25–60% больных ХСК патогенез опосредован присутствием
функциональных IgG-аутоантител к молекулам IgE или к α-субъединицам рецепторов
FcεRI на тучных клетках и базофилах. Недавно была описана IgE-аутореактивность,
возникающая из-за синтеза ауто-IgE-антител против двухспиральной ДНК,
тиреоглобулина, тиреопероксидазы и других аутоантигенов. У таких больных
отмечается повышение уровня общего IgE, возможно связанное с наличием
ауто-IgE-антител, но не со специфическими антителами IgE к аллергенам. Похожие
аутоантитела IgE были выявлены при других аутоиммунных болезнях, в частности при
системной красной волчанке (СКВ), что может указывать на общность патогенеза при
обеих болезнях и объяснять развитие ХСК у больных СКВ.
Известно, что ХСК, опосредованная IgG-аутореактивностью, протекает более
тяжело и длительно и устойчива к терапии АГП. При этом у многих больных
наблюдается не только положительный ТАС, но также повышение уровня маркеров
воспаления, например С-реактивного белка (СРБ) и цитокинов. С другой стороны,
маркеры IgE-аутореактивности и ее ассоциация с тяжестью ХСК и ответом на АГП II
поколения пока не описана. Согласно рекомендациям Европейской академии
аллергологии и клинической иммунологии (The European Academy of Allergy and
Clinical Immunology, EAACI) изучение и характеристика таких диагностических
биомаркеров ХСК, определяющих патофизилогические подгруппы (эндотипы)
заболевания и прогнозирующих ответ на лечение, является перспективным
направлением научных исследований в отношении крапивниц вообще.
Таким образом, целью нашего исследования явилась разработка эндотипической
классификации ХСК на основе изучения комплекса диагностических биомаркеров
«аллергии» (общий IgE), аутоиммунитета (ответ на ТАС), воспаления (СОЭ, СРБ) и
коагуляции (D-димер, фибриноген) для дифференцированного и персонифицированного
подхода к диагностике и терапии заболевания.
Материалы и методы исследования
В ходе работы мы обследовали 84 больных мужчин и женщин в возрасте от 16 до
80 лет с ХСК различной тяжести. Набор пациентов проводили с сентября 2012 г. по
январь 2015 г. во время амбулаторных приемов и консультаций в стационаре в
клинике кожных и венерических болезней им. В. А. Рахманова Первого МГМУ им. И.
М. Сеченова. Перед проведением обследования у пациентов получено информированное
согласие. Больных ХСК включали в исследование в соответствии с критериями
включения: возраст старше 16 лет и персистирующее течение крапивницы с
рецидивированием не менее 2 раз в неделю в течение > 6 недель. Диагноз ХСК
выставляли на основании жалоб, данных анамнеза, клинической картины и
физикального осмотра. Крапивницу определяли как спонтанную с известной или
неизвестной причиной (идиопатическая) в случае длительности заболевания > 6
недель и исключения других возможных форм хронической крапивницы и уртикарного
васкулита. Протокол обследования больных ХСК, включенных в исследование, состоял
из оценки жалоб, анамнеза, физикального осмотра и результатов лабораторных
исследований. Качество жизни (КЖ) оценивали с помощью русской версии
стандартизированного специфического для ХСК опросника CU-Q2oL (Chronic Urticaria
Quality of Life Questionnaire, опросник по оценке качества жизни пациентов с
хронической крапивницей; Baiardini I. и соавт., 2005; Некрасова Е. Е. и соавт.,
2010). Тяжесть заболевания устанавливали по шкале оценки тяжести/активности
течения ХСК (UAS, urticaria activity score) согласно критериям европейского
согласительного документа. Определение СОЭ проводили методом Вестергрена, уровня
общего IgE, D-димера и фибриногена в сыворотке крови — с помощью
иммуноферментного анализа, СРБ — с помощью высокочувствительного
нефелометрического метода. Для оценки кожной аутореактивности применяли
внутрикожный тест с аутологичной сывороткой согласно рекомендациям
международного консенсуса.
Оценку КЖ, активности болезни и забор крови
на биомаркеры осуществляли через 3–5 дней после отмены первоначального лечения.
После этого больным назначали АГП II поколения в стандартных дневных дозах на
срок 5–7 дней. Лечение проводили левоцетиризином или фексофенадином в дозе 1
таблетка 1 раз в день, при неэффективности терапии в первые 2–3 дня пациент мог
самостоятельно заменить препарат на другой АГП II поколения в тех же дозах по
собственному выбору. Эффект от терапии оценивали на 5–7 день при опросе и
осмотре больного. АГП были эффективны у 42 (50%) и неэффективны у других 42
(50%) больных.
Для построения базы данных и обработки информации использовали программу
Microsoft Excel 2010, SPSS версии 22. Для оценки различий между выборками
применяли U-критерий Манна–Уитни, для оценки корреляций между значениями
биомаркеров по номинальным переменным — χ2-критерий Пирсона и
интервальным — коэффициент корреляции Пирсона®. Для определения силы связи между
переменными применяли коэффициент Крамера V (V ≥ 0 ≤ 0,3 — сила связи слабая; V
> 0,3 ≤ 0,69 — сила связи умеренная; V > 0,7 — сильная связь). Связь считалась
статистически значимой при p ≤ 0,05.
Классифицирование ХСК на 2 подгруппы по ответу на терапию стандартными
дневными дозами АГП II поколения (наличие/отсутствие ответа) в зависимости от
набора биомаркеров проводили с помощью дискриминантного анализа — статистической
процедуры классифицирования, позволяющей предсказать принадлежность индивидуумов
к двум или более непересекающимся группам. Индивидуум причислялся к одной из
двух групп на основании признаков (независимых переменных-предикторов), к
которым относили СОЭ, СРБ, D-димер, фибриноген, общий IgE, значения CU-Q2oL и
UAS. Перед началом анализа данные переменных (СОЭ, D-димер, фибриноген, СРБ,
общий IgE) были трансформированы к нормальному распределению, что является одним
из условий проведения дискриминантного анализа. На начальном этапе анализа для
предполагаемых предикторов формировалась корреляционная матрица (общая
внутригрупповая корреляционная матрица).
Результаты
В исследование было включено 25 (29,8%) пациентов мужского пола и 59 (70,2%)
— женского (соотношение 1: 2,4). Возраст пациентов варьировал от 16 до 77 лет,
среднее значение было равно 36,9 ± 13,2 г, медиана — 33. Минимальная
длительность ХСК составила 0,2 г, максимальная — 43 г, среднее значение 4,5 ±
7,4 г, медиана — 1,0.
Эффект от приема АГП чаще отмечался в группе больных крапивницей средней и
легкой тяжести, чем тяжелой (77,1 против 22,9%, χ21 =
5,323; p = 0,021; V = 0,268), а также — у больных легкой крапивницей, чем
тяжелой (66,7 против 42,6%, χ21 = 3,696; p = 0,05; V =
0,228).
У больных с положительным ТАС чаще наблюдали более тяжелое заболевание
(средний ранг: 42,84 против 31,13; U = 895; р = 0,019), повышение уровней СРБ
(средний ранг: 43,02 против 31,94; U = 901; р = 0,031) и D-димера (средний ранг:
42,97 против 30,95; U = 900,5; р = 0,019), чем в группе пациентов с
отрицательным ТАС. Кроме того, у больных с ТАС+ имелась тенденция к более
выраженному снижению КЖ (р = 0,08), хотя статистически значимой разницы в ответе
на АГП у больных с ТАС+ и ТАС- выявлено не было (р = 0,656).
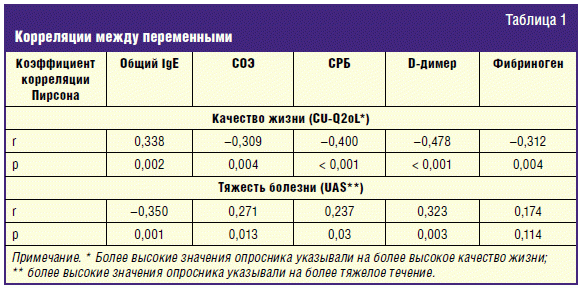
Была обнаружена статистически значимая корреляция между уровнями общего IgE,
СОЭ, СРБ и D-димера с тяжестью болезни. Из табл. 1 видно, что только уровень
общего IgE положительно коррелирует с КЖ и отрицательно — с тяжестью болезни.
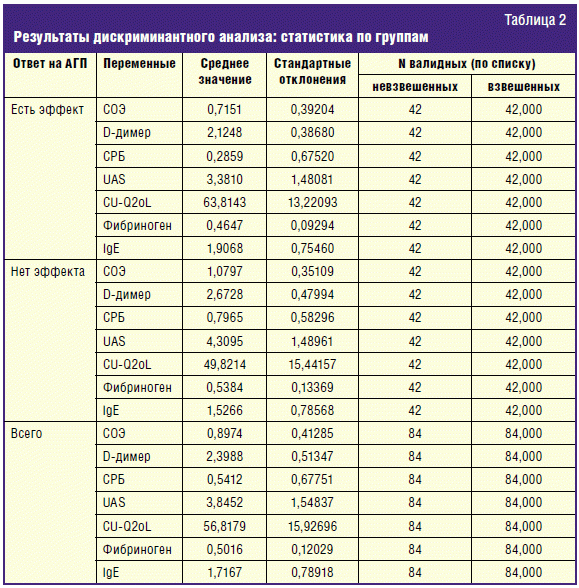
В табл. 2 приведены результаты дискриминантного анализа: средние значения,
стандартные отклонения и количество наблюдений для всех переменных из обеих
групп и для каждой группы в отдельности. По средним значениям уже заметно, что
для больных с хорошим эффектом от АГП характерны: более высокий уровень общего
IgE (1,9 против 1,5) и более низкие уровни D-димера (2,1 против 2,6),
фибриногена (0,46 против 0,53), СРБ (0,28 против 0,79) и СОЭ (8,2 против 16), а
также более высокое КЖ (63,8 против 49,8) и более легкое течение ХСК (3,38
против 4,3).
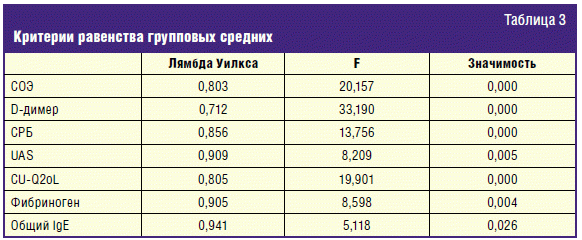
В табл. 3 показано, насколько значимо различаются между собой обе группы
больных по средним значениям используемых переменных. Обнаружено значимое
различие между обеими группами по всем переменным (p < 0,05), что указывает на
то, что эти переменные обладают разделяющими (дискриминирующими) особенностями,
позволяющими судить об отношении к одной из двух групп (хороший/плохой эффект от
АГП).
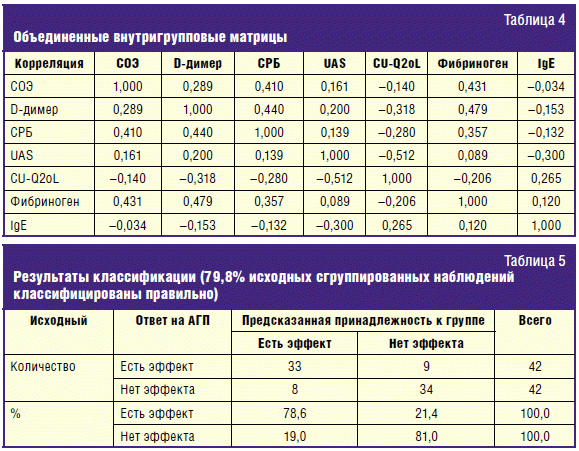
В табл. 4 приводится корреляционная матрица для всех переменных, причем
коэффициенты были рассчитаны для обеих групп, а потом усреднены. Наблюдается
положительная корреляция между уровнями D-димера, фибриногена, СРБ и СОЭ: при
высоком уровне маркеров коагуляции отмечается высокий уровень маркеров
воспаления, и эти показатели чаще наблюдаются у больных с отсутствием эффекта от
АГП. Кроме этого присутствует отрицательная корреляция между значениями КЖ и
уровнями D-димера и СРБ, между уровнем общего IgE и тяжестью болезни, КЖ и
тяжестью болезни и положительная — между IgE и КЖ.
Таким образом, предиктором группы больных с хорошим терапевтическим ответом
от АГП II поколения служит высокий уровень общего IgE, а предикторами больных
ХСК с отсутствием/слабым ответом на АГП — высокий уровень маркеров воспаления (СОЭ,
СРБ) и коагуляции (D-димер, фибриноген). Чтобы отчетливей разделить обе группы,
применяли расчет и анализ коэффициентов дискриминантной функции. Мерой удачности
разделения служит корреляционный коэффициент между рассчитанными значениями
дискриминантной функции и показателем принадлежности к группе. В нашем случае он
равен 0,616, что является удовлетворительным. На «качество» дискриминантной
функции указывает собственное значение, которое в нашем случае равно 0,612 и
указывает на вполне удачно подобранные дискриминантные функции.
Тест Лямбда Уилкса позволяет выяснить, насколько значимо отличаются друг от
друга средние значения дискриминантной функции в обеих группах. В нашем случае
значение Лямбда Уилкса равно 0,620, χ2 — 37,471, а p < 0,001, что
указывает на очень значимое различие.
Результаты классификации с указанием точности попадания прогнозов
представлены в табл. 5. Общее количество наблюдений по каждой из групп оказалось
равно 42. В группе с положительным эффектом от приема АГП корректно
спрогнозировано было 33 наблюдения (78,6%), а 9 наблюдений (21,4%) было по
ошибке отнесено ко второй группе. К группе больных без ответа на АГП было
корректно спрогнозировано 34 наблюдения (81%), а по ошибке отнесено — 8 (19%).
Итоговый результат: 79,8% наблюдений было классифицировано правильно, что может
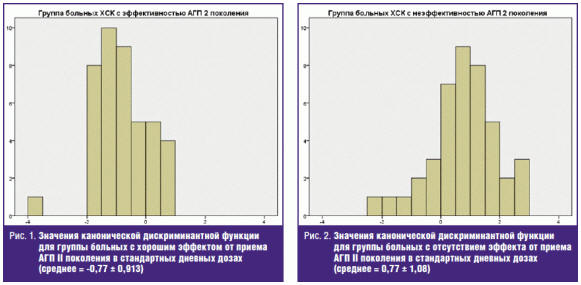
расцениваться как очень хороший результат. Значения канонической дискриминантной
функции представлены на рис. 1 и 2. Отмечается незначительное перекрывание
распределений между обеими группами, что указывает на хорошую дискриминантную
функцию.
Обсуждение
АГП II поколения — препараты выбора для лечения ХСК. Их эффективность и
безопасность доказана во многих научных исследованиях. В стандартных дневных
дозах (как правило, 1 т/сутки) они эффективны лишь у 40–50% больных, а у
остальных требуется повышение их суточной дозы до 2–4 раз («off-label») или
добавление препаратов 2–3 линии (циклоспорин, монтелукаст, омализумаб).
Полученные нами результаты дискриминантного анализа показали, что больные ХСК
могут быть отнесены к одной из двух групп (эндотипов) по терапевтическому ответу
на АГП II поколения в стандартных дневных дозах в зависимости от уровня
прогностических биомаркеров. Для больных с хорошим эффектом от АГП характерны
более высокий уровень общего IgE и более низкие уровни D-димера, фибриногена,
СРБ и СОЭ. Кроме того, мы обнаружили, что высокий уровень общего IgE указывает
на незначительное снижение качества жизни (r = 0,338, p = 0,002) и ХСК легкой
или средней тяжести (r = –0,350, p = 0,001), в отличие от данных других
исследований, где он предлагался как маркер тяжелой ХСК. Можно предположить, что
увеличение общего IgE в сыворотке крови может быть отражением
IgE-аутореактивности и позволяет дифференцировать IgG- и IgE-аутореактивность в
подгруппах больных аутоиммуной ХСК. Это, а также другие возможные причины
повышения общего IgE, например, из-за сопутствующих аллергических заболеваний
требуют дальнейшего изучения.
С одной стороны, измерение уровня общего IgE перед началом лечения позволит
спрогнозировать ответ на стандартные дозы АГП II поколения и тем самым
оптимизировать терапию у больных ХСК. С другой стороны, высокий уровень маркеров
воспаления (СОЭ, СРБ) и активации коагуляции (D-димера, фибриногена) характерен
для больных с отсутствием ответа на стандартные дозы АГП II поколения, тяжелым
заболеванием (r = 0,271, p = 0,013; r = 0,237, p = 0,03 и r = 0,323, p = 0,003
соответственно, кроме фибриногена) и значительно сниженным качеством жизни (r =
–0,309, p = 0,004; r = –0,400, p < 0,001; r = –0,478, p < 0,001 и r = –0,312, p
= 0,004 соответственно). Это предполагает переход на вторую ступень лечения и
увеличение дозы препаратов согласно рекомендациям.
Таким образом, второй эндотип опосредован выраженным воспалением, активацией
каскада коагуляции и, возможно, аутореактивностью IgG, определяемой в виде
положительного теста с аутосывороткой у многих больных. Тем не менее, мы не
выявили статистически значимых различий в ответе на АГП среди больных с ТАС+ и
ТАС-, что отличается от результатов одних исследований и подтверждается данными
других. Таким образом, вопрос, является ли ответ на ТАС значимым маркером
эффективности АГП, требует дальнейшего изучения в большей когорте больных.
Повышение уровня D-димера указывает на активацию коагуляционного каскада в
результате экспрессии тканевого фактора эозинофилами и образования тромбина.
Действие тромбина на рецепторы, активируемые протеазами (PAR) 1 и 2 на ТК,
приводит к дегрануляции ТК, увеличению сосудистой проницаемости с последующим
развитием симптомов ХСК. Предполагается, что активация коагуляции может
возникать в результате активации эозинофилов цитокинами или аутоантителами к
низкоаффинным рецепторам FcεRII. Результаты как нашего, так и более ранних
исследований показали, что повышение уровня D-димера связано с более тяжелым и
активным заболеванием. Мы также обнаружили, что концентрация D-димера чаще
увеличивается у больных с положительным ТАС (р = 0,019), также как и уровень СРБ
(р = 0,031), что может указывать на тесную взаимосвязь коагуляции, воспаления и
IgG-аутореактивности у части больных ХСК.
Обобщенная характеристика выделенных эндотипов представлена в табл. 6.
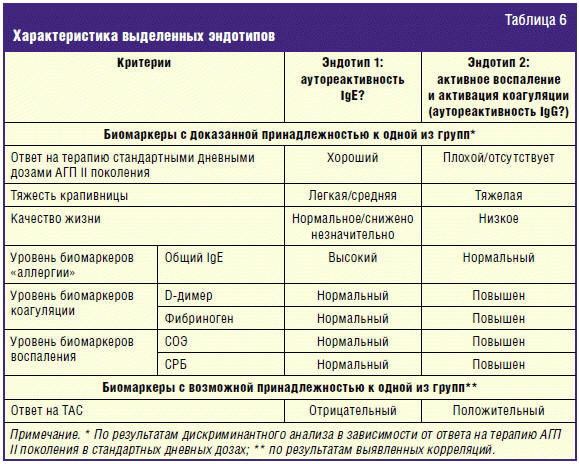
Таким образом, разработанная нами классификация позволяет предсказывать
вероятность наличия или отсутствия ответа на терапию стандартными дневными
дозами АГП II поколения, а также тяжесть заболевания и КЖ больных путем
определения уровней комплекса биомаркеров в сыворотке крови: аллергии (общий IgE),
воспаления (СОЭ, СРБ) и коагуляции (D-димер, фибриноген). Согласно приведенным
данным, эти анализы обладают достаточной степенью достоверности для отнесения
больных к тому или иному эндотипу и при этом являются экономичными и простыми в
исполнении в повседневной клинической практике. Такой подход позволяет в
значительной степени персонифицировать лечение больных ХСК и открывает
перспективы для дальнейшего исследования механизмов IgG- и IgE-аутореактивности,
лежащих в основе развития болезни в подгруппах пациентов с ХСК.
Литература
-
Zuberbier T., Aberer W., Asero R., Bindslev-Jensen C., Brzoza Z.,
Canonica G. W., Church M. K., Ensina L. F., Gimenez-Arnau A., Godse K.,
Goncalo M., Grattan C., Hebert J., Hide M., Kaplan A., Kapp A., Abdul Latiff
A. H., Mathelier-Fusade P., Metz M., Nast A., Saini S. S., Sanchez-Borges M.,
Schmid-Grendelmeier P., Simons F. E., Staubach P., Sussman G., Toubi E., Vena
G. A., Wedi B., Zhu X. J., Maurer M. The EAACI/GA (2) LEN/EDF/WAO
Guideline for the definition, classification, diagnosis, and management of
urticaria: the 2013 revision and update // Allergy. 2014. Т. 69. № 7. С.
868–887. -
Разваляева А. В. Комплексная клинико-экономическая и
фармакоэпидемиологическая оценка противоаллергических препаратов — путь
оптимизации лечения и профилактики аллергодерматозов. Автореф. дис. … д-ра
мед. наук. Волгоград, 2010. -
O’Donnell B. F., Lawlor F., Simpson J., Morgan M., Greaves M. W.
The impact of chronic urticaria on the quality of life // Br J Dermatol. 1997.
Т. 136. № 2. С. 197–201. -
Bernstein J. A., Lang D. M., Khan D. A., Craig T., Dreyfus D., Hsieh
F., Sheikh J., Weldon D., Zuraw B., Bernstein D. I., Blessing-Moore J., Cox
L., Nicklas R. A., Oppenheimer J., Portnoy J. M., Randolph C. R., Schuller D.
E., Spector S. L., Tilles S. A., Wallace D. The diagnosis and management
of acute and chronic urticaria: 2014 update // J Allergy Clin Immunol. 2014.
Т. 133. № 5. С. 1270–1277. -
Humphreys F., Hunter J. A. The characteristics of urticaria in
390 patients // Br J Dermatol. 1998. Т. 138. № 4. С. 635–638. -
Stitt J. M., Dreskin S. C. Urticaria and autoimmunity: where are
we now? // Curr Allergy Asthma Rep. 2013. Т. 13. № 5. С. 555–562. -
Bagnasco M., Minciullo P. L., Saraceno G. S., Gangemi S., Benvenga S.
Urticaria and thyroid autoimmunity // Thyroid. 2011. Т. 21. № 4. С.
401–410. -
Napoli D. C., Freeman T. M. Autoimmunity in chronic urticaria and
urticarial vasculitis // Curr Allergy Asthma Rep. 2001. Т. 1. № 4. С. 329–336. -
Grattan C. E., Boon A. P., Eady R. A., Winkelmann R. K. The
pathology of the autologous serum skin test response in chronic urticaria
resembles IgE-mediated late-phase reactions // Int Arch Allergy Appl Immunol.
1990. Т. 93. № 2–3. С. 198–204. -
Lopes A., Machado D., Pedreiro S., Henriques A., Silva I., Tavares B.,
Inacio M. J., Chieira C., Martinho A., Pais M. L., Pereira C., Paiva A.
Different frequencies of Tc17/Tc1 and Th17/Th1 cells in chronic spontaneous
urticaria // Int Arch Allergy Immunol. 2013. Т. 161. № 2. С. 155–162. -
Atwa M. A., Emara A. S., Youssef N., Bayoumy N. M. Serum
concentration of IL-17, IL-23 and TNF-alpha among patients with chronic
spontaneous urticaria: association with disease activity and autologous serum
skin test // J Eur Acad Dermatol Venereol. 2014. Т. 28. № 4. С. 469–474. -
Chang T. W., Chen C., Lin C. J., Metz M., Church M. K., Maurer M.
The potential pharmacologic mechanisms of omalizumab in patients with chronic
spontaneous urticaria // J Allergy Clin Immunol. 2014. -
Konstantinou G. N., Asero R., Ferrer M., Knol E. F., Maurer M., Raap
U., Schmid-Grendelmeier P., Skov P. S., Grattan C. E. EAACI taskforce
position paper: evidence for autoimmune urticaria and proposal for defining
diagnostic criteria // Allergy. 2013. Т. 68. № 1. С. 27–36. -
Neverman L., Weinberger M. Treatment of chronic urticaria in
children with antihistamines and cyclosporine // J Allergy Clin Immunol Pract.
2014. Т. 2. № 4. С. 434–438. -
O’Donnell B. F., O’Neill C. M., Francis D. M., Niimi N., Barr R. M.,
Barlow R. J., Kobza Black A., Welsh K. I., Greaves M. W. Human leucocyte
antigen class II associations in chronic idiopathic urticaria // Br J Dermatol.
1999. Т. 140. № 5. С. 853–858. -
Cebeci F., Tanrikut A., Topcu E., Onsun N., Kurtulmus N., Uras A. R.
Association between chronic urticaria and thyroid autoimmunity // Eur J
Dermatol. 2006. Т. 16. № 4. С. 402–405. -
Kaplan A. P. Chronic urticaria: pathogenesis and treatment // J
Allergy Clin Immunol. 2004. Т. 114. № 3. С. 465–474; quiz 475. -
Tong L. J., Balakrishnan G., Kochan J. P., Kinet J. P., Kaplan A. P.
Assessment of autoimmunity in patients with chronic urticaria // J Allergy
Clin Immunol. 1997. Т. 99. № 4. С. 461–465. -
Gruber B. L., Baeza M. L., Marchese M. J., Agnello V., Kaplan A. P.
Prevalence and functional role of anti-IgE autoantibodies in urticarial
syndromes // J Invest Dermatol. 1988. Т. 90. № 2. С. 213–217. -
Hide M., Francis D. M., Grattan C. E., Hakimi J., Kochan J. P.,
Greaves M. W. Autoantibodies against the high-affinity IgE receptor as a
cause of histamine release in chronic urticaria // N Engl J Med. 1993. Т. 328.
№ 22. С. 1599–1604. -
Fiebiger E., Maurer D., Holub H., Reininger B., Hartmann G.,
Woisetschlager M., Kinet J. P., Stingl G. Serum IgG autoantibodies
directed against the alpha chain of Fc epsilon RI: a selective marker and
pathogenetic factor for a distinct subset of chronic urticaria patients? // J
Clin Invest. 1995. Т. 96. № 6. С. 2606–2612. -
Ferrer M., Kinet J. P., Kaplan A. P. Comparative studies of
functional and binding assays for IgG anti-Fc (epsilon)RIalpha (alpha-subunit)
in chronic urticaria // J Allergy Clin Immunol. 1998. Т. 101. № 5. С. 672–676. -
Hatada Y., Kashiwakura J., Hayama K., Fujisawa D., Sasaki-Sakamoto T.,
Terui T., Ra C., Okayama Y. Significantly high levels of anti-dsDNA
immunoglobulin E in sera and the ability of dsDNA to induce the degranulation
of basophils from chronic urticaria patients // Int Arch Allergy Immunol.
2013. Т. 161 Suppl 2. С. 154–158. -
Kashiwakura J., Okayama Y., Furue M., Kabashima K., Shimada S., Ra C.,
Siraganian R. P., Kawakami Y., Kawakami T. Most Highly Cytokinergic IgEs
Have Polyreactivity to Autoantigens // Allergy Asthma Immunol Res. 2012. Т. 4.
№ 6. С. 332–340. -
Atta A. M., Sousa C. P., Carvalho E. M., Sousa-Atta M. L.
Immunoglobulin E and systemic lupus erythematosus // Braz J Med Biol Res.
2004. Т. 37. № 10. С. 1497–1501. -
Atta A. M., Santiago M. B., Guerra F. G., Pereira M. M., Sousa Atta M.
L. Autoimmune response of IgE antibodies to cellular self-antigens in
systemic Lupus Erythematosus // Int Arch Allergy Immunol. 2010. Т. 152. № 4.
С. 401–406. -
Konstantinou G. N., Asero R., Maurer M., Sabroe R. A.,
Schmid-Grendelmeier P., Grattan C. E. EAACI/GA (2)LEN task force
consensus report: the autologous serum skin test in urticaria // Allergy.
2009. Т. 64. № 9. С. 1256–1268. -
Ucmak D., Akkurt M., Toprak G., Yesilova Y., Turan E., Yildiz I.
Determination of dermatology life quality index, and serum C-reactive protein
and plasma interleukin-6 levels in patients with chronic urticaria // Postepy
Dermatol Alergol. 2013. Т. 30. № 3. С. 146–151. -
Takahagi S., Mihara S., Iwamoto K., Morioke S., Okabe T., Kameyoshi
Y., Hide M. Coagulation/fibrinolysis and inflammation markers are
associated with disease activity in patients with chronic urticaria // Allergy.
2010. Т. 65. № 5. С. 649–656. -
Piconi S., Trabattoni D., Iemoli E., Fusi M. L., Villa M. L., Milazzo
F., Clerici M. Immune profiles of patients with chronic idiopathic
urticaria // Int Arch Allergy Immunol. 2002. Т. 128. № 1. С. 59–66. -
Papadopoulos N. G., Agache I., Bavbek S., Bilo B. M., Braido F.,
Cardona V., Custovic A., Demonchy J., Demoly P., Eigenmann P., Gayraud J.,
Grattan C., Heffler E., Hellings P. W., Jutel M., Knol E., Lotvall J., Muraro
A., Poulsen L. K., Roberts G., Schmid-Grendelmeier P., Skevaki C., Triggiani
M., Vanree R., Werfel T., Flood B., Palkonen S., Savli R., Allegri P.,
Annesi-Maesano I., Annunziato F., Antolin-Amerigo D., Apfelbacher C., Blanca
M., Bogacka E., Bonadonna P., Bonini M., Boyman O., Brockow K., Burney P.,
Buters J., Butiene I., Calderon M., Cardell L. O., Caubet J. C., Celenk S.,
Cichocka-Jarosz E., Cingi C., Couto M., Dejong N., Del Giacco S., Douladiris
N., Fassio F., Fauquert J. L., Fernandez J., Rivas M. F., Ferrer M., Flohr C.,
Gardner J., Genuneit J., Gevaert P., Groblewska A., Hamelmann E., Hoffmann H.
J., Hoffmann-Sommergruber K., Hovhannisyan L., Hox V., Jahnsen F. L., Kalayci
O., Kalpaklioglu A. F., Kleine-Tebbe J., Konstantinou G., Kurowski M., Lau S.,
Lauener R., Lauerma A., Logan K., Magnan A., Makowska J., Makrinioti H.,
Mangina P., Manole F., Mari A., Mazon A., Mills C., Mingomataj E., Niggemann
B., Nilsson G., Ollert M., O’Mahony L., O’Neil S., Pala G., Papi A.,
Passalacqua G., Perkin M., Pfaar O., Pitsios C., Quirce S., Raap U.,
Raulf-Heimsoth M., Rhyner C., Robson-Ansley P., Alves R. R., Roje Z., Rondon
C., Rudzeviciene O., Rueff F., Rukhadze M., Rumi G., Sackesen C., Santos A.
F., Santucci A., Scharf C., Schmidt-Weber C., Schnyder B., Schwarze J., Senna
G., Sergejeva S., Seys S., Siracusa A., Skypala I., Sokolowska M., Spertini
F., Spiewak R., Sprikkelman A., Sturm G., Swoboda I., Terreehorst I., Toskala
E., Traidl-Hoffmann C., Venter C., Vlieg-Boerstra B., Whitacker P., Worm M.,
Xepapadaki P., Akdis C. A. Research needs in allergy: an EAACI position
paper, in collaboration with EFA // Clin Transl Allergy. 2012. Т. 2. № 1. С.
21. -
Zuberbier T., Asero R., Bindslev-Jensen C., Walter Canonica G., Church
M. K., Gimenez-Arnau A., Grattan C. E., Kapp A., Merk H. F., Rogala B., Saini
S., Sanchez-Borges M., Schmid-Grendelmeier P., Schunemann H., Staubach P.,
Vena G. A., Wedi B., Maurer M. EAACI/GA (2)LEN/EDF/WAO guideline:
definition, classification and diagnosis of urticaria // Allergy. 2009. Т. 64.
№ 10. С. 1417–1426. -
Некрасова Е. Е., Разваляева А. В., Малюжинская Н. В. Разработка
русской версии опросника CU-Q2oL для изучения качества жизни у пациентов с
хронической крапивницей // Саратовский научно-медицинский журнал. 2010. Т. 4.
С. 282–285. -
Baiardini I., Pasquali M., Braido F., Fumagalli F., Guerra L.,
Compalati E., Braga M., Lombardi C., Fassio O., Canonica G. W. A new tool
to evaluate the impact of chronic urticaria on quality of life: chronic
urticaria quality of life questionnaire (CU-QoL) // Allergy. 2005. Т. 60. № 8.
С. 1073–1078. -
Zuberbier T., Grattan C., Maurer M. Urticaria and angioedema.
Berlin: Springer, 2010. -
Mlynek A., Zalewska-Janowska A., Martus P., Staubach P., Zuberbier T.,
Maurer M. How to assess disease activity in patients with chronic
urticaria? // Allergy. 2008. Т. 63. № 6. С. 777–780. -
Оносов А. А. Многомерный статистический анализ в прикладных
социологических исследованиях. Учебное пособие курса подготовки по
специальности «Социология». М.: РУДН, факультет гуманитарных и социальных
наук, кафедра социологии, 2012. -
Charles N., Hardwick D., Daugas E., Illei G. G., Rivera J.
Basophils and the T helper 2 environment can promote the development of lupus
nephritis // Nat Med. 2010. Т. 16. № 6. С. 701–707. -
Sabroe R. A., Seed P. T., Francis D. M., Barr R. M., Black A. K.,
Greaves M. W. Chronic idiopathic urticaria: comparison of the clinical
features of patients with and without anti-FcepsilonRI or anti-IgE
autoantibodies // J Am Acad Dermatol. 1999. Т. 40. № 3. С. 443–450. -
Caproni M., Volpi W., Giomi B., Cardinali C., Antiga E., Melani L.,
Dagata A., Fabbri P. Chronic idiopathic and chronic autoimmune urticaria:
clinical and immunopathological features of 68 subjects // Acta Derm Venereol.
2004. Т. 84. № 4. С. 288–290. -
Staubach P., Onnen K., Vonend A., Metz M., Siebenhaar F., Tschentscher
I., Opper B., Magerl M., Ludtke R., Kromminga A., Maurer M. Autologous
whole blood injections to patients with chronic urticaria and a positive
autologous serum skin test: a placebo-controlled trial // Dermatology. 2006.
Т. 212. № 2. С. 150–159. -
Kulthanan K., Jiamton S., Gorvanich T., Pinkaew S. Autologous
serum skin test in chronic idiopathic urticaria: prevalence, correlation and
clinical implications // Asian Pac J Allergy Immunol. 2006. Т. 24. № 4. С.
201–206. -
Staubach P., Eckhardt-Henn A., Dechene M., Vonend A., Metz M., Magerl
M., Breuer P., Maurer M. Quality of life in patients with chronic
urticaria is differentially impaired and determined by psychiatric comorbidity
// Br J Dermatol. 2006. Т. 154. № 2. С. 294–298. -
Tedeschi A., Kolkhir P., Asero R., Pogorelov D., Olisova O., Kochergin
N., Cugno M. Chronic urticaria and coagulation: pathophysiological and
clinical aspects // Allergy. 2014. Т. 69. № 6. С. 683–691. -
Asero R., Tedeschi A., Cugno M. Heparin and tranexamic Acid
therapy may be effective in treatment-resistant chronic urticaria with
elevated d-dimer: a pilot study // Int Arch Allergy Immunol. 2010. Т. 152. №
4. С. 384–389. -
Ver Elst K., Jochmans K., De Pauw A., De Waele M. Plasma D-dimer
concentrations in different clinical conditions // Acta Clin Belg. 2002. Т.
57. № 6. С. 325–330. -
Criado P. R., Antinori L. C., Maruta C. W., Reis V. M. Evaluation
of D-dimer serum levels among patients with chronic urticaria, psoriasis and
urticarial vasculitis // An Bras Dermatol. 2013. Т. 88. № 3. С. 355–360. -
Asero R., Tedeschi A., Riboldi P., Griffini S., Bonanni E., Cugno M.
Severe chronic urticaria is associated with elevated plasma levels of
D-dimer // Allergy. 2008. Т. 63. № 2. С. 176–180. -
Magen E., Mishal J., Zeldin Y., Feldman V., Kidon M., Schlesinger M.,
Sthoeger Z. Increased mean platelet volume and C-reactive protein levels
in patients with chronic urticaria with a positive autologous serum skin test
// Am J Med Sci. 2010. Т. 339. № 6. С. 504–508.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru