Введение
Саркопения — это дегенеративное и генерализованное заболевание скелетных мышц, характеризующееся возрастной потерей мышечной массы и силы с нарушением функции, определенное в качестве болезни Международной классификацией болезней (МКБ-10-КМ) в 2016 г., поражает до 10% лиц старше 60 лет и имеет серьезные последствия для систем здравоохранения во всем мире [1]. Саркопения способствует увеличению расходов на здравоохранение из-за повторных госпитализаций, потребностей в длительном уходе [2], ограничивает независимость, снижает качество жизни, у пациентов отмечается снижение физической работоспособности, они испытывают трудности в повседневной жизни [3].
Показатель распространенности саркопении, параметры эффективности лечебных технологий по увеличению мышечной массы или мышечной силы широко варьируют в зависимости от используемого определения этого термина [4], в связи с чем сегодня разрабатываются определения, диагностические критерии, классификация саркопении [5].
Постепенное уменьшение размера и количества мышечных волокон приводит к снижению мышечной массы примерно на 40% с 20 до 80 лет [2]. Саркопения появляется в результате сочетания внутренних факторов, изменяющих энергетическое обеспечение на молекулярном и клеточном уровнях, и внешних факторов (питание, физические упражнения) [6].
При саркопении в большей степени страдают мышечные волокна II типа, отвечающие за действия, требующие силы, и связанные с массой мышц и их функцией. Волокна I типа сохраняют свою функцию при нормальном старении [7]. Коактиватор γ-рецептора, активируемого пролифератором пероксисом, 1-α (PPAR1α) защищает волокна I типа от атрофии, в то время как семейство трансформирующих факторов роста β (TGFβ) и ядерный фактор каппа B (NF-κB) влияют на волокна II типа [8]. Изменения в скелетных мышцах при саркопении связаны с накоплением липофусцина, перекисным окислением липидов и увеличением делеций митохондриальной ДНК [9]. Показана роль циркулирующих факторов (слабый индуктор апоптоза, подобный фактору некроза опухоли (ФНО), интерлейкин (ИЛ)18, лептин, инсулиноподобный фактор роста 1 (ИФР-1), инсулин, адипонектин) в развитии саркопении. Микронутриенты с антиоксидантной активностью снижают последствия окислительного стресса при саркопении [10]. Прием витамина D улучшает качество работы скелетных мышц [11]. Показана связь между ожирением и саркопенией [12].
Остеоартрит (ОА), распространенность которого составила 7,6% населения в мире в 2020 г. [13], и хроническая боль у пациентов пожилого возраста ускоряют прогрессирование саркопении и требуют оптимизации терапевтических подходов. Распространенность саркопении среди женщин старше 70 лет с ОА была в 1,6 раза выше, чем у женщин без ОА [14]. Ожирение с саркопенией способствует более быстрому прогрессированию ОА КС по сравнению с ожирением без саркопении [15].
Увеличение содержания провоспалительных цитокинов ФНО-α и ИЛ-6 вызывает экспрессию атрогина-1 и MuRF-1, способствуя распаду и уменьшая синтез белков мышц [16], активирует путь NF-κB в хондроцитах и синовиоцитах, приводящий к апоптозу хондроцитов, деградации внеклеточного матрикса хряща и дисфункции субхондральной кости (СК) при ОА [17].
Основные направления профилактики или лечения саркопении включают коррекцию питания, физические упражнения и фармакологические стратегии [18]. Целью превентивной лекарственной стратегии саркопении является блокада старения клеток скелетных мышц и сателлитных клеток с хроническим повышением активности секреторного фенотипа старения (senescence-associated secretory phenotype, SASP) и воспалительным процессом в скелетных мышцах, что было подтверждено в экспериментальном исследовании [19]. Противовоспалительным и миопротективным действием на уровне скелетных мышц и сателлитных клеток при саркопении обладает фармацевтически активная субстанция хондроитина сульфата (ХС) (препарат Хондрогард®, ЗАО «ФармФирма «Сотекс», Россия)1. В России в клинических рекомендациях «Хроническая боль у пациентов пожилого и старческого возраста» (2020 г.) представлены режимы назначения ХС пациентам старше 60 лет с болью в суставах и противопоказаниями к приему нестероидных противовоспалительных препаратов (НПВП) или со старческой астенией для купирования боли и профилактики ее обострений (уровень убедительности рекомендации — A, уровень достоверности доказательств — 1)1 [20, 21]. ХС в рамках базисной терапии ОА имеет доказанные симптом- и структурно-модифицирующие эффекты [22–24], связанные с влиянием на ангиогенные процессы в синовии и неоиннервацию в условиях ремоделирования в СК. ХС претендует на активность в отношении саркопении у пациентов с декомпенсированной формой ОА и показаниями к тотальному эндопротезированию (ТЭ) [25]. Накапливаются данные о применении коллагенов в терапии саркопении [26].
Цель исследования: анализ эффективности и безопасности болезнь-модифицирующей терапии и вспомогательной поддержки саркопении парентеральной формой высокоочищенного ХС и фармаконутрицевтиком у пожилых пациентов с ОА КС III стадии по Kellgren — Lawrence и функциональной недостаточностью (ФН) суставов 2-й степени при ТЭ КС.
Содержание статьи
Материал и методы
Проведено открытое проспективное контролируемое рандомизированное исследование с участием пожилых пациентов с ОА КС III стадии по Kellgren — Lawrence, ФН суставов 2-й степени и саркопенией. В контралатеральном суставе идентифицирован ОА II стадии по Kellgren — Lawrence. Пациенты с ОА КС в стадии обострения и саркопенией соответствовали диагностическим критериям и алгоритмам специализированной медицинской помощи, представленным в Клинических рекомендациях «Старческая астения» (2024) [27], методических рекомендациях «Общие принципы фармакотерапии у лиц пожилого и старческого возраста» (2019) [28].
Критерии включения в исследование: возраст старше 65 лет; наличие рентгенологически подтвержденного ОА КС III стадии по Kellgren — Lawrence, соответствующего классификационным критериям ОА КС и диагностическим критериям ОА КС EULAR (European Alliance of Associations for Rheumatology) (2010 г.); ФН 2; декомпенсированная форма заболевания; отсутствие любых заболеваний суставов в период до появления ОА КС; интенсивность боли в покое не менее 40 мм и при ходьбе не менее 55 мм по визуальной аналоговой шкале (ВАШ); функциональный индекс Лекена >8 и <13 баллов; подтвержденная саркопения (4 или более баллов по простому опроснику для быстрой диагностики саркопении (SARC-F); лучший показатель динамометрии <16 кг у женщин и <23 кг у мужчин; тест «5 подъемов со стула» не менее 12 с; индекс скелетных мышц по двухэнергетической рентгеновской абсорбциометрии (DXA) <5,5 кг/м2 у женщин и <7,0 кг/м2 у мужчин); отсутствие терапии препаратами из группы симптоматических лекарственных средств замедленного действия (СЛСЗД) и приема биологически активных добавок на протяжении минимум 60 дней до включения в исследование; подписанное информированное согласие на участие в клиническом исследовании.
Критерии невключения: впервые возникшая боль в суставах в течение ближайших 3 нед.; боль при ходьбе <40 мм по ВАШ; хирургическое лечение в анамнезе; аутоиммунные, онкологические заболевания, болезни крови; наличие грубых и обширных посттравматических рубцов, спаянных с подлежащей костью в области КС; признаки острого тромбофлебита; психические нарушения; умеренные и тяжелые когнитивные нарушения; болезнь Паркинсона; обострение сердечно-сосудистых заболеваний; высокий и очень высокий кардиоваскулярный риск; хроническая болезнь почек со скоростью клубочковой фильтрации <50 мл/мин; декомпенсированная стадия сахарного диабета и заболеваний щитовидной железы; печеночная недостаточность; гипергидратация; жалобы на диспепсию; обострение язвенной болезни желудка или двенадцатиперстной кишки за последний год; хронический эрозивный гастрит; лечение пероральными формами ХС и/или глюкозамином, коллагеном и его пептидами, диацереином, неомыляемыми соединениями авокадо и сои; индивидуальная непереносимость ХС, НПВП; участие в другом клиническом исследовании по препаратам из группы СЛСЗД, НПВП, коллагену, диацереину, неомыляемым соединениям авокадо и сои в течение 60 дней до начала исследования; наличие административных препятствий.
Проведение исследования одобрено независимым этическим комитетом ГБУЗ РБ ГКБ № 13, г. Уфа (протокол № 11/2 от 01.03.2024). Клиническое исследование выполнено на базе ФГБОУ ВО БГМУ Минздрава России, ООО «Башкирский НИИ травматологии и ортопедии» (Уфа), ООО «Медицинский центр «Новомедицина» (Ростов-на-Дону).
Пациентам обеих групп назначили стандартную терапию саркопении: прием витамина D 2000 МЕ/сут, индивидуальная диета с содержанием белка 1,5 г на 1 кг массы тела, не менее 5 порций овощей и фруктов ежедневно, 3 г лейцина, комплекс физических упражнений, рассчитанный на 175 мин в неделю. С целью терапии боли пациенты получали целекоксиб в дозе 200 мг/сут при включении в исследование со снижением дозы до 100 мг/сут или отказом от применения при купировании боли, местную форму мелоксикама с отказом от применения при отсутствии необходимости в использовании.
В зависимости от получаемой до ТЭ КС терапии сформированы 2 группы: контрольная группа (КГ, n=30), где пациенты получали только стандартную терапию (СРТ): НПВП (целекоксиб, местная форма мелоксикама) в стандартной суточной дозе, и основная группа (ОГ, n=32), где пациенты в дополнение к НПВП получали курс парентеральной формы ХС (Хондрогард®) внутримышечно через день за 2 мес. до проведения ТЭ КС: первые 3 инъекции в дозе 100 мг/сут; при хорошей переносимости начиная с 4-й инъекции, в дозе 200 мг/сут (курс — 25 инъекций) и вспомогательную фармаконутрицевтическую поддержку Хондрогард®ТРИО (состав: глюкозамина сульфат (ГС) — 1500 мг, ХС — 1200 мг, неденатурированный коллаген II типа — 40 мг) после выписки из стационара в течение 2 мес.
Проводили рентгенографию КС в прямой и боковой проекциях. ТЭ КС осуществляли на основе данных рентгенометрического анализа по методике C. Ranawat [29]. Применяли системы полусвязанной фиксации без сохранения крестообразных связок. Выполняли парапателлярный доступ к суставу, релиз мягких тканей, вскрытие канала бедренной кости, резекцию эпифизов бедренной (с внутренней навигацией) и большеберцовой (с наружной навигацией) костей и цементную фиксацию компонентов эндопротеза. При наличии остеофитов проводили краевую моделирующую резекцию надколенника. Для морфологического анализа были получены биообразцы медиальной головки четырехглавой мышцы бедра, которые фиксировали в 10% нейтральном формалине, заливали в парафин. Срезы толщиной 4–5 мкм готовили на микротоме и окрашивали гематоксилином и эозином. Структуру биоптата изучали с помощью цифрового сканирующего микроскопа 3DHISTECH Pannoramic 250 Flash (Carl Zeiss, Германия) с увеличением 125 и 250. Количественный анализ морфологических параметров проведен в пакете ImagrJ 1.46 (https://imagej.nih.gov/ij/). Расчеты выполнены с помощью стереометрического анализа.
На визите 0 за 50 дней до ТЭ КС, визите 1 на 14-й день после операции, при выписке из стационара, визите 2 через 74±2 дня после ТЭ КС оценивали интенсивность боли по ВАШ в покое и при ходьбе, по KOOS (The Knee injury and Osteoarthritis Outcome Score, шкала оценки результатов при травмах колена и остеоартрите) и WOMAC (The Western Ontario and McMaster Universities Osteoarthritis Index, Индекс оценки остеоартрита университетов Западного Онтарио и МакМастера), индекс Лекена, выраженность саркопении по шкале SARC-F (A Simple Questionnaire to Rapidly Diagnose Sarcopenia, опросник для скрининга саркопении), результаты динамометрии и теста «5 подъемов со стула», количественные измерения мышечной массы (индекс скелетных мышц, DEXA STRATOS, DMS, Франция).
Проведен анализ лабораторных тестов в образцах крови, полученных у пациентов натощак на визитах 0, 1 и 2: альбумина сыворотки, лептина, С-реактивного белка (СРБ), ИЛ-6 ФНО-α, ИЛ-1β, N-терминального пропептида коллагена IIα (РIIANP), BDNF, миостатина, фоллистатина, ИФР-1 дегидроэпиандростерон-сульфата (ДГЭАС), кортизола в крови на иммунохимическом анализаторе Cobas 6000 (Roche Diagnostics, Швейцария), 25(OH)D3 на иммунохемилюминесцентном анализаторе UniCel DxI 800 (Beckman Coulter, США), витамина С, общих каротиноидов, α-токоферола в крови на высокоэффективном жидкостном хроматографе-масс-спектрометре (Agilent 6230B TOF LC/MS, США), индекса саркопении, определяемого по формуле: сывороточный креатинин (мг/дл) / сывороточный цистатин C (мг/л) × 100.
Оценку безопасности терапии парентеральным препаратом ХС и вспомогательной поддержки фармаконутрицевтиком проводили путем оценки частоты, характера, выраженности, длительности нежелательных явлений и их связи с приемом препарата и фармаконутрицевтика по шкалам ВОЗ и Наранжо согласно международному словарю нежелательных реакций (Medical Dictionary for Regulatory Activities Terminology, MedDRA).
Статистический анализ данных выполнили в программах Statistica 10.0, XLSTAT version 2019.3.2 (США). Рандомизацию проводили методом стратифицированной случайной выборки на основе стратифицирующих переменных (возраст, масса тела, рост, пол, среднее число коморбидных заболеваний, индекс коморбидности Charlson, интенсивность боли по ВАШ, KOOS, WOMAC, ФН по индексу Лекена, продолжительность обострения болевого синдрома в КС, рентгенологическая стадия ОА по Kellgren — Lawrence). Рассчитан объем выборки, необходимый для 90% мощности обнаружения значимого различия при применении СРТ и оптимизированного режима лечения, вспомогательной поддержки саркопении у пожилых пациентов с ОА КС в стадии обострения.
Нормальность распределения количественных данных оценивали с помощью теста Колмогорова — Смирнова. Количественные данные представлены как среднее и стандартное отклонение (M±SD) и медиана и квартили Mе [Q1; Q3]. Для оценки межгрупповых различий применяли U-тест Манна — Уитни, внутригрупповых различий — критерий Уилкоксона. Для сравнения частот показателей использовали точный критерий Фишера. Статистически значимыми считали различия при р<0,05.
Результаты исследования
Объекты (участники) исследования
Включено 62 пациента (24 мужчины и 38 женщин в возрасте 65–73 лет), соответствовавших критериям включения. Средняя клиническая длительность ОА КС — 10±3 года, дебют заболевания — в возрасте 52±5 лет. Пациенты обеих групп существенно не различались по анализируемым показателям (табл. 1).

На визите 0 у всех пациентов верифицировали умеренную и сильную боль по ВАШ в покое и при ходьбе, по WOMAC, KOOS, резкое ограничение жизнедеятельности по индексу Лекена, саркопению по медиане балльной оценки SARC-F (≥4 баллов), результатам тестов определения мышечной силы (лучший результат динамометрии <16 кг у женщин и <23 кг у мужчин; тест «5 подъемов со стула» более 16 с) и количественным показателям мышечной массы (DXA <5 кг/м2 у женщин и <6,0 кг/м2 у мужчин) (табл. 2).
![Таблица 2. Результаты скрининга и диагностики болевого синдрома и саркопении у пациентов групп исследования, Mе [Q1; Q3] Таблица 2. Результаты скрининга и диагностики болевого синдрома и саркопении у пациентов групп исследования, Mе [Q1; Q3]](https://medblog.su/wp-content/uploads/2025/12/1766496093_410_Effektivnost-patogeneticheskoj-korrektsii-sarkopenii-u-patsientov-s-osteoartritom-Minasov.png)
В ОГ на фоне приема препарата ХС отметили динамику показателей боли, функции суставов и скрининга саркопении на визите 1: значимое уменьшение интенсивности боли по ВАШ до уровня умеренной боли в покое и при ходьбе в диапазоне 45–49 и 53–57 мм соответственно, медианы боли по WOMAC и интенсивности боли по KOOS, существенное уменьшение ФН в суставах по индексу Лекена, выраженности саркопении по SARC-F и показателю теста «5 подъемов со стула» при значимом увеличении медианы теста определения мышечной силы и отсутствии динамики теста динамометрии у пациентов в сравнении с показателями в ОГ на визите 0 и в КГ на визите 1, за исключением динамометрии, где не было различий в день визита 1 в ОГ и КГ (см. табл. 2).
На визите 1 в КГ зарегистрировали динамику интенсивности боли, ФН и скрининга саркопении, аналогичную таковой в ОГ; динамика показателей в КГ оказалась менее выраженной в сравнении с таковой в ОГ на визите 1 (см. табл. 2).
На визите 2, после окончания курса фармаконутрицевтика в ОГ, отметили динамику показателей боли, функции суставов и скрининга саркопении: значимое уменьшение выраженности боли по ВАШ в покое и при ходьбе в пределах диапазона умеренной боли 40–46 и 50–56 мм соответственно, медианы боли по WOMAC и интенсивности боли по KOOS, существенное уменьшение ФН в суставах по индексу Лекена, выраженности саркопении по SARC-F и показателя теста «5 подъемов со стула» при выраженном увеличении медианы теста определения мышечной силы и отсутствии динамики теста динамометрии при сравнении с показателями в ОГ на визите 0 и в КГ на визите 2, отмечены значимые различия по показателю динамометрии на визите 2 в ОГ и КГ (см. табл. 2).
По результатам оценки на визите 2 прием СРТ саркопении пожилыми пациентами с ОА и болью в КС сопровождался динамикой интенсивности боли, ФН и скрининга саркопении, аналогичной таковой у пациентов ОГ, однако менее выраженной (см. табл. 2).
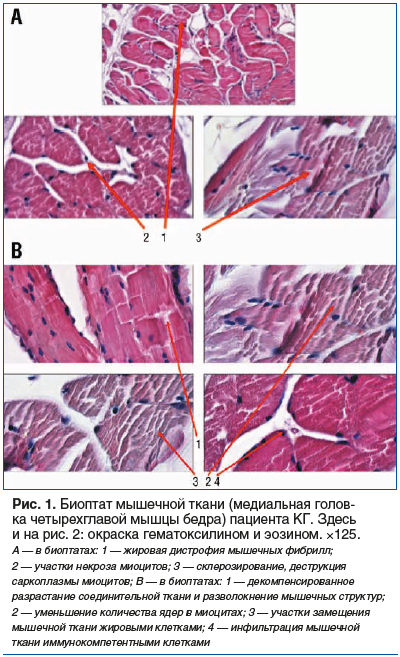
При оценке морфологии биоптата медиальной головки четырехглавой мышцы бедра в КГ выявлены декомпенсация в увеличении объема соединительной ткани, разволокнение мышечных структур, склерозирование и деструкция саркоплазмы миоцитов, уменьшение количества ядер в миоцитах и участки некроза, замещение мышечной ткани жировыми клетками и жировая дистрофия миофибрилл, инфильтрация мышечной ткани иммунокомпетентными клетками (рис. 1).
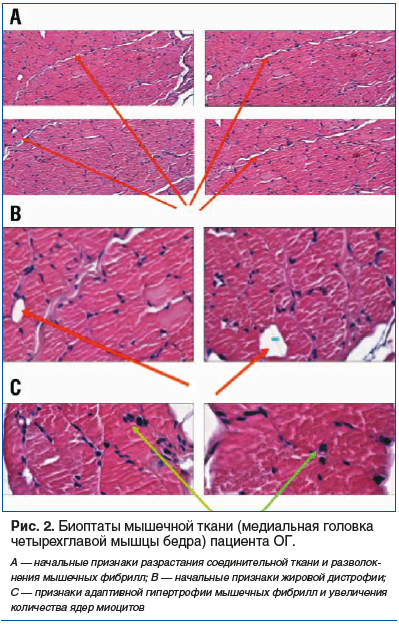
Оценка морфологии биоптата медиальной головки четырехглавой мышцы бедра при приеме парентеральной формы препарата ХС выявила признаки адаптивной гипертрофии миофибрилл, увеличения количества ядер миоцитов, начальные признаки разрастания соединительной ткани и разволокнения миофибрилл, начальные признаки жировой дистрофии (рис. 2).
На визите 0 у всех пациентов зарегистрировали изменения лабораторных показателей, связанных с саркопенией: значимое снижение уровней альбумина, 25(ОН)D3, каротиноидов, α-токоферола, BDNF, ИФР-1, ДГЭАС в крови, индекса саркопении при существенном увеличении уровня витамина С и маркеров системного воспаления в крови — уровней СРБ, ИЛ-6, ИЛ-1β, ФНО-α, лептина, а также РIIANP, миостатина, фоллистатина, кортизола в крови по сравнению с показателями у пожилых лиц без саркопении (см. табл. 3).
![Таблица 3. Содержание биомаркеров в крови у пациентов групп исследования до и после операции, Mе [Q1; Q3] Таблица 3. Содержание биомаркеров в крови у пациентов групп исследования до и после операции, Mе [Q1; Q3]](https://medblog.su/wp-content/uploads/2025/12/1766496093_237_Effektivnost-patogeneticheskoj-korrektsii-sarkopenii-u-patsientov-s-osteoartritom-Minasov.png)
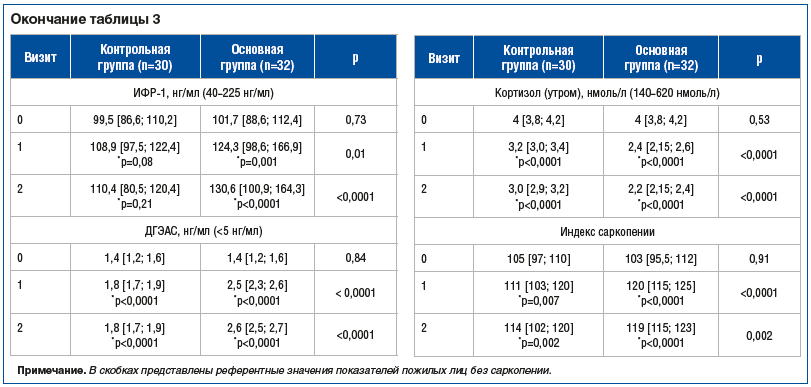
На визите 1 в ОГ, получившей курс парентерального препарата ХС, отмечено значимое увеличение уровней альбумина, 25(ОН)D3, общих каротиноидов, BDNF, ИФР-1, ДГЭАС в крови и индекса саркопении, существенное снижение системного воспаления — уровней СРБ, ИЛ-6, ИЛ-1β, ФНО-α, лептина, а также РIIANP, миостатина, фоллистатина и кортизола в крови, отсутствие динамики уровней α-токоферола и витамина С в сравнении с показателями на визите 0. При сравнении показателей, полученных в ОГ и КГ на визите 1, выявлены значимые различия по всем лабораторным тестам, за исключением уровней витамина С и фоллистатина (см. табл. 3).
При СРТ саркопении на визите 1 зарегистрировали значимое увеличение уровней 25(ОН)D3, α-токоферола, BDNF, ДГЭАС в крови и индекса саркопении, существенное снижение системного воспаления — уровней СРБ, ИЛ-6, ИЛ-1β, ФНО-α, лептина, а также миостатина, фоллистатина и кортизола в крови при отсутствии динамики концентрации альбумина, общих каротиноидов, витамина С, РIIANP, ИФР-1 в сравнении с показателями на визите 0. Динамика лабораторных тестов в КГ оказалась менее выраженной в сравнении с таковой в ОГ (табл. 3).
На визите 2, по окончании приема нутрицевтика, отметили следующую динамику лабораторных тестов: значимое увеличение уровней альбумина, 25(ОН)D3, BDNF, ИФР-1, ДГЭАС в крови и индекса саркопении, существенное снижение системного воспаления — уровней СРБ, ИЛ-6, ИЛ-1β, ФНО-α, лептина, а также РIIANP, миостатина, фоллистатина и кортизола в крови, отсутствие динамики концентрации α-токоферола, общих каротиноидов и витамина С в крови в сравнении с показателями на визите 0. При сравнении с показателями в КГ на этом же сроке установлены значимые различия по всем лабораторным показателям, за исключением уровня фоллистатина (см. табл. 3).
В КГ на визите 2 констатировали значимое увеличение уровней α-токоферола, ДГЭАС в крови и индекса саркопении, существенное снижение системного воспаления — уровней СРБ, ИЛ-6, ИЛ-1β, ФНО-α, лептина, а также концентрации РIIANP, миостатина, фоллистатина и кортизола в крови при отсутствии динамики уровней альбумина, 25(ОН)D3, общих каротиноидов, витамина С, BDNF, ИФР-1 в сравнении с показателями на визите 0. Динамика показателей в КГ была менее выраженной в сравнении с таковой в ОГ на этом же сроке наблюдения (см. табл. 3).
Отметили снижение потребности в приеме и полную отмену приема целекоксиба на 60-й день исследования у 6 (18,7%) и 26 (81,3%) пациентов ОГ соответственно (против 26 (86,7%) и 4 (13,3%) в КГ соответственно; p<0,01). Уменьшение потребности в приеме и полную отмену топической формы мелоксикама на 60-й день исследования зарегистрировали у 10 (31,2%) и 22 (68,8%) пациентов ОГ соответственно (против 17 (56,7%) и 13 (43,3%) пациентов КГ соответственно; p<0,05).
Не зарегистрированы нежелательные явления при приеме препарата Хондрогард® и фармаконутрицевтика Хондрогард®ТРИО.
Обсуждение
Улучшение балльной оценки по ВАШ, WOMAC, KOOS, SARC-F и показателей теста «5 подъемов со стула», мышечной силы (DXA) при приеме препарата Хондрогард® и фармаконутрицевтика Хондрогард®ТРИО дополнительно к СРТ саркопении у пожилых пациентов с ОА КС связано с миопротективным эффектом ХС, подтвержденным данными гистопатологического анализа биоптатов медиальной головки четырехглавой мышцы бедра. Фармакологические эффекты ХС включают регуляцию молекулярных событий клеточного старения: накопления жировой ткани, резистентности к инсулину, воспаления низкой степени выраженности, дисбаланса белкового обмена, оксидативного стресса, митохондриальной дисфункции, регенеративной способности.
Потеря миоцитов связана с протеолитическими системами: кальпаиновой, убиквитин-протеасомной и системой лизосом-аутофагии в клетке. Воспаление и формирование SASP в стареющих миоцитах конвергируют на уровне активации передачи сигналов NF-κB, что повышает экспрессию мышечной убиквитиновой протеин-лигазы (muscle RING-finger protein-1, MuRF1). Прием ХС восстанавливает степень сульфатирования и связывания с белками молекул ХС в экстра- и околоклеточном пространстве миоцитов скелетных мышц, определяет дифференцировку миобластов на стадии экстенсивного формирования синцития миотрубок [30]. Механизм действия ХС обусловлен активацией рецептора CD44 на поверхности клеток (хондроцитов, лейкоцитов, миоцитов), блокадой сигнального белка киназы IKKβ внутри клетки и фосфорилирования белка IkBα с отсутствием образования активной формы NF-kB. Активная форма NF-kB не образуется при приеме ХС, не поступает в клеточное ядро и не активирует гены провоспалительного ответа, в том числе гены хемокинов и цитокинов, что было подтверждено в исследовании снижением уровней ИЛ1-β, ИЛ-6 и ФНО-α в крови. Снижение уровня провоспалительных цитокинов тормозит деградацию миоцитов и сателлитных клеток. Уменьшение активности NF-kB подавляет экспрессию толл-подобных рецепторов TLR2 и TLR4 в сателлитных клетках и лейкоцитах. Блокада рецептора CD97 снижает активацию лейкоцитов при саркопении, что подтверждено данными гистопатологического анализа мышечной ткани с отсутствием ее инфильтрации иммунокомпетентными клетками. ХС, снижая активность NF-κB, активирует сигнальный путь PGC-1α/Sirt1 с сохранением митохондриальной ДНК [31]. Передача сигналов в системе ИФР-1 (IGF-1/PI3K-Akt) отвечает за синтез мышечного белка и развитие саркопении, что согласуется с нашими данными о снижении уровня ИФР-1 при включении пациентов в исследование и увеличении при терапии парентеральным препаратом ХС и фармаконутрицевтиком, состоящим из ГС, ХС и НК II типа.
Регуляция ХС патобиохимического пути PKC/PI3K/Akt посредством усиления фосфорилирования Аkt является перспективной стратегией миопротекции [32], снижая уровень миостатина в скелетных мышцах при саркопении. Фоллистатин, уровень которого снижался в крови как при назначении СРТ, так и при назначении комплексной терапии, является ингибитором миостатина через сигнальные пути активин/миостатин [33]. Показано взаимосвязанное снижение уровня миостатина/фоллистатина при увеличении концентрации ДГЭАС в крови пациентов ОГ, что может указывать на снижение риска прогрессирования остеосаркопении, как показано в других исследованиях [34].
Увеличение уровня сывороточного альбумина при приеме комбинации СРТ, ХС в составе парентерального препарата и фармаконутрицевтика свидетельствует об уменьшении его катаболизма и повышении антиоксидантной емкости в скелетных мышцах и мышечной массы при саркопении [35]. Следствием увеличения концентрации сывороточного альбумина при добавлении ХС является повышение связанной фракции гормонов, в том числе андрогенов, влияющих на мышечную массу, функции скелетных мышц, увеличение количества сателлитных клеток и ядер в миоцитах [36].
Увеличение уровня BDNF в крови при приеме СРТ и ХС, ГС, НК II типа означает увеличение его экспрессии в мышцах и окисление жирных кислот через AMP-активируемую протеинкиназу (AMPK) [37]. BDNF регулирует миогенез, регенерацию мышц и активацию сателлитных клеток [38], потенцирует синаптическую передачу, связываясь с тропомиозин-родственными рецепторными киназами (Trk) A и B. Рецепторы Trk экспрессируются двигательными нейронами и скелетными миоцитами, их нисходящая сигнализация активирует PI3K, митоген-активируемую протеинкиназу (MAPK), фосфолипазу C-γ (PLC-γ) с выживанием нейронов [39].
Повышенный уровень кортизола в крови при саркопении у пожилых пациентов с ОА КС связан со снижением их физической работоспособности [40]. Показано снижение уровня кортизола в крови пациентов при приеме ХС в составе парентерального препарата и фармаконутрицевтика, что снижает риск прогрессирования остеосаркопении.
Известно об отрицательной корреляции между скоростью синтеза белка в скелетных мышцах и уровнями СРБ, ИЛ-6, рецептора 2-го типа к ФНОα, что совпадает с данными об уровнях альбумина, провоспалительных цитокинов, СРБ в крови пациентов обеих групп до назначения терапии [41]. ХС уменьшает выраженность клинических признаков саркопении при ОА КС, блокируя опосредованную NF-κB секрецию ИЛ-6. В результате увеличивается синтез и уменьшается распад мышечных белков, снижается экспрессия миостатина, подавляющего рост мышц, белков мышечной атрофии (F-box-1, атрогина-1), катаболизм белка и увеличивается анаболизм в скелетных мышцах. Выраженный эффект комбинации СРТ и ХС в составе парентерального препарата и фармаконутрицевтика в отношении увеличения мышечной силы связан в том числе со снижением активности одного из провоспалительных факторов в крови — ФНО-α. Уменьшение активности воспалительных реакций при приеме СРТ и ХС является эффектом устранения митохондриальной дисфункции.
Снижение уровня лептина в крови, зарегистрированное нами у пациентов ОГ, связано со снижением выработки провоспалительных цитокинов (ИЛ-6, ФНО-α), что уменьшает выраженность инсулинорезистентности, предотвращает потерю мышечной массы и снижение силы [42]. В механизме действия ХС предполагается устранение накопления миоцеллюлярных липидов и формирования липотоксичности в скелетных мышцах в связи с эффективным снижением уровня лептина в крови и ограничением саркопенического ожирения [43].
Эффективное снижение уровня факторов системного воспаления в крови, обнаруженное в исследовании после 2 мес. приема фармаконутрицевтика, cвязано с иммуноопосредованным действием НК II типа в его составе: НК II типа в тонкой кишке замедляет воспалительное повреждение коллагена II типа во внеклеточной соединительной ткани в скелетных мышцах, опосредованное Т-лимфоцитами, по механизму оральной толерантности. Применение низких доз НК II типа приводит к тому, что дендритные клетки в лимфоидной ткани в кишечнике поглощают его в гликозилированной форме. Распознавание эпитопов антигена осуществляется Тh-лимфоцитами, которые обеспечивают начальный невысокий иммунный ответ, в дальнейшем постепенно развивается «толерантность» и ослабляется иммунный ответ против коллагена II типа в соединительной ткани. Этот эффект сопровождается стимуляцией Тreg-лимфоцитов и снижением активности Тh-лимфоцитов с увеличением уровня противовоспалительных цитокинов (ИЛ-10 и TGF-β), подавляющих активность матриксных металлопротеиназ, разрушающих коллаген [44]. Снижение уровня РIIANP в крови пациентов ОГ свидетельствует об ограничении разрушения коллагена II типа в суставном хряще и во внеклеточной соединительной ткани скелетных мышц [45].
При приеме ХС у пожилых пациентов отметили увеличение концентрации общих каротиноидов в крови, что является результатом синергизма антиоксидантного и противовоспалительного эффектов ХС и α-токоферола при саркопении [46]. Вышеперечисленные эффекты ХС связаны с механизмом устранения высокой текучести мембран митохондрий и увеличением синтеза цитохромоксидазы и NADH-кофермента Q1-редуктазы, повышением соотношения восстановленного и окисленного глутатиона в клетках скелетных мышц [47].
При приеме СРТ и ХС отметили стабилизацию уровня витамина С в крови с большими его уровнями после приема фармаконутрицевтика по сравнению с СРТ. Механизмы действия витамина C в скелетных мышцах включают синтез карнитина и коллагена, уменьшение окислительного повреждения мышц и концентрации провоспалительных цитокинов в крови [48]. Молекулярным драйвером снижения выраженности саркопении и восстановления уровня витамина С в крови при приеме ХС является снижение активности убиквитин-лигаз атрогина 1 / белка MAFbx и белка MuRF1F в мышцах [49].
При дополнительном к СРТ приеме ХС в составе парентерального препарата и фармаконутрицевтика отмечено увеличение уровня 25(ОН)D3 в крови. В гистологических срезах, полученных от 25(OH)D-дефицитных людей, наблюдаются атрофия мышечных волокон, увеличенные межфибриллярные промежутки, жировая инфильтрация, фиброз и отложение гранул гликогена, что является метаболически-морфологической основой снижения мышечной функции и было подтверждено в исследовании. Восстановление уровня 25(OH)D в крови и увеличение уровня сывороточного альбумина при приеме ХС способствует увеличению плотности VDR, эффекту 25(OH)D в отношении увеличения синтеза белка в скелетных мышцах с повышением их мышечной силы и сократимости, снижению воспаления в скелетных мышцах пожилых пациентов с ОА КС [50].
В исследовании отметили увеличение индекса саркопении у пациентов пожилого возраста с ОА КС при дополнительном приеме ХС в составе парентерального препарата и фармаконутрицевтика, что указывает на улучшение выживаемости и снижение смертности в данной когорте пациентов [51].
Ограничения исследования. Это было клиническое исследование с небольшим размером выборки, что повышает неопределенность относительно его обобщения для всех групп населения. Для подтверждения результатов необходимы многоцентровые исследования.
Заключение
Прием СРТ ОА КС и саркопении и курс лечения препаратом Хондрогард® c последующей поддержкой фармаконутрицевтиком Хондрогард®ТРИО пациентами пожилого возраста сопровождались более значимым улучшением балльной оценки интенсивности боли по ВАШ, WOMAC, KOOS, уменьшением ФН по индексу Лекена, выраженности саркопении по SARC-F, улучшением и стабилизацией результатов тестов определения мышечной силы и показателя мышечной массы по сравнению с пациентами, получавшими только СРТ, улучшением витаминного профиля крови, выраженным снижением уровня маркеров системного воспаления в крови при увеличении уровня альбумина в крови при сравнении динамики лабораторных тестов после приема СРТ саркопении и болевого синдрома с пероральным и локальным приемом топических НПВП. Молекулярные звенья механизма действия ХС, ГС и НК II типа требуют дальнейших исследований.
Таким образом, блокада старения сателлитных клеток, повышение антиоксидантной активности крови и скелетных мышц, усиление противовоспалительного действия, снижение провоспалительной активности, сохранение митохондриальной функции в миоцитах скелетных мышц рассматриваются как многообещающие стратегии лечения саркопении парентеральной формой ХС у пожилых пациентов с ОА и болью, а также как перспективы вспомогательной поддержки пациентов фармаконутрицевтиками, содержащими ХС, ГС и НК II типа.
Конфликт интересов: в статье выражена позиция авторов, которая может отличаться от позиции компании ЗАО «ФармФирма «Сотекс».
1Клинические рекомендации. Хроническая боль у пациентов пожилого и старческого возраста. (Электронный ресурс.). URL: https://cr.minzdrav.gov.ru/preview-cr/616_1 (дата обращения: 12.09.2025).
Информация с rmj.ru