Эффективность и безопасность пробиотических бактерий
Lactobacillus reuteri DSMZ17648 у инфицированных Helicobacter pylori, не имеющих
абсолютных показаний
Д. С. Бордин*, доктор медицинских наук
О. Б. Янова, кандидат медицинских наук
И. Н. Войнован
С. Г. Хомерики, доктор медицинских наук, профессор
В. А. Ким, кандидат медицинских наук
Е. В. Быстровская, доктор медицинских наук
Э. Р. Валитова, кандидат медицинских наук
ГНИИГ ГБУЗ МКНЦ ДЗМ, Москва
*ЦНИИГ МКНЦ ДЗМ, Москва
Helicobacter pylori (НР) относится к наиболее частым инфекциям
человека. В развитых странах уровень распространенности НР не превышает
40%, в то время как в развивающихся странах достигает 80–90%. Россия относится к
странам с высокой распространенностью НР. У взрослых в разных регионах
страны она находится на уровне 60–90%. В Москве распространенность НР
составляет 60,7–88% [1, 2], в Санкт-Петербурге — 63,6% [3], в Восточной Сибири —
около 90% [4, 5].
Эрадикация НР строго рекомендована больным язвенной болезнью желудка
и двенадцатиперстной кишки, MALTомой желудка, атрофическим гастритом, перенесшим
резекцию желудка по поводу рака желудка и при первой степени родства с больным
раком желудка, кроме того, эрадикация показана при желании инфицированного
НР пациента после консультации с доктором [6]. У инфицированных НР
без симптомов или с проявлениями функциональной диспепсии, с хроническим
неатрофическим гастритом абсолютных показаний к эрадикации НР нет.
Вместе с тем длительное персистирование НР может сопровождаться
воспалительной реакцией, а итогом хронического воспаления является уменьшение
массы функционально активной железистой ткани, то есть развитие атрофического
гастрита [7]. Атрофический гастрит является следствием естественного течения
длительно существующего хронического гастрита, вызванного инфекцией НР
[8]. Его частота увеличивается с возрастом, и он рассматривается в качестве
ступени каскада Корреа — последовательности изменений слизистой оболочки
желудка, включающей хронический поверхностный гастрит, атрофический гастрит,
кишечную метаплазию, дисплазию, приводящую к раку [9]. НР является
наиболее важным фактором риска рака желудка, ее эрадикация признана наиболее
перспективной стратегией снижения заболеваемости раком желудка [10].
Метаанализы и систематические обзоры демонстрируют, что наиболее часто
назначаемая 7-дневная тройная схема терапии первой линии (ингибитор протонной
помпы, амоксициллин, кларитромицин) в подавляющем большинстве случаев не
достигает целевого уровня эффективности [11–13]. Это связывают с формированием
резистентности НР к антибиотикам как вследствие недостаточной
комплаентности больных (несоблюдение дозировок, режима и длительности приема
препаратов), так и широкого применения антибиотиков на популяционном уровне
[14].
В связи с этим проводится поиск способов повышения эффективности
антибактериальной терапии, а также альтернатив для лиц, не имеющих абсолютных
показаний к эрадикации либо страдающих аллергией к антибиотикам. Консенсус
«Маастрихт-4» констатировал, что «некоторые пробиотики и пребиотики, добавляемые
в схемы эрадикации, демонстрируют многообещающие результаты в снижении частоты
побочных эффектов» [6]. Опубликованные в последние годы исследования
свидетельствуют, что ряд штаммов лактобактерий, бифидобактерий, сахаромицетов
способны повысить эффективность и снизить частоту нежелательных явлений при
проведении эрадикационной терапии [15].
Результаты плацебо-контролируемых исследований у лиц, инфицированных НР,
не имевших клинических симптомов заболеваний, демонстрируют существенное
снижение уровня колонизации желудка НР по данным 13C-уреазного
дыхательного теста (13С-УДТ) на фоне приема высушенных клеток
Lactobacillus reuteri DSMZ17648 [16, 17]. Особенность данного штамма
лактобактерий заключается в том, что они связываются с поверхностными
рецепторами клеточной стенки НР, образуя ко-агрегаты, которые
естественным образом, через желудочно-кишечный тракт, выводятся из организма
[18]. На этом основании обсуждается возможность применения Lactobacillus
reuteri DSMZ17648 для снижения обсемененности НР в популяциях с
высоким уровнем распространения инфекции. При этом остается не ясным,
сопровождается ли снижение обсемененности НР уменьшением выраженности
воспаления слизистой оболочки желудка и снижением риска развития и
прогрессирования атрофии.
На базе Центрального научно-исследовательского института гастроэнтерологии с
августа 2014 г. по настоящее время проводится постмаркетинговое исследование,
целью которого является оценка эффективности и безопасности 28-дневного приема
инактивированных клеток пробиотических бактерий Lactobacillus reuteri
DSMZ17648 (Хелинорм®) у пациентов с выявленным НР, не имеющих
абсолютных показаний для эрадикационной терапии.
Основные задачи исследования:
- Оценка динамики обсемененности НР по данным 13С-УДТ
при приеме пробиотических бактерий Lactobacillus reuteri DSMZ17648. - Оценка морфологической динамики степени и стадии гастрита по системе OLGA
(Operative Link for Gastritis Assessment) на фоне лечения. - Оценка динамики клинических проявлений заболевания и частоты выявления
нежелательных явлений терапии.
Исследование одобрено решением Локального комитета по этике при МКНЦ № 3/2014
от 4 июля 2014 г.
Материалы и методы исследования
В исследовании принимают участие пациенты в возрасте от 18 до 60 лет с
подтвержденным 13С-УДТ наличием НР, подписавшие
информированное согласие, одобренное локальным этическим комитетом при МКНЦ.
Из исследования исключаются больные, отказавшиеся от дальнейшего
исследования, при ухудшении объективных показателей состояния больного, при
появлении заболеваний, требующих приема препаратов, влияющих на оценку
эффективности терапии (антибиотики, ингибиторы протонной помпы, Н2-блокаторы,
препараты висмута), при возникновении серьезных нежелательных явлений.
В исследование не включаются больные:
- c выраженным болевым и диспепсическим синдромом;
- имеющие абсолютные показания для проведения эрадикационной терапии
(язвенная болезнь желудка и двенадцатиперстной кишки, атрофический гастрит,
родственники больных раком желудка (первая степень родства), больные раком
желудка, больные MALTомой желудка); - принимавшие антибиотики, ингибиторы протонной помпы, Н2-блокаторы,
препараты висмута в течение 30 дней до визита; - с новообразованиями;
- при наличии клинически значимых аллергических реакций в анамнезе;
- при наличии тяжелых клинически значимых неврологических,
сердечно-сосудистых, желудочно-кишечных, печеночных, почечных, иммунных и
прочих заболеваний в анамнезе; - больные психическими заболеваниями, которые, по мнению исследователя,
делают неприемлемым участие пациента в исследовании; - беременные, в период лактации;
- пациенты, склонные к отказу от исследования и выполнения предписаний
врача; - невозможность или нежелание дать информированное согласие на участие в
исследовании или на выполнение требований исследования.
Дизайн исследования
В ходе исследования, представленного в настоящей статье, пациенты получали
монотерапию средством Хелинорм® в дозе по 200 мг (1 капсула) в день в течение 4
недель.
Уровень обсемененности НР определялся с помощью 13С-УДТ, который
проводился до начала приема средства Хелинорм®, через 2 недели приема и через 4
недели после начала терапии.
13С-УДТ состоит в следующем: пациенту предлагается выдохнуть в
емкость воздух. Емкость после выдоха сразу закупоривают. Затем он выпивает
тестовый раствор (Карбамид, обогащенный изотопом углерода 13С) и через полчаса
выдыхает вновь в другую емкость. При наличии в желудке обследуемого НР
мочевина подвергается гидролизу с выделением меченого 13С углекислого
газа, который поступает в кровь и выводится из организма через легкие. При
отсутствии НР этого не происходит. Изотопный состав углерода в выдыхаемом
воздухе определяется спектрометром (анализатором) до и после приема Карбамида с
определением отношения 13C/12С. Вывод о наличии бактерии
делается, если это отношение превышает 2‰.
До начала терапии и по ее завершении проводилась эзофагогастродуоденоскопия (ЭГДС),
забор биоптатов (три в антральном отделе и два в теле желудка) и морфологическое
исследование с целью оценки степени и стадии гастрита по системе OLGA [19]. Под
степенью гастрита понимают выраженность воспаления слизистой оболочки (суммарной
воспалительной инфильтрации нейтрофильными лейкоцитами и мононуклеарными
клетками) с интегративной оценкой выраженности изменений в теле и антральном
отделе желудка. Степень отражает риск развития атрофического гастрита. Под
стадией хронического гастрита понимают выраженность утраты железистых структур,
характерных для тела и антрального отдела желудка. Стадия отражает риск развития
рака желудка.
Больные ведут дневник, в котором ежедневно отмечают факт приема средства,
оценивают выраженность симптомов по 3-балльной шкале (выраженный симптом — 3;
умеренно выраженный симптом — 2; слабо выраженный симптом, проявляющийся время
от времени — 1; отсутствие симптомов — 0) и отмечают возможные нежелательные
явления.
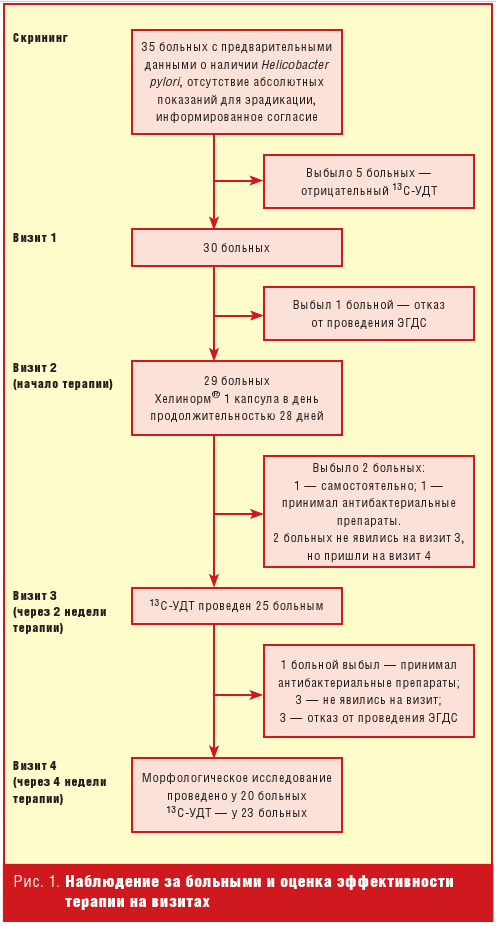
В скрининг было включено 35 пациентов с предполагавшимся ранее наличием
НР (рис. 1). У 5 из них при 13С-УДТ был получен отрицательный
результат. Отказался от проведения ЭГДС и выбыл из исследования до начала
терапии 1 больной. Получили средство и начали лечение 29 больных. Средний
возраст 45,5 ± 13,2 года. Через 2 недели терапии 13С-УДТ был проведен
25 пациентам. Через 4 недели терапии 13С-УДТ был проведен 23 больным,
ЭГДС и морфологическое исследование — 20 больным.

Результаты исследования
Количественная оценка обсемененности H. pylori по данным
13С-уреазного дыхательного теста
При сопоставлении количественных данных результата 13С-УДТ до
терапии и на 14-й день лечения положительная динамика (уменьшения показателя
более чем на 1‰) отмечена у 56% больных, к 28-му дню терапии — у 56,5%
обследованных больных (табл. 1).
Следует отметить, что у 15 больных направление изменения показателя к 14 и 28
дню лечения совпадали. Вместе с тем, у 4 пациентов с изначально положительной
динамикой или без динамики в 14-му дню терапии наблюдалась отрицательная
динамика к 28 дню лечения. И, напротив, у 2 больных с отрицательной динамикой
показателя к 14-му дню терапии была отмечена положительная динамика к 28 дню.
Для объяснения этих данных требуются дальнейшие наблюдения.
Морфологическая оценка признаков воспаления в гастродуоденальной зоне
(система OLGA)
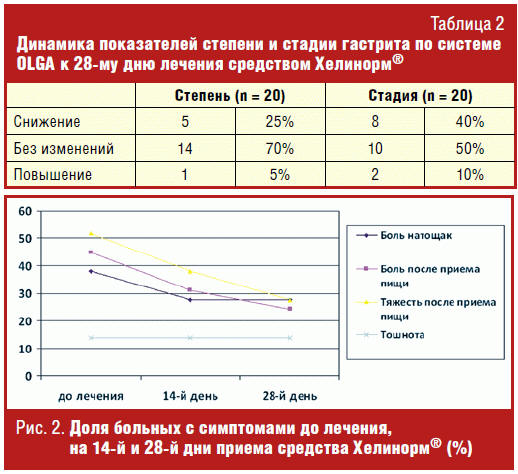
При оценке морфологической динамики через 28 дней лечения средством Хелинорм®
показано, что снижение степени гастрита наблюдалось у 25% больных, стадии — у
40% пациентов (табл. 2).
При анализе морфологической динамики у 10 больных, у которых наблюдалось
снижение обсемененности HР по 13С-УДТ, по данным
морфологического исследования степени гастрита снизилась в 3 случаях, динамики
не было в 7, нарастания степени гастрита не наблюдалось. У больных без динамики
показателя 13С-УДТ не было изменений степени воспаления. У больных с
отрицательной динамикой 13С-УДТ в 1 случае наблюдалось повышение
степени воспаления. Оценка клинической значимости этих данных будет возможна
после набора большего количества больных.
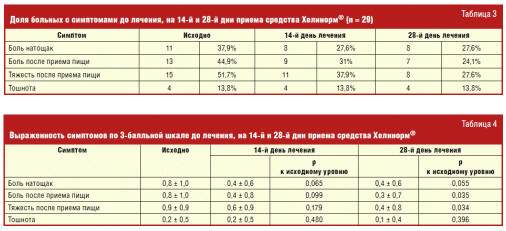
Динамика клинических симптомов заболевания
На фоне лечения было отмечено уменьшение доли больных, которых беспокоила
боль в эпигастрии натощак и после приема пищи, тяжесть после приема пищи. Доля
больных, которых беспокоила тошнота, не изменилась (табл. 3, рис. 2).
Выраженность боли и тяжести, возникающих после еды, к концу лечения достоверно
снизилась (табл. 4).
Таким образом, наблюдалось снижение как доли больных с болью в эпигастрии
натощак и после приема пищи, а также с тяжестью в эпигастрии после приема пищи,
так и выраженности этих симптомов.
На фоне лечения не было отмечено нежелательных явлений.
Обсуждение
Представленные данные позволяют заключить, что положительная динамика
обсемененности HР по 13С-УДТ наблюдалась у половины больных,
получавших Хелинорм® по 1 капсуле в день в течение 28 дней, при этом у
большинства из них положительный ответ наблюдался уже к 14-му дню терапии.
Вместе с тем положительная динамика 13С-УДТ сопровождалась
уменьшением степени воспаления у 3 из 10 больных.
H. Mehling и соавт. (2013) в ходе слепого плацебо-контролируемого
исследования у лиц, инфицированных НP, без клинических симптомов
заболеваний, показали, что на фоне приема действующего вещества Pylopass™
(высушенных клеток Lactobacillus reuteri DSMZ17648) происходило
существенное снижение уровня колонизации желудка НР. Уровень
обсемененности НР определялся с помощью 13C-уреазного
дыхательного теста до и через 14 дней приема препарата. Значительное снижение
уровня обсемененности НР было выявлено в группе получавших L.
reuteri DSMZ17648 (ежедневная доза 2 × 1010 нежизнеспособных
клеток в два приема — после завтрака и ужина), но не в группе плацебо. Ответ был
значительно более выражен при высокой исходной степени обсемененности HР
[16].
По данным плацебо-контролируемого исследования, проведенного C. Holz
и соавт. (2014) у бессимптомных инфицированных НР (47 пар близнецов и
34 лиц, инфицированных НР), в группе принимавших L. reuteri DSMZ17648
было отмечено выраженное снижение показателя 13C-уреазного
дыхательного теста (–4,9 ± 7,8, в группе плацебо –0,6 ± 5,3, р = 0,026),
отражавшее уменьшение обсемененности желудка НР. Препарат также
назначался в два приема — после завтрака и ужина [17].
Таким образом, дальнейшее изучение свойств данного продукта видится
интересным и перспективным.
Литература
-
Лазебник Л. Б., Васильев Ю. В., Щербаков П. Л., Хомерики С. Г.,
Машарова А. А., Бордин Д. С., Касьяненко В. И., Дубцова Е. А.
Helicobacter pylori: распространенность, диагностика, лечение //
Экспериментальная и клиническая гастроэнтерология. 2010; 2: 3–7. -
Герман С. В., Зыкова И. Е., Модестова А. В., Ермаков Н. В.
Распространенность инфекции H. pylori среди населения Москвы // РЖГГК. 2010;
2: 25–30. -
Барышникова Н. В., Ткаченко Е. И., Успенский Ю. П. Современные
аспекты состояния проблемы Helicobacter pylori-ассоциированных заболеваний. В
кн.: Гастроэнтерология. Болезни взрослых / Под общ. ред. Л. Б. Лазебника, П.
Л. Щербакова. М.: МК, 2011. С. 103. -
Цуканов В. В., Хоменко О. В., Ржавичева О. С., Буторин Н. Н.,
Штыгашева О. В., Маады А. С., Бичурина Т. Б., Амельчугова О. С.
Распространенность Helicobacter pylori и ГЭРБ у монголоидов и европеоидов
восточной Сибири // Российский журнал гастроэнтерологии, гепатологии,
колопроктологии. 2009; 19 (3): 38–41. -
Решетников О. В., Курилович С. А., Кротов С. А., Кротова В. А.
Хеликобактерная инфекция в сибирских популяциях // Бюллетень Сибирского
отделения Российской академии медицинских наук. 2010; 2: 88–93. -
Malfertheiner P., Megraud F., O’Morain C. A. et al. Management of
Helicobacter pylori infection — the Maastricht IV. Florence Consensus Report
// Gut. 2012; 61: 646–664. -
Бордин Д. С., Машарова А. А., Хомерики С. Г. Хронический гастрит:
современный взгляд на старую проблему // Экспериментальная и клиническая
гастроэнтерология. 2012; 5: 99–106. -
Sakaki N., Kozawa H., Egawa N., Tu Y., Sanaka M. Ten-year
prospective follow-up study on the relationship between Helicobacter pylori
infection and progression of atrophic gastritis, particularly assessed by
endoscopic findings // Aliment Pharmacol Ther. 2002; 16 Suppl 2: 198–203. -
Correa P. Helicobacter pylori and gastric carcinogenesis // Am.
J. Surg. Pathol. 1995; 19 Suppl 1: S37–43. -
Бордин Д. С., Бяхов М. Ю., Федуленкова Л. В. «Серологическая
биопсия» и скрининг рака желудка // Злокачественные опухоли. 2014; 2 (9):
30–36. -
Graham D. Y., Fischbach L. Helicobacter pylori treatment in the
era of increasing antibiotic resistance // Gut. 2010; 59 (8): 1143–1153. -
Wang B., Lv Z. F., Wang Y. H., Wang H., Liu X. Q., Xie Y., Zhou X. J.
Standard triple therapy for Helicobacter pylori infection in China: a
meta-analysis // World J Gastroenterol. 2014; 20 (40): 14973–14985. -
McNicholl A. G., Tepes B., Gasbarrini A. et al. Pan-European
Registry on H. pylori Management: Interim Analysis // Gastroenterology. 2014;
146 (5): S-395. -
Megraud F., Coenen S., Versporten A. et al. Helicobacter pylori
resistance to antibiotics in Europe and its relationship to antibiotic
consumption // Gut. 2013; 62 (1): 34–42. -
Бордин Д. С., Колбасников С. В., Кононова А. Г.. Войнован И. Н.
Роль пробиотиков в лечении заболеваний, ассоциированных с Н. pylori // Врач.
2015; 3: 23–27. -
Mehling H., Busjahn A. Non-Viable Lactobacillus reuteri DSMZ
17648 (Pylopass™) as a New Approach to Helicobacter pylori Control in Humans
// Nutrients. 2013, 5, 3062–3073. -
Holz C., Busjahn A., Mehling H., Arya S., Boettner M., Habibi H., Lang
C. Significant Reduction in Helicobacter pylori Load in Humans with
Non-viable Lactobacillus reuteri DSM17648: A Pilot Study // Probiotics
Antimicrob Proteins. 2014 Dec 7. [Epub ahead of print]. -
Mukai T., Asasaka T., Sato E., Mori K., Matsumoto M., Ohori H.
Inhibition of binding of Helicobacter pylori to the glycolipid receptors by
probiotic Lactobacillus reuteri. FEMS Immunol // Med. Microbiol. 2002; 32 (2):
105–110. -
Rugge M., Correa P., Di Mario F. et al. OLGA staging for
gastritis: a tutorial // Dig. Liver Dis. 2008; 40 (8): 650–658.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru







