Введение
Боль в горле, развивающаяся в результате инфекционного воспаления верхних дыхательных путей, служит одним из наиболее частых поводов обращения пациентов всех возрастов к специалистам амбулаторного звена, включая оториноларингологические, терапевтические, педиатрические службы, а также семейных врачей и врачей общей практики. Наиболее часто данный симптом возникает при острых респираторных инфекциях (ОРВИ, ОРЗ, назофарингит, ларингофарингит), а также на фоне изолированного поражения глотки (фарингит, тонзиллит, тонзиллофарингит) [1–3].
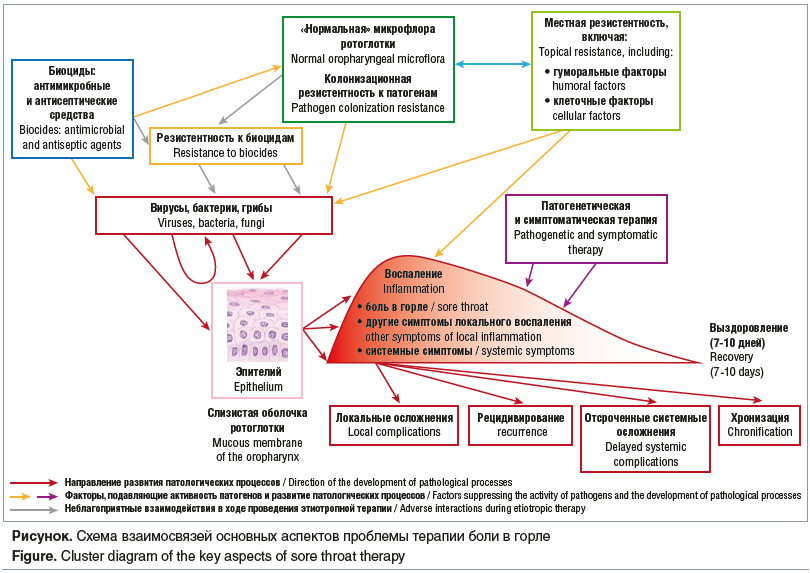
Актуальность проблемы терапии состояний, сопровождающихся болью в горле, помимо значительной распространенности самих заболеваний, определяется еще рядом аспектов (см. рисунок). Так, несмотря на особенности этиологии, которые кратко будут обсуждаться ниже, боль в горле на протяжении многих десятков лет является одним из самых частых поводов для назначения системных антибактериальных препаратов в качестве базисной терапии [4–6]. В свою очередь, высокая частота применения системных антибактериальных препаратов для лечения боли в горле во многом способствует дальнейшему росту антибиотикорезистентности [6, 7]. Наконец, значительное внимание в последние годы уделяется влиянию антибактериальной терапии на качественно-количественный состав микробиоты [8].
Содержание статьи
Этиология инфекционных заболеваний, сопровождающихся болью в горле
Среди этиологических факторов инфекционных заболеваний, сопровождающихся болью в горле, вне зависимости от возраста пациентов, доминируют респираторные вирусы (аденовирус, вирус Эпшейна — Барр, вирусы гриппа B и парагриппа, респираторно-синтициальный вирус, риновирус, бокавирус, метапневмовирус). У детей младше 3 лет частота воспалительных заболеваний глотки вирусной этиологии может достигать 80–90%, но по мере взросления возрастает доля «бактериального» генеза данного заболевания (24% в дошкольном возрасте против 52% в старшем школьном возрасте) [7, 9, 10]. По данным результатов исследований, проведенных в период пандемии COVID-19, вирус SARS-CoV-2 (штаммы дельта и омикрон) также может быть причиной возникновения боли в горле на фоне легкого течения инфекции [11].
Несмотря на то, что, по данным литературы, среди бактериальных возбудителей (особенно у детей от 3 лет и подростков до 15 лет) лидирующая роль по частоте и клинической значимости отводится Streptococcus pyogenes (β-гемолитический стрептококк группы А (БГСА)) [2, 7, 9], существуют работы, в которых исследователи демонстрируют меньшую значимость этого возбудителя в генезе острого тонзиллофарингита у педиатрических пациентов [10, 12].
По результатам исследований, нацеленных на выявление этиологической значимости других возбудителей, обсуждается возможная этиологическая роль гемолитических стрептококков групп С и G, Fusobacterium necrophorum, Arcanоbacterium haemolyticum, Mycoplasma pneumoniae, Chlamydophila pneumoniae [9, 13, 14].
Современные подходы к диагностике и лечению заболеваний, сопровождающихся болью в горле
В соответствии с современными отечественными и международными клиническими рекомендациями инфекции, вызываемые БГСА, требуют лечения с применением системных антибактериальных препаратов с целью предупреждения развития метатонзиллярных и системных осложнений. В настоящее время «золотым стандартом» для подтверждения стрептококковой этиологии заболевания являются экспресс-тесты, основанные на выявлении антигенов или ДНК возбудителя, хотя использование клинических шкал (Centor score, McIsaac score, FeverPain) также допускается. Следует подчеркнуть, что проведение экспресс-тестов не рекомендуется в возрастных категориях, для которых БГСА-этиология не является преобладающей (дети младше 3 лет, пациенты старше 50 лет). У детей старше 3–5 лет и подростков в сомнительных случаях (при расхождении результатов экспресс-диагностики с клиническими шкалами), а также в группах риска по развитию осложнений рекомендуется проведение классического бактериологического метода исследования [7, 9, 15].
С учетом сохраняющейся высокой чувствительности БГСА к β-лактамным антибиотикам, препаратами первой линии терапии являются пенициллины (предпочтительно применение амоксициллина). В случаях аллергии на препараты пенициллинов назначаются цефалоспорины, а при непереносимости всей β-лактамной группы — макролиды. Однако следует учитывать, что за последнее десятилетие отмечается существенный рост устойчивости БГСА к препаратам этой группы, а также к линкозамидам. Во всех остальных случаях абсолютное большинство клинических руководств рекомендуют проводить лишь симптоматическую терапию, направленную на купирование боли и других сопутствующих жалоб [2, 7, 9, 15]. Обсуждается применение топических препаратов, обладающих противовоспалительными свойствами, а также анестетиков и антисептиков [16, 17].
Среди причин для отказа от применения именно системных антибиотиков отмечаются риски формирования устойчивости, развития системных нежелательных явлений и отрицательного влияния на микробиоту макроорганизма. Для сокращения использования системных антибактериальных препаратов рекомендуется строгое следование клиническим руководствам (тщательная, последовательная клиническая и лабораторная диагностика) — так называемый «умный» выбор терапии, тактика отсроченного назначения препаратов. Кроме того, в ряде обзоров отмечается, что даже нелеченые случаи БГСА-фарингитов склонны к самоизлечению, и с учетом низкой частоты развития отсроченных осложнений обсуждается возможность отказа от применения системных антибактериальных препаратов у иммунокомпетентных пациентов [15].
Несмотря на активно предпринимаемые усилия, включая создание клинических руководств, различные образовательные проекты и контроль за назначениями, медицинское сообщество испытывает значительные затруднения в реализации стратегий снижения частоты использования системных противомикробных препаратов среди практикующих специалистов различных стран, в том числе стран Европы и Америки с высокоразвитыми системами здравоохранения [2, 4, 6, 18].
Согласно результатам проведенных исследований инфекционно-воспалительные заболевания, сопровождающиеся болью в горле, в значительной степени снижают качество жизни пациентов. Большинство обратившихся за медицинской помощью связывают более выраженную боль именно с развившейся инфекцией, что во многом определяет выбор врача в пользу этиотропной терапии [19].
При более тщательном изучении этиологического профиля с одновременной детекцией вирусных и бактериальных возбудителей очень часто выявляются вирусно-бактериальные ассоциации [3, 10, 11, 20]. Однако авторам не удалось найти публикации результатов исследований, в которых наряду с выявлением вирусных и/или бактериальных возбудителей одновременно проводилось бы комплексное исследование их этиологической значимости по классическим серологическим методикам. В то же время в клинической практике при обсуждении этиотропной терапии не учитывается классический тезис: вирусы открывают ворота очага воспаления для экспансии бактерий, а также тот факт, что в реальности на слизистой оболочке ротоглотки одновременно присутствуют и вирусные, и бактериальные патогены. Именно в отношении патогенеза острого фарингита/тонзиллофарингита логично допустить постепенный, не сразу обозначаемый клиническими маркерами переход преобладающей этиологической роли от вирусов к бактериям, что, возможно, и отражается данными исследований, одновременно выявляющих вирусное и бактериальное присутствие [10, 20, 21].
Наконец, авторы обращают внимание на сочетание двух важных тенденций. С одной стороны, желание уйти от повсеместного применения системных антибактериальных препаратов широкого спектра действия с целью снизить давление на микроорганизмы в целом и в первую очередь снизить агрессивное воздействие на региональные биотопы и микробиом пациента. Следует отметить при этом, что даже в странах с самым высоким уровнем здравоохранения применение узконаправленных антибиотиков потребует проведения значительного комплекса диагностических мероприятий в режиме, приближающемся к режиму реального времени, что в настоящее время является трудноосуществимой стратегией [8]. Вторая важная тенденция заключается в активном применении препаратов, обладающих способностью преодолевать основные механизмы формирования микробной устойчивости, что также может обеспечить снижение угрозы распространения антибиотикорезистентности [22].
Не вдаваясь в подробное описание самих механизмов реализации устойчивости бактерий к действию противомикробных средств, отметим, что в основе их развития можно выделить два принципиально важных направления: мутации в собственном геноме и приобретение генов резистентности посредством горизонтального переноса, в том числе через плазмиды. Двумя другими важнейшими аспектами устойчивости микроорганизмов к действию противомикробных препаратов являются уменьшение их метаболической активности, в частности переход в состояние персистеров, и формирование биопленок. Оценивая перспективы преодоления резистентности и толерантности, следует признать, что с эволюционной точки зрения создание средств, воздействующих на возбудителя инфекции при полном отсутствии риска формирования резистентности, крайне маловероятно. Более реалистичный подход — разработка препаратов, действующих одновременно на несколько мишеней в бактериальной клетке [23].
К таким препаратам относятся антимикробные пептиды, в частности наиболее подробно изученные и длительно применяемые антимикробные полипептиды (АМП) микробного происхождения [24]. Топическое применение АМП благодаря прямому попаданию в очаг воспаления в адекватной и безопасной концентрации позволяет в большей мере, чем системное введение антибактериальных препаратов, добиваться быстрой и полной эрадикации возбудителя, купирования воспаления и болевого синдрома. В отличие от классических антибактериальных препаратов АМП действуют одновременно на несколько мишеней, основной из которых является цитоплазматическая мембрана бактериальной клетки. Гибель микроорганизмов (достижение быстрого бактерицидного эффекта) происходит в очень короткие сроки, что обусловливает существенно более низкий риск формирования устойчивости патогенов.
В фокусе — АМП
Грамицидин С
Учитывая вышесказанное, АМП микробного происхождения в последнее время рассматриваются в качестве перспективных средств лечения инфекционных заболеваний в условиях высокого риска развития антибиотикорезистентности к системным препаратам [25]. Так, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) включило вещества из группы грамицидинов в список одобренных к применению против инфекций, вызванных грамположительными и грамотрицательными бактериями [24].
В отличие от линейных грамицидинов, открытых Рене Дюбо в составе противомикробных полипептидов (тиротрицин), продуцируемых бактерией Aneurinibacillus migulanus (прежнее название — Bacillus brevis) в 1939 г. [26], циклический декапептид грамицидин С (грамицидин советский, ГС) был выделен Г.Ф. Гаузе и М.Г. Бражниковой и описан в 40-х годах ХХ в. [27].
Молекула ГС является жестким кольцом, обладает амфифильными свойствами за счет наличия заряженной положительно (катионной) и гидрофобной частей. В состав молекулы ГС, синтезируемой нерибосомальным путем, входит в числе других аминокислот крайне редко встречающийся в составе природных белков и пептидов L-орнитин. Высокая стабильность молекулы в совокупности с наличием в составе неканонической аминокислоты позволяет ГС сохранять бактерицидное действие в широком диапазоне pH и избегать протеолитической деградации обычными протеазами микроорганизмов [28].
Благодаря своим свойствам ГС характеризуется выраженным многоцелевым бактерицидным действием в отношении широкого спектра грамположительных и грамотрицательных бактерий и некоторых дрожжевых грибов. ГС активен в отношении как планктонных форм микроорганизмов, включая клетки-персистеры, так и в отношении биопленок [28–30]. Согласно данным исследований, проведенных в рамках поиска перспективных препаратов против SARS-CoV-2, была выявлена способность ГС значительно снижать вирусную нагрузку в клетках Vero, инфицированных SARS-CoV-2, в эффективной концентрации 1,57 мкг/мл с сохранением максимальной эффективности до 24 ч. Кроме того, протеомный анализ показал, что в инфицированных клетках на фоне применения ГС нарушались регуляция и синтез белков, связанных с размножением вируса в клетках in vitro [31].
Основным способом реализации бактерицидного действия ГС является нарушение строения и функции липидного бислоя плазматической мембраны бактерий вплоть до образования значительных дефектов в высокой концентрации. За счет низкой молекулярной массы и особенностей строения молекулы ГС обладает, в отличие от других антимикробных пептидов, более высокой проницаемостью и быстро попадает внутрь клеток грамположительных и грамотрицательных микроорганизмов. Кроме того, ГС нарушает процессы клеточного дыхания и деления клеток широкого спектра патогенных бактерий [28, 32, 33].
Дополнительно показано, что одной из ключевых мишеней ГС могут являться молекулы (p)ppGpp (сигнальные молекулы стресса, которые инициируют и регулируют образование биопленок, переход клеток в персистирующее состояние и ряд других адаптационных реакций). Эта активность очевидно лежит в основе способности ГС эффективно ингибировать бактериальную стрессовую реакцию и препятствовать формированию биопленок, а также вызывать киллинг клеток-персистеров [28].
По механизму действия в целом ряде аспектов — влияние на биосинтез и целостность клеточной мембраны, изменение мембранного потенциала, делокализация белка MinD-GFP, активация быстрой потери калия, индукция белков-маркеров мембранного стресса LiaH и TrmB — ГС схож с низином (бактериоцин, продуцируемый стрептококками группы N, такими как Lactobacillus lactis), а также с рядом бактериоцинов I и II классов нормобиоты полости рта, в частности с циклическим бактериоцином 1B класса, вырабатываемым Lactobacillus acidophilus [34, 35]. В связи с такой функциональной близостью ГС может позитивно взаимодействовать не только с нормальной микрофлорой ротоглотки, но и с факторами местной неспецифической защиты [36].
Крайне высокая протеолитическая стабильность, а также множественные механизмы бактерицидного действия, включая выраженную мембранотропность, могут обусловливать практическое отсутствие случаев выявления у микроорганизмов приобретенной резистентности в отношении ГС в клинической практике вплоть до настоящего времени [24, 28, 37].
Полученные в условиях in vitro в ходе целенаправленного эксперимента с применением искусственной индукции, лабораторные штаммы Staphylococcus aureus 209P со сниженной чувствительностью к ГС сохраняли чувствительность к другим антибактериальным препаратам, но обладали пониженной на 30% дыхательной активностью и жизнеспособностью [38]. В отличие от ГС, в отношении других антимикробных пептидов, входящих в состав безрецептурных препаратов для лечения боли в горле (линейный грамицидин А, бацитрацин и тиротрицин), в ходе экспериментов по формированию устойчивости было продемонстрировано стабильно сохраняющееся после прекращения действия пептидов увеличение минимальной подавляющей концентрации (МПК) в отношении ряда микроорганизмов. Одновременно с возникновением устойчивости к данным пептидам у бактерий сформировалась приобретенная перекрестная устойчивость к классическим противомикробным препаратам (ципрофлоксацин, фузидиевая кислота, гентамицин, цефподоксим, амоксициллин / клавулановая кислота и цефотаксим) [39], что ставит вопрос о пересмотре перспективности этих пептидов в топической этиотропной терапии.
Согласно данным, опубликованным за последние 40 лет, показана высокая бактерицидная активность ГС в отношении грамотрицательных бактерий, включая Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae и др., с МПК в диапазоне 4–64 мкг/мл. Более активен ГС в отношении грамположительных патогенных микроорганизмов. Например, МПК в отношении Staphylococcus aureus, включая штаммы, устойчивые к метициллину (MRSA), начиная с 1981 г. стабильно сохраняется на уровне, не превышающем 8 мкг/мл [40–42]. По данным S. Derbal et al. [43], ГС в концентрации <10 мкг/мл подавляет рост стрептококков (БГСА-штамм 5448 и ряд других стрептококков).
В проведенном с участием одного из авторов в октябре — декабре 2021 г. исследовании МПК ГС в отношении Staphylococcus aureus не превышала 8 мкг/мл, в том числе у клинических изолятов, характеризующихся множественной резистентностью в отношении нескольких групп классических антимикробных препаратов для системного действия (группы β-лактамов, макролидов, респираторных фторхинолонов, тетрациклинов, аминогликозидов и др.), что позволяет в очередной раз сделать вывод об отсутствии у данного патогена устойчивости к ГС [44]. Уровень МПК ГС в отношении всех тестовых патогенов не превышал концентрацию, содержащуюся в широко применяемых в клинической практике лекарственных препаратах (линия Граммидин® (URL: https://grls.rosminzdrav.ru/grls.aspx?s=%D0%B3%D1%80%D0%B0%D0%BC%D0%BC%D0%B8%D0%B4%D0%B8%D0%BD&m=tn)…. МПК ГС в отношении Streptococcus pneumoniaе, включая штамм, резистентный к оксациллину и эритромицину, не превышала 16 мкг/мл.
Исследование показало, что различие между МПК и минимальной бактерицидной концентрацией (МБК, концентрация, вызывающая полную гибель бактериальных клеток) ГС в отношении исследуемых клинических изолятов патогенов не превышало 8 раз, что также отражает высокий потенциал бактерицидного действия.
Дополнительно проводили эксперимент, имевший задачей моделирование курсового воздействия ГС, приближенное к применению вещества в составе лекарственных препаратов в клинической практике (7-дневное применение в разовой дозе 1600–3200 мкг по 3–4 раза в сутки согласно инструкции по медицинскому применению препаратов линии Граммидин®). В данном эксперименте изучали влияние ГС на тестовые патогены в подавляющих и субподавляющих концентрациях (концентрации меньше МПК отражают реальные концентрации, создаваемые при клиническом применении в ротовой полости, а также используются в экспериментах по целенаправленному формированию резистентности микроорганизмов к противомикробным средствам в лабораторных условиях) на плотных и жидких средах. Результаты эксперимента показали, что при многократном ежедневном воздействии ГС на исследуемые микроорганизмы характеристики антимикробной активности ГС (МПК и МБК) не повышались на всем протяжении эксперимента (7 пассажей на плотных и жидких средах). Таким образом, результаты исследования продемонстрировали высокую бактерицидную активность ГС в отношении ведущих возбудителей респираторных инфекций, а в ходе многократного воздействия ГС на патогены, включая обладающие устойчивостью к широко применяемым системным антибиотикам и противомикробным средствам, не было выявлено признаков формирования у них резистентности [44].
Как указывалось выше, в случаях отсутствия показаний к системному назначению противомикробных препаратов в клинической практике широко применяется местная терапия, что нашло отражение в актуальных клинических рекомендациях [9]. Целью назначения местных препаратов являются подавление активности возбудителей инфекции, быстрое достижение противовоспалительного и болеутоляющего эффектов, а также профилактика вторичного инфицирования поврежденной слизистой оболочки глотки при благоприятном профиле безопасности препарата [9]. Вместе с тем в клинических рекомендациях отмечается наличие нежелательных эффектов и риска развития аллергических реакций, присущих некоторым из данных препаратов, например содержащим хлоргексидин и соединения йода [9]. Кроме того, не для всех местных противомикробных и антисептических средств понятны степень и характер их влияния на нормальную микробиоту, что является актуальным аспектом в настоящее время [9].
С учетом всех рассмотренных выше аспектов (широта спектра действия, выраженность терапевтического эффекта противомикробных препаратов, преодоление рисков развития антибиотикорезистентности, а также влияние на местные факторы защиты, включая нормальную микробиоту ротоглотки) наибольшую эффективность при применении топических препаратов можно достичь благодаря комбинированному воздействию нескольких синергично действующих компонентов [45]. Так, помимо топического применения антимикробных пептидов, перспективным может считаться местное использование препаратов, обладающих антисептическими свойствами, которое обеспечит более устойчивое воздействие на широкий спектр возбудителей заболевания [9].
Цетилпиридиния хлорид
К антисептическим средствам, разрешенным для топического применения у детей и взрослых, относится цетилпиридиния хлорид (ЦПХ) — четвертичное аммониевое соединение, широко известное с 1946 г. [46]. В исследованиях in vitro и in vivo продемонстрированы безопасность и эффективность применения ЦПХ в полости рта и в глотке [35, 47]. Механизм действия ЦПХ основан на дезинтеграции липидных мембран грамположительных и грамотрицательных патогенных и условно-патогенных бактерий ротовой полости, таких как Staphylococcus aureus, включая MRSA, Streptococcus sanguinis, Pseudomonas aeruginosa, а также грибов Candida albicans и Aspergillus niger. Кроме того, ЦПХ препятствует созданию биопленок патогенной микробиоты в полости рта и глотке и проявляет высокую активность в отношении мультимикробных биопленок [48]. Лабораторные исследования влияния антисептиков на микробиоту показали, что ЦПХ оказывал наиболее щадящее воздействие на индигенные микроорганизмы (представители нормальной микробиоты) [49]. Клиническое исследование группы профессора J.R. Radford et al. [50] продемонстрировало отсутствие нарушений нормобиоты полости рта при применении 0,05% раствора ЦПХ 2 раза в день в течение 6 нед. у здоровых добровольцев. Помимо этого, согласно результатам исследований, опубликованных за последние 10 лет, ЦПХ проявляет противовирусную активность в отношении респираторных вирусов (вирусы гриппа А и B, парагриппа, респираторно-синцитиальный вирус, коронавирусы SARS-COV-2, MERS-CoV, MHV-A59 и HCoV-NL63) [47, 51, 52].
Комбинация грамицидина С и ЦПХ широко применяется в клинической практике в двух лекарственных формах для топической терапии боли в горле (линия препаратов Граммидин®). Эффективность и безопасность препаратов в форме спрея подтверждены у взрослых и детей в возрасте с 3 лет [35, 53] и в форме таблеток для рассасывания у детей в возрасте 4 года и старше [54, 55].
Известно, что вирусы, обладающие тропностью к эпителию слизистой оболочки носо- и ротоглотки, а также бактериальные патогены и вирусно-бактериальные ассоциации в процессе развития инфекционного воспаления приводят к выраженным изменениям нормобиоты — одного из важнейших физиологических барьеров и звеньев неспецифической резистентности организма человека в верхних отделах дыхательного и пищеварительного трактов [56].
Возвращаясь к одному из очень важных аспектов, затронутых в статье, следует отметить, что состав и функциональная активность нормальной микробиоты играют ключевую роль в функционировании системы местной резистентности. Нарушение колонизационной резистентности слизистой оболочки респираторного тракта в результате воздействия вирусных и бактериальных возбудителей респираторных инфекций приводит к более легкому развитию указанных инфекций, выраженному длительному и рецидивирующему характеру их течения [57]. В связи с этим при выборе препаратов для топической этиотропной терапии инфекционно-воспалительных заболеваний верхних дыхательных путей целесообразно использовать сценарий биоценозсберегающей терапии [58, 59].
Заключение
Проблема адекватной терапии острых инфекционно-воспалительных заболеваний верхних дыхательных путей, сопровождающихся болью в горле, остается актуальной, несмотря на многочисленные исследования, имеющиеся авторитетные клинические рекомендации и алгоритмы диагностики и терапии.
Актуальность этой темы определяется не только высокой распространенностью данной группы заболеваний среди населения практически всех возрастов — важнейшими аспектами являются выбор терапевтической стратегии с учетом потребностей пациентов, а также последствия антимикробной терапии в виде роста антибиотикорезистентности и снижения колонизационной резистентности слизистой оболочки с развитием дисбиотических изменений.
В настоящее время, с одной стороны, отмечается необоснованно широкое применение практикующими специалистами системных антибактериальных препаратов с указанными выше последствиями, с другой стороны, имеются отдаленные перспективы по внедрению системных узконаправленных противомикробных агентов и формированию по сути новой парадигмы противомикробной терапии в целом. Вместе с тем уже в настоящее время существует вполне реальная возможность решения имеющихся проблем — использование топических комбинированных препаратов, компоненты которых оказывают синергичное этиотропное действие и вместе с тем существенно снижают риск формирования устойчивости микроорганизмов при щадящем влиянии на функционирование нормальной микробиоты ротоглотки, которая является ключевым звеном системы резистентности организма человека.
Сведения об авторах:
Радциг Елена Юрьевна — д.м.н., профессор, профессор кафедры оториноларингологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4613-922X.
Гуров Александр Владимирович — д.м.н., профессор кафедры оториноларингологии лечебного факультета, профессор кафедры микробиологии и вирусологии РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; старший научный сотрудник отдела эпидемиологии, клинических исследований и научного прогнозирования ГБУЗ НИКИО им. Л.И. Свержевского ДЗМ; 117152, Россия, г. Москва, Загородное ш., д. 18а, стр. 2; ORCID iD 0000-0001-9811-8397.
Контактная информация: Радциг Елена Юрьевна, e-mail: radtsig_e@rsmu.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов: А.В. Гуров сообщил о получении гранта на проведение независимого экспертного анализа результатов доклинического изучения антимикробной активности грамицидина С в отношении ведущих возбудителей респираторных инфекций, которое по заказу АО «Валента Фарм» в рамках осуществления текущего плана научных работ компании было выполнено независимой исследовательской организацией АО «НПО «Дом фармации».
Статья поступила 09.07.2022.
Поступила после рецензирования 02.08.2022.
Принята в печать 25.08.2022.
About the authors:
Elena Yu. Radtsig — Dr. Sc. (Med.), Professor, Professor of the Department of Otorhinolaryngology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-4613-922X.
Aleksandr V. Gurov — Dr. Sc. (Med.), Professor of the Department of Otorhinolaryngology, Professor of the Department of Microbiology and Virology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; senior researcher of the Division of Epidemiology, Clinical Trials and Prognostic Research, L.I. Sverzhevskiy Research Clinical Institute of Otorhinolaryngology; 18A Build. 2, Zagorodnoe road, Moscow, 117152, Russian Federation; ORCID iD 0000-0001-9811-8397.
Contact information: Elena Yu. Radtsig, e-mail: radtsig_e@rsmu.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Conflict of interests: A.V. Gurov informed that he has received a grant for performing an independent panel review of the results of the pre-clinical study of Gramycidin S antimicrobial activity against the most prevalent pathogens causing respiratory infections. The study was conducted upon request of AO Valenta Pharm within the implementation of the current plan of company’s research activities by an independent research organization AO NPO «Home of Pharmacy».
Received 09.07.2022.
Revised 02.08.2022.
Accepted 25.08.2022.
.
Информация с rmj.ru